Valitutti Tifi Gentile Esploriamo la chimica Zanichelli editore




































- Slides: 41

Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 1

Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento

Capitolo 11 1. La forma delle molecole 2. La teoria VSEPR 3. Molecole polari e apolari 4. Le forze intermolecolari 5. Legami a confronto Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 3

Capitolo 7 Le particelle dell’atomo 4. La classificazione dei solidi 5. Le proprietà intensive dello stato liquido Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 4

1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma delle loro molecole. I moderni mezzi di indagine hanno messo in evidenza che in una molecola gli atomi sono disposti in rapporti geometrici particolari che conferiscono alle sostanze le loro proprietà peculiari. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 5

1. La forma delle molecole Ciò che definisce la geometria di una molecola è l’angolo di legame, ovvero l’angolo formato dagli assi congiungenti i nuclei degli atomi che si legano. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 6

2. La teoria VSEPR (Valence Shell Electron-Pair Repulsion) è detta teoria della repulsione delle coppie di elettroni del guscio di valenza. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 7

2. La teoria VSEPR I principi fondamentali della teoria VSEPR sono • la disposizione degli atomi in una molecola dipende dal numero totale di coppie elettroniche di valenza che circondano l’atomo centrale; • le coppie elettroniche, avendo uguale segno, si respingono e si collocano alla maggiore distanza possibile le une dalle altre. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 8

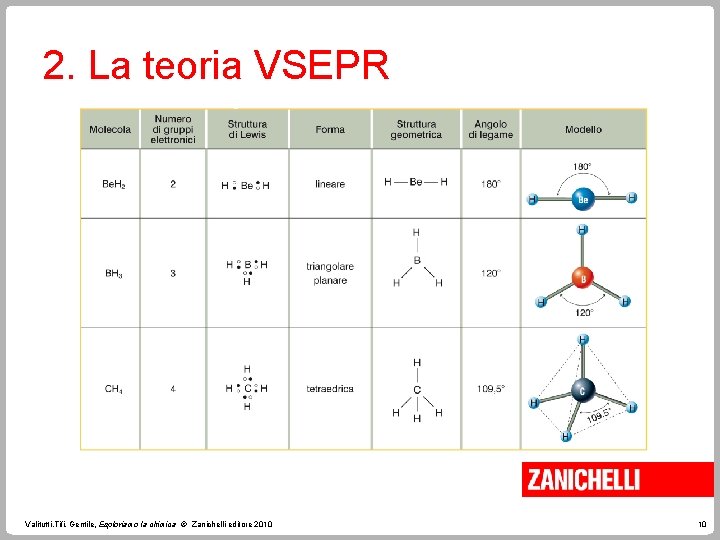
2. La teoria VSEPR In base al numero di coppie elettroniche intorno all’atomo centrale si ha che • due coppie individuano una geometria lineare con angoli di 180°; • tre coppie determinano un assetto triangolare equilatero con angoli di 120°; • quattro coppie individuano una geometria tetraedrica con angoli di 109, 5°. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 9

2. La teoria VSEPR Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 10

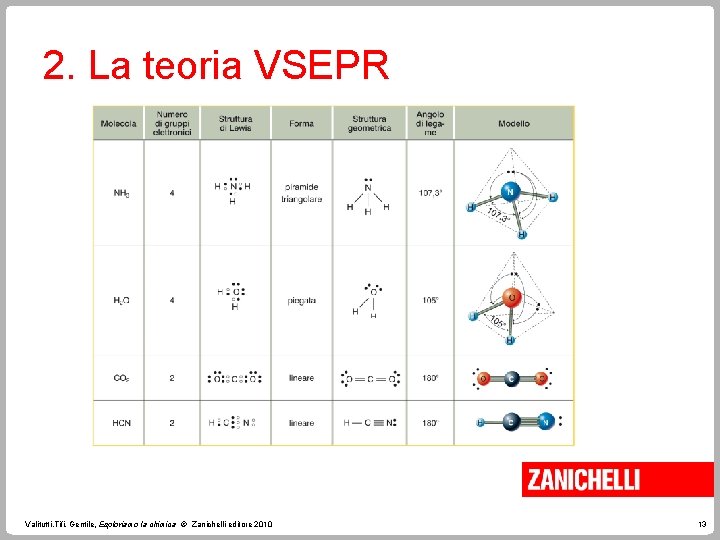
2. La teoria VSEPR Le coppie di elettroni liberi hanno un comportamento simile a quello delle coppie condivise, ma la repulsione tra coppie elettroniche libere è maggiore di quella tra coppie elettroniche condivise. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 11

2. La teoria VSEPR Nel caso di coppie elettroniche libere, la forma della molecola tiene conto anche del doppietto elettronico. I legami covalenti doppi e tripli valgono come un legame singolo ai fini della geometria molecolare. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 12

2. La teoria VSEPR Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 13

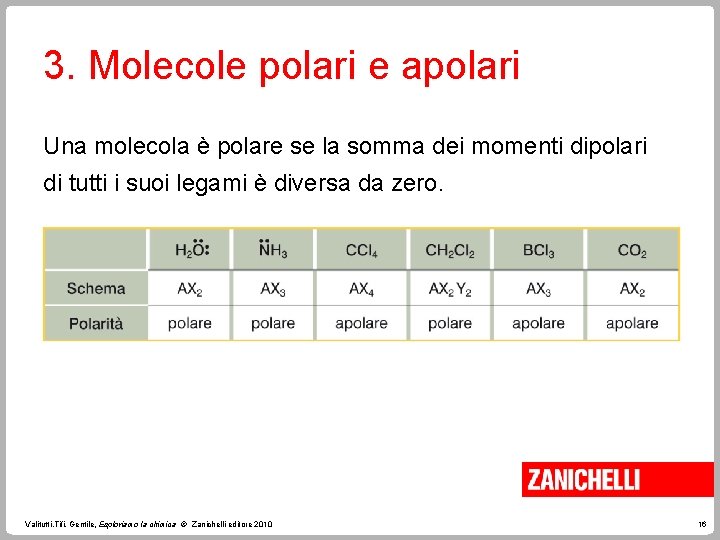
3. Molecole polari e apolari La polarità di una molecola dipende anche dalla geometria della molecola, cioè dalla disposizione nello spazio dei suoi legami. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 14

3. Molecole polari e apolari Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 15

3. Molecole polari e apolari Una molecola è polare se la somma dei momenti dipolari di tutti i suoi legami è diversa da zero. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 16

3. Molecole polari e apolari La polarità delle molecole determina la solubilità della sostanza nei diversi solventi. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 17

3. Molecole polari e apolari I solventi sciolgono le sostanze che hanno polarità simile: solventi polari sciolgono sostanze polari, solventi apolari solubilizzano sostanze apolari. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 18

4. Le forze intermolecolari sono forze di natura elettrostatica che mantengono le molecole vicine tra loro. Si conoscono due tipi di legami intermolecolari 1. forze dipolo-dipolo e di London; 2. legame a idrogeno. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 19

4. Le forze intermolecolari Le forze dipolo-dipolo sono forze di attrazione tra dipoli, in qualsiasi stato fisico si trovino. I legami elettrostatici tra dipoli permanenti sono chiamati forze dipolo-dipolo. Le forze di London sono dovute all’attrazione tra i dipoli temporanei di molecole vicine. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 20

4. Le forze intermolecolari Il legame a idrogeno è una forza attrattiva che si instaura tra molecole che contengono un atomo di idrogeno legato covalentemente a un atomo piccolo, molto elettronegativo e con una coppia elettronica libera (N, O, F). Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 21

4. Le forze intermolecolari Il legame a idrogeno è la più grande forza attrattiva intermolecolare ma è circa 10 volte più debole di un legame covalente. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 22

4. Le forze intermolecolari Le proprietà dell’acqua dipendono dal legame a idrogeno. Il legame a idrogeno influisce sulle proprietà fisiche delle sostanze che lo contengono. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 23

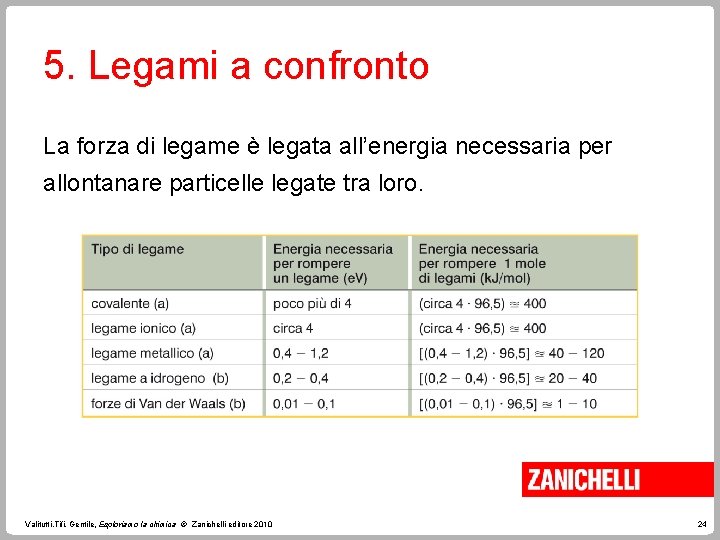
5. Legami a confronto La forza di legame è legata all’energia necessaria per allontanare particelle legate tra loro. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 24

5. Legami a confronto La scala di energia dei legami atomici è assai diversa da quella delle forze intermolecolari. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 25

6. La classificazione dei solidi Le proprietà macroscopiche della materia dipendono dalle interazioni fra particelle microscopiche la costituiscono. I solidi vengono classificati in base al tipo di legame che aggrega le unità costitutive. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 26

6. La classificazione dei solidi I solidi cristallini hanno una dispozsizione interna regolare di atomi, molecole e ioni. Essi possono essere • ionici; • reticolari; • molecolari; • metallici. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 27

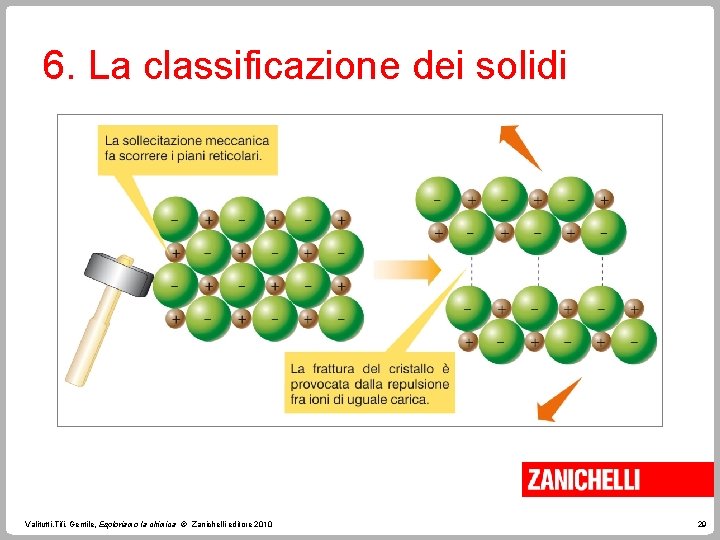
6. La classificazione dei solidi I cristalli ionici si formano in virtù dell’attrazione fra ioni con carica opposta. Sono fragili, presentano elevata temperatura di fusione, conducono elettricità allo stato fuso e in soluzione acquosa. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 28

6. La classificazione dei solidi Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 29

6. La classificazione dei solidi I cristalli covalenti o solidi reticolari si formano grazie a una rete tridimensionale di legami covalenti fra gli atomi. Sono duri, hanno temperatura di fusione elevata, non conducono elettricità e non sono solubili in acqua. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 30

6. La classificazione dei solidi I cristalli molecolari apolari sono costituiti da molecole apolari tenute insieme da forze di Van der Waals. Sono solidi a bassissime temperature, quasi mai a temperatura ambiente, sono solubili in solventi apolari e non in acqua. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 31

6. La classificazione dei solidi I cristalli molecolari polari sono costituiti da molecole polari che si attraggono con legami dipolo-dipolo o legami a idrogeno. Hanno basse temperature di fusione, non conducono elettricità nonostante siano solubili in acqua. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 32

6. La classificazione dei solidi I cristalli metallici sono costituiti da atomi legati con legame metallico. Sono duttili, malleabili, conducono elettricità e calore. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 33

6. La classificazione dei solidi Le leghe sono soluzioni di più metalli allo stato solido. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 34

7. Le proprietà intensive dello stato liquido Le molecole dei liquidi sono molto mobili e incomprimibili. Molte proprietà dei liquidi dipendono dalla natura delle forze intermolecolari che agiscono nella sostanza. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 35

7. Le proprietà intensive dello stato liquido La tensione di vapore è la pressione esercitata dalle molecole che evaporano da un liquido in un recipiente chiuso quando velocità di evaporazione e di condensazione si uguagliano. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 36

7. Le proprietà intensive dello stato liquido La tensione di vapore è tanto più alta quanto più è elevata la temperatura. A parità di temperatura, la facilità con cui le molecole sfuggono dal proprio liquido dipende dall’intensità delle loro forze attrattive. I liquidi che hanno un’elevata tensione di vapore si dicono volatili. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 37

7. Le proprietà intensive dello stato liquido La tensione superficiale di un liquido è l’energia necessaria per far aumentare di un’unità la sua area superficiale. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 38

7. Le proprietà intensive dello stato liquido La tensione superficiale diminuisce all’aumentare della temperatura perché l’agitazione termica delle molecole attenua i legami intermolecolari. La presenza di tensioattivi diminuisce la tensione superficiale. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 39

7. Le proprietà intensive dello stato liquido La capillarità è un fenomeno che provoca l’innalzamento o l’abbassamento del livello di un liquido all’interno di un capillare. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 40

7. Le proprietà intensive dello stato liquido La viscosità, cioè la resistenza alla scorrimento, è dovuta alla forza di attrazione intermolecolare tra le lamine liquide. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 41
 Valitutti esploriamo soluzioni
Valitutti esploriamo soluzioni Valitutti soluzioni capitolo 11
Valitutti soluzioni capitolo 11 Ionizzazione dell'acqua zanichelli
Ionizzazione dell'acqua zanichelli Franco lucisano editore
Franco lucisano editore Valitutti zanichelli
Valitutti zanichelli Ku isitma
Ku isitma N
N Chimica zanichelli soluzioni capitolo 16
Chimica zanichelli soluzioni capitolo 16 Proust
Proust Reazioni reversibili e irreversibili
Reazioni reversibili e irreversibili Chimica più soluzioni capitolo 6
Chimica più soluzioni capitolo 6 Stati condensati della materia
Stati condensati della materia Capitolo 11 chimica zanichelli
Capitolo 11 chimica zanichelli Molarità e molalità
Molarità e molalità Solu zanichelli
Solu zanichelli Scala di riduzione
Scala di riduzione Soluzioni chimica zanichelli capitolo 6
Soluzioni chimica zanichelli capitolo 6 Soluzioni capitolo 8
Soluzioni capitolo 8 Soluzioni capitolo 16 le reazioni chimiche
Soluzioni capitolo 16 le reazioni chimiche Chimica più dalla materia alla nomenclatura soluzioni
Chimica più dalla materia alla nomenclatura soluzioni Elettrolisi acqua
Elettrolisi acqua Soluzioni capitolo 11 chimica più
Soluzioni capitolo 11 chimica più Capitolo 19 zanichelli chimica
Capitolo 19 zanichelli chimica Energia cinetica
Energia cinetica Sistema endocrino zanichelli
Sistema endocrino zanichelli Scopriamo la biologia zanichelli
Scopriamo la biologia zanichelli Formula minima
Formula minima Chimica piu capitolo 19 soluzioni
Chimica piu capitolo 19 soluzioni Capitolo 10 chimica più soluzioni
Capitolo 10 chimica più soluzioni Soluzioni capitolo 10
Soluzioni capitolo 10 Soluzioni zanichelli chimica capitolo 14
Soluzioni zanichelli chimica capitolo 14 Dissociazione chimica
Dissociazione chimica Capitolo 14 chimica zanichelli
Capitolo 14 chimica zanichelli Dina gentile
Dina gentile Gentile da fabriano adorazione dei magi analisi
Gentile da fabriano adorazione dei magi analisi Andorre gentilé
Andorre gentilé Chi è questa che ven ch ogn om la mira
Chi è questa che ven ch ogn om la mira Un'intera nottata buttato vicino a un compagno massacrato
Un'intera nottata buttato vicino a un compagno massacrato Tim gentile
Tim gentile Greg matarazzo
Greg matarazzo Thomas c gentile
Thomas c gentile Riforma gentile 1923
Riforma gentile 1923






























































