Capitolo 10 Gli stati condensati della materia Copyright
































- Slides: 58

Capitolo 10 Gli stati condensati della materia Copyright © 2008 Zanichelli editore 10. 1 Le forze intermolecolari dipendono dalla distanza fra le molecole e spiegano le differenze fra gas, liquidi e solidi 10. 2 Le attrazioni intermolecolari sono determinate dall’interazione fra cariche elettriche 10. 3 Le proprietà fisiche dei liquidi e dei solidi sono influenzate dalle forze intermolecolari 10. 4 I cambiamenti di stato implicano equilibri dinamici 10. 5 La pressione di vapore dipende dalla temperatura e dalle interazioni intermolecolari 10. 6 Un liquido bolle quando la sua pressione di vapore è uguale alla pressione atmosferica 10. 7 I diagrammi di fase rappresentano graficamente le relazioni fra temperatura e pressione 10. 8 Lo stato solido è caratterizzato da una struttura interna ordinata 10. 9 Lo stato solido è caratterizzato da una struttura interna ordinata 10. 10 Le nanotecnologie consentono di controllare la struttura a livello molecolare

10. 1 LE FORZE INTERMOLECOLARI DIPENDONO DALLA DISTANZA FRA LE MOLECOLE E SPIEGANO LE DIFFERENZE FRA GAS, LIQUIDI E SOLIDI Come sappiamo la spiegazione delle proprietà fisiche delle sostanze sta nel modo in cui le particelle si dispongono nei tre stati solido, liquido e gassoso. Se tra le particelle della materia non si instaurassero forze di attrazione reciproche, essa si troverebbe tutta allo stato gassoso in ogni condizione di temperatura e pressione. Le proprietà delle sostanze negli stati condensati sono sensibilmente influenzate da forze intermolecolari, forze che si stabiliscono tra le particelle e che dipendono strettamente dalla loro distanza reciproca. Copyright © 2008 Zanichelli editore

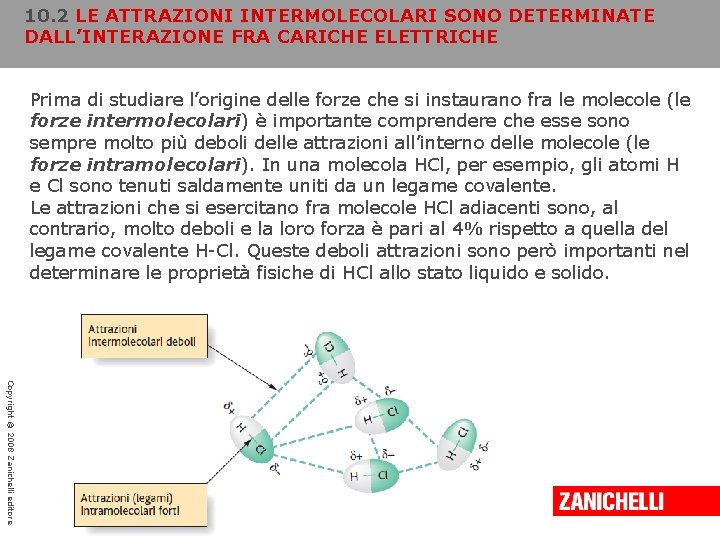
10. 2 LE ATTRAZIONI INTERMOLECOLARI SONO DETERMINATE DALL’INTERAZIONE FRA CARICHE ELETTRICHE Prima di studiare l’origine delle forze che si instaurano fra le molecole (le forze intermolecolari) è importante comprendere che esse sono sempre molto più deboli delle attrazioni all’interno delle molecole (le forze intramolecolari). In una molecola HCl, per esempio, gli atomi H e Cl sono tenuti saldamente uniti da un legame covalente. Le attrazioni che si esercitano fra molecole HCl adiacenti sono, al contrario, molto deboli e la loro forza è pari al 4% rispetto a quella del legame covalente H-Cl. Queste deboli attrazioni sono però importanti nel determinare le proprietà fisiche di HCl allo stato liquido e solido. Copyright © 2008 Zanichelli editore

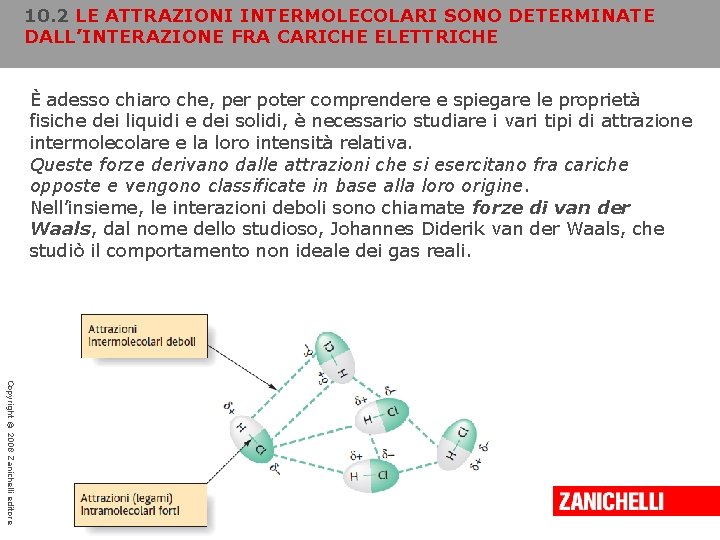
10. 2 LE ATTRAZIONI INTERMOLECOLARI SONO DETERMINATE DALL’INTERAZIONE FRA CARICHE ELETTRICHE È adesso chiaro che, per poter comprendere e spiegare le proprietà fisiche dei liquidi e dei solidi, è necessario studiare i vari tipi di attrazione intermolecolare e la loro intensità relativa. Queste forze derivano dalle attrazioni che si esercitano fra cariche opposte e vengono classificate in base alla loro origine. Nell’insieme, le interazioni deboli sono chiamate forze di van der Waals, dal nome dello studioso, Johannes Diderik van der Waals, che studiò il comportamento non ideale dei gas reali. Copyright © 2008 Zanichelli editore

10. 2 LE ATTRAZIONI INTERMOLECOLARI SONO DETERMINATE DALL’INTERAZIONE FRA CARICHE ELETTRICHE LE ATTRAZIONI DIPOLO-DIPOLO SI STABILISCONO TRA MOLECOLE POLARI ► Le molecole polari, come HCl tendono a orientarsi in modo che la parte positiva di un dipolo sia vicina a quella negativa di un altro, anche se l’oscillazione termica delle molecole determina un allineamento non perfetto. Ciò non impedisce, però, un’attrazione fra le molecole polari. Questo tipo di attrazione intermolecolare prende il nome di attrazione dipolo-dipolo e ha un’intensità pari a circa l’ 1% rispetto a quella di un legame covalente. Le attrazioni dipolo-dipolo si indeboliscono rapidamente all’aumentare della distanza fra i dipoli. Copyright © 2008 Zanichelli editore

10. 2 LE ATTRAZIONI INTERMOLECOLARI SONO DETERMINATE DALL’INTERAZIONE FRA CARICHE ELETTRICHE IL LEGAME A IDROGENO È LA PIÙ INTENSA TRA LE FORZE INTERMOLECOLARI ► Quando un atomo di idrogeno è legato covalentemente a un piccolo atomo molto elettronegativo, come il fluoro, l’ossigeno o l’azoto, si verifica un’attrazione dipolo-dipolo particolarmente forte. In queste condizioni, l’intensità delle interazioni è insolitamente elevata per diverse ragioni. In primo luogo, i legami F-H, O-H e N-H sono molto polari. Data la notevole differenza di elettronegatività fra gli atomi, le due estremità dei dipoli portano una frazione di carica piuttosto alta. Le cariche sono inoltre particolarmente concentrate a causa delle ridotte dimensioni degli atomi coinvolti (ciò equivale a dire che gli atomi presentano un’alta densità di carica). Copyright © 2008 Zanichelli editore

10. 2 LE ATTRAZIONI INTERMOLECOLARI SONO DETERMINATE DALL’INTERAZIONE FRA CARICHE ELETTRICHE IL LEGAME A IDROGENO È LA PIÙ INTENSA TRA LE FORZE INTERMOLECOLARI ► Per lo stesso motivo, infine, la distanza fra le estremità di segno opposto è molto piccola. La combinazione di questi tre fattori produce un’attrazione dipolo-dipolo piuttosto intensa, nota come legame a idrogeno. Un legame a idrogeno è circa cinque volte più forte di una qualsiasi altra attrazione dipolo-dipolo. Molte molecole di importanza biologica, come le proteine e gli acidi nucleici, contengono legami N-H e O-H; il legame a idrogeno rappresenta quindi un fattore di importanza primaria nel determinare la struttura complessiva e la funzione di queste particolari molecole. La presenza del legame a idrogeno conferisce all’acqua alcune proprietà insolite e peculiari. Copyright © 2008 Zanichelli editore

10. 2 LE ATTRAZIONI INTERMOLECOLARI SONO DETERMINATE DALL’INTERAZIONE FRA CARICHE ELETTRICHE IL LEGAME A IDROGENO È LA PIÙ INTENSA TRA LE FORZE INTERMOLECOLARI ► La maggior parte delle sostanze aumenta la propria densità nel passaggio dallo stato liquido allo stato solido, ma ciò non accade nel caso dell’acqua. Nell’acqua liquida i legami a idrogeno si rompono e si riformano secondo un processo continuo. Non appena l’acqua comincia a congelare, però, le molecole vengono bloccate in una precisa posizione e ciascuna di esse partecipa alla formazione di quattro legami a idrogeno. La struttura che ne risulta occupa un volume maggiore rispetto all’acqua liquida: il ghiaccio è quindi meno denso e vi galleggia sopra. Copyright © 2008 Zanichelli editore

10. 2 LE ATTRAZIONI INTERMOLECOLARI SONO DETERMINATE DALL’INTERAZIONE FRA CARICHE ELETTRICHE LE FORZE DI LONDON SI STABILISCONO PER TEMPORANEA POLARIZZAZIONE DI MOLECOLE APOLARI ► Le forze di attrazione intermolecolari esistono anche fra le particelle che costituiscono le sostanze apolari, come gli atomi dei gas nobili e le molecole apolari Cl 2 e CH 4. Se raffreddate a temperature sufficientemente basse, anche queste sostanze apolari possono essere condensate allo stato liquido o, addirittura, solido. Per quanto deboli, quindi, devono esistere delle forze di attrazione fra le particelle, tali da determinare il loro avvicinamento. Nel 1930 Fritz London, un fisico tedesco, spiegò come le attrazioni intermolecolari potessero influenzare le particelle delle sostanze apolari. Egli partì dalla considerazione che gli elettroni di un atomo o di una molecola sono in continuo movimento. Copyright © 2008 Zanichelli editore

10. 2 LE ATTRAZIONI INTERMOLECOLARI SONO DETERMINATE DALL’INTERAZIONE FRA CARICHE ELETTRICHE LE FORZE DI LONDON SI STABILISCONO PER TEMPORANEA POLARIZZAZIONE DI MOLECOLE APOLARI ► Se potessimo esaminare questi movimenti in due particelle vicine, osserveremmo che gli elettroni delle due particelle si influenzano reciprocamente; essi, infatti, si respingono e tendono a disporsi il più lontano possibile fra loro. Quindi, se gli elettroni di una particella si avvicinano all’altra, gli elettroni di quest’ultima vengono respinti. In una certa misura, a causa del continuo movimento degli elettroni, la densità elettronica nelle due particelle fluttua in modo sincrono. Copyright © 2008 Zanichelli editore

10. 2 LE ATTRAZIONI INTERMOLECOLARI SONO DETERMINATE DALL’INTERAZIONE FRA CARICHE ELETTRICHE LE FORZE DI LONDON SI STABILISCONO PER TEMPORANEA POLARIZZAZIONE DI MOLECOLE APOLARI ► È importante osservare che, in un certo istante, la densità elettronica di una particella può essere asimmetrica, con un addensamento disomogeneo di carica alle due estremità. In quell’istante, la particella è un dipolo temporaneo o dipolo istantaneo. Copyright © 2008 Zanichelli editore

10. 2 LE ATTRAZIONI INTERMOLECOLARI SONO DETERMINATE DALL’INTERAZIONE FRA CARICHE ELETTRICHE LE FORZE DI LONDON SI STABILISCONO PER TEMPORANEA POLARIZZAZIONE DI MOLECOLE APOLARI ► Copyright © 2008 Zanichelli editore La formazione di un dipolo istantaneo influenza la densità elettronica della particella vicina che, sua volta, diventa un dipolo. In questo caso si parla di dipolo indotto, perché è causato o indotto dalla formazione e dalla vicinanza del primo dipolo. In virtù di come si formano questi dipoli, l’estremità positiva di uno è sempre vicina all’estremità negativa dell’altro, causando un’attrazione reciproca. L’attrazione ha però un carattere temporaneo. Queste interazioni appena viste sono chiamate attrazioni dipolo istantaneo-dipolo e sono interazioni deboli indotto per distinguerle dalle attrazioni permanenti fra i dipoli delle molecole polari come HCl. Sono anche note come forze di dispersione di London (o semplicemente forze di London o forze di dispersione). Le forze di London sono presenti in tutte le molecole e gli ioni.

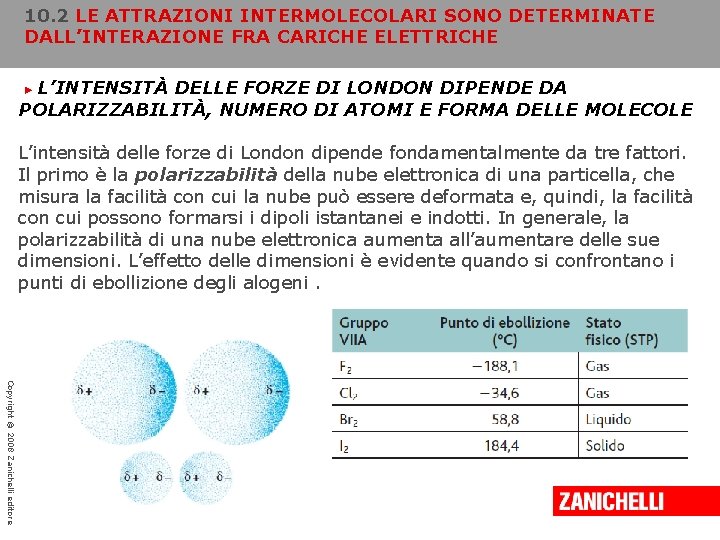
10. 2 LE ATTRAZIONI INTERMOLECOLARI SONO DETERMINATE DALL’INTERAZIONE FRA CARICHE ELETTRICHE L’INTENSITÀ DELLE FORZE DI LONDON DIPENDE DA POLARIZZABILITÀ, NUMERO DI ATOMI E FORMA DELLE MOLECOLE ► L’intensità delle forze di London dipende fondamentalmente da tre fattori. Il primo è la polarizzabilità della nube elettronica di una particella, che misura la facilità con cui la nube può essere deformata e, quindi, la facilità con cui possono formarsi i dipoli istantanei e indotti. In generale, la polarizzabilità di una nube elettronica aumenta all’aumentare delle sue dimensioni. L’effetto delle dimensioni è evidente quando si confrontano i punti di ebollizione degli alogeni. Copyright © 2008 Zanichelli editore

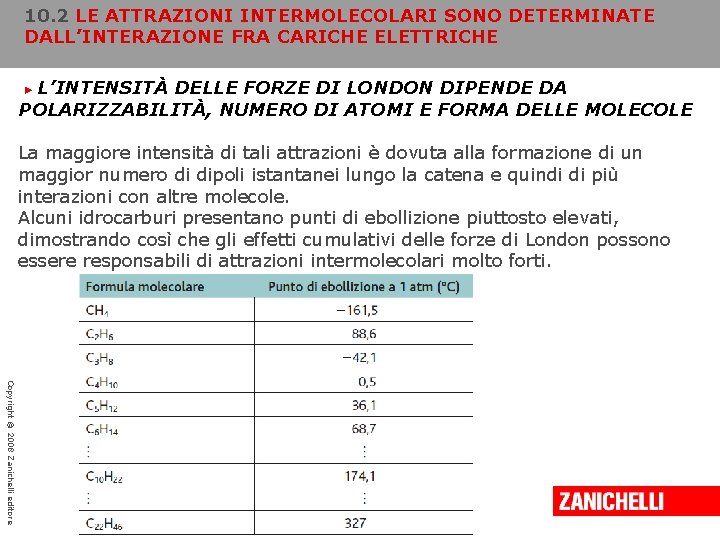
10. 2 LE ATTRAZIONI INTERMOLECOLARI SONO DETERMINATE DALL’INTERAZIONE FRA CARICHE ELETTRICHE L’INTENSITÀ DELLE FORZE DI LONDON DIPENDE DA POLARIZZABILITÀ, NUMERO DI ATOMI E FORMA DELLE MOLECOLE ► Il secondo fattore che influenza l’entità delle forze di London è il numero di atomi presenti in una molecola. Nel caso di molecole che contengono gli stessi elementi, le forze di London divengono più intense all’aumentare del numero di atomi, come dimostrato dagli idrocarburi. Le molecole degli idrocarburi sono costituite da catene di atomi di carbonio legati ad atomi di idrogeno. Quando confrontiamo due molecole di diversa lunghezza, per esempio C 3 H 8 e C 6 H 14, quella con la catena più lunga possiede un punto di ebollizione più elevato. Ciò significa che la molecola più grande risente maggiormente delle forze di attrazione intermolecolari. Copyright © 2008 Zanichelli editore

10. 2 LE ATTRAZIONI INTERMOLECOLARI SONO DETERMINATE DALL’INTERAZIONE FRA CARICHE ELETTRICHE L’INTENSITÀ DELLE FORZE DI LONDON DIPENDE DA POLARIZZABILITÀ, NUMERO DI ATOMI E FORMA DELLE MOLECOLE ► La maggiore intensità di tali attrazioni è dovuta alla formazione di un maggior numero di dipoli istantanei lungo la catena e quindi di più interazioni con altre molecole. Alcuni idrocarburi presentano punti di ebollizione piuttosto elevati, dimostrando così che gli effetti cumulativi delle forze di London possono essere responsabili di attrazioni intermolecolari molto forti. Copyright © 2008 Zanichelli editore

10. 2 LE ATTRAZIONI INTERMOLECOLARI SONO DETERMINATE DALL’INTERAZIONE FRA CARICHE ELETTRICHE L’INTENSITÀ DELLE FORZE DI LONDON DIPENDE DA POLARIZZABILITÀ, NUMERO DI ATOMI E FORMA DELLE MOLECOLE ► Copyright © 2008 Zanichelli editore Il terzo fattore che influenza l’intensità delle forze di London è la forma delle molecole, importante anche quando due molecole hanno lo stesso numero e tipo di atomi. Consideriamo, per esempio, due molecole, entrambe con formula molecolare C 5 H 12. La molecola del neopentano, (CH 3)4 C, più compatta, ha un punto di ebollizione inferiore rispetto alla molecola lineare dell’npentano, CH 3 CH 2 CH 2 CH 3. A causa di tale compattezza, i singoli atomi di idrogeno di due molecole di neopentano vicine non possono interagire così efficacemente come quelli presenti nella molecola lineare.

10. 2 LE ATTRAZIONI INTERMOLECOLARI SONO DETERMINATE DALL’INTERAZIONE FRA CARICHE ELETTRICHE L’INTENSITÀ DELLE FORZE DI LONDON DIPENDE DA POLARIZZABILITÀ, NUMERO DI ATOMI E FORMA DELLE MOLECOLE ► Conoscendo la struttura molecolare di una sostanza, siamo adesso in grado di stimare la natura e l’intensità relativa delle attrazioni intermolecolari in essa presenti. Copyright © 2008 Zanichelli editore

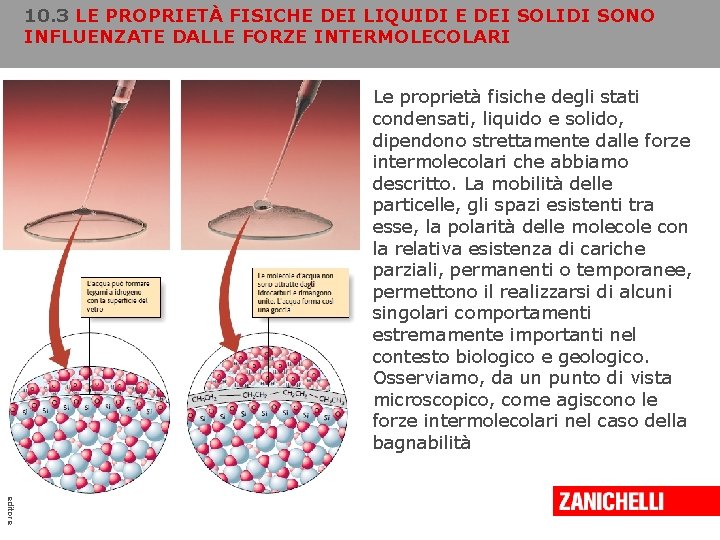
10. 3 LE PROPRIETÀ FISICHE DEI LIQUIDI E DEI SOLIDI SONO INFLUENZATE DALLE FORZE INTERMOLECOLARI Copyright © 2008 Zanichelli editore Le proprietà fisiche degli stati condensati, liquido e solido, dipendono strettamente dalle forze intermolecolari che abbiamo descritto. La mobilità delle particelle, gli spazi esistenti tra esse, la polarità delle molecole con la relativa esistenza di cariche parziali, permanenti o temporanee, permettono il realizzarsi di alcuni singolari comportamenti estremamente importanti nel contesto biologico e geologico. Osserviamo, da un punto di vista microscopico, come agiscono le forze intermolecolari nel caso della bagnabilità

10. 3 LE PROPRIETÀ FISICHE DEI LIQUIDI E DEI SOLIDI SONO INFLUENZATE DALLE FORZE INTERMOLECOLARI Ecco alcune proprietà comuni: Copyright © 2008 Zanichelli editore

10. 3 LE PROPRIETÀ FISICHE DEI LIQUIDI E DEI SOLIDI SONO INFLUENZATE DALLE FORZE INTERMOLECOLARI Copyright © 2008 Zanichelli editore

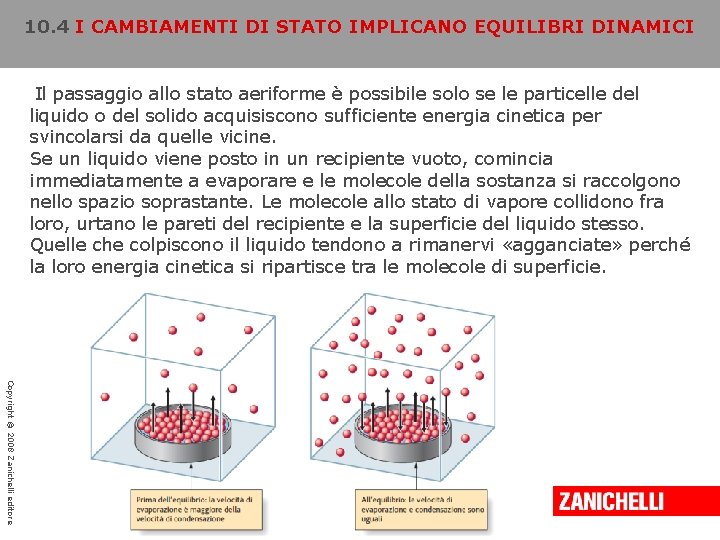
10. 4 I CAMBIAMENTI DI STATO IMPLICANO EQUILIBRI DINAMICI Il passaggio allo stato aeriforme è possibile solo se le particelle del liquido o del solido acquisiscono sufficiente energia cinetica per svincolarsi da quelle vicine. Se un liquido viene posto in un recipiente vuoto, comincia immediatamente a evaporare e le molecole della sostanza si raccolgono nello spazio soprastante. Le molecole allo stato di vapore collidono fra loro, urtano le pareti del recipiente e la superficie del liquido stesso. Quelle che colpiscono il liquido tendono a rimanervi «agganciate» perché la loro energia cinetica si ripartisce tra le molecole di superficie. Copyright © 2008 Zanichelli editore

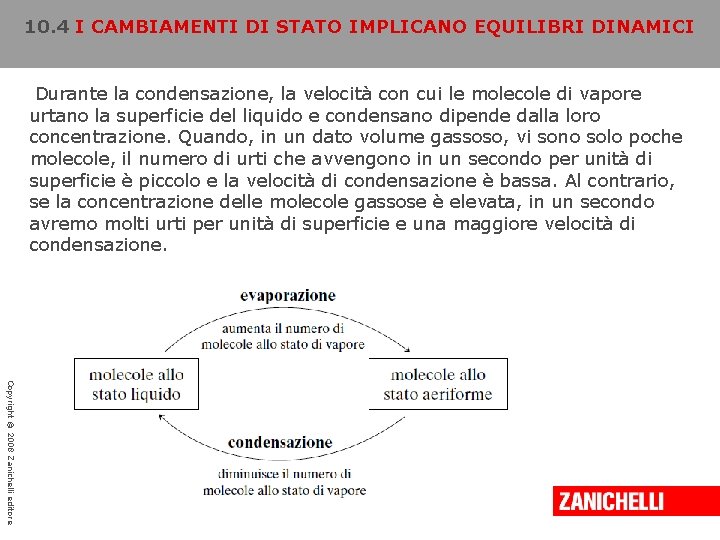
10. 4 I CAMBIAMENTI DI STATO IMPLICANO EQUILIBRI DINAMICI Durante la condensazione, la velocità con cui le molecole di vapore urtano la superficie del liquido e condensano dipende dalla loro concentrazione. Quando, in un dato volume gassoso, vi sono solo poche molecole, il numero di urti che avvengono in un secondo per unità di superficie è piccolo e la velocità di condensazione è bassa. Al contrario, se la concentrazione delle molecole gassose è elevata, in un secondo avremo molti urti per unità di superficie e una maggiore velocità di condensazione. Copyright © 2008 Zanichelli editore

10. 4 I CAMBIAMENTI DI STATO IMPLICANO EQUILIBRI DINAMICI A mano a mano che il vapore si accumula, la velocità di condensazione aumenta a sua volta, fino a quando non diventa uguale alla velocità di evaporazione. Da questo momento in poi il numero di molecole allo stato di vapore rimane costante perché si è raggiunta una condizione di equilibrio dinamico, in cui i due fenomeni, l’evaporazione e la condensazione, avvengono alla stessa velocità annullando reciprocamente i loro effetti. Si tratta di un equilibrio perché non si verificano variazioni: il numero delle molecole allo stato di vapore rimane costante come quello delle molecole allo stato liquido. L’equilibrio è dinamico perché i due fenomeni non sono cessati: le molecole continuano a evaporare e a condensare, ma lo fanno alla stessa velocità. Copyright © 2008 Zanichelli editore

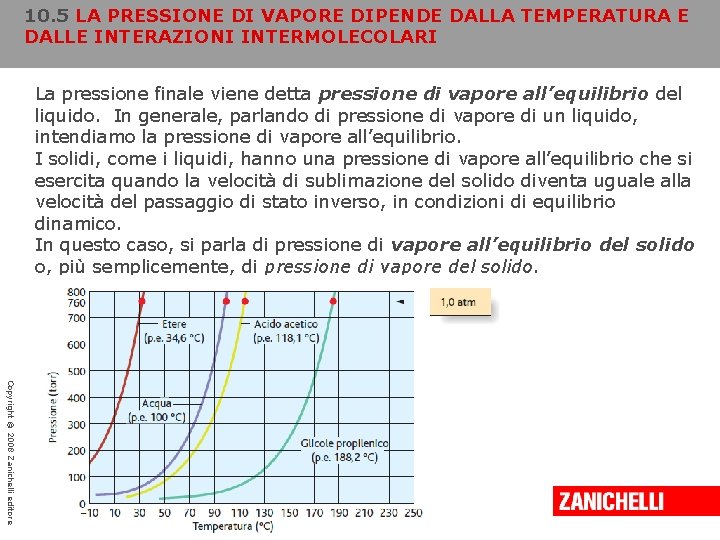
10. 5 LA PRESSIONE DI VAPORE DIPENDE DALLA TEMPERATURA E DALLE INTERAZIONI INTERMOLECOLARI Quando un liquido evapora, le molecole che passano allo stato di vapore esercitano una pressione chiamata pressione di vapore, che si registra dal momento in cui il liquido inizia a evaporare, riempiendo lo spazio soprastante. Se l’evaporazione avviene all’interno di un recipiente chiuso, questa pressione aumenta fino a quando non si raggiunge la condizione di equilibrio; una volta che le velocità di evaporazione e condensazione si sono eguagliate, la concentrazione delle molecole nel vapore rimane costante e il vapore esercita una pressione costante. La pressione finale viene detta pressione di vapore all’equilibrio del liquido. In generale, parlando di pressione di vapore di un liquido, intendiamo la pressione di vapore all’equilibrio. Copyright © 2008 Zanichelli editore

10. 5 LA PRESSIONE DI VAPORE DIPENDE DALLA TEMPERATURA E DALLE INTERAZIONI INTERMOLECOLARI La pressione finale viene detta pressione di vapore all’equilibrio del liquido. In generale, parlando di pressione di vapore di un liquido, intendiamo la pressione di vapore all’equilibrio. I solidi, come i liquidi, hanno una pressione di vapore all’equilibrio che si esercita quando la velocità di sublimazione del solido diventa uguale alla velocità del passaggio di stato inverso, in condizioni di equilibrio dinamico. In questo caso, si parla di pressione di vapore all’equilibrio del solido o, più semplicemente, di pressione di vapore del solido. Copyright © 2008 Zanichelli editore

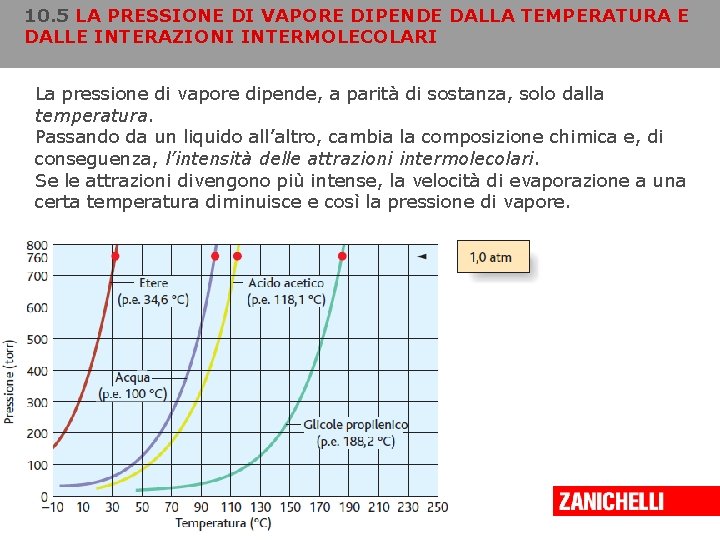
10. 5 LA PRESSIONE DI VAPORE DIPENDE DALLA TEMPERATURA E DALLE INTERAZIONI INTERMOLECOLARI La pressione di vapore dipende, a parità di sostanza, solo dalla temperatura. Passando da un liquido all’altro, cambia la composizione chimica e, di conseguenza, l’intensità delle attrazioni intermolecolari. Se le attrazioni divengono più intense, la velocità di evaporazione a una certa temperatura diminuisce e così la pressione di vapore. Copyright © 2008 Zanichelli editore

10. 6 UN LIQUIDO BOLLE QUANDO LA SUA PRESSIONE DI VAPORE È UGUALE ALLA PRESSIONE ATMOSFERICA Quando un liquido comincia a bollire, al suo interno si formano delle grosse bolle che salgono in superficie. Se poniamo un termometro nell’acqua bollente, osserviamo che la sua temperatura rimane costante pur continuando a fornire calore. La temperatura di qualsiasi liquido puro non varia durante l’ebollizione. La temperatura a cui un liquido bolle si chiama punto di ebollizione (p. e. ); ogni liquido puro ha un proprio punto di ebollizione, caratteristico a una data pressione. Se la pressione non cambia, esso rimane costante. Copyright © 2008 Zanichelli editore

10. 6 UN LIQUIDO BOLLE QUANDO LA SUA PRESSIONE DI VAPORE È UGUALE ALLA PRESSIONE ATMOSFERICA Le bolle di un liquido in ebollizione non contengono aria ma vapore del liquido. A mano a mano che una bolla aumenta di dimensioni, si arricchisce di vapore che esercita una pressione sempre maggiore sul liquido circostante. La pressione atmosferica che preme alla superficie si oppone però all’espansione del vapore contenuto nella bolla, determinando il collasso della bolla stessa. Le bolle di vapore non si possono formare fino a quando la temperatura del liquido non ha raggiunto il valore a cui la pressione di vapore uguaglia la pressione atmosferica. Copyright © 2008 Zanichelli editore Più formalmente, si definisce punto di ebollizione la temperatura alla quale la pressione di vapore di un liquido è uguale alla pressione atmosferica sovrastante.

10. 6 UN LIQUIDO BOLLE QUANDO LA SUA PRESSIONE DI VAPORE È UGUALE ALLA PRESSIONE ATMOSFERICA Copyright © 2008 Zanichelli editore Per confrontare il punto di ebollizione di liquidi diversi, i chimici hanno scelto un valore di pressione atmosferica di riferimento pari a 1 atm. Il punto di ebollizione di un liquido a 1 atm è chiamato punto di ebollizione normale. Il punto di ebollizione è una proprietà che dipende dall’intensità delle attrazioni intermolecolari di un liquido. Quando le forze di attrazione sono intense, la pressione di vapore è bassa e il liquido deve essere riscaldato a maggior temperatura perché la sua pressione di vapore risulti uguale alla pressione atmosferica; un elevato punto di ebollizione è perciò una conseguenza delle intense attrazioni intermolecolari. I valori dei punti di ebollizione normali possono essere utilizzati per stimare le attrazioni intermolecolari relative di liquidi diversi.

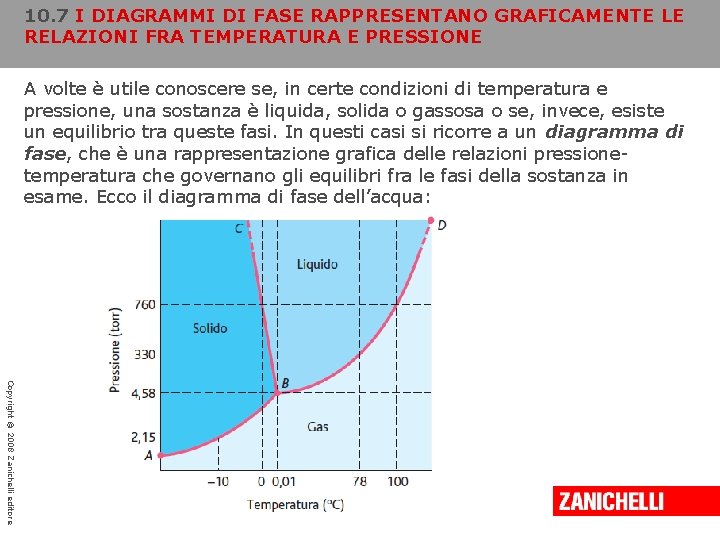
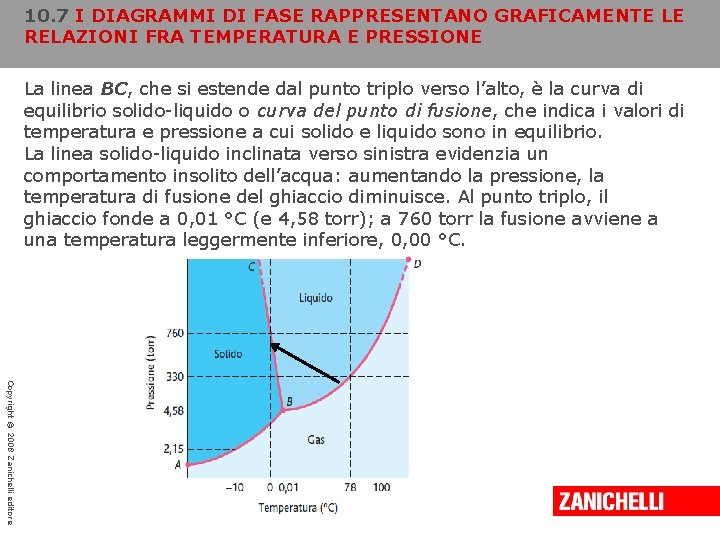
10. 7 I DIAGRAMMI DI FASE RAPPRESENTANO GRAFICAMENTE LE RELAZIONI FRA TEMPERATURA E PRESSIONE A volte è utile conoscere se, in certe condizioni di temperatura e pressione, una sostanza è liquida, solida o gassosa o se, invece, esiste un equilibrio tra queste fasi. In questi casi si ricorre a un diagramma di fase, che è una rappresentazione grafica delle relazioni pressionetemperatura che governano gli equilibri fra le fasi della sostanza in esame. Ecco il diagramma di fase dell’acqua: Copyright © 2008 Zanichelli editore

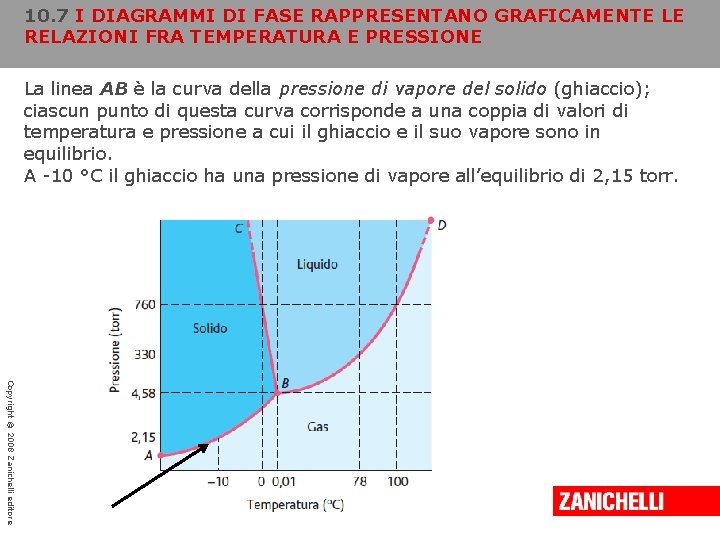
10. 7 I DIAGRAMMI DI FASE RAPPRESENTANO GRAFICAMENTE LE RELAZIONI FRA TEMPERATURA E PRESSIONE La linea AB è la curva della pressione di vapore del solido (ghiaccio); ciascun punto di questa curva corrisponde a una coppia di valori di temperatura e pressione a cui il ghiaccio e il suo vapore sono in equilibrio. A -10 °C il ghiaccio ha una pressione di vapore all’equilibrio di 2, 15 torr. Copyright © 2008 Zanichelli editore

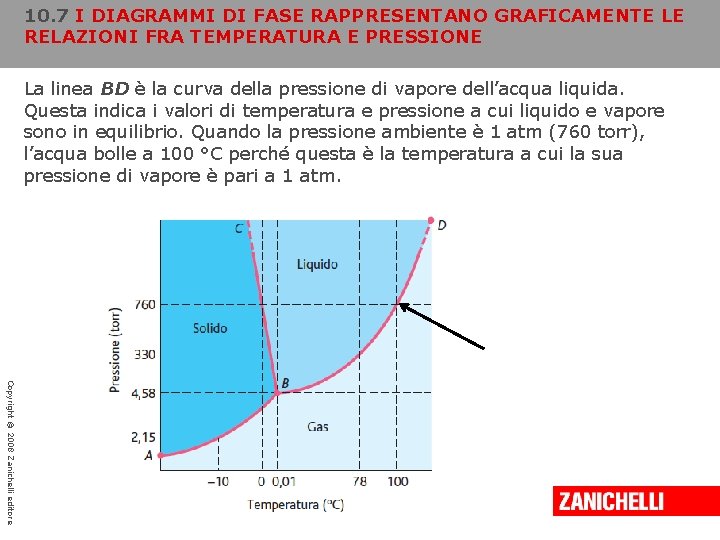
10. 7 I DIAGRAMMI DI FASE RAPPRESENTANO GRAFICAMENTE LE RELAZIONI FRA TEMPERATURA E PRESSIONE La linea BD è la curva della pressione di vapore dell’acqua liquida. Questa indica i valori di temperatura e pressione a cui liquido e vapore sono in equilibrio. Quando la pressione ambiente è 1 atm (760 torr), l’acqua bolle a 100 °C perché questa è la temperatura a cui la sua pressione di vapore è pari a 1 atm. Copyright © 2008 Zanichelli editore

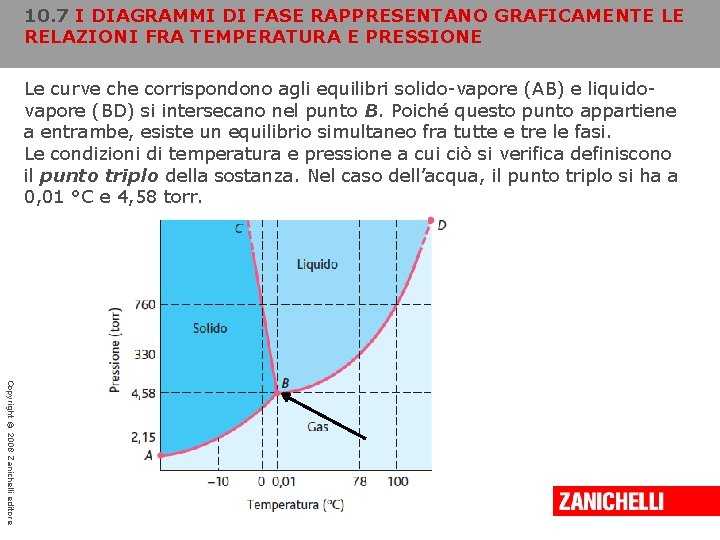
10. 7 I DIAGRAMMI DI FASE RAPPRESENTANO GRAFICAMENTE LE RELAZIONI FRA TEMPERATURA E PRESSIONE Le curve che corrispondono agli equilibri solido-vapore (AB) e liquidovapore (BD) si intersecano nel punto B. Poiché questo punto appartiene a entrambe, esiste un equilibrio simultaneo fra tutte e tre le fasi. Le condizioni di temperatura e pressione a cui ciò si verifica definiscono il punto triplo della sostanza. Nel caso dell’acqua, il punto triplo si ha a 0, 01 °C e 4, 58 torr. Copyright © 2008 Zanichelli editore

10. 7 I DIAGRAMMI DI FASE RAPPRESENTANO GRAFICAMENTE LE RELAZIONI FRA TEMPERATURA E PRESSIONE La linea BC, che si estende dal punto triplo verso l’alto, è la curva di equilibrio solido-liquido o curva del punto di fusione, che indica i valori di temperatura e pressione a cui solido e liquido sono in equilibrio. La linea solido-liquido inclinata verso sinistra evidenzia un comportamento insolito dell’acqua: aumentando la pressione, la temperatura di fusione del ghiaccio diminuisce. Al punto triplo, il ghiaccio fonde a 0, 01 °C (e 4, 58 torr); a 760 torr la fusione avviene a una temperatura leggermente inferiore, 0, 00 °C. Copyright © 2008 Zanichelli editore

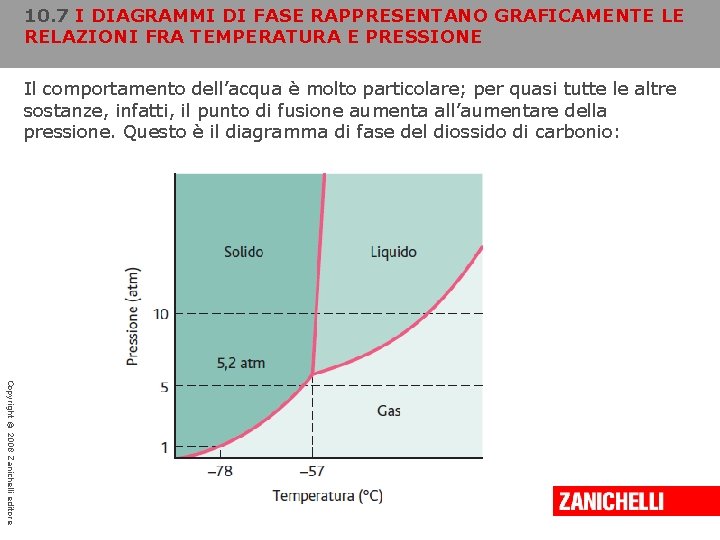
10. 7 I DIAGRAMMI DI FASE RAPPRESENTANO GRAFICAMENTE LE RELAZIONI FRA TEMPERATURA E PRESSIONE Il comportamento dell’acqua è molto particolare; per quasi tutte le altre sostanze, infatti, il punto di fusione aumenta all’aumentare della pressione. Questo è il diagramma di fase del diossido di carbonio: Copyright © 2008 Zanichelli editore

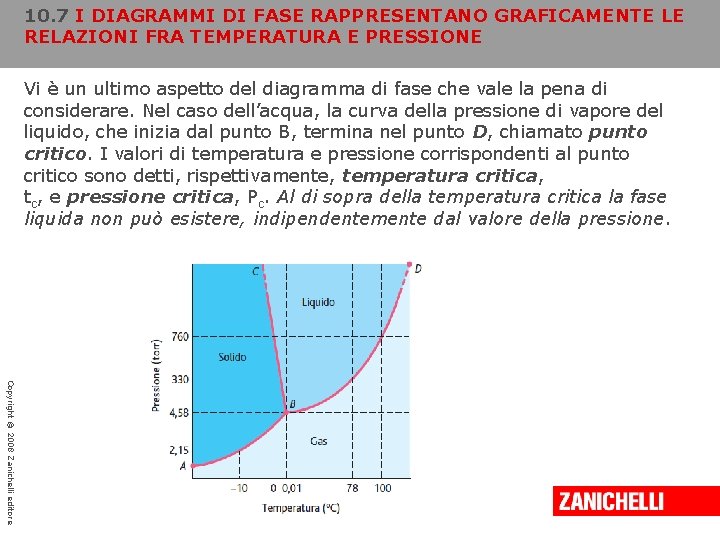
10. 7 I DIAGRAMMI DI FASE RAPPRESENTANO GRAFICAMENTE LE RELAZIONI FRA TEMPERATURA E PRESSIONE Vi è un ultimo aspetto del diagramma di fase che vale la pena di considerare. Nel caso dell’acqua, la curva della pressione di vapore del liquido, che inizia dal punto B, termina nel punto D, chiamato punto critico. I valori di temperatura e pressione corrispondenti al punto critico sono detti, rispettivamente, temperatura critica, tc, e pressione critica, Pc. Al di sopra della temperatura critica la fase liquida non può esistere, indipendentemente dal valore della pressione. Copyright © 2008 Zanichelli editore

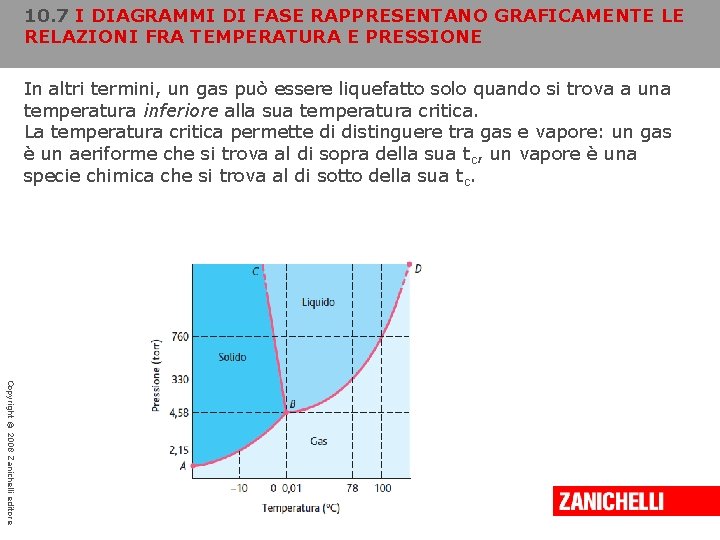
10. 7 I DIAGRAMMI DI FASE RAPPRESENTANO GRAFICAMENTE LE RELAZIONI FRA TEMPERATURA E PRESSIONE In altri termini, un gas può essere liquefatto solo quando si trova a una temperatura inferiore alla sua temperatura critica. La temperatura critica permette di distinguere tra gas e vapore: un gas è un aeriforme che si trova al di sopra della sua t c, un vapore è una specie chimica che si trova al di sotto della sua t c. Copyright © 2008 Zanichelli editore

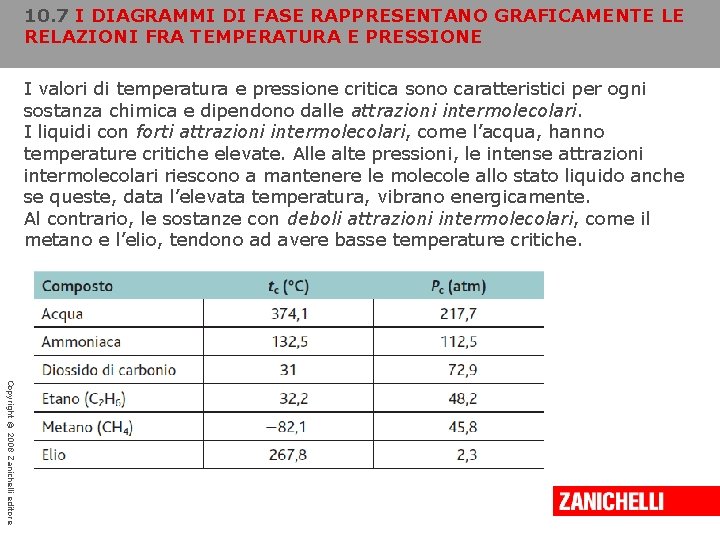
10. 7 I DIAGRAMMI DI FASE RAPPRESENTANO GRAFICAMENTE LE RELAZIONI FRA TEMPERATURA E PRESSIONE I valori di temperatura e pressione critica sono caratteristici per ogni sostanza chimica e dipendono dalle attrazioni intermolecolari. I liquidi con forti attrazioni intermolecolari, come l’acqua, hanno temperature critiche elevate. Alle alte pressioni, le intense attrazioni intermolecolari riescono a mantenere le molecole allo stato liquido anche se queste, data l’elevata temperatura, vibrano energicamente. Al contrario, le sostanze con deboli attrazioni intermolecolari, come il metano e l’elio, tendono ad avere basse temperature critiche. Copyright © 2008 Zanichelli editore

10. 8 LO STATO SOLIDO È CARATTERIZZATO DA UNA STRUTTURA INTERNA ORDINATA Molte sostanze, quando solidificano o si separano da una soluzione in forma solida, tendono a formare cristalli con caratteristiche molto regolari; i cristalli di cloruro di sodio, per esempio, hanno l’aspetto di minuscoli cubi. Più in generale, i cristalli di una data sostanza hanno superfici piane inclinate secondo angoli caratteristici. La regolarità di queste strutture è dovuta all’elevato grado d’ordine con cui si organizzano le particelle all’interno del cristallo, indipendentemente dal fatto che siano atomi, molecole o ioni. Le particelle, infatti, sono disposte secondo schemi che si ripetono puntualmente in tutte le direzioni. Copyright © 2008 Zanichelli editore

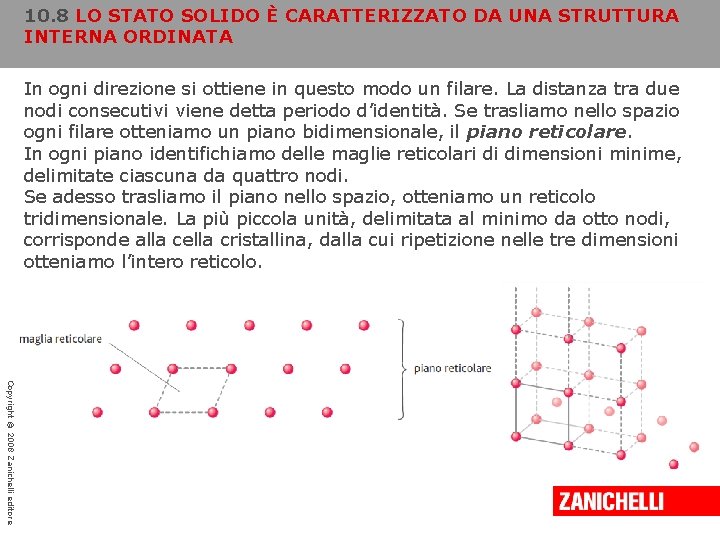
10. 8 LO STATO SOLIDO È CARATTERIZZATO DA UNA STRUTTURA INTERNA ORDINATA Tali schemi ripetitivi possono essere descritti come un insieme di punti disposti con una geometria ben precisa; la struttura che ne risulta è chiamata reticolo cristallino. Poiché l’intero cristallo è formato dalla ripetizione di uno schema di base, non dobbiamo fare altro che descrivere l’unità costitutiva del reticolo, detta cella elementare. Ripetendo questa semplice unità in tutte le direzioni è possibile costruire l’intero reticolo. I punti dello spazio intorno ai quali le particelle del cristallo vibrano senza però spostarsi reciprocamente vengono detti nodi reticolari. I nodi si susseguono in ognuna delle tre direzioni dello spazio mantenendo una regolarità nella disposizione e nella distanza. Copyright © 2008 Zanichelli editore

10. 8 LO STATO SOLIDO È CARATTERIZZATO DA UNA STRUTTURA INTERNA ORDINATA In ogni direzione si ottiene in questo modo un filare. La distanza tra due nodi consecutivi viene detta periodo d’identità. Se trasliamo nello spazio ogni filare otteniamo un piano bidimensionale, il piano reticolare. In ogni piano identifichiamo delle maglie reticolari di dimensioni minime, delimitate ciascuna da quattro nodi. Se adesso trasliamo il piano nello spazio, otteniamo un reticolo tridimensionale. La più piccola unità, delimitata al minimo da otto nodi, corrisponde alla cella cristallina, dalla cui ripetizione nelle tre dimensioni otteniamo l’intero reticolo. Copyright © 2008 Zanichelli editore

10. 8 LO STATO SOLIDO È CARATTERIZZATO DA UNA STRUTTURA INTERNA ORDINATA Il cristallo non conserva necessariamente la forma della cella elementare: solo la ripetizione in tutte le direzioni dello spazio, in modo simmetrico, porta alla formazione di un cristallo la cui forma geometrica è simile a quella della cella. La cella elementare ha la stessa composizione chimica del cristallo e dimensioni che vanno da 2 Å a 3 Å nei solidi formati da atomi uguali, fino a centinaia di ångström nei cristalli delle molecole proteiche. Nella figura è rappresentato il reticolo cubico semplice. La sua cella elementare, detta cella cubica semplice, è una figura in cui i nodi del reticolo, e quindi le particelle, sono disposti esclusivamente ai vertici di un cubo. Copyright © 2008 Zanichelli editore

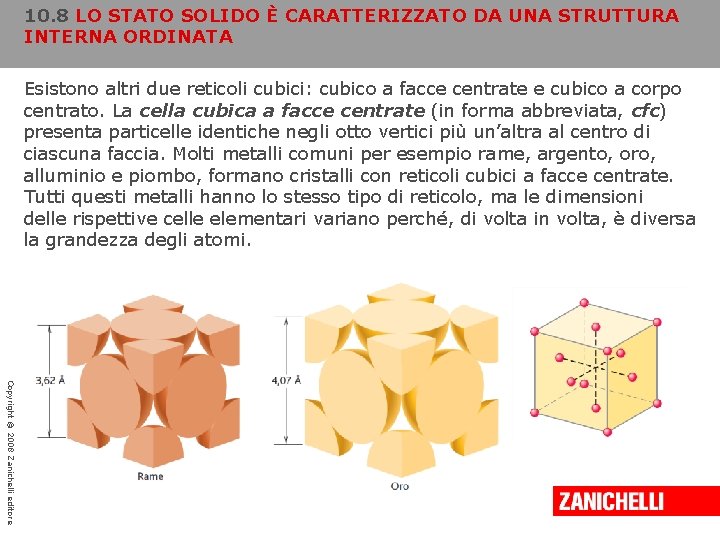
10. 8 LO STATO SOLIDO È CARATTERIZZATO DA UNA STRUTTURA INTERNA ORDINATA Esistono altri due reticoli cubici: cubico a facce centrate e cubico a corpo centrato. La cella cubica a facce centrate (in forma abbreviata, cfc) presenta particelle identiche negli otto vertici più un’altra al centro di ciascuna faccia. Molti metalli comuni per esempio rame, argento, oro, alluminio e piombo, formano cristalli con reticoli cubici a facce centrate. Tutti questi metalli hanno lo stesso tipo di reticolo, ma le dimensioni delle rispettive celle elementari variano perché, di volta in volta, è diversa la grandezza degli atomi. Copyright © 2008 Zanichelli editore

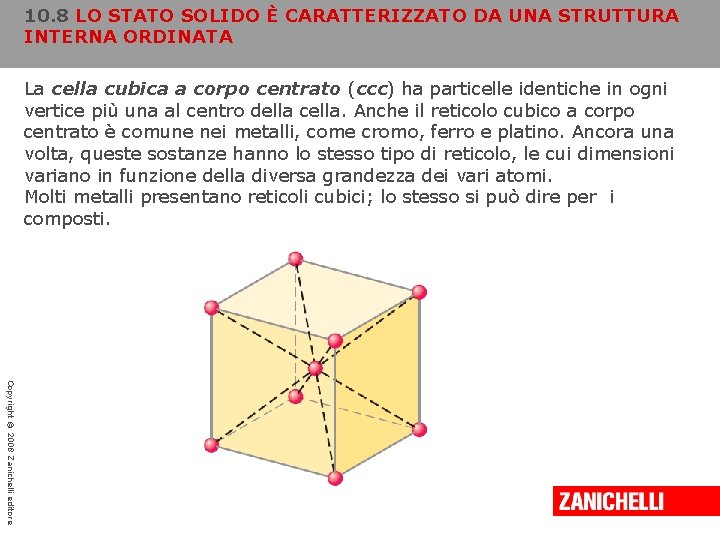
10. 8 LO STATO SOLIDO È CARATTERIZZATO DA UNA STRUTTURA INTERNA ORDINATA La cella cubica a corpo centrato (ccc) ha particelle identiche in ogni vertice più una al centro della cella. Anche il reticolo cubico a corpo centrato è comune nei metalli, come cromo, ferro e platino. Ancora una volta, queste sostanze hanno lo stesso tipo di reticolo, le cui dimensioni variano in funzione della diversa grandezza dei vari atomi. Molti metalli presentano reticoli cubici; lo stesso si può dire per i composti. Copyright © 2008 Zanichelli editore

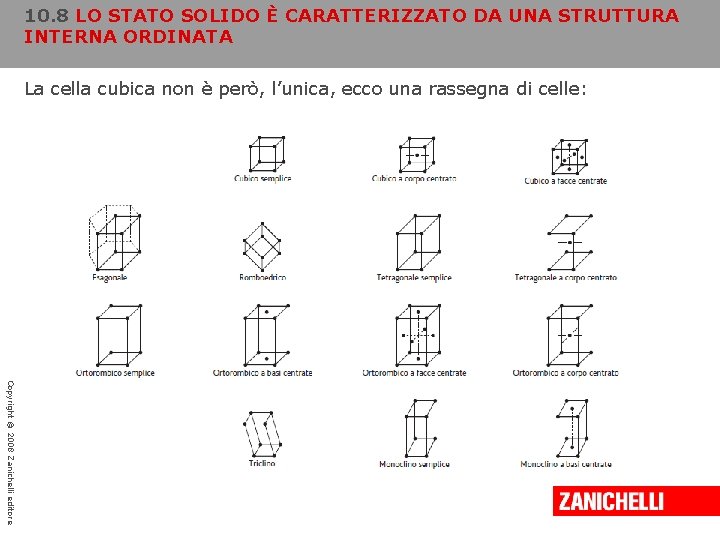
10. 8 LO STATO SOLIDO È CARATTERIZZATO DA UNA STRUTTURA INTERNA ORDINATA La cella cubica non è però, l’unica, ecco una rassegna di celle: Copyright © 2008 Zanichelli editore

10. 8 LO STATO SOLIDO È CARATTERIZZATO DA UNA STRUTTURA INTERNA ORDINATA ► NON TUTTI I SOLIDI SONO CRISTALLINI Quando un cristallo cubico di sale viene spezzato, tutti i frammenti ottenuti presentano ancora facce piane che si intersecano con angoli di 90°. Al contrario, quando rompiamo un vetro, i frammenti hanno quasi sempre facce irregolari, spesso ricurve, con margini smussati. Questa osservazione mette in evidenza la principale differenza fra solidi cristallini, come Na. Cl, e solidi non cristallini, come il vetro; questi ultimi sono anche chiamati solidi amorfi. Copyright © 2008 Zanichelli editore

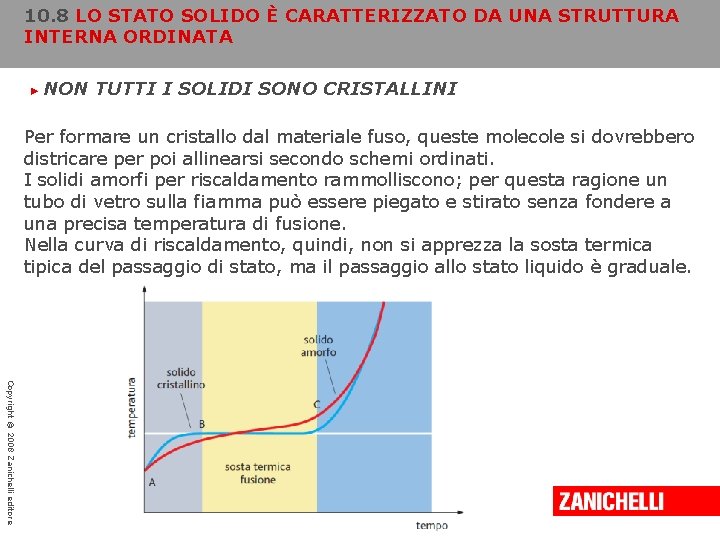
10. 8 LO STATO SOLIDO È CARATTERIZZATO DA UNA STRUTTURA INTERNA ORDINATA ► NON TUTTI I SOLIDI SONO CRISTALLINI Il termine «amorfo» deriva dalla parola greca amorphos che significa «privo di forma» . I solidi amorfi non presentano gli schemi strutturali ripetitivi propri dei cristalli. Per certi versi, le loro strutture disordinate assomigliano più ai liquidi che ai solidi. Il vetro e alcuni polimeri, sono alcuni esempi di solidi amorfi. Per le loro caratteristiche i solidi amorfi possono essere considerati dei liquidi ad altissima viscosità. Le sostanze che formano solidi amorfi sono, in genere, costituite da lunghe molecole simili a catene che, allo stato liquido, sono molto aggrovigliate. Copyright © 2008 Zanichelli editore

10. 8 LO STATO SOLIDO È CARATTERIZZATO DA UNA STRUTTURA INTERNA ORDINATA ► NON TUTTI I SOLIDI SONO CRISTALLINI Per formare un cristallo dal materiale fuso, queste molecole si dovrebbero districare per poi allinearsi secondo schemi ordinati. I solidi amorfi per riscaldamento rammolliscono; per questa ragione un tubo di vetro sulla fiamma può essere piegato e stirato senza fondere a una precisa temperatura di fusione. Nella curva di riscaldamento, quindi, non si apprezza la sosta termica tipica del passaggio di stato, ma il passaggio allo stato liquido è graduale. Copyright © 2008 Zanichelli editore

10. 9 LE PROPRIETÀ FISICHE DIPENDONO DAL TIPO DI CRISTALLO ► I CRISTALLI IONICI SONO COSTITUITI DA CATIONI E ANIONI I cristalli ionici sono piuttosto duri, fragili e fondono a temperature elevate. Queste proprietà riflettono le intense forze di attrazione che si esercitano fra ioni di carica opposta, ma anche le repulsioni fra ioni con la stessa carica quando si trovano a distanza ravvicinata. I composti ionici allo stato solido non conducono la corrente elettrica mentre sono ottimi conduttori allo stato fuso; ciò è dovuto alla mobilità degli ioni costitutivi nello stato liquido, ma non in quello solido. Copyright © 2008 Zanichelli editore

10. 9 LE PROPRIETÀ FISICHE DIPENDONO DAL TIPO DI CRISTALLO I CRISTALLI MOLECOLARI SONO COSTITUITI DA MOLECOLE NEUTRE ► Copyright © 2008 Zanichelli editore I cristalli molecolari sono solidi in cui le posizioni del reticolo sono occupate da atomi (argon e kripton solidi) o da molecole (CO 2, SO 2 o H 2 O). Se le molecole che li costituiscono sono piccole, i cristalli tendono a essere teneri e presentano bassi punti di fusione, dal momento che le particelle interagiscono fra loro solo con attrazioni intermolecolari deboli. Nei cristalli di argon, per esempio, le interazioni esistenti sono soltanto forze di London; in quelli di SO 2, costituiti da molecole polari, vi sono anche attrazioni dipolo; nei cristalli di ghiaccio (H 2 O), infine, le molecole interagiscono mediante forti legami a idrogeno. Quando le molecole di un solido sono grandi, le proprietà fisiche possono essere molto diverse da quelle dei solidi che contengono molecole più piccole.

10. 9 LE PROPRIETÀ FISICHE DIPENDONO DAL TIPO DI CRISTALLO I CRISTALLI COVALENTI SONO COSTITUITI DA ATOMI LEGATI COVALENTEMENTE FRA LORO ► I cristalli covalenti sono solidi in cui le posizioni del reticolo sono occupate da atomi legati covalentemente tra loro. Il cristallo si comporta nell’insieme come se fosse una sola enorme molecola. Il diamante ne è un tipico esempio. I cristalli covalenti sono tendenzialmente molto duri e hanno punti di fusione elevati, perché le attrazioni fra gli atomi legati covalentemente sono particolarmente intense. Copyright © 2008 Zanichelli editore

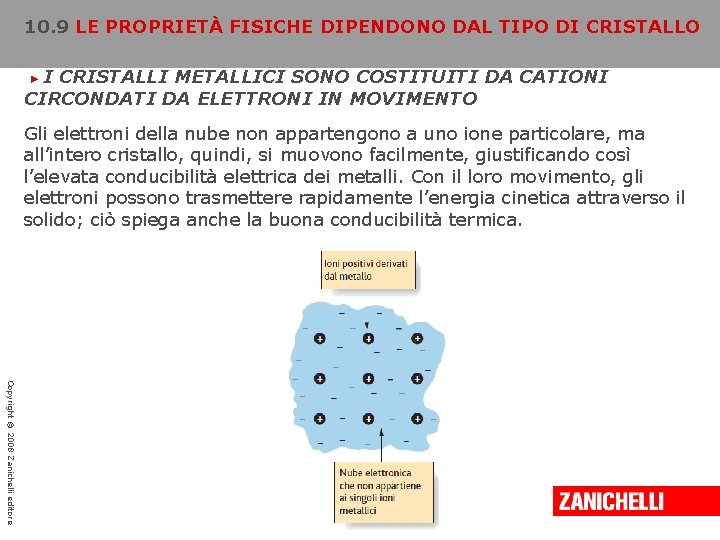
10. 9 LE PROPRIETÀ FISICHE DIPENDONO DAL TIPO DI CRISTALLO I CRISTALLI METALLICI SONO COSTITUITI DA CATIONI CIRCONDATI DA ELETTRONI IN MOVIMENTO ► I cristalli metallici possiedono proprietà molto diverse rispetto agli altri tre tipi: sono buoni conduttori di calore e di elettricità e hanno una particolare lucentezza, che è una delle caratteristiche utili per identificarli. In un modello adottato per descrivere queste caratteristiche, le posizioni del reticolo di un cristallo metallico sono occupate da ioni positivi, costituiti dai nuclei e dagli elettroni del core degli atomi Copyright © 2008 Zanichelli editore

10. 9 LE PROPRIETÀ FISICHE DIPENDONO DAL TIPO DI CRISTALLO I CRISTALLI METALLICI SONO COSTITUITI DA CATIONI CIRCONDATI DA ELETTRONI IN MOVIMENTO ► Gli elettroni della nube non appartengono a uno ione particolare, ma all’intero cristallo, quindi, si muovono facilmente, giustificando così l’elevata conducibilità elettrica dei metalli. Con il loro movimento, gli elettroni possono trasmettere rapidamente l’energia cinetica attraverso il solido; ciò spiega anche la buona conducibilità termica. Copyright © 2008 Zanichelli editore

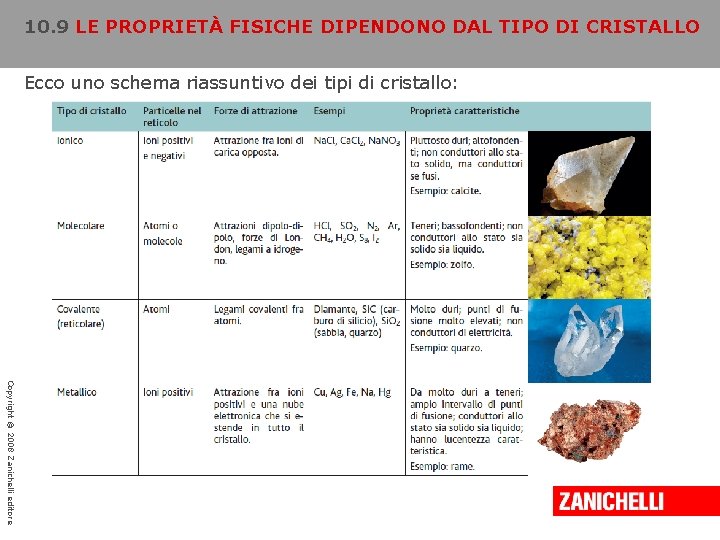
10. 9 LE PROPRIETÀ FISICHE DIPENDONO DAL TIPO DI CRISTALLO Ecco uno schema riassuntivo dei tipi di cristallo: Copyright © 2008 Zanichelli editore

10. 10 LE NANOTECNOLOGIE CONSENTONO DI CONTROLLARE LA STRUTTURA A LIVELLO MOLECOLARE Gli atomi e le piccole molecole hanno dimensioni dell’ordine di qualche decimo di nanometro; il diametro di un atomo di carbonio, per esempio, è pari a circa 0, 15 nm. Quando esaminiamo la materia a scala nanometrica, abbiamo a che fare con strutture molto piccole, costituite da qualche decina fino a poche centinaia di atomi. Le nanotecnologie si occupano degli oggetti di queste dimensioni e delle loro particolari proprietà che possono essere sfruttate per utili applicazioni. Copyright © 2008 Zanichelli editore

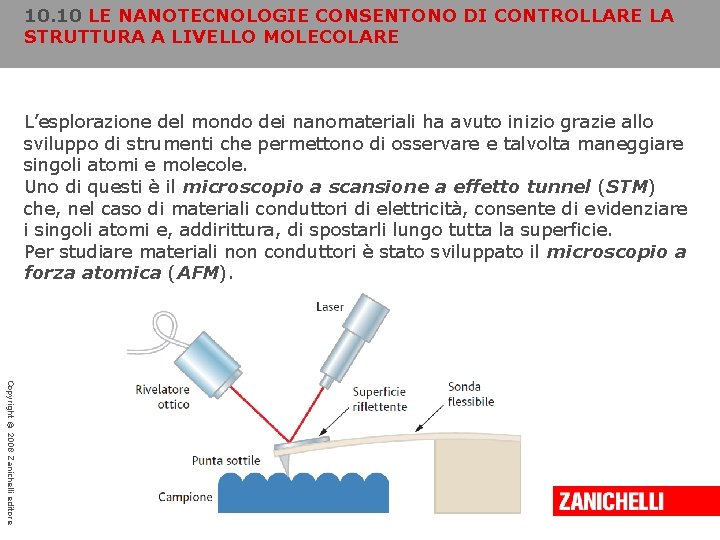
10. 10 LE NANOTECNOLOGIE CONSENTONO DI CONTROLLARE LA STRUTTURA A LIVELLO MOLECOLARE L’esplorazione del mondo dei nanomateriali ha avuto inizio grazie allo sviluppo di strumenti che permettono di osservare e talvolta maneggiare singoli atomi e molecole. Uno di questi è il microscopio a scansione a effetto tunnel (STM) che, nel caso di materiali conduttori di elettricità, consente di evidenziare i singoli atomi e, addirittura, di spostarli lungo tutta la superficie. Per studiare materiali non conduttori è stato sviluppato il microscopio a forza atomica (AFM). Copyright © 2008 Zanichelli editore

10. 10 LE NANOTECNOLOGIE CONSENTONO DI CONTROLLARE LA STRUTTURA A LIVELLO MOLECOLARE Fra i materiali innovativi scoperti grazie alla ricerca nel campo delle nanotecnologie sono da ricordare i nanotubi di carbonio, tubi molto piccoli formati dall’avvolgimento di sottili strati di atomi di carbonio. Nel 1985 fu scoperta una nuova forma del carbonio in cui gli atomi si dispongono a costituire piccole sfere, la più semplice delle quali ha formula C 60. Queste furono definite nel loro insieme fullereni, mentre la molecola C 60 venne chiamata buckyball (o fullerene di Buckminster), in onore di Richard Buckminster Fuller. Copyright © 2008 Zanichelli editore

10. 10 LE NANOTECNOLOGIE CONSENTONO DI CONTROLLARE LA STRUTTURA A LIVELLO MOLECOLARE I nanotubi di carbonio, scoperti nel 1991, rappresentano un’altra forma del carbonio riconducibile ai fullereni. Al pari di questi ultimi, i nanotubi si formano quando fra due elettrodi di carbonio si genera un arco elettrico. I primi nanotubi scoperti erano essenzialmente costituiti da fogli arrotolati di grafite, chiusi a entrambe le estremità da strutture semisferiche simili a una porzione di molecola di fullerene. Copyright © 2008 Zanichelli editore
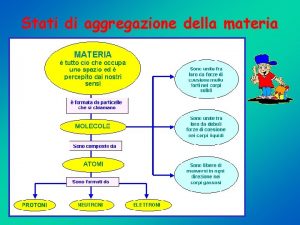
 Stati condensati della materia
Stati condensati della materia Gli stati di aggregazione della materia
Gli stati di aggregazione della materia I solidi sono comprimibili
I solidi sono comprimibili Stati di aggregazione della materia
Stati di aggregazione della materia In una scuola gli studenti sono stati divisi in 3 gruppi
In una scuola gli studenti sono stati divisi in 3 gruppi In una scuola gli studenti sono stati divisi in tre gruppi
In una scuola gli studenti sono stati divisi in tre gruppi La materia e i suoi stati
La materia e i suoi stati What is condensati
What is condensati Mappa concettuale trasformazioni chimiche e fisiche
Mappa concettuale trasformazioni chimiche e fisiche Chimica piu capitolo 18 soluzioni
Chimica piu capitolo 18 soluzioni Gli elementi della comunicazione
Gli elementi della comunicazione Che cos'è la fabula
Che cos'è la fabula 5 assiomi della comunicazione
5 assiomi della comunicazione Declinazione aggettivo
Declinazione aggettivo Gli ostacoli della vita
Gli ostacoli della vita Verticale orizzontale
Verticale orizzontale Struttura delle fiabe
Struttura delle fiabe Enti primitivi definizione
Enti primitivi definizione Geografia diagramma cartesiano
Geografia diagramma cartesiano Il sacrificio di ifigenia
Il sacrificio di ifigenia Assiomi della comunicazione umana
Assiomi della comunicazione umana Curve di riscaldamento e raffreddamento zanichelli
Curve di riscaldamento e raffreddamento zanichelli Proprietà magnetiche della materia
Proprietà magnetiche della materia Teoria atomica della materia
Teoria atomica della materia I solidi
I solidi Proprietà macroscopiche della materia
Proprietà macroscopiche della materia Teoria cinetico molecolare
Teoria cinetico molecolare Il ciclo della materia
Il ciclo della materia Fenomeni magnetici fondamentali
Fenomeni magnetici fondamentali Compressibilità isoterma
Compressibilità isoterma Stati europei
Stati europei Africa meridionale stati
Africa meridionale stati Dynamic characte
Dynamic characte Subcontinente indiano stati
Subcontinente indiano stati Termodinamica degli stati
Termodinamica degli stati Tropico del capricorno
Tropico del capricorno Reno paesi attraversati
Reno paesi attraversati Metodo semiprobabilistico agli stati limite
Metodo semiprobabilistico agli stati limite Impero asburgico
Impero asburgico Danubio recorrido
Danubio recorrido Stati regionali italiani
Stati regionali italiani Settore primario stati uniti
Settore primario stati uniti A muro basso ognuno ci si appoggia
A muro basso ognuno ci si appoggia Moti millenari zanichelli
Moti millenari zanichelli I tre principi di fichte
I tre principi di fichte Ritopei
Ritopei Disturbo oppositivo provocatorio sostegno
Disturbo oppositivo provocatorio sostegno Klein soluzioni
Klein soluzioni Il racconto della chimica e della terra
Il racconto della chimica e della terra Culture e formati della televisione e della radio
Culture e formati della televisione e della radio Caratteristiche della seta
Caratteristiche della seta La storia della coccinella in cerca della felicità
La storia della coccinella in cerca della felicità Ritratto della mia bambina esercizi
Ritratto della mia bambina esercizi Elena bettinelli
Elena bettinelli Soluzioni il racconto delle scienze naturali
Soluzioni il racconto delle scienze naturali Simonetta klein il racconto della chimica
Simonetta klein il racconto della chimica Prove della sfericità della terra
Prove della sfericità della terra Soluzioni il racconto della chimica e della terra
Soluzioni il racconto della chimica e della terra Prove della sfericità della terra zanichelli
Prove della sfericità della terra zanichelli