Vito Posca Tiziana Fiorani Chimica pi verde Capitolo























































- Slides: 61


Vito Posca, Tiziana Fiorani Chimica più. verde

Capitolo 18 L’elettrochimica

Sommario 1. Le reazioni di ossido-riduzione comportano la variazione del numero di ossidazione 2. Una reazione di ossido-riduzione è costituita da due semireazioni: l’ossidazione e la riduzione 3. Il bilanciamento delle reazioni redox deve garantire la conservazione della massa e della carica 4. La tendenza di un elemento all’ossidazione o alla riduzione 5. Le pile trasformano energia chimica in energia elettrica 6. La pila Daniell è costituita da un elettrodo di rame e da uno di zinco Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 4

Sommario 7. Il potenziale standard di riduzione misura la tendenza a ridursi di un elettrodo 1. La serie dei potenziali standard di riduzione 2. Le celle elettrolitiche trasformano l’energia elettrica in energia chimica 3. L’elettrolisi dell’acqua genera idrogeno e ossigeno 4. Le leggi di Faraday definiscono gli aspetti quantitativi dell’elettrolisi Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 5

Le reazioni di ossido-riduzione comportano la variazione del numero di ossidazione Gli elementi chimici possono ottenere una maggiore stabilità con il trasferimento parziale o totale di elettroni, cioè con una variazione del numero di ossidazione (n. o. ). Con il termine ossidazione si indica un aumento dell’n. o. Con il termine riduzione si indica una diminuzione dell’n. o. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 6

Le reazioni di ossido-riduzione comportano la variazione del numero di ossidazione Un atomo o ione che perde elettroni si ossida. Un atomo o ione che acquista elettroni si riduce. Una reazione in cui si ha trasferimento (parziale o totale) di elettroni tra due atomi o ioni, conseguente variazione dell’n. o. dei due atomi o ioni reagenti, è una reazione di ossido-riduzione. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 7

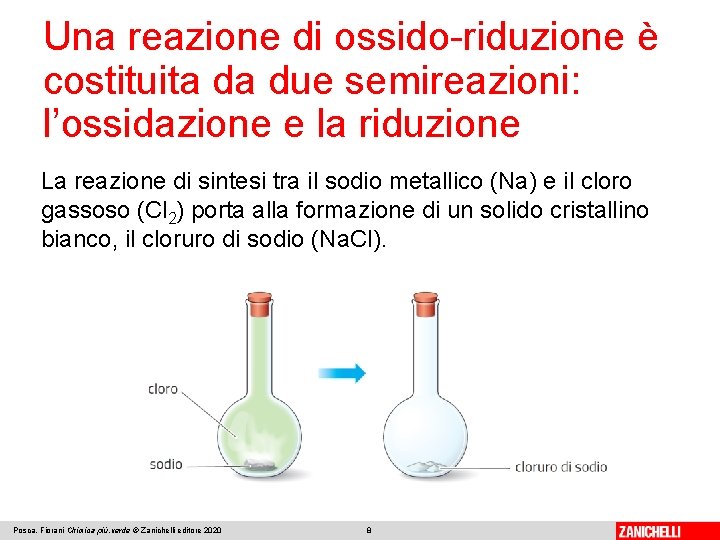
Una reazione di ossido-riduzione è costituita da due semireazioni: l’ossidazione e la riduzione La reazione di sintesi tra il sodio metallico (Na) e il cloro gassoso (Cl 2) porta alla formazione di un solido cristallino bianco, il cloruro di sodio (Na. Cl). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 8

Una reazione di ossido-riduzione è costituita da due semireazioni: l’ossidazione e la riduzione La reazione tra sodio e cloro è una reazione di ossidoriduzione. Si ha trasferimento di un elettrone da un atomo di sodio (che lo perde) a un atomo di cloro (che lo acquista). La reazione di ossido-riduzione (detta anche reazione redox) è costituita da due semireazioni. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 9

Una reazione di ossido-riduzione è costituita da due semireazioni: l’ossidazione e la riduzione La semireazione di ossidazione (ox) corrisponde a una perdita di elettroni, con aumento dell’n. o. : La semireazione di riduzione (red) corrisponde a un acquisto di elettroni, con diminuzione dell’n. o. : Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 10

Una reazione di ossido-riduzione è costituita da due semireazioni: l’ossidazione e la riduzione L’atomo o ione che perde elettroni si chiama riducente, quello che acquista elettroni si chiama ossidante. Nella reazione tra il sodio e il cloro: il sodio si comporta da riducente e riduce il cloro; il cloro si comporta da ossidante e ossida il sodio. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 11

Il bilanciamento delle reazioni redox deve garantire la conservazione della massa e della carica Il bilanciamento di una reazione redox prevede il calcolo dei coefficienti stechiometrici per garantire la conservazione sia della massa sia della carica. Esaminiamo la reazione tra zinco metallico e una soluzione di acido cloridrico e assegniamo i n. o. : Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 12

Il bilanciamento delle reazioni redox deve garantire la conservazione della massa e della carica l’atomo di zinco è il riducente (n. o. aumenta di 2 unità) e perde 2 elettroni: l’atomo di idrogeno è l’ossidante (n. o. diminuisce di 1 unità) ma, poiché lo zinco perde 2 elettroni, 2 atomi di idrogeno (ioni H+) acquistano ciascuno 1 elettrone: Il numero degli elettroni ceduti dal riducente deve essere uguale al numero degli elettroni accettati dall’ossidante. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 13

Il bilanciamento delle reazioni redox deve garantire la conservazione della massa e della carica Il metodo della variazione del numero di ossidazione Metodo di bilanciamento preferibile quando i reagenti non si possono rappresentare in forma ionica. Consideriamo la reazione redox tra l’ossido ferrico e il carbonio: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 14

Il bilanciamento delle reazioni redox deve garantire la conservazione della massa e della carica 1. Assegniamo i numeri di ossidazione agli atomi in cui si ha una variazione di n. o. : 2. Identifichiamo l’ossidante e il riducente. Il ferro è l’ossidante (n. o. diminuisce di 3 unità), il carbonio è il riducente (n. o. aumenta di 4 unità). 3. Stabiliamo l’entità della variazione del numero di ossidazione (Δ n. o. ): per il ferro Δ n. o. = 3; per il carbonio Δ n. o. = 4. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 15

Il bilanciamento delle reazioni redox deve garantire la conservazione della massa e della carica 4. Definiamo il numero di elettroni acquistati dall’ossidante (6) e ceduti dal riducente (4): 5. Rendiamo uguale il numero degli elettroni assegnando agli atomi opportuni coefficienti: 6. Completiamo il bilanciamento degli altri atomi (ossigeno). La reazione finale è: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 16

Il bilanciamento delle reazioni redox deve garantire la conservazione della massa e della carica Il metodo delle semireazioni Metodo di bilanciamento usato quando i reagenti si possono rappresentare in forma ionica. Le reazioni possono essere condotte in ambiente acido (presenti ioni H+) o basico (presenti ioni OH-). Reazione redox in ambiente acido: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 17

Il bilanciamento delle reazioni redox deve garantire la conservazione della massa e della carica 1. Assegniamo i numeri di ossidazione agli atomi in cui si ha una variazione di n. o. : 2. Rappresentiamo le semireazioni di riduzione e di ossidazione identificando l’ossidante e il riducente. Il manganese è l’ossidante (n. o. diminuisce di 5 unità), lo iodio è il riducente (n. o. aumenta di 1 unità). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 18

Il bilanciamento delle reazioni redox deve garantire la conservazione della massa e della carica 3. Per entrambe le semireazioni: a) bilanciamo gli atomi: b) definiamo il numero di elettroni acquistati dall’ossidante e ceduti dal riducente: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 19

Il bilanciamento delle reazioni redox deve garantire la conservazione della massa e della carica c) bilanciamo le cariche aggiungendo ioni H+, in modo che la somma delle cariche sia uguale in entrambi i membri delle semireazioni: d) bilanciamo gli atomi di idrogeno e di ossigeno aggiungendo molecole di H 2 O: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 20

Il bilanciamento delle reazioni redox deve garantire la conservazione della massa e della carica 4. Rendiamo uguale il numero di elettroni moltiplicando i componenti di ciascuna semireazione per un opportuno coefficiente. Sommiamo membro a membro le due semireazioni: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 21

Il bilanciamento delle reazioni redox deve garantire la conservazione della massa e della carica 5. Eliminiamo i termini comuni (elettroni, H 2 O, H+): 6. Verifichiamo che gli atomi e le cariche risultino bilanciati e che i coefficienti siano ridotti a numeri interi più semplici: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 22

Il bilanciamento delle reazioni redox deve garantire la conservazione della massa e della carica Reazione redox in ambiente basico: Il procedimento è analogo a quello per la redox in ambiente acido; per bilanciare le cariche è necessario aggiungere ioni OH- e molecole di H 2 O. Le due semireazioni sono rappresentate: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 23

Il bilanciamento delle reazioni redox deve garantire la conservazione della massa e della carica 1. Bilanciamo le cariche aggiungendo ioni OH-, in modo che la somma delle cariche sia uguale in entrambi i membri delle semireazioni: 2. Bilanciamo gli atomi di idrogeno e di ossigeno aggiungendo molecole di H 2 O: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 24

Il bilanciamento delle reazioni redox deve garantire la conservazione della massa e della carica 3. Rendiamo uguale il numero di elettroni. Sommiamo membro a membro le due semireazioni: 4. Eliminiamo i termini comuni (elettroni, H 2 O, H+): 5. Verifichiamo che atomi e cariche risultino bilanciati: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 25

✓ Mettiamoci alla prova Individua il riducente e l’ossidante nella reazione redox: Li + 2 HCl → 2 Li. Cl + H 2 Secondo il metodo delle semireazioni, quali ioni si aggiungono per bilanciare le cariche in una reazione redox in ambiente acido? E in ambiente basico? Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 26

La tendenza di un elemento alla riduzione o all’ossidazione Il comportamento riducente o ossidante di un elemento dipende dal potere ossidante (capacità di acquistare elettroni) o dal potere riducente (capacità di cedere elettroni) dell’elemento con cui reagisce. Una lamina di zinco immersa in una soluzione di Cu. SO 4 si ricopre di rame metallico di colore rosso (A). Lo ione rameico Cu 2+ si riduce, Zn si ossida a Zn 2+. Cu 2+ ha tendenza ad acquistare elettroni maggiore di Zn 2+. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 27

La tendenza di un elemento alla riduzione o all’ossidazione Immergendo parzialmente una lamina di rame in una soluzione di solfato di zinco (Zn. SO 4) non avviene nessuna reazione (B). Pertanto, lo zinco ha una tendenza a ossidarsi maggiore del rame. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 28

La tendenza di un elemento alla riduzione o all’ossidazione Immergendo parzialmente una lamina di zinco in una soluzione di HCl si sviluppa idrogeno in corrispondenza della lamina (A). Lo ione H+ ha una tendenza a ridursi maggiore dello zinco. Immergendo una lamina di rame in HCl non avviene alcuna reazione (B). Lo ione rame ha una tendenza a ridursi maggiore di H+. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 29

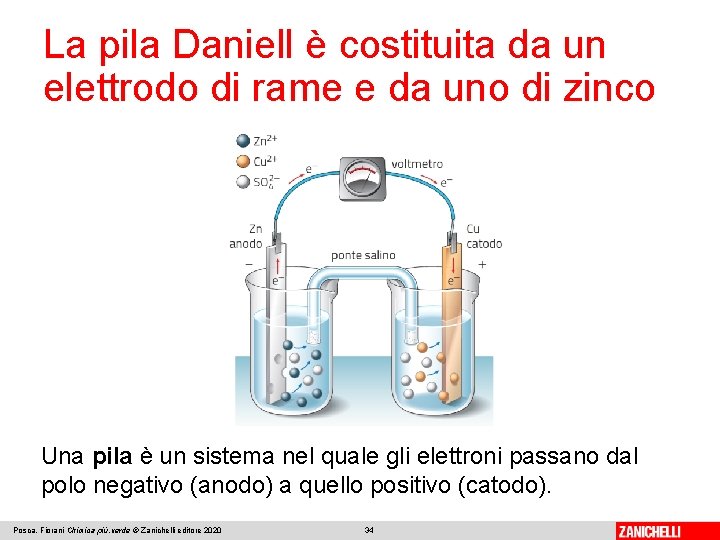
Le pile trasformano energia chimica in energia elettrica Una pila o cella galvanica è un sistema capace di trasformare energia chimica in energia elettrica utilizzando una reazione redox spontanea. È formata da: Due semielementi costituiti dai componenti delle semireazioni di ossidazione e di riduzione: una lamina metallica (elettrodo) e una soluzione contenente ioni dello stesso metallo. Un ponte salino che collega i semielementi permettere il passaggio di ioni e garantire l’elettroneutralità delle soluzioni. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 30

La pila Daniell è costituita da un elettrodo di rame e da uno di zinco La pila Daniell è costituita da una lamina di zinco (Zn) immersa parzialmente in una soluzione di solfato di zinco (Zn. SO 4) e da una lamina di rame (Cu) immersa parzialmente in una soluzione di solfato di rame (Cu. SO 4). Le lamine (elettrodi) sono collegate da un conduttore metallico e si ha passaggio di corrente elettrica, rilevato tramite un voltmetro. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 31

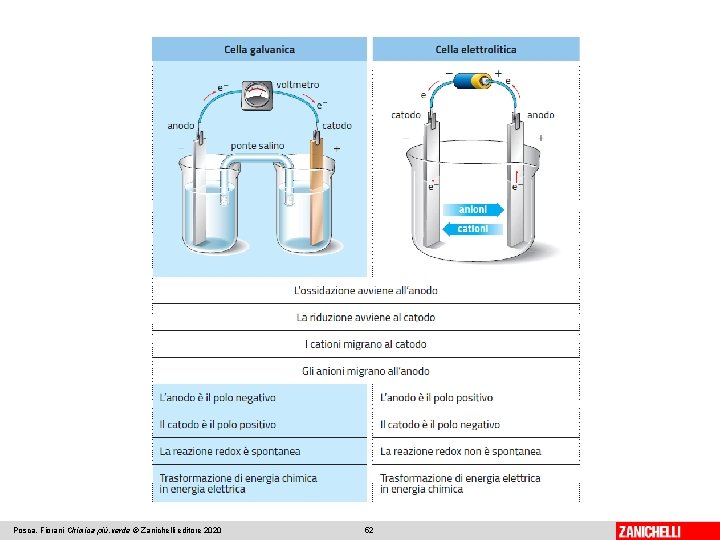
La pila Daniell è costituita da un elettrodo di rame e da uno di zinco La semireazione di ossidazione è: Con il procedere della reazione, la lamina di zinco diminuisce di massa e la soluzione di Zn. SO 4, per eccesso di ioni Zn 2+, diventa positiva. L’elettrodo dove si verifica la semireazione di ossidazione si chiama anodo e corrisponde al polo negativo della pila. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 32

La pila Daniell è costituita da un elettrodo di rame e da uno di zinco Gli elettroni si trasferiscono alla lamina di Cu; attirano gli ioni Cu 2+ della soluzione, che si riducono ad atomi di rame e si depositano sulla lamina. La semireazione di riduzione è: Con il procedere della reazione, la lamina di rame aumenta di massa e la soluzione di Cu. SO 4 diventa negativa. L’elettrodo dove si verifica la semireazione di riduzione si chiama catodo e corrisponde al polo positivo della pila. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 33

La pila Daniell è costituita da un elettrodo di rame e da uno di zinco Una pila è un sistema nel quale gli elettroni passano dal polo negativo (anodo) a quello positivo (catodo). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 34

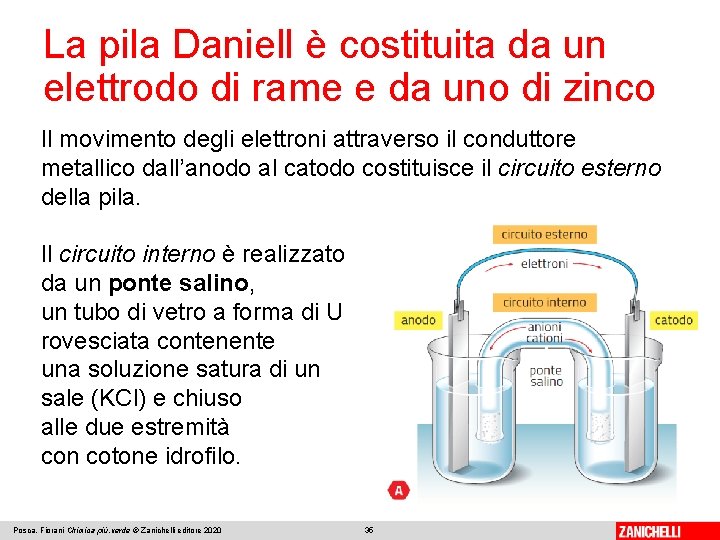
La pila Daniell è costituita da un elettrodo di rame e da uno di zinco Il movimento degli elettroni attraverso il conduttore metallico dall’anodo al catodo costituisce il circuito esterno della pila. Il circuito interno è realizzato da un ponte salino, un tubo di vetro a forma di U rovesciata contenente una soluzione satura di un sale (KCl) e chiuso alle due estremità con cotone idrofilo. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 35

La pila Daniell è costituita da un elettrodo di rame e da uno di zinco Il ponte salino assicura l’elettroneutralità delle soluzioni mediante la migrazione di ioni positivi (K+) nella soluzione catodica e ioni negativi (Cl-) nella soluzione anodica. La reazione redox complessiva è: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 36

La pila Daniell è costituita da un elettrodo di rame e da uno di zinco La notazione con cui si rappresenta una cella galvanica si chiama diagramma di cella, che riporta: a sinistra la semicella dove avviene l’ossidazione, l’anodo, che costituisce il polo negativo; a destra la semicella dove avviene la riduzione, il catodo, che costituisce il polo positivo. Il ponte salino è rappresentato da una doppia barra: ANODO//CATODO Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 37

La pila Daniell è costituita da un elettrodo di rame e da uno di zinco Il riducente deve essere sempre rappresentato nella semicella anodica, l’ossidante in quella catodica. La forma ridotta e la forma ossidata dello stesso semielemento sono separate da una barretta: forma ridotta/forma ossidata/forma ridotta Per la pila Daniell costituita dagli elettrodi di zinco e di rame, il diagramma di cella è: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 38

La pila Daniell è costituita da un elettrodo di rame e da uno di zinco Il valore che misura la tendenza a ridursi (ad acquistare elettroni) di un semielemento si chiama potenziale di riduzione (E). La misura della differenza di potenziale (d. d. p. ) tra le due semicelle costituisce la forza elettromotrice. Si esprime in volt e (V) si misura mediante un voltmetro. La forza elettromotrice (f. e. m. ), detta anche voltaggio della pila, è uguale alla differenza tra il potenziale di riduzione del catodo e il potenziale di riduzione dell’anodo: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 39

Il potenziale standard di riduzione misura la tendenza a ridursi di un elettrodo Per misurare il potenziale di riduzione di un singolo elettrodo si realizza una pila costituita: • dall’elettrodo di cui si vuole determinare il potenziale nelle condizioni standard (soluzione 1 M, 25 °C); • da un elettrodo di riferimento o standard. L’elettrodo standard è l’elettrodo a idrogeno, al quale si assegna il valore di potenziale standard di riduzione (E °) uguale a 0, 00 V. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 40

Il potenziale standard di riduzione misura la tendenza a ridursi di un elettrodo Il potenziale standard di riduzione (E°) è il valore che misura la tendenza di un elettrodo a ridursi (ad acquistare elettroni) nelle condizioni standard. • Il valore positivo di E° indica che la tendenza a ridursi dell’elettrodo è maggiore di quella dello ione H+. L’elettrodo a idrogeno funziona da anodo: • Il valore negativo di E° indica che la tendenza a ridursi dell’elettrodo è minore di quella dello ione H+. L’elettrodo a idrogeno funziona da catodo: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 41

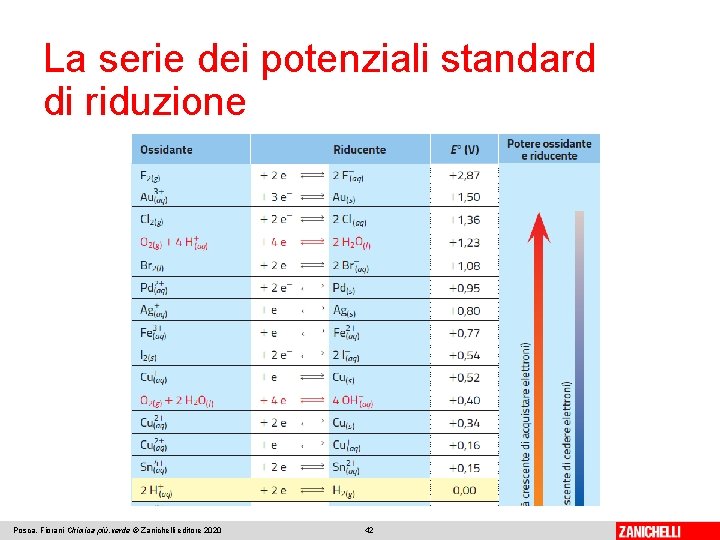
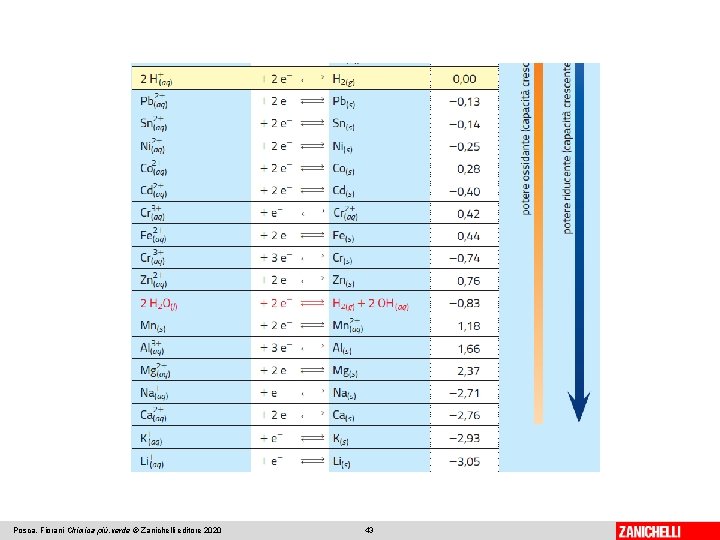
La serie dei potenziali standard di riduzione Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 42

Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 43

La serie dei potenziali standard di riduzione è l’insieme dei valori dei potenziali standard di riduzione degli elettrodi. L’ossidante si indica a sinistra della doppia freccia e il riducente a destra. I valori permettono di: 1. valutare il potere ossidante o riducente di un elettrodo: un elettrodo si comporta da ossidante con un elettrodo ad E° minore, da riducente con un elettrodo a E°maggiore; Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 44

La serie dei potenziali standard di riduzione 2. identificare l’anodo e il catodo, rappresentare il diagramma di cella e calcolare la forza elettromotrice standard (f. e. m. °) di una pila con la relazione: 3. prevedere la spontaneità di una reazione redox: la tendenza a procedere spontaneamente è definita dalla differenza dei potenziali standard di riduzione dell’ossidante e del riducente: Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 45

La serie dei potenziali standard di riduzione In base ai valori dei due potenziali standard di riduzione, il valore di ΔE° può essere positivo o negativo: ΔE° > 0, la reazione è spontanea e avviene nel verso indicato, da sinistra a destra; ΔE° < 0, la reazione non è spontanea e non avviene nel verso indicato, ma solo da destra a sinistra. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 46

✓ Mettiamoci alla prova Qual è la funzione del ponte salino all’interno di una pila? Per misurare il potenziale di riduzione, quale elettrodo si considera come riferimento? Quale valore di potenziale standard di riduzione (E °) si assegna a questo elettrodo? Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 47

Le celle elettrolitiche trasformano l’energia elettrica in energia chimica Il processo che utilizza la corrente elettrica per far avvenire una reazione redox non spontanea si chiama elettrolisi. L’elettrolisi si svolge in una cella elettrolitica costituita da una soluzione elettrolitica o da un elettrolita fuso e da due elettrodi (conduttori di corrente) in genere di platino o grafite. Tra i due elettrodi collegati da un generatore di corrente continua (pila o batteria) si origina una differenza di potenziale. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 48

Le celle elettrolitiche trasformano l’energia elettrica in energia chimica Questa differenza di potenziale permette: mediante un conduttore metallico il passaggio di elettroni tra l’elettrodo con carica positiva e l’elettrodo con carica negativa; la migrazione degli ioni che derivano dalla dissociazione dell’elettrolita all’interno della cella. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 49

Le celle elettrolitiche trasformano l’energia elettrica in energia chimica I cationi sono attratti dall’elettrodo negativo (catodo). All’anodo gli ioni negativi cedono elettroni all’elettrodo (semireazione di ossidazione). Gli anioni sono attratti dall’elettrodo positivo (anodo). Al catodo gli ioni positivi acquistano elettroni dall’elettrodo (semireazione di riduzione). Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 50

Le celle elettrolitiche trasformano l’energia elettrica in energia chimica Nel conduttore metallico (circuito esterno) la carica elettrica è trasportata dagli elettroni che passano dall’anodo al catodo. Nella cella elettrolitica (circuito interno) la carica elettrica è trasportata dagli ioni che passano dal catodo all’anodo. Il passaggio di energia elettrica nella cella fa avvenire una reazione redox non spontanea. La cella elettrolitica è un sistema capace di trasformare l’energia elettrica in energia chimica. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 51

Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 52

L’elettrolisi dell’acqua genera idrogeno e ossigeno L’elettrolisi dell’acqua pura non si può realizzare poiché l’acqua è un elettrolita debolissimo. Gli ioni che derivano dalla sua dissociazione sono in una concentrazione così bassa da non permettere il passaggio di corrente elettrica. Il problema si risolve aggiungendo all’acqua un elettrolita forte che, dissociandosi completamente, aumenta la concentrazione degli ioni e quindi la conducibilità nella cella elettrolitica. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 53

L’elettrolisi dell’acqua genera idrogeno e ossigeno Nel voltametro di Hoffmann, una cella elettrolitica, è presente una soluzione di solfato di sodio (Na 2 SO 4). Tra i due elettrodi, collegati con un generatore di corrente continua, si stabilisce una d. d. p. che determina una reazione di ossido-riduzione. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 54

L’elettrolisi dell’acqua genera idrogeno e ossigeno Al catodo si ha la riduzione dell’acqua, all’anodo si ha l’ossidazione dell’acqua. Le semireazioni sono: L’equazione definitiva è: L’acqua si riduce e si ossida, sviluppando idrogeno al catodo e ossigeno all’anodo: è avvenuta l’elettrolisi dell’acqua. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 55

Le leggi di Faraday definiscono gli aspetti quantitativi dell’elettrolisi Tra la quantità di carica elettrica che passa in una cella elettrolitica e la quantità di sostanza che si deposita o si sviluppa agli elettrodi intercorrono relazioni quantitative. Queste relazioni sono state descritte dal fisico inglese Michael Faraday nel 1833. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 56

Le leggi di Faraday definiscono gli aspetti quantitativi dell’elettrolisi La prima legge di Faraday Nell’elettrolisi di una soluzione acquosa contenente ioni Ag+, al catodo si ha la riduzione dello ione ad Ag metallico: Se la cella è attraversata da un solo elettrone si deposita un solo atomo di argento, ma se è attraversata da una mole di elettroni, si ha deposizione di una mole di argento. Durante l’elettrolisi la quantità di sostanza che si deposita o si sviluppa a un elettrodo è direttamente proporzionale alla quantità di carica elettrica che passa nella cella elettrolitica. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 57

Le leggi di Faraday definiscono gli aspetti quantitativi dell’elettrolisi La quantità di carica elettrica che corrisponde a un numero di Avogadro di elettroni (cioè a una mole) si chiama faraday (F): Il valore di 1 F usato generalmente è 96500 C/mol. La quantità di carica elettrica (Q) corrisponde al prodotto tra l’intensità (i) della corrente elettrica espressa in ampere (A) e il tempo (t) espresso in secondi (s): Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 58

Le leggi di Faraday definiscono gli aspetti quantitativi dell’elettrolisi La seconda legge di Faraday Esaminiamo tre celle elettrolitiche rispettivamente con soluzioni di ioni con una carica, due cariche e tre cariche. Al passaggio di 1 faraday nella prima si deposita una quantità di sostanza pari a una mole, nella seconda mezza mole, nella terza un terzo di mole. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 59

Le leggi di Faraday definiscono gli aspetti quantitativi dell’elettrolisi Il passaggio in una soluzione elettrolitica di 1 faraday fa depositare o sviluppare agli elettrodi una mole di uno ione con una carica, mezza mole di uno ione con due cariche e un terzo di mole di uno ione con tre cariche. Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 60

✓ Mettiamoci alla prova Quale semireazione si verifica all’anodo di una pila e quale al catodo? E all’anodo e al catodo di una cella elettrolitica? Perché non è possibile realizzare l’elettrolisi dell’acqua pura? Posca, Fiorani Chimica più. verde © Zanichelli editore 2020 61