Capitolo 18 La velocit di reazione Sommario 1















- Slides: 18

Capitolo 18 La velocità di reazione

Sommario 1. Che cos’è la velocità di reazione 2. L’equazione cinetica 3. Gli altri fattori che influiscono sulla velocità di reazione 4. La teoria degli urti 5. L’energia di attivazione 6. Il meccanismo di reazione Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 2

Che cos’è la velocità di reazione La cinetica chimica studia tutti gli aspetti relativi alla velocità delle trasformazioni chimiche. La velocità di reazione (v) è la variazione della concentrazione dei reagenti, Δ[R], o dei prodotti, Δ[P], nell’intervallo di tempo Δt. L’unità di misura della velocità di reazione è mol/(L ∙ s). Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 3

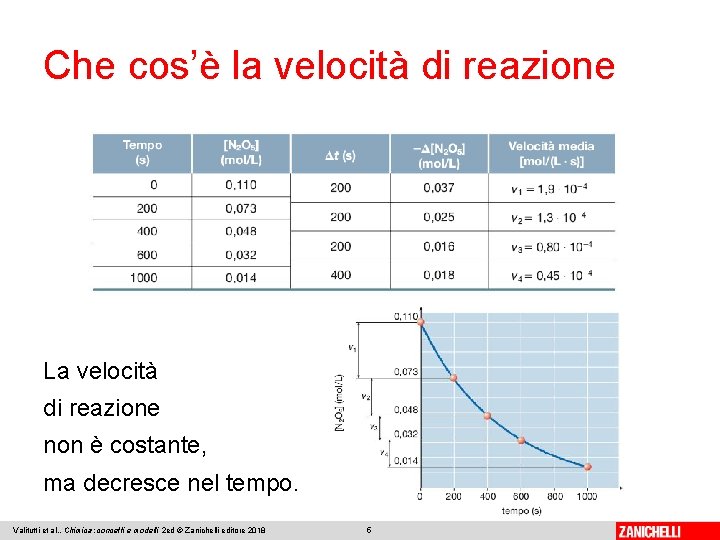
Che cos’è la velocità di reazione Se si considera, per esempio, la reazione: Man mano che N 2 O 5 si decompone, aumenta il numero di molecole allo stato gassoso. Dato che la pressione è proporzionale al numero di moli gassose, se si misura a intervalli di tempo regolari l’aumento di pressione all’interno del contenitore, è possibile calcolare quanto reagente si è trasformato e determinare la corrispondente velocità di reazione. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 4

Che cos’è la velocità di reazione La velocità di reazione non è costante, ma decresce nel tempo. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 5

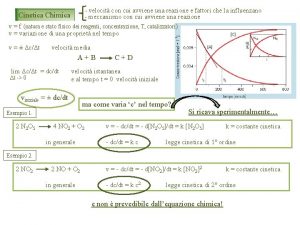
L’equazione cinetica è una relazione matematica che lega la velocità, v, di una data reazione alla concentrazione molare dei reagenti. Per la generica reazione: si può scrivere la seguente espressione: dove gli esponenti n ed m sono spesso numeri interi che devono essere determinati sperimentalmente e nella maggior parte dei casi, sono diversi dai coefficienti stechiometrici. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 6

L’equazione cinetica Reazioni di ordine superiore al secondo non sono frequenti. Esistono, invece, reazioni di ordine zero in cui la velocità è indipendente dalla concentrazione del reagente; la loro equazione cinetica è: • In una reazione di ordine zero la velocità è costante, per cui la diminuzione della concentrazione del reagente nell’unità di tempo è sempre della stessa entità. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 7

Gli altri fattori che influiscono sulla velocità di reazione I fattori che influenzano la velocità di una reazione sono: • la natura dei reagenti; • la temperatura a cui essa si svolge; • la superficie di contatto fra i reagenti in fase eterogenea; • l’eventuale presenza di catalizzatori. • La natura dei reagenti: l’attitudine di ogni sostanza a trasformarsi dipende dalle sue particolari proprietà chimiche e fisiche; per esempio, calcio, zinco e rame sono metalli, ma la loro reattività con HCl è molto diversa. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 8

Gli altri fattori che influiscono sulla velocità di reazione • La temperatura: in generale, un abbassamento della temperatura rallenta le reazioni; un innalzamento le accelera. • La superficie di contatto: due sostanze reagiscono tra loro tanto più velocemente quanto più estesa è la loro superficie di contatto. • La presenza dei catalizzatori: i catalizzatori sono sostanze che accelerano le reazioni chimiche senza consumarsi durante la trasformazione. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 9

Gli altri fattori che influiscono sulla velocità di reazione I catalizzatori sono in genere altamente specifici, cioè accelerano solo la reazione prescelta. Catalizzatori di processi industriali. Gli enzimi, sostanze di natura proteica capaci di catalizzare le reazioni che avvengono nelle cellule degli organismi, presentano la massima specificità. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 10

La teoria degli urti Il presupposto fondamentale della teoria degli urti è che le molecole dei reagenti possono scambiarsi gli atomi e originare i prodotti soltanto se, urtandosi, questi vengono a diretto contatto tra loro. Raddoppiando o triplicando la concentrazione di uno dei due reagenti, raddoppia o triplica anche il numero degli urti con il conseguente aumento della velocità. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 11

La teoria degli urti In fase eterogenea, l’aumento della superficie di contatto espone un maggior numero di molecole all’ambiente di reazione; si ha quindi un aumento del numero degli urti. Non tutti gli urti sono efficaci ai fini della formazione dei prodotti. Affinché un urto sia reattivo: 1. le collisioni devono avere un’orientazione appropriata; 2. l’energia dell’urto deve essere sufficiente a effettuare la trasformazione. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 12

L’energia di attivazione In generale, le molecole possono reagire soltanto in seguito a uno specifico aumento della loro energia potenziale, definito energia di attivazione, Ea, da Svante Arrhenius nel 1888. L’energia di attivazione, Ea, è la quota di energia potenziale in eccesso che occorre ai reagenti per rompere alcuni dei loro legami e iniziare una reazione. A temperatura ambiente, procedono a velocità apprezzabile le reazioni con Ea < 80 k. J/mol. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 13

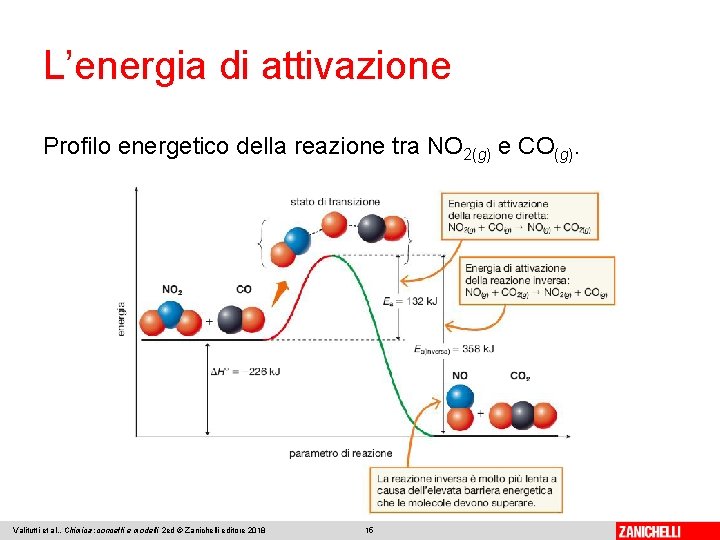
L’energia di attivazione Lo stato energetico raggiunto dalle molecole dei reagenti a seguito di un urto efficace è detto stato di transizione. L’energia di attivazione corrisponde alla differenza di energia tra il livello dei reagenti e lo stato di transizione. Se si rappresenta l’andamento dell’energia potenziale durante una trasformazione chimica, si ottiene un tracciato chiamato profilo di reazione. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 14

L’energia di attivazione Profilo energetico della reazione tra NO 2(g) e CO(g). Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 15

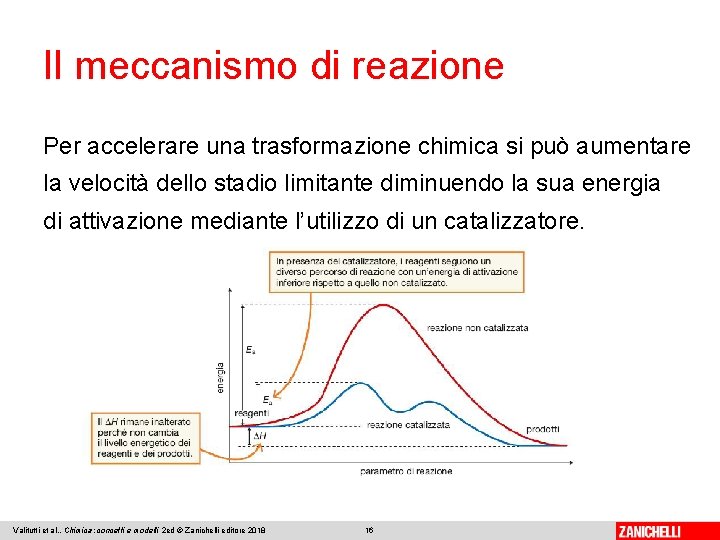
Il meccanismo di reazione Per accelerare una trasformazione chimica si può aumentare la velocità dello stadio limitante diminuendo la sua energia di attivazione mediante l’utilizzo di un catalizzatore. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 16

Il meccanismo di reazione I catalizzatori omogenei operano nella stessa fase dei reagenti. I catalizzatori eterogenei operano in una fase diversa da quella dei reagenti e dei prodotti. Sono catalizzatori eterogenei catalizzatori presenti nelle marmitte catalitiche delle automobili Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 17

Il meccanismo di reazione Il platino, il rodio e il palladio sono depositati su microscopici canali in una struttura di ceramica a nido d’ape. Una volta completata la trasformazione degli ossidi di azoto (NOx) e degli idrocarburi incombusti, le particelle di prodotto si staccano dalla superficie e il catalizzatore si rigenera. Marmitta catalitica. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 18
 Soluzioni chimica capitolo 18
Soluzioni chimica capitolo 18 Equazione pura definizione
Equazione pura definizione Sommario excel
Sommario excel Divide due vocali
Divide due vocali La chimica di rippa soluzioni
La chimica di rippa soluzioni Quoziente di reazione
Quoziente di reazione (s)-2-bromobutano
(s)-2-bromobutano Bilanciamento
Bilanciamento Entalpia di reazione
Entalpia di reazione Reazione regiospecifica
Reazione regiospecifica Cinetica ordine 1
Cinetica ordine 1 Entalpia
Entalpia Gessi da presa
Gessi da presa Complesso della piruvato deidrogenasi
Complesso della piruvato deidrogenasi Reazione ossidoriduzione
Reazione ossidoriduzione Equazione chimica
Equazione chimica Costante di equilibrio
Costante di equilibrio Legge di lavoisier
Legge di lavoisier Reazione di fenton
Reazione di fenton