Reazioni degli alcheni Reazioni degli alcheni Il meccanismo


- Slides: 24

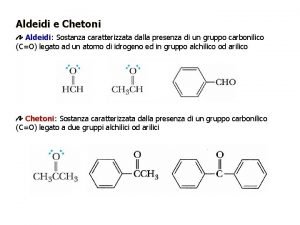
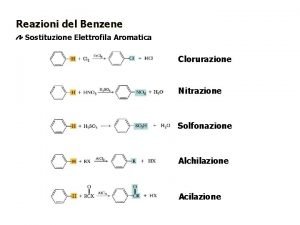
Reazioni degli alcheni

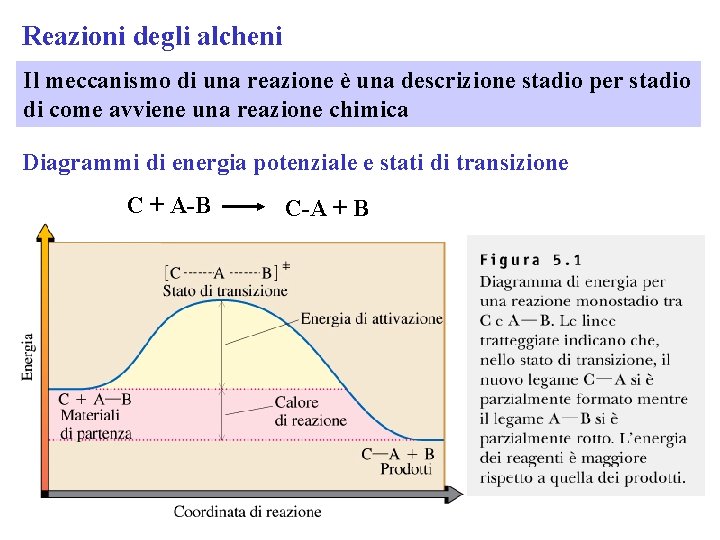
Reazioni degli alcheni Il meccanismo di una reazione è una descrizione stadio per stadio di come avviene una reazione chimica Diagrammi di energia potenziale e stati di transizione C + A-B C-A + B

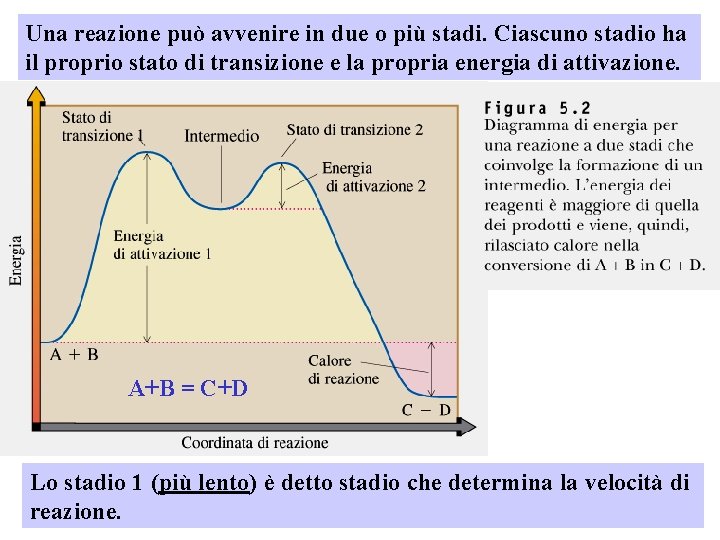
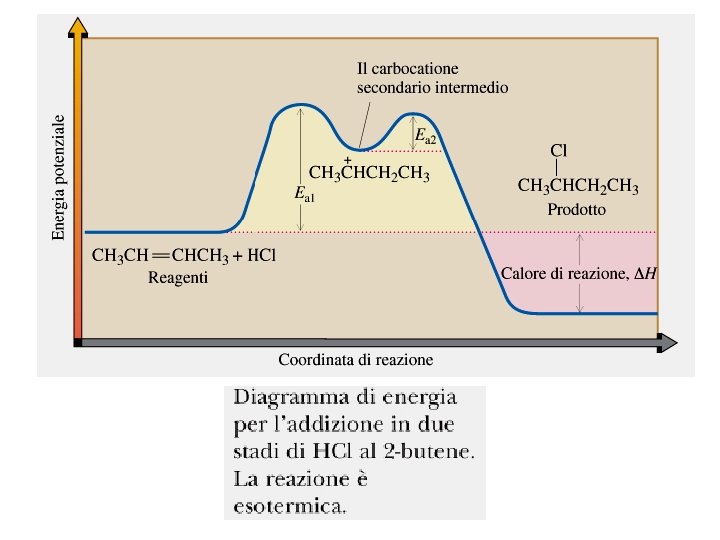
Una reazione può avvenire in due o più stadi. Ciascuno stadio ha il proprio stato di transizione e la propria energia di attivazione. A+B = C+D Lo stadio 1 (più lento) è detto stadio che determina la velocità di reazione.

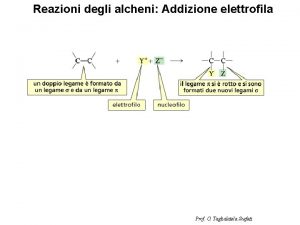
Nucleofilo: una specie con una coppia di elettroni non condivisa su un atomo. molecole anioniche molecole neutre I nucleofili sono anche basi di Lewis poiché posseggono una coppia di elettroni non condivisa. Tuttavia basicità e nucleofilicità sono proprietà differenti per cui non tutte le basi possono essere dei buoni nucleofili (e viceversa).

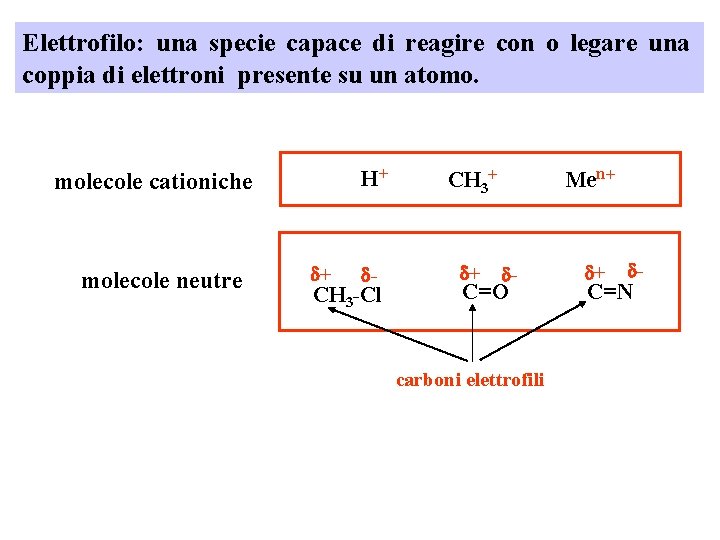
Elettrofilo: una specie capace di reagire con o legare una coppia di elettroni presente su un atomo. molecole cationiche molecole neutre d+ H+ CH 3+ d- d+ CH 3 -Cl Men+ d- C= O carboni elettrofili d+ d- C= N

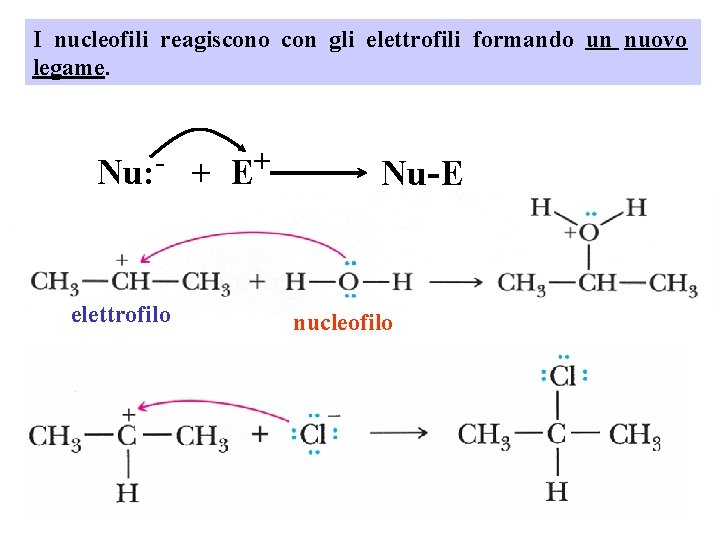
I nucleofili reagiscono con gli elettrofili formando un nuovo legame. Nu: elettrofilo + + E Nu-E nucleofilo

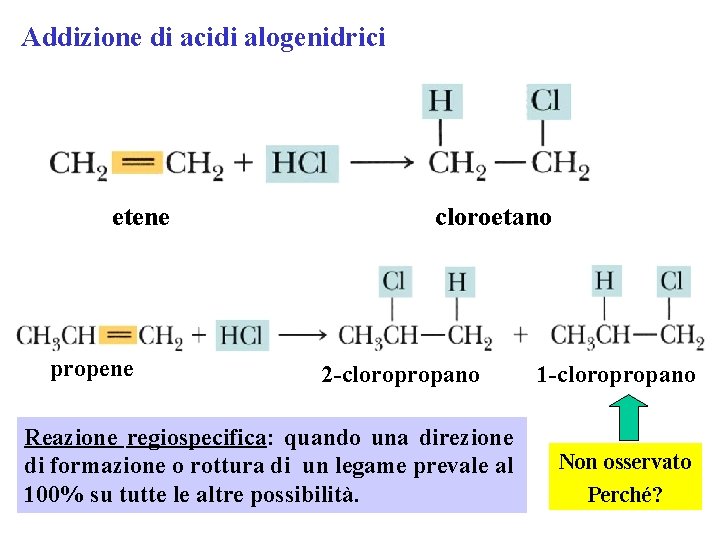
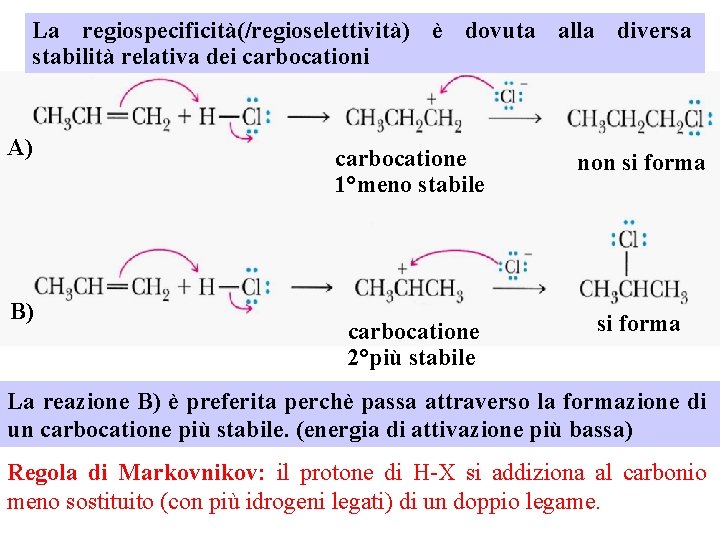
Addizione di acidi alogenidrici etene propene cloroetano 2 -cloropropano Reazione regiospecifica: quando una direzione di formazione o rottura di un legame prevale al 100% su tutte le altre possibilità. 1 -cloropropano Non osservato Perché?

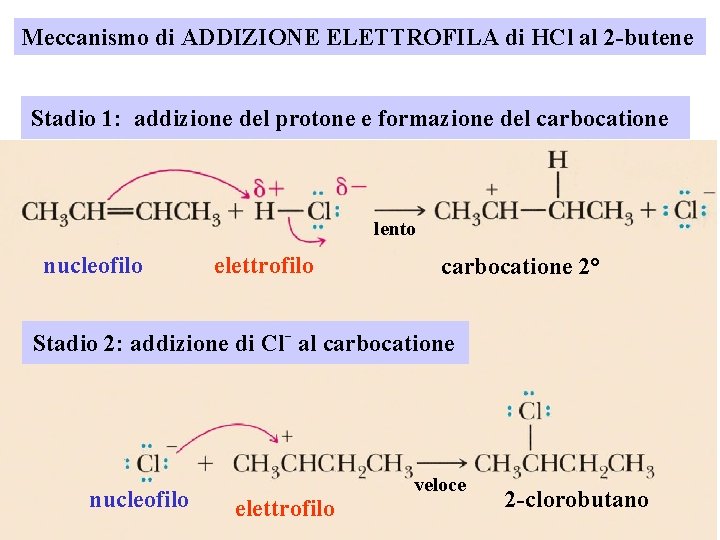
Meccanismo di ADDIZIONE ELETTROFILA di HCl al 2 -butene Stadio 1: addizione del protone e formazione del carbocatione lento nucleofilo elettrofilo carbocatione 2° Stadio 2: addizione di Cl- al carbocatione nucleofilo elettrofilo veloce 2 -clorobutano


La regiospecificità(/regioselettività) è dovuta alla diversa stabilità relativa dei carbocationi A) B) carbocatione 1°meno stabile non si forma carbocatione 2°più stabile si forma La reazione B) è preferita perchè passa attraverso la formazione di un carbocatione più stabile. (energia di attivazione più bassa) Regola di Markovnikov: il protone di H-X si addiziona al carbonio meno sostituito (con più idrogeni legati) di un doppio legame.

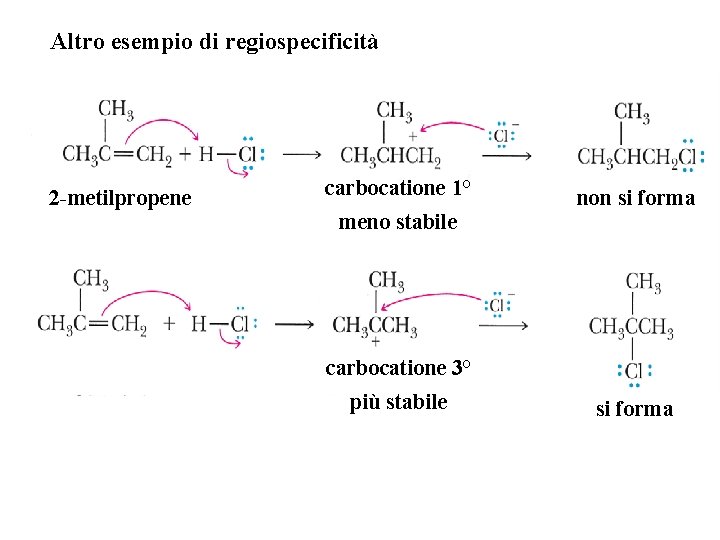
Altro esempio di regiospecificità 2 -metilpropene carbocatione 1° meno stabile non si forma carbocatione 3° più stabile si forma

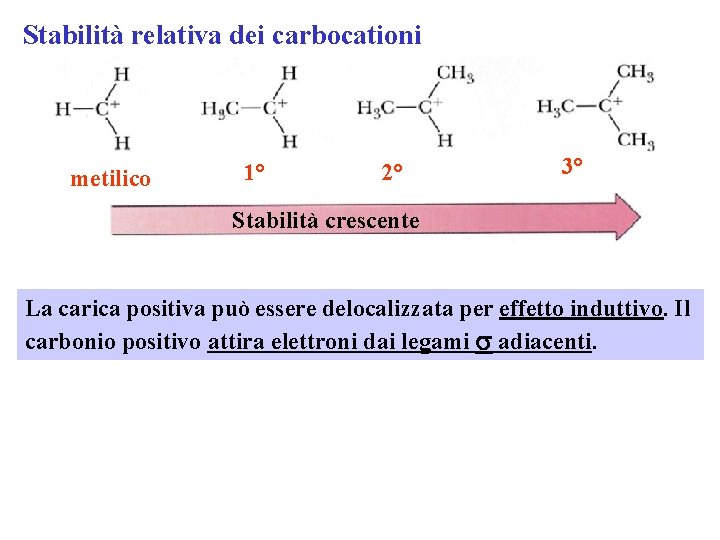
Stabilità relativa dei carbocationi metilico 1° 2° 3° Stabilità crescente La carica positiva può essere delocalizzata per effetto induttivo. Il carbonio positivo attira elettroni dai legami s adiacenti.

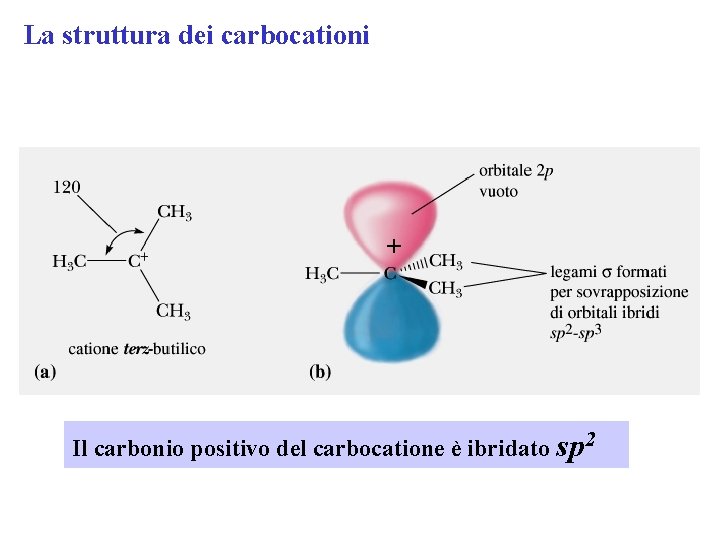
La struttura dei carbocationi + Il carbonio positivo del carbocatione è ibridato sp 2

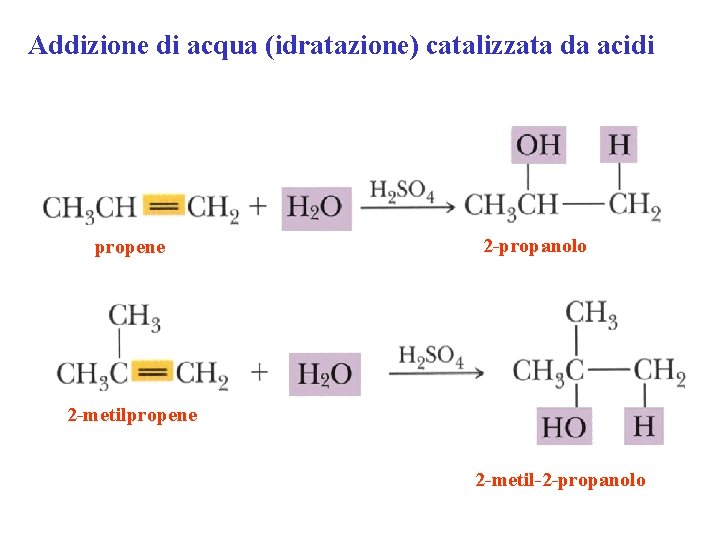
Addizione di acqua (idratazione) catalizzata da acidi propene 2 -propanolo 2 -metilpropene 2 -metil-2 -propanolo

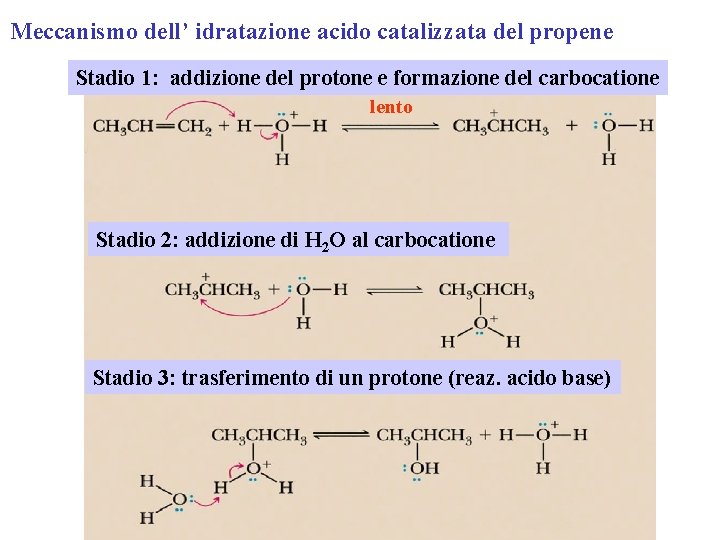
Meccanismo dell’ idratazione acido catalizzata del propene Stadio 1: addizione del protone e formazione del carbocatione lento Stadio 2: addizione di H 2 O al carbocatione Stadio 3: trasferimento di un protone (reaz. acido base)

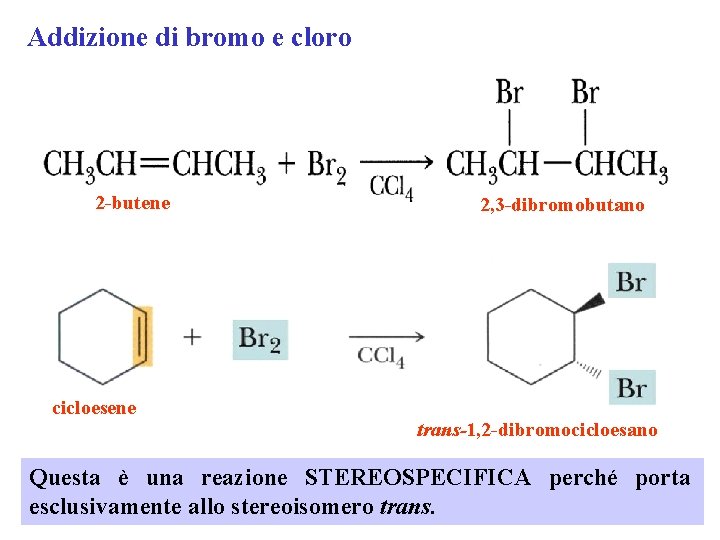
Addizione di bromo e cloro 2 -butene cicloesene 2, 3 -dibromobutano trans-1, 2 -dibromocicloesano Questa è una reazione STEREOSPECIFICA perché porta esclusivamente allo stereoisomero trans.

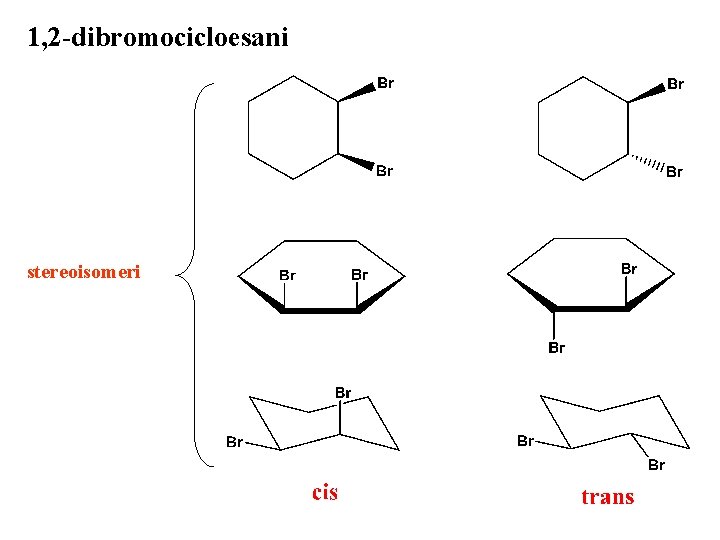
1, 2 -dibromocicloesani stereoisomeri

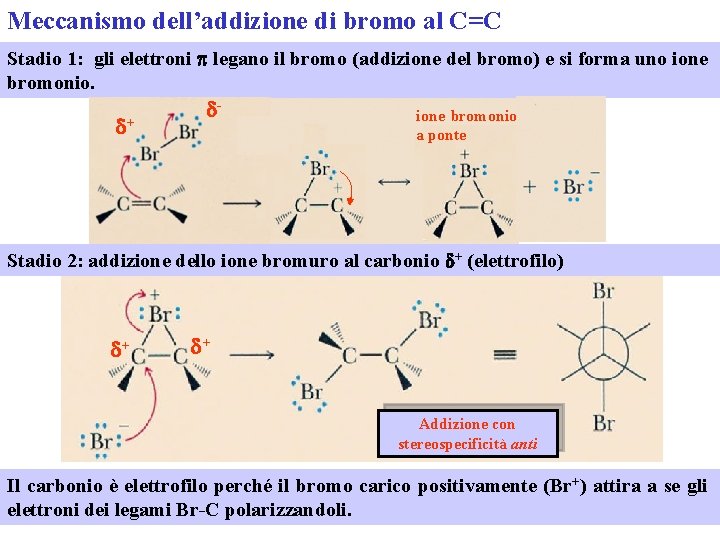
Meccanismo dell’addizione di bromo al C=C Stadio 1: gli elettroni p legano il bromo (addizione del bromo) e si forma uno ione bromonio. d+ d- ione bromonio a ponte Stadio 2: addizione dello ione bromuro al carbonio d+ (elettrofilo) d+ d+ Addizione con stereospecificità anti Il carbonio è elettrofilo perché il bromo carico positivamente (Br+) attira a se gli elettroni dei legami Br-C polarizzandoli.

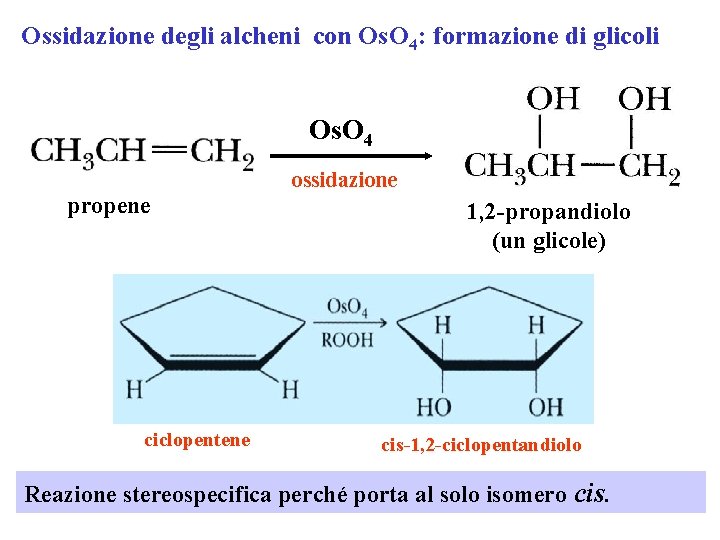
Ossidazione degli alcheni con Os. O 4: formazione di glicoli Os. O 4 propene ciclopentene ossidazione 1, 2 -propandiolo (un glicole) cis-1, 2 -ciclopentandiolo Reazione stereospecifica perché porta al solo isomero cis.

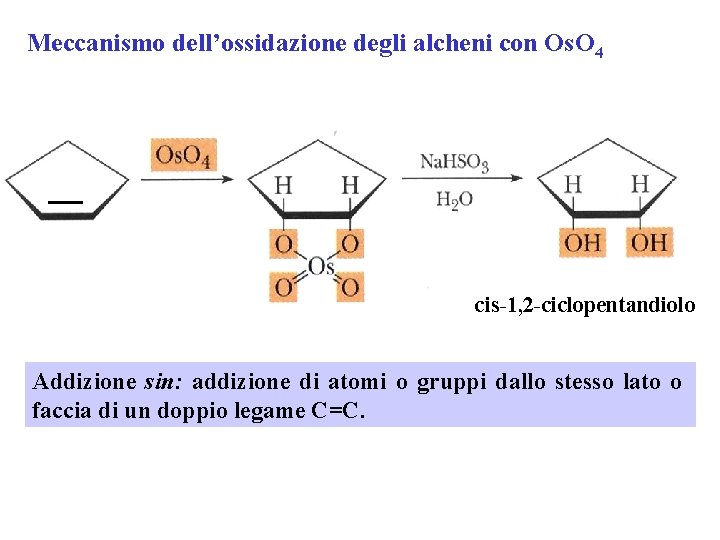
Meccanismo dell’ossidazione degli alcheni con Os. O 4 cis-1, 2 -ciclopentandiolo Addizione sin: addizione di atomi o gruppi dallo stesso lato o faccia di un doppio legame C=C.

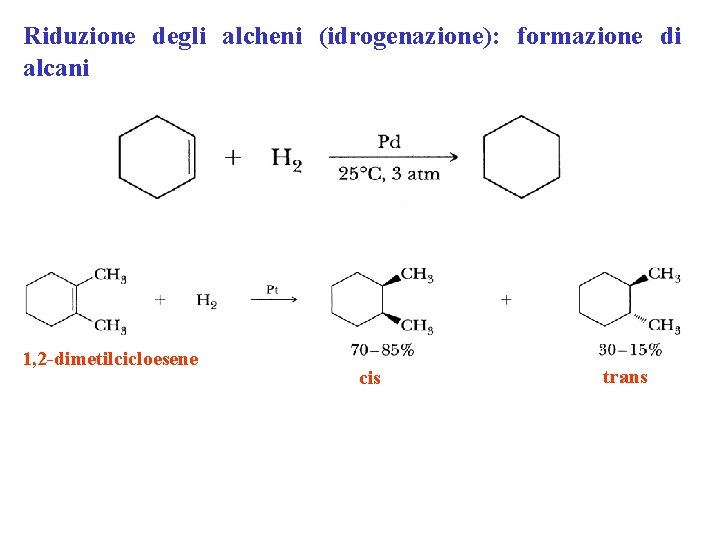
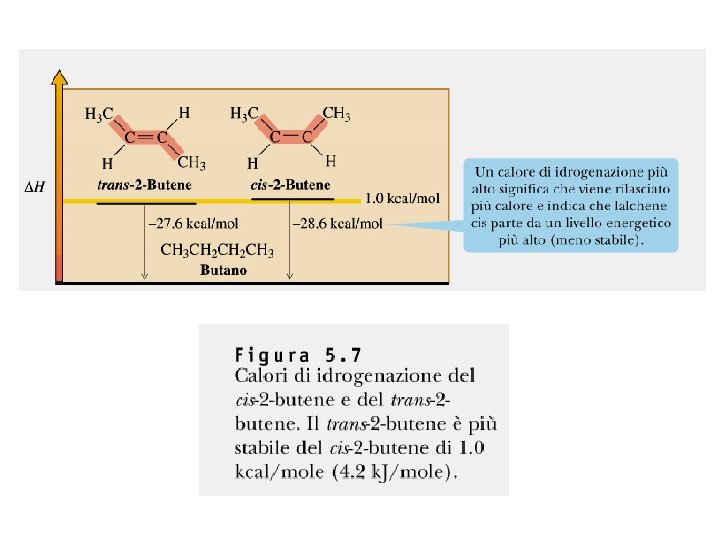
Riduzione degli alcheni (idrogenazione): formazione di alcani 1, 2 -dimetilcicloesene cis trans

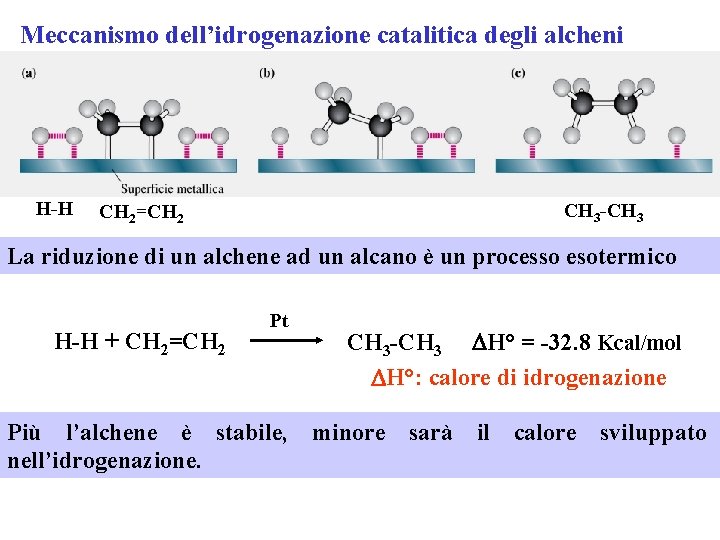
Meccanismo dell’idrogenazione catalitica degli alcheni H-H CH 3 -CH 3 CH 2=CH 2 La riduzione di un alchene ad un alcano è un processo esotermico H-H + CH 2=CH 2 Pt CH 3 -CH 3 DH° = -32. 8 Kcal/mol DH°: calore di idrogenazione Più l’alchene è stabile, minore sarà il calore sviluppato nell’idrogenazione.


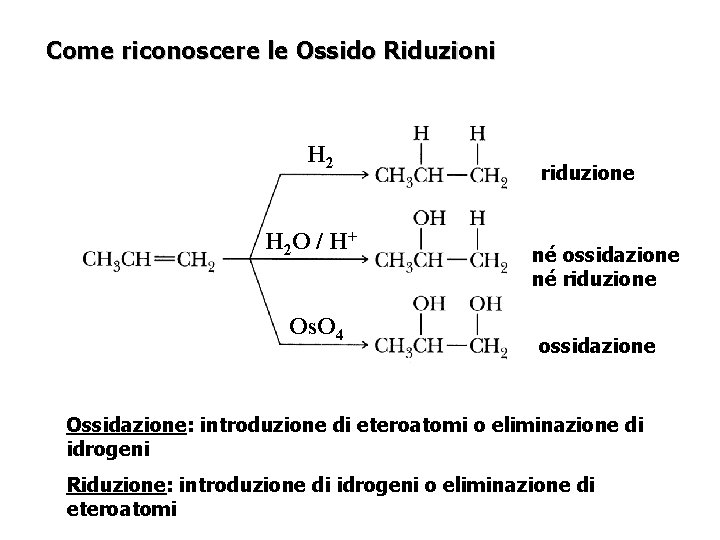
Come riconoscere le Ossido Riduzioni H 2 O / H + Os. O 4 riduzione né ossidazione né riduzione ossidazione Ossidazione: introduzione di eteroatomi o eliminazione di idrogeni Riduzione: introduzione di idrogeni o eliminazione di eteroatomi
 1 2-dimetilcicloesene
1 2-dimetilcicloesene Teofillina meccanismo d'azione
Teofillina meccanismo d'azione Ciclopentancarbaldeide
Ciclopentancarbaldeide Legge frank starling
Legge frank starling Meccanismo d'azione penicilline
Meccanismo d'azione penicilline Gradiente osmotico verticale
Gradiente osmotico verticale Rene
Rene Meccanismo di moltiplicazione controcorrente
Meccanismo di moltiplicazione controcorrente Delaglutide
Delaglutide Cellula adiposa
Cellula adiposa Benzodiazepine meccanismo d'azione
Benzodiazepine meccanismo d'azione Etilefrina meccanismo d'azione
Etilefrina meccanismo d'azione Sessualizzazione meccanismo di difesa
Sessualizzazione meccanismo di difesa Ione cloronio
Ione cloronio When does a comma splice occur
When does a comma splice occur 3 metil ciclopentino
3 metil ciclopentino Gruppi alchilici
Gruppi alchilici Alcani alcheni alchini
Alcani alcheni alchini Alcani alcheni alchini mappa concettuale
Alcani alcheni alchini mappa concettuale Idrogenazione alchini
Idrogenazione alchini Propino
Propino Dalle soluzioni all'elettrochimica soluzioni capitolo 16
Dalle soluzioni all'elettrochimica soluzioni capitolo 16 Bilanciamento reazioni redox
Bilanciamento reazioni redox Ossidoriduzioni
Ossidoriduzioni Fe2no3
Fe2no3