Elettrochimica Reazioni di Ossidoriduzione l Le reazioni di






















- Slides: 27

Elettrochimica

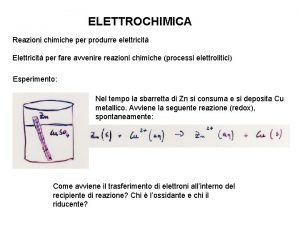
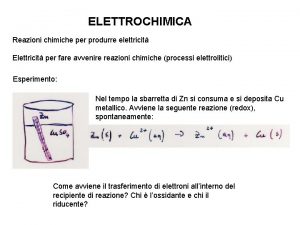
Reazioni di Ossidoriduzione l Le reazioni di ossido-riduzione generano un flusso di elettroni. l La reazione di Ossidazione libera elettroni l La reazione di Riduzione cattura elettroni

Applicazioni Il movimento di elettroni genera corrente elettrica. + 2+ l 8 H +Mn. O 4 + 5 Fe ® Mn 2+ + 5 Fe 3+ +4 H 2 O l Scrivendo in due semireazioni avremo: + 2+ +4 H O l 8 H +Mn. O 4 +5 e ® Mn 2 2+ ® Fe 3+ + e- ) l 5(Fe l Nella stessa soluzione le due semireazioni non producono lavoro, ma se le semireazioni avvenissero in due soluzioni…… l

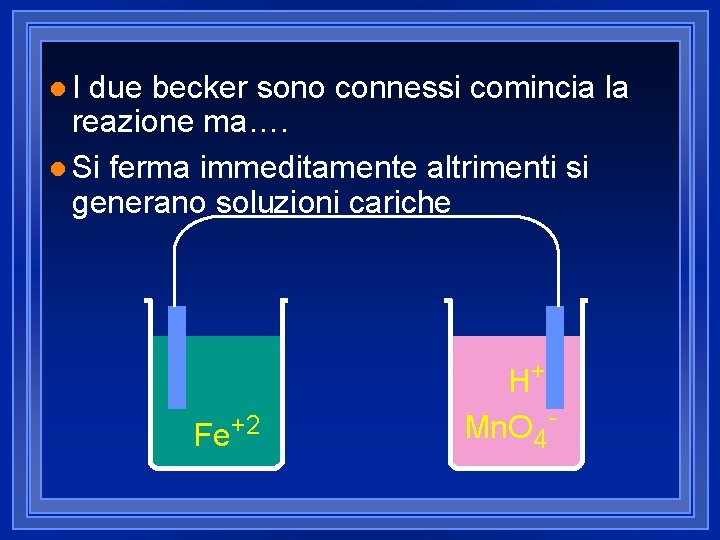
l. I due becker sono connessi comincia la reazione ma…. l Si ferma immeditamente altrimenti si generano soluzioni cariche Fe+2 H+ Mn. O 4 -

Cella Galvanica Il ponte salino permette flusso di corrente Fe+2 H+ Mn. O 4 -

viaggia in un circuito chiuso e- l L’Elettricità Fe+2 H+ Mn. O 4 -

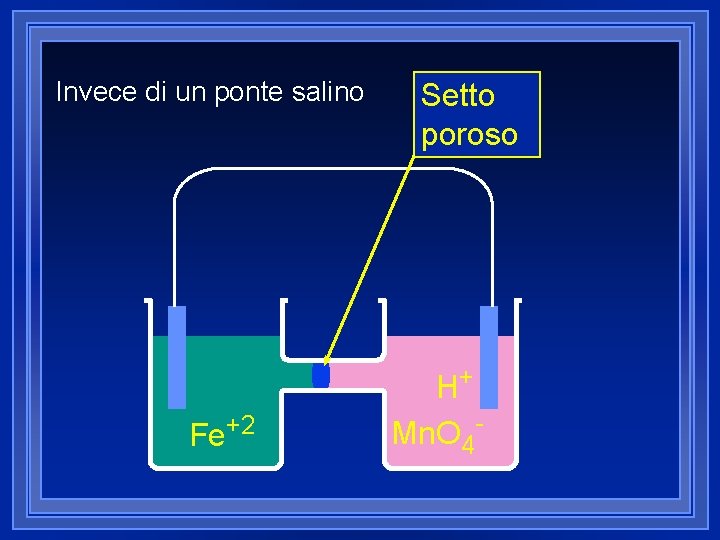
Invece di un ponte salino Fe+2 Setto poroso H+ Mn. O 4 -

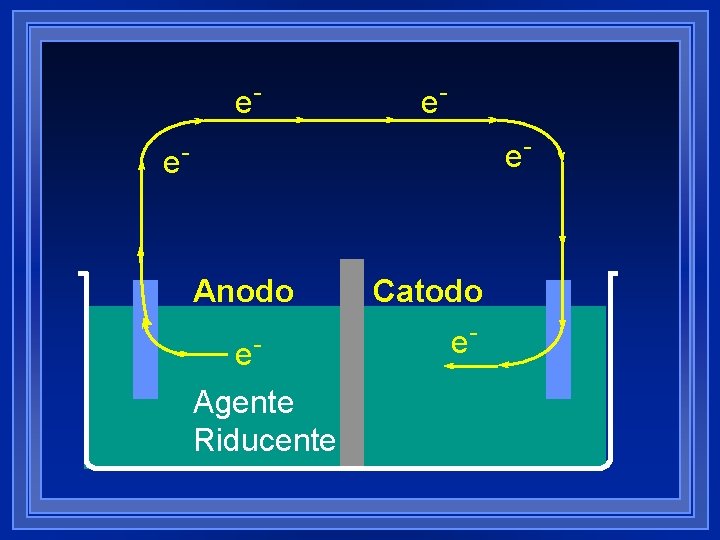
e- e- Anodo e. Agente Riducente Catodo e. Agente Ossidante

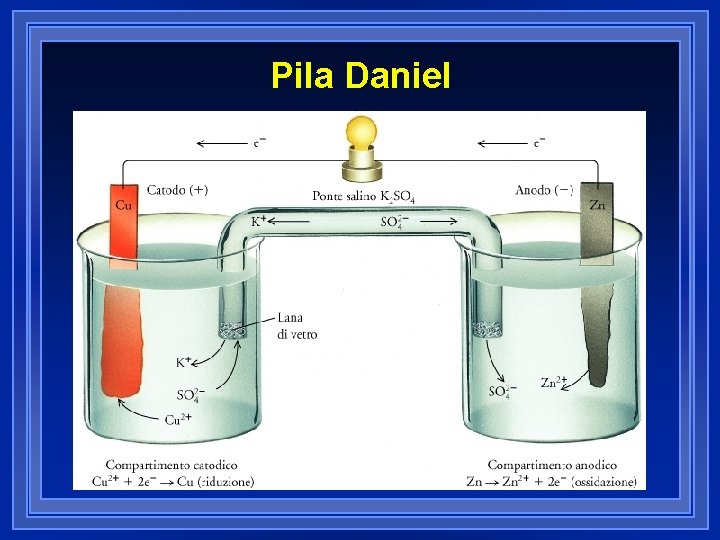
Pila Daniel

Pila a secco 2+ + 2 e. Anodo: Zn + OH Zn(OH)2 + 2 e- H + 2 NH +2 Cl Catodo: 1° 2 NH+4 Cl + 2 e - 2 3 Catodo: Mn. O H 2 O Mn. O(OH) + OH 2 Catodo: 2° 2 Mn. O 2 + H 2 + 2 e- Mn 2 O 3 + H 2 O

Potenziale della Cella l La specie che si ossida libera elettroni. l La specie che si riduce acquista elettroni. l Queste azioni (“driving force”) generano una differenza di potenziale della cella Ecella (anche chiamata forza elettromotrice (fem) l Unità di misura è il volt(V) l Un volt = 1 joule/coulomb (lavoro/carica)

+0. 34 H 2 in Anodo H+ - Cl 1 M HCl Catodo Cu+2 SO 4 -2 1 M Cu. SO 4

Elettrodo Standard ad Idrogeno l Tutte le reazioni di riduzione sono paragonate a questo elettrodo l. E º = 0 lº H 2 in H+ Cl indica che si tratta di stati standard a 25ºC, 1 atm, 1 M soluzioni. 1 M HCl

Potenziale della Cella Zn(s) + Cu 2 + (aq) ® Zn 2+ (aq) + Cu(s) l Il potenziale totale della cella è la somma del potenziale di ciascun elettrodo. l l Eº cell = EºZn® Zn 2+ + Eº Cu 2+ ® Cu I potenziali di riduzione delle singole semicelle sono riportati in una tabella. l Essendo nella tabella riportato il potenziale di riduzione uno dei due valori deve essere cambiato di segno! l

Potenziale della Cella l Determinare il potenziale della cella galvanica basata sulla reazione redox: l Cu(s) + Fe+3(aq) ® Cu+2(aq) + Fe+2(aq) l Fe+3(aq) + e-® Fe+2(aq) Eº = 0. 77 V l Cu+2(aq)+2 e- ® Cu(s) Eº = 0. 34 V l Cu(s) ® Cu+2(aq)+2 e. Eº= -0. 34 V l 2 Fe+3(aq) + 2 e-® 2 Fe+2(aq) Eº = 0. 77 V

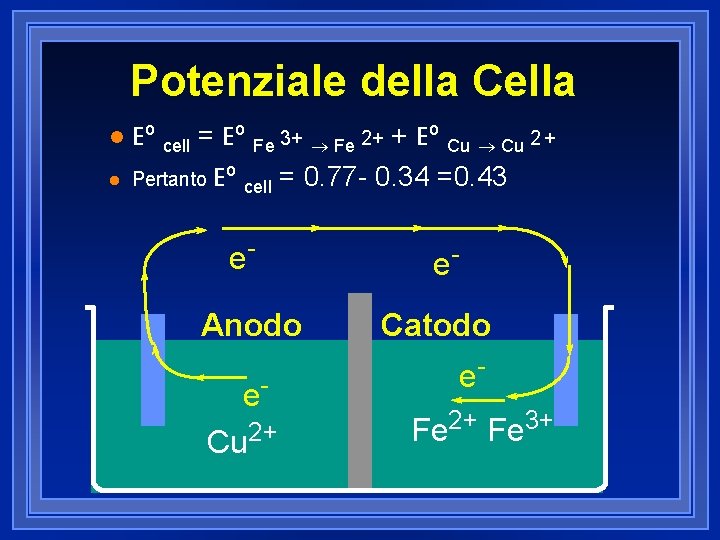
Potenziale della Cella l l Eº cell = Eº Fe 3+ ® Fe 2+ + Eº Cu ® Cu 2 + Pertanto Eº cell = 0. 77 - 0. 34 =0. 43 e. Anodo e. Cu 2+ e. Catodo e. Fe 2+ Fe 3+

Notazione lineare solido½Acquoso½solido l Anodo a sinistra½½Catodo a destra l Fasi differente linea singola. l Setto poroso o ponte salino doppia linea. l Se tutte le specie sono in soluzione in una delle due semicelle allora c’è un elettrodo inerte ad esempio di Platino l Per l’ultima reazione Cu(s)½Cu 2+ (aq)½½Fe 2+ (aq), Fe 3+(aq)½Pt(s) l

Cella Galvanica l l 1) 2) 3) 4) Le reazioni si svolgono spontaneamente sempre nella direzione che produce un potenziale positivo della cella. Per una completa descrizione di una cella bisogna: Determinare il Potenziale della cella Determinare la direzione del flusso di elettroni Designare l’anodo e il catodo Natura di tutti I componenti elettrodi e ioni

Esercizio l Completamente descrivere la cella galvanica basata sulle seguenti semireazioni a condizioni standard. l Mn. O 4 - + 8 H+ +5 e- ® Mn 2+ + 4 H 2 O Eº=1. 51 l Fe 3+ +3 e- ® Fe(s) Eº=0. 036 V

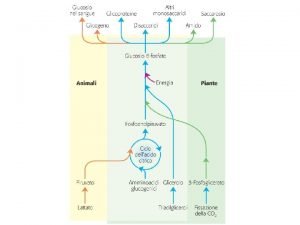
Definizione del G G Fornisce la direzione del processo Fornisce il massimo lavoro utilizzabile di un processo

Energia di Gibbs e Spontaneità n n n G < 0 - la reazione di definisce esoergonica e procede spontaneamente nella direzione in cui è scritta, ossia da sinistra a destra G > 0 - la reazione si definisce endoergonica e procede spontaneamente nella direzione opposta. G = 0 - la reazione è all'equilibrio

Potenziale Lavoro e DG l F. e. m. = potenziale (V) = lavoro (J) / Carica(C) l E = Lavoro fatto dal sistema/carica l E = -w/q l -w = q. E l Una mole di elettroni avrà una carica 96, 485 C/mol e- (Faraday) l q = n. F = moli di e- x carica/mole el w = -q. E = -n. FE = G

Potenziale Lavoro e DG Gº = -n. FE º l se E º > 0, quindi Gº < 0 spontaneo l se E º < 0, quindi Gº > 0 non spontaneo l l Infatti, il processo inverso è spontaneo. l Calcolate Gº per la seguente reazione: l Cu 2+ (aq)+ Fe(s) ® Cu(s)+ Fe 2+ (aq) l Fe 2+ (aq) + e-® Fe(s) l Cu 2+ (aq)+2 e- ® Cu(s) Eº = 0. 44 V Eº = 0. 34 V

Stati non standard l Per un solido o un liquido puri: G = G° • Per un gas: G = G° + RT ln (P/P°) • Per una soluzione: G = G° + RT ln[soluto]

L’ Equazione di Nernst l G = Gº +RTln(Q) l -n. FE = -n. FEº + RTln(Q) l E = Eº - RTln(Q) n. F l 2 Al(s) + 3 Mn+2(aq) ® 2 Al+3(aq) + 3 Mn(s) Eº = 0. 48 V l E’ possibile quindi mediante questa equazione determinare dalle concentrazioni la F. e. m. o viceversa

Potenziale della Cella e Concentrazione 2 Al(s) + 3 Mn 2+ (aq) ® 2 Al 3+ (aq) + 3 Mn(s) se Ecell sarà più grande o meno di Eºcell se [Al 3+] = 1. 5 M e [Mn 2+] = 1. 0 M l Predire [Al 3+] = 1. 0 M e [Mn 2+] = 1. 5 M l Se [Al 3+] = 1. 5 M e [Mn 2+] = 1. 5 M l Se

L’ Equazione Nernst l Quando le reazioni procedono le concentrazioni dei prodotti aumentano e dei reagenti diminuiscono. l La reazione termina quando Q = K e Ecell = 0 l 0 = Eº - RTln(K) n. F l Eº = RTln(K) n. F l n. FEº = ln(K) RT
 Reazione ossidoriduzione
Reazione ossidoriduzione Elettrodo di terza specie
Elettrodo di terza specie Ossidazione perde elettroni
Ossidazione perde elettroni Soluzioni zanichelli capitolo 19
Soluzioni zanichelli capitolo 19 Pila daniell zanichelli
Pila daniell zanichelli Elettrodo seconda specie
Elettrodo seconda specie Capitolo 16 zanichelli chimica
Capitolo 16 zanichelli chimica Reazioni complete e reversibili
Reazioni complete e reversibili Concentrazione molare
Concentrazione molare Reazioni tardive al mezzo di contrasto iodato
Reazioni tardive al mezzo di contrasto iodato Fbpasi
Fbpasi Giuseppe valitutti
Giuseppe valitutti Reazioni di precipitazione
Reazioni di precipitazione Scoperte geografiche mappa concettuale
Scoperte geografiche mappa concettuale Reazioni di ossido riduzione
Reazioni di ossido riduzione Ossidazione e riduzione
Ossidazione e riduzione Reazione chimica esempi
Reazione chimica esempi Reazioni chimiche esempi
Reazioni chimiche esempi Reazioni avverse
Reazioni avverse Bilanciamento reazioni redox
Bilanciamento reazioni redox Gradi di vincolo pattino
Gradi di vincolo pattino Leggi ponderali zanichelli
Leggi ponderali zanichelli Esempio di idrossido
Esempio di idrossido Reazione regiospecifica
Reazione regiospecifica Reazioni reversibili e irreversibili
Reazioni reversibili e irreversibili