Le reazioni chimiche Definizione Per reazione chimica si



























- Slides: 28

Le reazioni chimiche

Definizione Ø Per reazione chimica si intende un processo che porta alla formazione di nuove sostanze (prodotti), diverse dalle sostanze di partenza (reagenti)

Simbolismo Ø Ø Le reazioni chimiche sono rappresentate in modo abbreviato e simbolico mediante equazioni chimiche dove figurano le formule chimiche delle sostanze messe a reagire, dette reagenti, e quelle delle sostanze che si ottengono in seguito alla reazione, dette prodotti. A+B C+D reagenti prodotti

a. A + b. B c. C + d. D ØLe sostanze che reagiscono tra loro lo fanno secondo rapporti di combinazione precisi, nel rispetto della legge di conservazione della massa (Lavoisier) ØAd ogni prodotto o reagente è associato un coefficiente stechiometrico che rappresenta il numero di particelle (atomi o molecole) che prendono parte alla reazione. ØBilanciare una reazione significa trovare i coefficienti stechiometrici per rispettare la legge di conservazione della massa (tutti gli atomi presenti nei reagenti devono necessariamente essere presenti nei prodotti, anche se inseriti in nuovi composti)

Regole per il bilanciamento Ø Conoscere le formule esatte di tutti i reagenti e di tutti i prodotti Davanti ad ogni formula scrivere il coefficiente opportuno in modo da avere lo stesso numero di atomi di ciascun elemento sia tra i reagenti che tra i prodotti. Il coefficiente 1 non viene mai indicato. Ø Es. Ø 2 C + O 2 2 CO

La mole è una quantità di materia che contiene un numero fisso e costante di piccolissime parti Ø 1 mole contiene un numero di particelle pari a 6, 023 x 1023 (No, numero di Avogadro) Ø Si possono convertire i grammi di una sostanza nel n° di moli corrispondenti mediante la relazione: n° moli = g di sostanza / M (composto o elemento) Ø Ø M è la massa in grammi di una mole e le sue dimensioni sono misurate in g/mol

Relazioni ponderali Ø Un’equazione chimica letta in termini di moli anziché di molecole consente di passare da quantità microscopiche a quantità macroscopiche (espresse con ordine di grandezza che va dai grammi fino alle tonnellate)

Convenzioni Ø La reazione può essere scritta utilizzando una freccia orizzontale ( ) oppure una doppia freccia ( ) a) a) se la reazione produce una trasformazione completa ed è irreversibile se la reazione avviene solo parzialmente ed è reversibile

Convenzioni Ø Bisogna indicare con dei simboli lo stato fisico delle sostanze coinvolte nella reazione: (S) = solido (soln) = genericamente in soluzione (l) = liquido (aq) = in soluzione acquosa (g) = gassoso Si indicano in basso a destra della formula Es: C(s) + O 2(g) CO 2(g) Se tutte le sostanze, reagenti e prodotti, si trovano nella stessa fase si dice che la reazione è in fase omogenea, se si trovano in fasi diverse si dice che la reazione è in fase eterogenea

Convenzioni Ø Se la reazione avviene in soluzione, spesso le sostanze possono essere presenti in forma ionica. Si usa scrivere allora solo gli ioni effettivamente coinvolti. Ø Gli ioni che non partecipano alla reazione si dicono ioni spettatori e possono essere omessi.

Reazioni in forma ionica Na 2 CO 3(s) + Ca. Cl 2(s) 2 Na. Cl(s) + Ca. CO 3(s) In forma ionica: 2 Na+ + CO 32 - + Ca 2+ + 2 Cl - 2 Na+ + 2 Cl - + Ca. CO 3(s) Eliminando gli ioni spettatori risulta: CO 32 - + Ca 2+ Ca. CO 3(s)

Classificazione delle reazioni chimiche Ø Reazioni di sintesi: A+B Es: 2 Cu + O 2 AB 2 Cu. O

Classificazione delle reazioni chimiche Ø Reazioni di decomposizione: AB + calore Es: Cu. CO 3 calore A + B Cu. O + CO 2(g)

Classificazione delle reazioni chimiche Ø Reazioni di precipitazione: A + B C(s) + D Una reazione è detta di precipitazione quando provoca la formazione di un composto insolubile. I reagenti sono considerati in soluzione acquosa e solubili. Es: Pb(NO 3)2 + 2 KI 2 KNO 3 + Pb. I 2(s) giallo

Classificazione delle reazioni chimiche Ø Reazioni di sostituzione o di scambio: AB + C AC + B (sostituzione) Zn + H 2 SO 4 AB + CD Zn. SO 4 + H 2 CB + AD (doppio scambio) Na. I + HCl Na. Cl + HI

Classificazione delle reazioni chimiche Ø Reazioni di combustione: Combustibile + Comburente prodotti + calore Una reazione è detta di combustione quando un composto, detto combustibile , reagisce con l’ossigeno e sviluppa una sensibile quantità di calore oltre ai prodotti della combustione. calore CH 4 + 2 O 2 CO 2(g) + 2 H 2 O(g) Per innescare una reazione di combustione è necessaria una sufficiente temperatura di accensione.

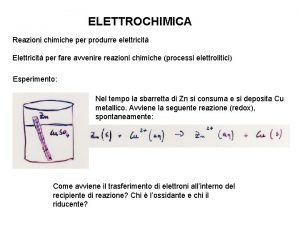
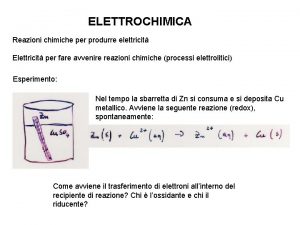
Classificazione delle reazioni chimiche Ø Reazioni di ossido – riduzione (redox): Una reazione di ossido – riduzione è una reazione in cui si verifica uno scambio di elettroni da una sostanza all’altra. - La sostanza che perde elettroni si ossida - La sostanza che acquista elettroni si riduce

Come si riconoscono le redox Ø Un modo semplice per riconoscere le reazioni redox è quello di osservare se vi è variazione del numero di ossidazione di due differenti elementi. Infatti, se vi è variazione del numero di ossidazione, la reazione è di ossido-riduzione. 0 +2 -1 2 Al(s) + 3 Cu. Cl 2(aq) +3 -1 0 2 Al. Cl 3(aq) + 3 Cu

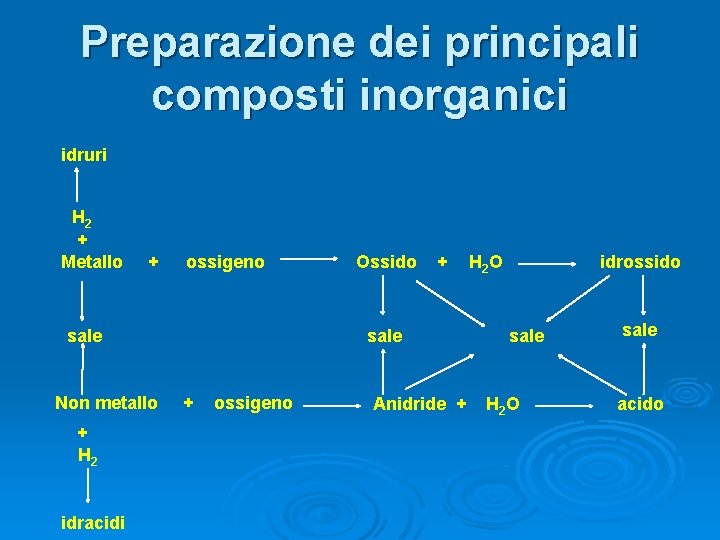
Preparazione dei principali composti inorganici idruri H 2 + Metallo + ossigeno sale Non metallo + H 2 idracidi Ossido + sale + ossigeno Anidride + H 2 O idrossido sale H 2 O sale acido

Preparazione dei principali composti inorganici IDRURI Metallo + H 2 Ø 2 K + H 2 → 2 KH IDRACIDI Non Metallo + H 2 + Cl 2 → 2 HCl

Preparazione dei principali composti inorganici ANIDRIDI OSSIDI Non Metallo + O 2 Ø 4 Li(s) + O 2(g ) S(s) + O 2(g) SO 2(g) 2 N 2(g) + 5 O 2(g) 2 N 2 O 5(g) Ø 2 Li 2 O Ø Decomposizione per riscaldamento (calcinazione di Sali) Ø Ø Ca. CO 3(s) Ca. O + CO 2 Fe. SO 3 Fe. O + SO 2

Preparazione dei principali composti inorganici IDROSSIDI 1. Metalli del 1° e 2° gruppo con H 2 O 2 K + 2 H 2 O 2 KOH + H 2 Ca + 2 H 2 O Ca(OH)2 + H 2

Preparazione dei principali composti inorganici IDROSSIDI Ø Ossidi dei metalli del 1° e 2° gruppo + H 2 O Na 2 O + H 2 O 2 Na. OH Ca. O + H 2 O Ca(OH)2

Preparazione dei principali composti inorganici IDROSSIDI 3. Sale solubile e idrossido per preparare idrossidi dei metalli di transizione Cr. Cl 3 +3 Na. OH Cr(OH)3 + 3 Na. Cl Fe. Cl 3 + 3 Na. OH Fe(OH)3 + 3 Na. Cl

Preparazione dei principali composti inorganici ACIDI OSSIGENATI Ø Anidridi (ossidi di non metalli) con H 2 O SO 3 + H 2 O H 2 SO 4 N 2 O 5 + H 2 O 2 HNO 3 Cl 2 O + H 2 O 2 HCl. O

Preparazione dei principali composti inorganici SALI 1. 2. 3. 4. Idrossido + acido 2 Al(OH)3 + 3 H 2 SO 4 Metallo + acido Mg + 2 HNO 3 Ossido + acido Cu. O + H 2 SO 4 Ossido + anidride Ca. O + CO 2 Al 2(SO 4)3 + 6 H 2 O Mg(NO 3)2 + H 2 Cu. SO 4 + H 2 O Ca. CO 3

Preparazione dei principali composti inorganici 5. 6. 7. 8. SALI Doppio scambio tra Sali Ag. NO 3 + Na. I Ag I + Na. NO 3 Idrossido + anidride Ba(OH)2 + CO 2 Ba. CO 3 + H 2 O Metallo + non metallo 2 Al + 3 Cl 2 2 Al. Cl 3 Decomposizione 2 KCl. O 3 calore 2 KCl + 3 O 2

PREPARAZIONE COMPOSTI INORGANICI IDRURI/ IDRACIDI OSSIDI BASICI OSSIDI ACIDI • Sintesi Me + H 2 Me + O 2 NMe + O 2 Ossido b. +H 20 • Decomp. riscaldam. • Scambio s. NMe + H 2 • Sintesi IDROSSIDI • Sintesi Me + H 20 • Scambio d. Sale + idrossido OSSIACIDI • Sintesi Ossido a. +H 20 SALI ………. .
 Scoperte geografiche mappa concettuale
Scoperte geografiche mappa concettuale Le leggi ponderali zanichelli
Le leggi ponderali zanichelli Equazione chimica
Equazione chimica Reazioni chimiche esempi
Reazioni chimiche esempi Coefficienti stechiometrici
Coefficienti stechiometrici Le reazioni chimiche capitolo 16
Le reazioni chimiche capitolo 16 Fe2no3
Fe2no3 Calcolo stechiometrico
Calcolo stechiometrico Ciclo alcano
Ciclo alcano Beuta codata chimica
Beuta codata chimica Mappa concettuale trasformazioni chimiche e fisiche
Mappa concettuale trasformazioni chimiche e fisiche Trasformazioni fisiche e chimiche zanichelli
Trasformazioni fisiche e chimiche zanichelli Analisi del mosto
Analisi del mosto Chartbu
Chartbu Legge proust
Legge proust Patrizia amadio
Patrizia amadio Bilanciamento reazioni redox
Bilanciamento reazioni redox Reazioni tardive al mezzo di contrasto iodato
Reazioni tardive al mezzo di contrasto iodato Ossidazione e riduzione
Ossidazione e riduzione Reazioni reversibili e irreversibili
Reazioni reversibili e irreversibili Reazioni avverse
Reazioni avverse Ciclo di cori
Ciclo di cori Vincolo carrello nella realtà
Vincolo carrello nella realtà Ossidazione perde elettroni
Ossidazione perde elettroni Regiospecificità
Regiospecificità Reazioni di ossido riduzione
Reazioni di ossido riduzione Soluzioni capitolo 17
Soluzioni capitolo 17 Comcentrazione molare
Comcentrazione molare Superossido dismutasi reazione
Superossido dismutasi reazione