Valitutti Tifi Gentile Esploriamo la chimica Zanichelli editore


































- Slides: 35

Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 1

Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento

Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione delle soluzioni 4. Le soluzioni elettrolitiche e il p. H 5. Le proprietà colligative Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 3

1. Perché le sostanze si sciolgono? Nella formazione di una soluzione le molecole di solvente circondano le molecole di soluto. Tale fenomeno è chiamato solvatazione ed è dovuto alle attrazioni che si esercitano fra solvente e soluto. Quando il solvente è l’acqua la solvatazione prende il nome di idratazione. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 4

1. Perché le sostanze si sciolgono? La capacità di un soluto di sciogliersi in un dato solvente dipende da molti fattori, tra cui i tipi di legami che si devono spezzare nel soluto e nel solvente e quelli che si possono formare nella soluzione. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 5

1. Perché le sostanze si sciolgono? I composti molecolari formano soluzioni per dispersione nell’acqua delle molecole elettricamente neutre; l’acqua rompe i deboli legami intermolecolari. Queste soluzioni non conducono elettricità. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 6

1. Perché le sostanze si sciolgono? I composti polari (come gli acidi) in acqua si ionizzano: le molecole dipolari dell’acqua spezzano i legami covalenti polari della molecola conseguente formazione di ioni HCl(g) ⇄ H+(aq) + Cl–(aq) Queste soluzioni conducono elettricità. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 7

1. Perché le sostanze si sciolgono? I composti ionici in acqua si dissociano, ovvero liberano ioni: le molecole d’acqua separano gli ioni di carica opposta già presenti nel composto. Questo processo viene chiamato dissociazione. Na. Cl(s) ⇄ Na+(aq) + Cl-(aq) Queste soluzioni conducono elettricità. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 8

1. Perché le sostanze si sciolgono? Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 9

1. Perché le sostanze si sciolgono? Le sostanze non polari non si miscelano con l’acqua ma solo con i solventi non polari. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 10

1. Perché le sostanze si sciolgono? Un elettrolita è una sostanza che rende elettricamente conduttrice la soluzione acquosa in cui è disciolto. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 11

1. Perché le sostanze si sciolgono? Soluzioni con alta conducibilità elettrica contengono soluti detti elettroliti forti. Soluzioni con modesta conducibilità elettrica contengono soluti detti elettroliti deboli. Soluzioni che non presentano conducibilità elettrica contengono soluti detti non elettroliti. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 12

1. Perché le sostanze si sciolgono? Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 13

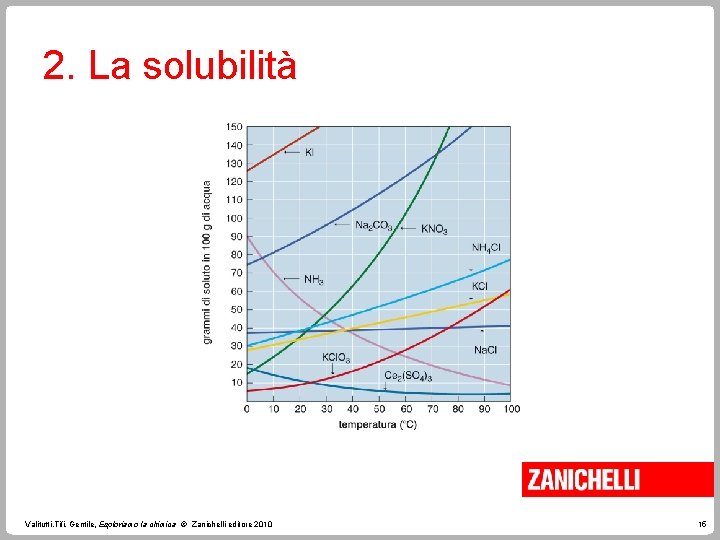
2. La solubilità è la quantità massima di soluto che si può sciogliere in una determinata quantità di solvente. Per la maggior parte delle sostanze solide, la solubilità cresce all’aumentare della temperatura. Per tutti i soluti gassosi la solubilità diminuisce all’aumentare della temperatura. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 14

2. La solubilità Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 15

3. La concentrazione delle soluzioni La concentrazione di una soluzione è il rapporto tra la quantità di soluto e la quantità di solvente in cui il soluto è disciolto. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 16

3. La concentrazione delle soluzioni La concentrazione percentuale in massa (% m/m) indica la quantità in grammi di soluto sciolta in 100 grammi di soluzione. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 17

3. La concentrazione delle soluzioni La concentrazione percentuale massa su volume (% m/V) indica la quantità in grammi di soluto sciolta in 100 m. L di soluzione. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 18

3. La concentrazione delle soluzioni La concentrazione percentuale in volume (% V/V) indica il volume in millilitri di soluto sciolto in 100 m. L di soluzione. Il grado alcolico di una bevanda corrisponde ai millilitri di alcol disciolti in 100 m. L di bevanda. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 19

3. La concentrazione delle soluzioni La concentrazione in parti per milione (ppm) indica il numero di parti di soluto presenti in un milione di parti di soluzione. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 20

3. La concentrazione delle soluzioni La concentrazione molare (M) o molarità indica il rapporto fra le moli di soluto e il volume in litri della soluzione. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 21

3. La concentrazione delle soluzioni Soluzioni a concentrazione nota si possono preparare o con il metodo della diluizione, oppure con il metodo della titolazione. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 22

3. La concentrazione delle soluzioni La concentrazione molale (m) o molalità è il rapporto tra le moli di soluto e la massa del solvente espressa in kilogrammi. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 23

4. Le soluzioni elettrolitiche e il p. H Le soluzioni che contengono ioni conducono elettricità e vengono dette elettrolitiche. Gli acidi sono gli elettroliti che in acqua liberano ioni H+; le basi invece liberano ioni OH-. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 24

4. Le soluzioni elettrolitiche e il p. H Le soluzioni acide che si usano nella vita quotidiana sono numerose: il limone, l’aceto e l’acido muriatico. Le soluzioni basiche, invece, sono il detersivo e il bicarbonato. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 25

4. Le soluzioni elettrolitiche e il p. H Il p. H è un numero che misura il grado di acidità (o di basicità) di una soluzione. Il valore del p. H dipende dalla concentrazione degli ioni H 3 O+ presenti nella soluzione. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 26

4. Le soluzioni elettrolitiche e il p. H Maggiore è la concentrazione degli ioni, più basso è il valore del p. H. Una soluzione può essere • neutra: il p. H è uguale a 7, 00; • acida: il p. H è minore di 7, 00; • basica: il p. H è maggiore di 7, 00. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 27

4. Le soluzioni elettrolitiche e il p. H Una reazione di neutralizzazione è la razione che avviene tra una soluzione acida e una soluzione basica in quantità stechiometrica equivalente. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 28

5. Le proprietà colligative Quando un soluto si scioglie in un solvente, le particelle del soluto si legano con le particelle del solvente. Questi legami modificano il comportamento della soluzione. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 29

5. Le proprietà colligative La tensione di vapore, cioè la pressione di vapore della soluzione, è più bassa della pressione di vapore del solvente puro, alla stesa temperatura. Ci sono due efffetti visibili • il punto di ebollizione si innalza (innalzamento ebulloscopico); • il punto di congelamento si abbassa (innalzamento crioscopico). Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 30

5. Le proprietà colligative Una proprietà colligativa è una proprietà che dipende soltanto dal numero di particelle di soluto presenti in soluzione, e non dalla loro natura. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 31

5. Le proprietà colligative La pressione osmotica è la pressione idrostatica che si deve esercitare sulla soluzione più concentrata separata da una meno concentrata (o dal solvente puro) da una membrana semipermeabile, perché in essa non entri altro solvente (equazione di van’t Hoff). V=n R T Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 32

5. Le proprietà colligative Se la soluzione è un elettrolita, è necessario introdurre il coefficiente i. =M R T i Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 33

5. Le proprietà colligative Le soluzioni che presentano uguale pressione osmotica si dicono isotoniche. Se due soluzioni hanno diversa pressione osmotica, si dice ipotonica quella a concentrazione minore, ipertonica quella a concentrazione maggiore. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 34

5. Le proprietà colligative Grazie all’osmosi si attua il trasporto dei fluidi nel nostro organismo o il trasferimento della linfa dalle radici alle foglie nelle piante. Le pareti delle cellule animali e vegetali sono membrane semipermeabili. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 35
 Zanichelli chimica molecole in movimento soluzioni
Zanichelli chimica molecole in movimento soluzioni Molecole in movimento soluzioni capitolo 11
Molecole in movimento soluzioni capitolo 11 Acidi e basi si scambiano protoni zanichelli
Acidi e basi si scambiano protoni zanichelli Franco lucisano editore
Franco lucisano editore Principio di le chatelier
Principio di le chatelier Etiotrop davolash
Etiotrop davolash Tifi
Tifi Capitolo 14 zanichelli chimica
Capitolo 14 zanichelli chimica Soluzione lineamenti di chimica
Soluzione lineamenti di chimica Osmosi uovo zanichelli
Osmosi uovo zanichelli Chimica più soluzioni capitolo 12
Chimica più soluzioni capitolo 12 Resa effettiva chimica
Resa effettiva chimica Leggi ponderali della chimica zanichelli
Leggi ponderali della chimica zanichelli Dalle soluzioni all'elettrochimica soluzioni capitolo 16
Dalle soluzioni all'elettrochimica soluzioni capitolo 16 Soluzioni chimica più capitolo 17
Soluzioni chimica più capitolo 17 Soluzioni chimica più dalla materia alla nomenclatura
Soluzioni chimica più dalla materia alla nomenclatura Soluzioni capitolo 13 zanichelli chimica
Soluzioni capitolo 13 zanichelli chimica Soluzioni capitolo 11 zanichelli chimica
Soluzioni capitolo 11 zanichelli chimica Soluzioni capitolo 19 zanichelli chimica
Soluzioni capitolo 19 zanichelli chimica Scopriamo la biologia zanichelli soluzioni esercizi
Scopriamo la biologia zanichelli soluzioni esercizi Verifica sistema endocrino zanichelli
Verifica sistema endocrino zanichelli Soluzioni chimica zanichelli capitolo 6
Soluzioni chimica zanichelli capitolo 6 Chimica più soluzioni capitolo 8
Chimica più soluzioni capitolo 8 Pila daniell zanichelli
Pila daniell zanichelli Legge azione reazione
Legge azione reazione Scoprire la chimica seconda edizione soluzioni
Scoprire la chimica seconda edizione soluzioni Chimica più soluzioni capitolo 18
Chimica più soluzioni capitolo 18 Reazioni di precipitazione
Reazioni di precipitazione Barriere postzigotiche
Barriere postzigotiche Zanichelli soluzioni capitolo 16
Zanichelli soluzioni capitolo 16 Soluzioni chimica più capitolo 19
Soluzioni chimica più capitolo 19 Valitutti soluzioni capitolo 6
Valitutti soluzioni capitolo 6 Stati condensati della materia
Stati condensati della materia Un'intera nottata buttato vicino a un compagno massacrato
Un'intera nottata buttato vicino a un compagno massacrato Tim gentile
Tim gentile Greg matarazzo
Greg matarazzo
























































