AMMINOACIDI PEPTIDI PROTEINE Classificazione degli Amminoacidi Anche se






































- Slides: 107

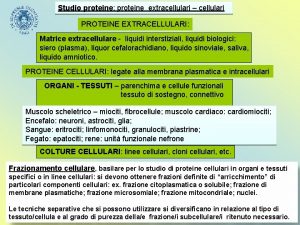
AMMINOACIDI PEPTIDI PROTEINE

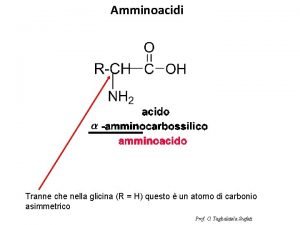
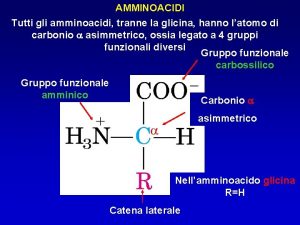
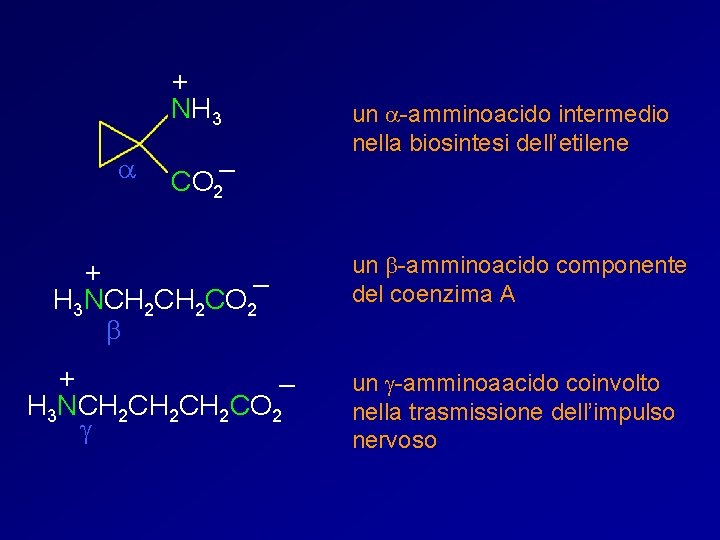
Classificazione degli Amminoacidi Anche se il nome implica la presenza di un gruppo amminico —NH 2 e di un gruppo carbossilico —CO 2 H, in realtà sono presenti i gruppi —NH 3+ and —CO 2–. Sono classificati come a, b, g, ecc. ammino acidi in funzione del carbonio che porta la funzione ammonio

+ NH 3 a CO 2– un a-amminoacido intermedio nella biosintesi dell’etilene + – H 3 NCH 2 CO 2 b un b-amminoacido componente del coenzima A + – H 3 NCH 2 CH 2 CO 2 g un g-amminoaacido coinvolto nella trasmissione dell’impulso nervoso

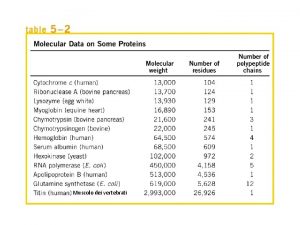
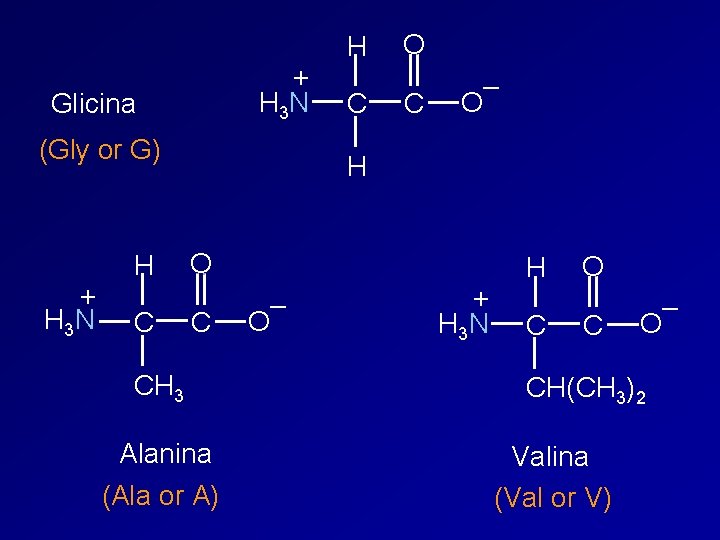
Sono noti 700 amminoacidi naturali 20 ammino acidi, tutti a-amminoacidi, sono i componenti delle proteine. I 20 amminoacidi differiscono per il gruppo legato al carbonio a. + H 3 N H C R O C – O

+ H 3 N Glicina (Gly or G) + H 3 N H C O C – O H O C CH 3 Alanina (Ala or A) – O + H 3 N H C O C – O CH(CH 3)2 Valina (Val or V)

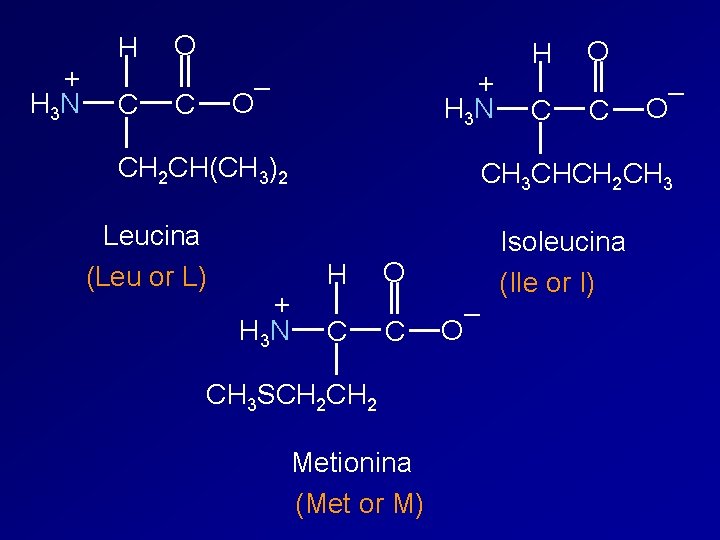
+ H 3 N H C O + H 3 N – O C CH 2 CH(CH 3)2 Leucina (Leu or L) H C O C – O CH 3 CHCH 2 CH 3 + H 3 N H C O C CH 3 SCH 2 Metionina (Met or M) – O Isoleucina (Ile or I)

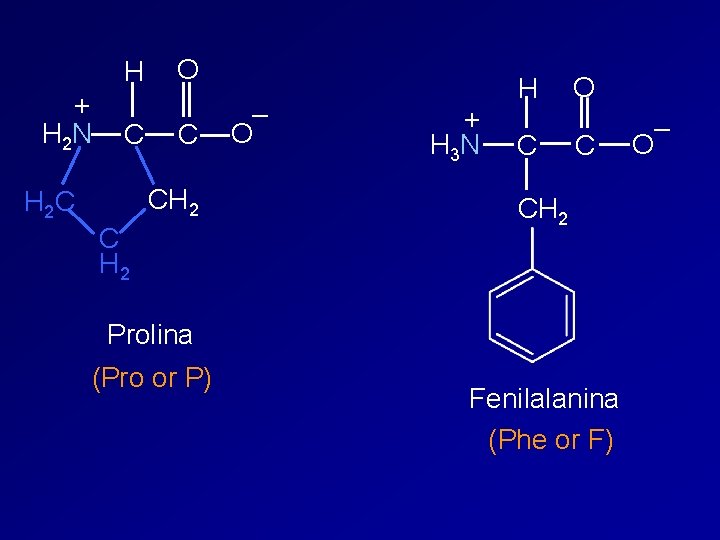
H + H 2 N C O C CH 2 H 2 C C H 2 – O + H 3 N H C O C CH 2 Prolina (Pro or P) Fenilalanina (Phe or F) – O

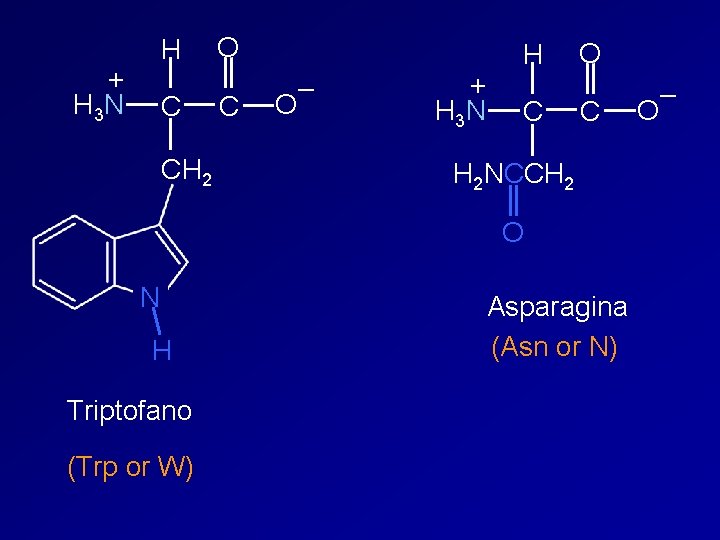
+ H 3 N H C CH 2 O C – O + H 3 N H C O C H 2 NCCH 2 O N H Triptofano (Trp or W) Asparagina (Asn or N) – O

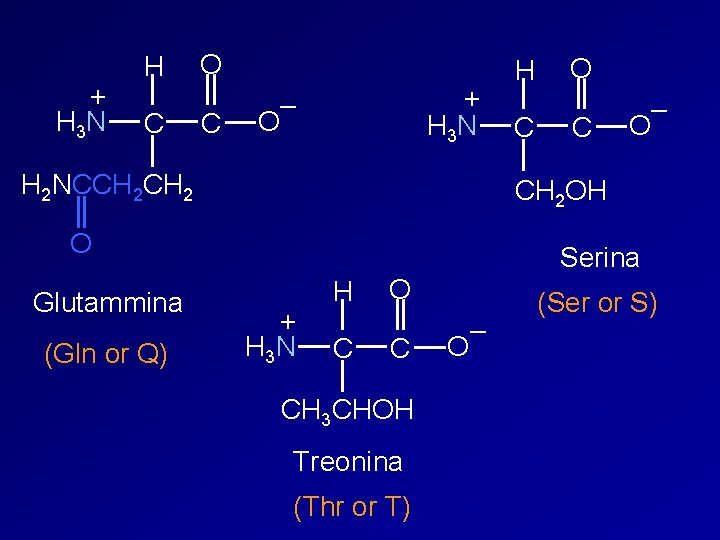
+ H 3 N H C O C + H 3 N – O H 2 NCCH 2 (Gln or Q) C O C – O CH 2 OH O Glutammina H + H 3 N H C Serina O C CH 3 CHOH Treonina (Thr or T) – O (Ser or S)

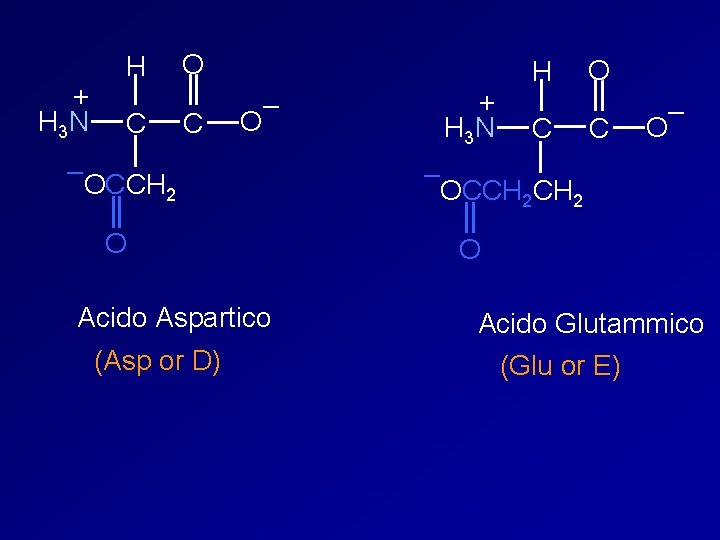
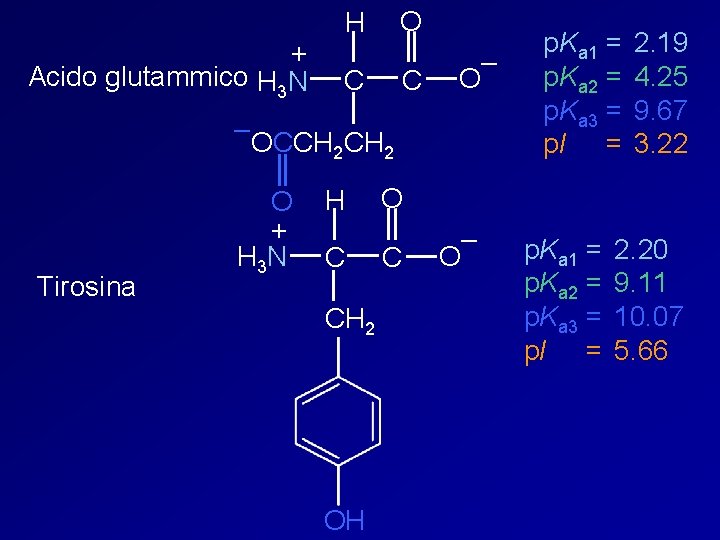
+ H 3 N H C O C – OCCH 2 O Acido Aspartico (Asp or D) + H 3 N H C O C – OCCH 2 O Acido Glutammico (Glu or E)

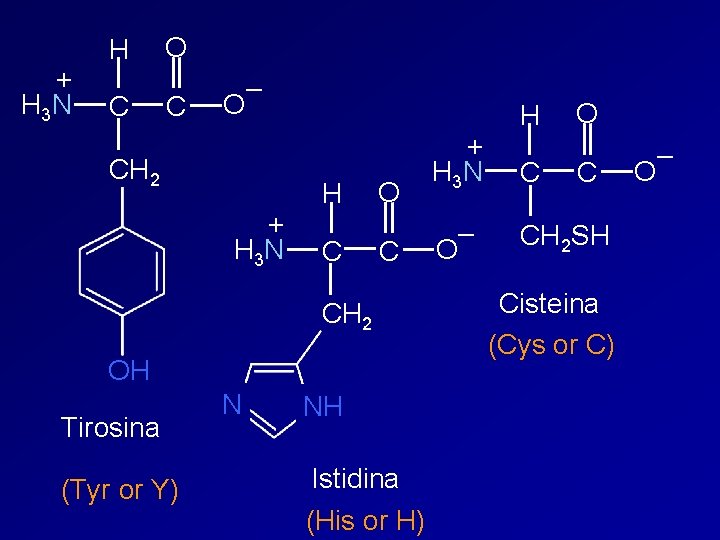
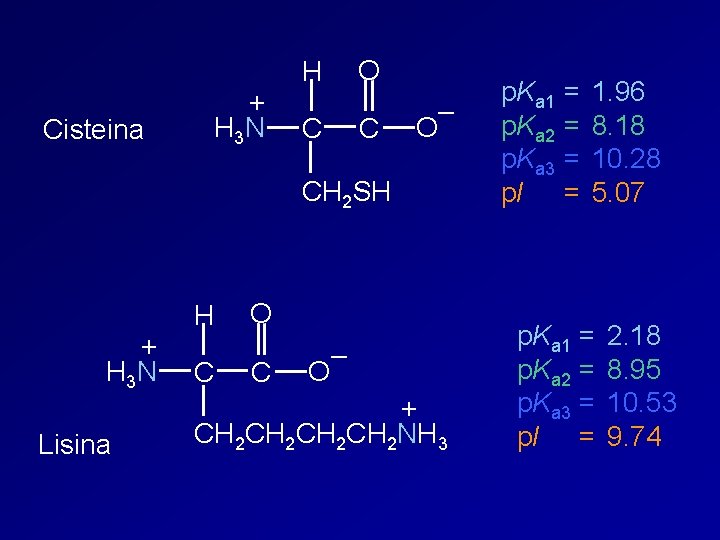
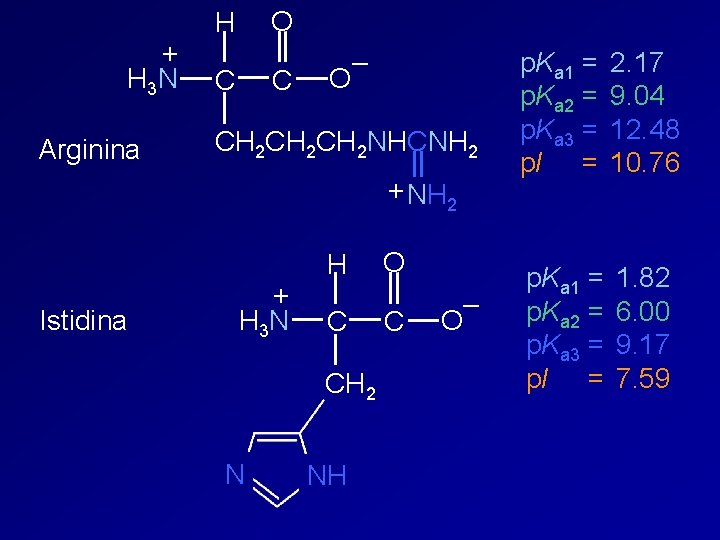
+ H 3 N H C O C – O CH 2 + H 3 N H C O C CH 2 OH Tirosina (Tyr or Y) N NH Istidina (His or H) + H 3 N – O H C O C CH 2 SH Cisteina (Cys or C) – O

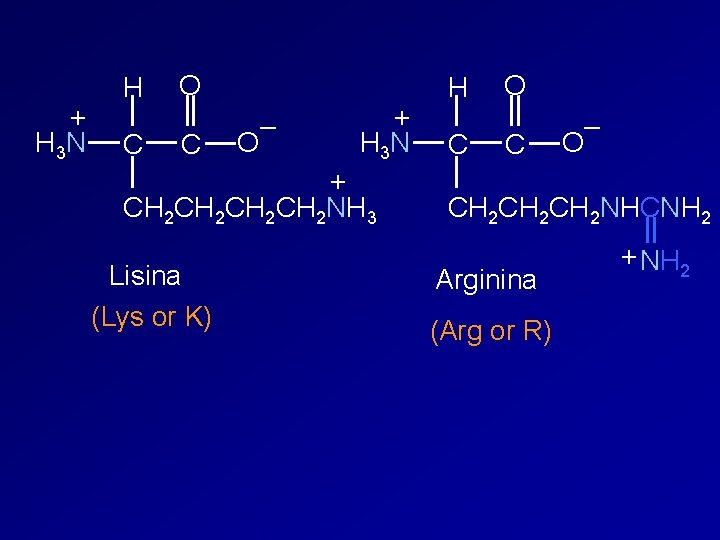
+ H 3 N H C O C – O + H 3 N + CH 2 CH 2 NH 3 Lisina (Lys or K) H C O C – O CH 2 CH 2 NHCNH 2 Arginina (Arg or R) + NH 2

Stereochimica degli Amminoacidi

La Glicina è achirale. Tutti gli altri ammino acidi presenti nelle proteine hanno L -configurazione al carbonio a. – CO 2 + H 3 N H R

Proprietà Acido-Base degli Amminoacidi

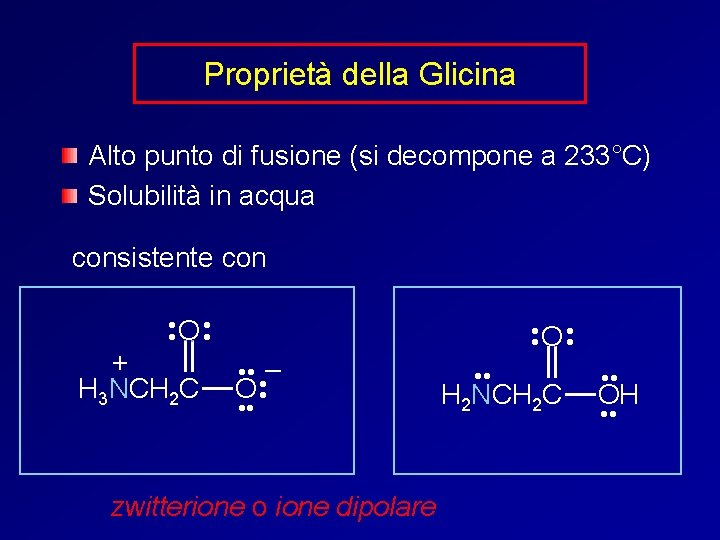
Proprietà della Glicina Alto punto di fusione (si decompone a 233°C) Solubilità in acqua consistente con • • O • • + H 3 NCH 2 C • • • – O • • • zwitterione o ione dipolare • • O • • H 2 NCH 2 C • • OH • •

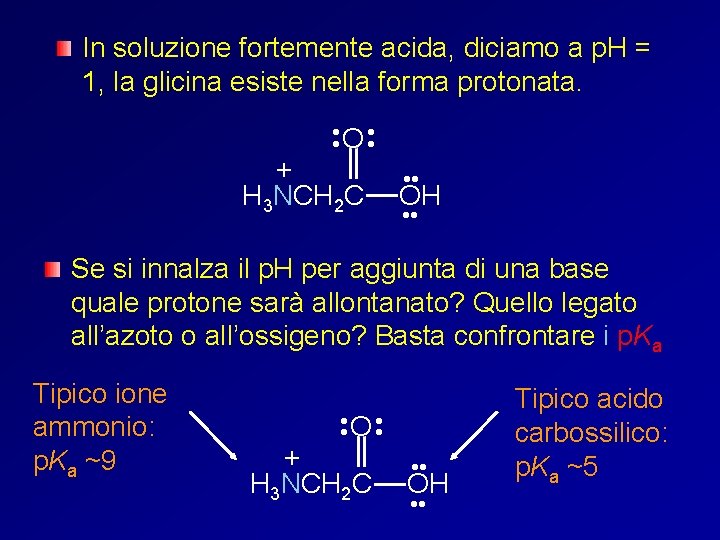
In soluzione fortemente acida, diciamo a p. H = 1, la glicina esiste nella forma protonata. • • O • • + H 3 NCH 2 C • • OH • • Se si innalza il p. H per aggiunta di una base quale protone sarà allontanato? Quello legato all’azoto o all’ossigeno? Basta confrontare i p. Ka Tipico ione ammonio: p. Ka ~9 • • O • • + H 3 NCH 2 C • • OH • • Tipico acido carbossilico: p. Ka ~5

La forma neutra più stabile della glicina è lo ione dipolare • • O • • + H 3 NCH 2 C • • • – O • • • Il p. Ka sperimentale della glicina è 2. 34. L’acidità maggiore di quella di un tipico acido carbossilico si giustifica con l’azione elettronattrice stabilizzante del gruppo ammonio.

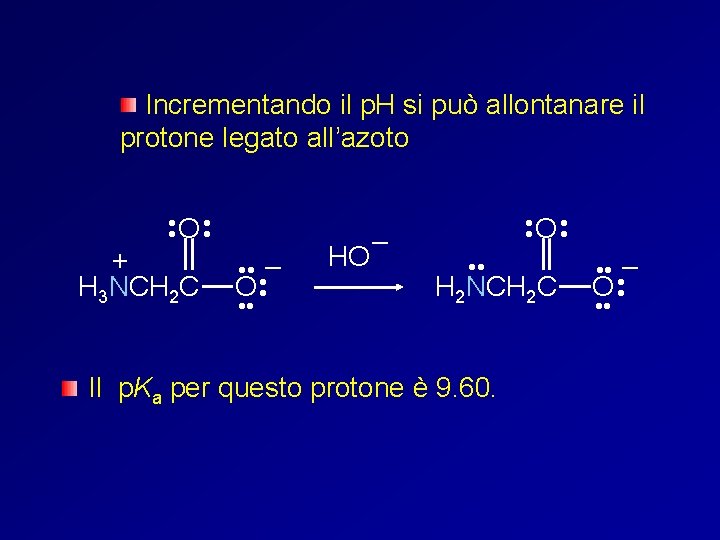
Incrementando il p. H si può allontanare il protone legato all’azoto • • O • • + H 3 NCH 2 C • • • – O • • • HO – • • O • • H 2 NCH 2 C Il p. Ka per questo protone è 9. 60. • • • – O • • •

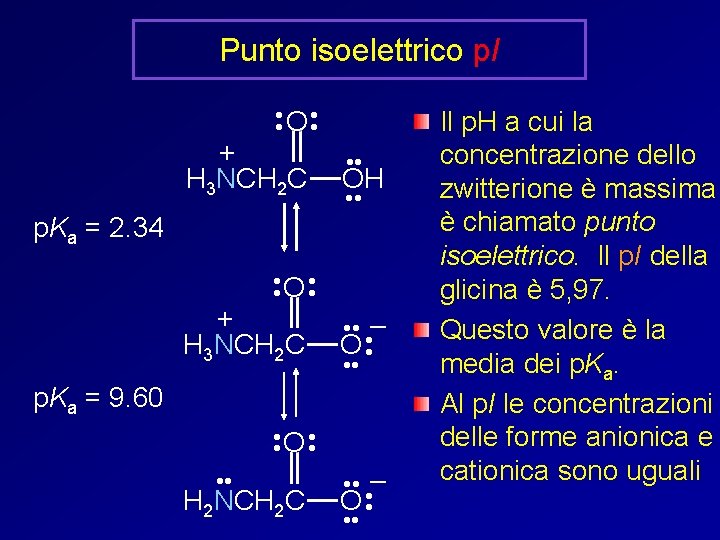
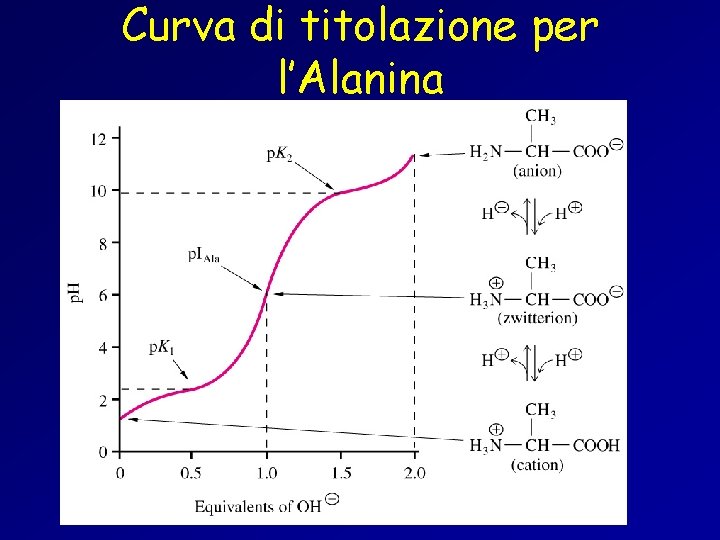
Punto isoelettrico p. I • • O • • + H 3 NCH 2 C p. Ka = 2. 34 • • OH • • O • • + H 3 NCH 2 C • • • – O • • • p. Ka = 9. 60 • • O • • H 2 NCH 2 C • • • – O • • • Il p. H a cui la concentrazione dello zwitterione è massima è chiamato punto isoelettrico. Il p. I della glicina è 5, 97. Questo valore è la media dei p. Ka. Al p. I le concentrazioni delle forme anionica e cationica sono uguali

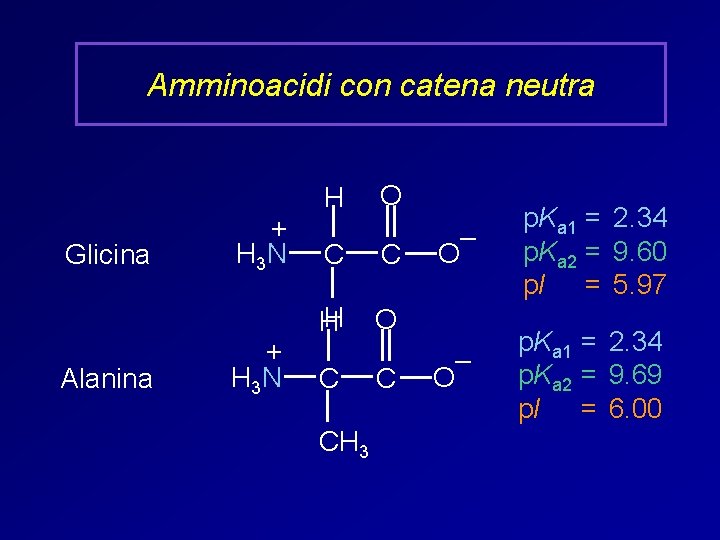
Amminoacidi con catena neutra Glicina Alanina + H 3 N H O C C H H O C CH 3 C – O p. Ka 1 = p. Ka 2 = p. I = 2. 34 9. 60 5. 97 – O p. Ka 1 = 2. 34 p. Ka 2 = 9. 69 p. I = 6. 00

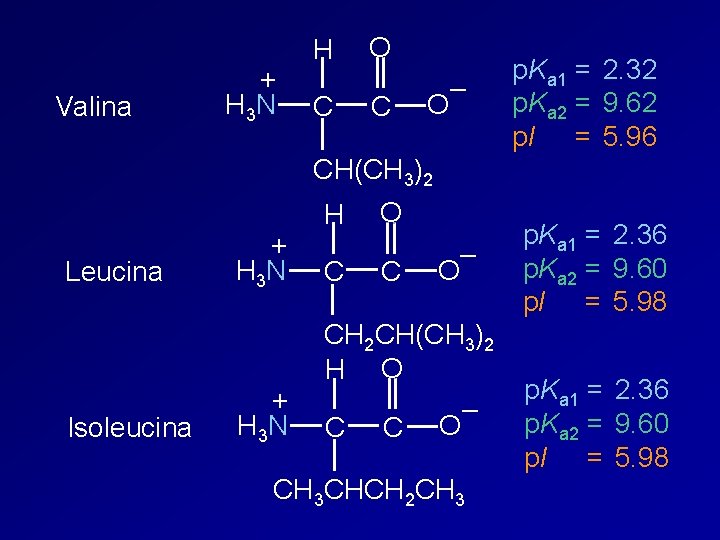
Valina + H 3 N H C O C – O p. Ka 1 = 2. 32 p. Ka 2 = 9. 62 p. I = 5. 96 CH(CH 3)2 Leucina Isoleucina H O + H 3 N CH 2 CH(CH 3)2 H O – C C O C – O CH 3 CHCH 2 CH 3 p. Ka 1 = p. Ka 2 = p. I = 2. 36 9. 60 5. 98

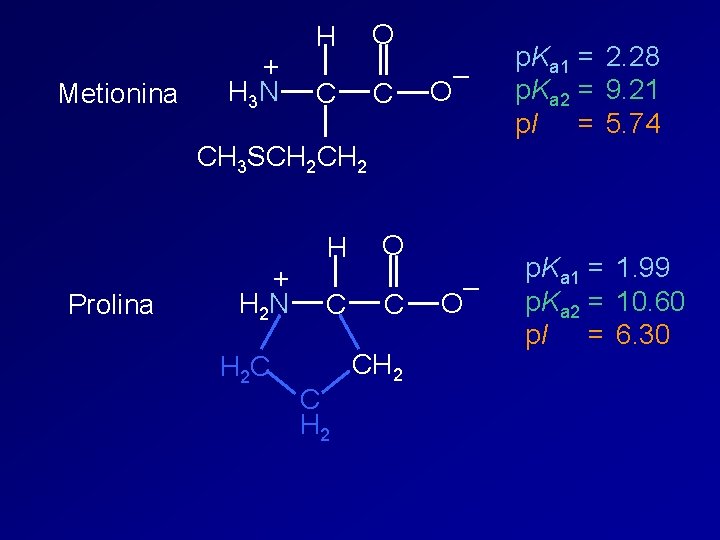
Metionina + H 3 N O H C C – O p. Ka 1 = p. Ka 2 = p. I = 2. 28 9. 21 5. 74 CH 3 SCH 2 Prolina + H 2 N H 2 C H C C H 2 O C CH 2 – O p. Ka 1 = 1. 99 p. Ka 2 = 10. 60 p. I = 6. 30

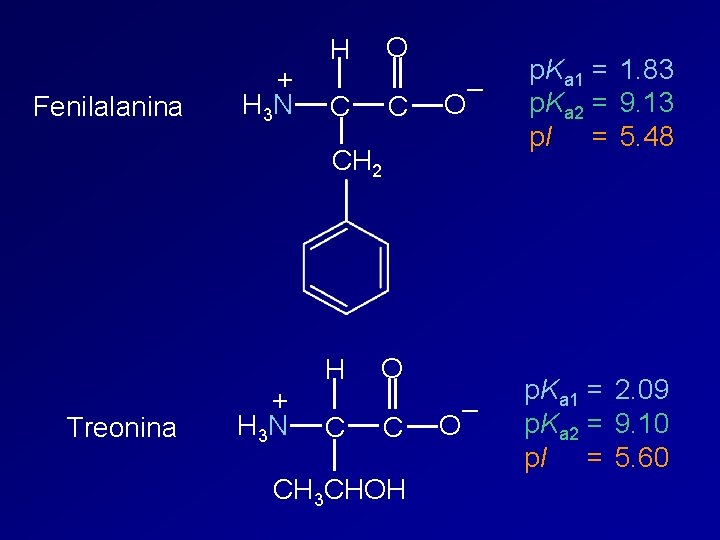
Fenilalanina + H 3 N O H C C – O p. Ka 1 = 1. 83 p. Ka 2 = 9. 13 p. I = 5. 48 – O p. Ka 1 = p. Ka 2 = p. I = CH 2 Treonina + H 3 N H C O C CH 3 CHOH 2. 09 9. 10 5. 60

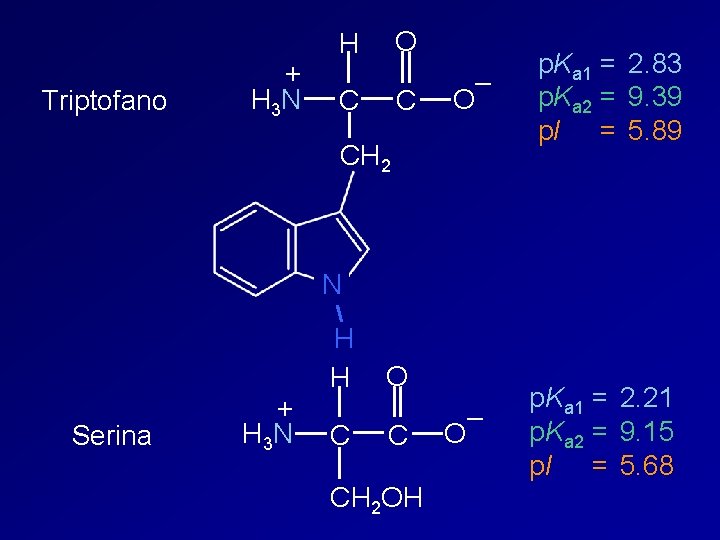
Triptofano + H 3 N O H C C – O p. Ka 1 = 2. 83 p. Ka 2 = 9. 39 p. I = 5. 89 – O p. Ka 1 = p. Ka 2 = p. I = CH 2 N Serina + H 3 N H H C O C CH 2 OH 2. 21 9. 15 5. 68

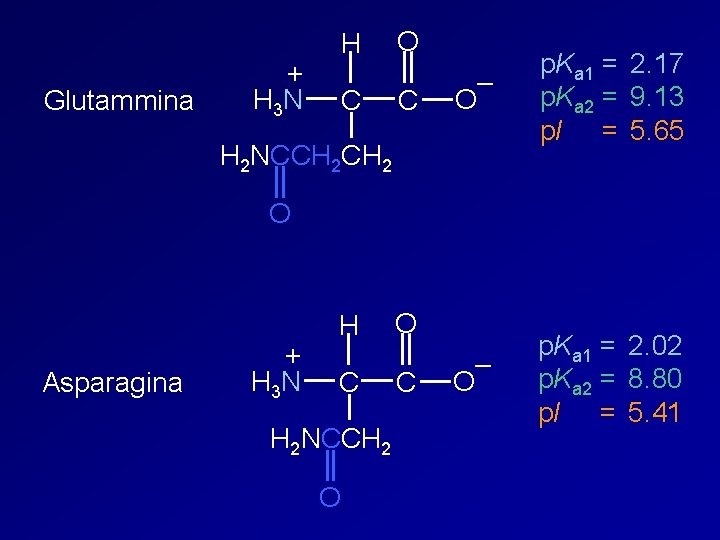
Glutammina + H 3 N H C O C – O p. Ka 1 = 2. 17 p. Ka 2 = 9. 13 p. I = 5. 65 – O p. Ka 1 = 2. 02 p. Ka 2 = 8. 80 p. I = 5. 41 H 2 NCCH 2 O Asparagina + H 3 N H C H 2 NCCH 2 O O C

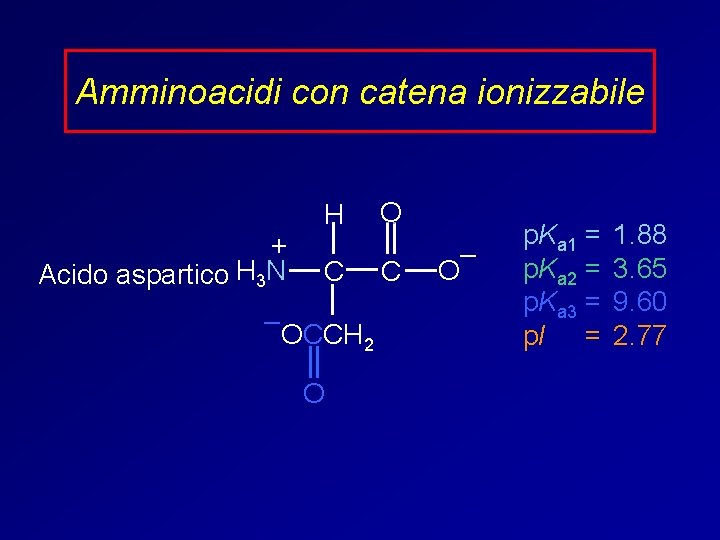
Amminoacidi con catena ionizzabile + Acido aspartico H 3 N H C – OCCH 2 O O C – O p. Ka 1 = p. Ka 2 = p. Ka 3 = p. I = 1. 88 3. 65 9. 60 2. 77

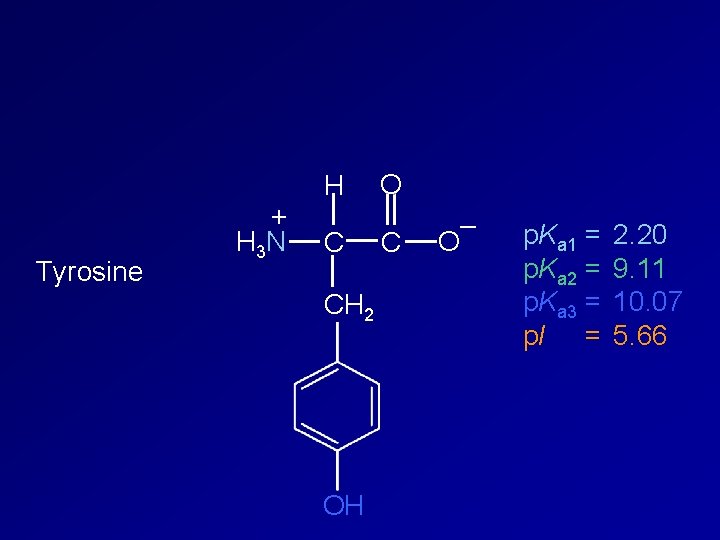
+ Acido glutammico H 3 N O H C C – OCCH 2 Tirosina O + H 3 N H C CH 2 OH p. Ka 1 = p. Ka 2 = p. Ka 3 = p. I = 2. 19 4. 25 9. 67 3. 22 O C – O p. Ka 1 = p. Ka 2 = p. Ka 3 = p. I = 2. 20 9. 11 10. 07 5. 66

Tyrosine + H 3 N H C CH 2 OH O C – O p. Ka 1 = p. Ka 2 = p. Ka 3 = p. I = 2. 20 9. 11 10. 07 5. 66

Cisteina + H 3 N H C O C – O CH 2 SH + H 3 N Lisina H C O C – O + CH 2 CH 2 NH 3 p. Ka 1 = p. Ka 2 = p. Ka 3 = p. I = 1. 96 8. 18 10. 28 5. 07 p. Ka 1 = p. Ka 2 = p. Ka 3 = p. I = 2. 18 8. 95 10. 53 9. 74

+ H 3 N Arginina O H C C – O CH 2 CH 2 NHCNH 2 + NH 2 Istidina + H 3 N H C CH 2 N NH O C – O p. Ka 1 = p. Ka 2 = p. Ka 3 = p. I = 2. 17 9. 04 12. 48 10. 76 p. Ka 1 = p. Ka 2 = p. Ka 3 = p. I = 1. 82 6. 00 9. 17 7. 59

Curva di titolazione per l’Alanina


Sintesi degli Amminoacidi

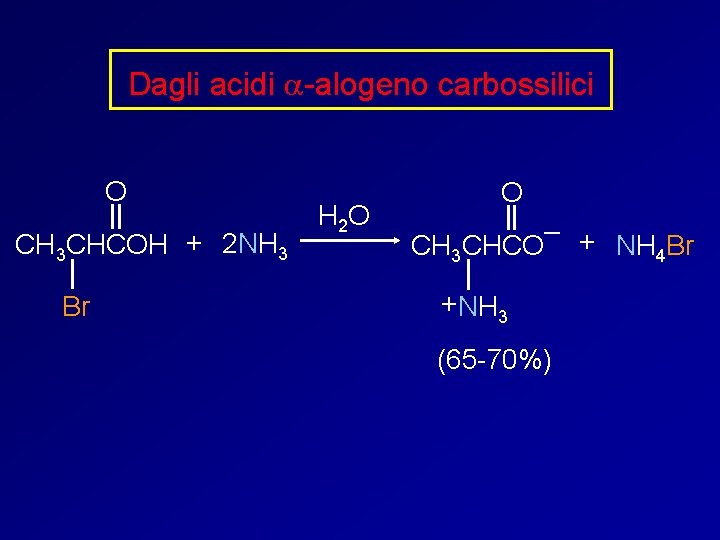
Dagli acidi a-alogeno carbossilici O CH 3 CHCOH + 2 NH 3 Br H 2 O O – CH 3 CHCO + NH 4 Br + NH 3 (65 -70%)

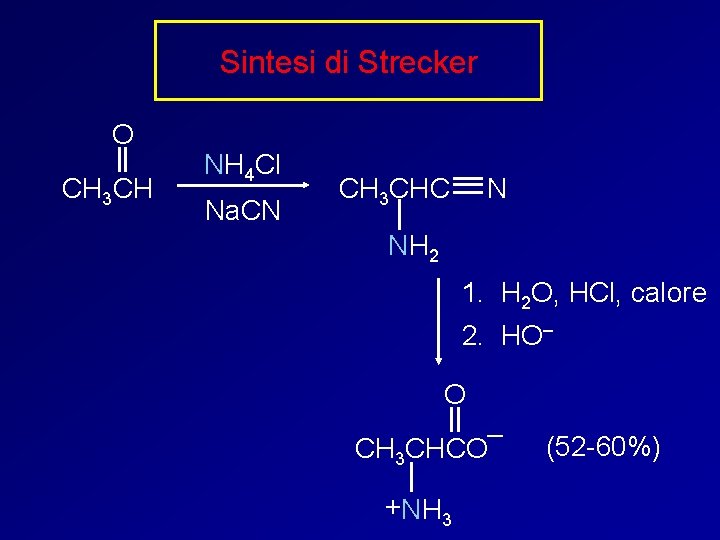
Sintesi di Strecker O CH 3 CH NH 4 Cl Na. CN CH 3 CHC N NH 2 1. H 2 O, HCl, calore 2. HO– O – CH 3 CHCO + NH 3 (52 -60%)

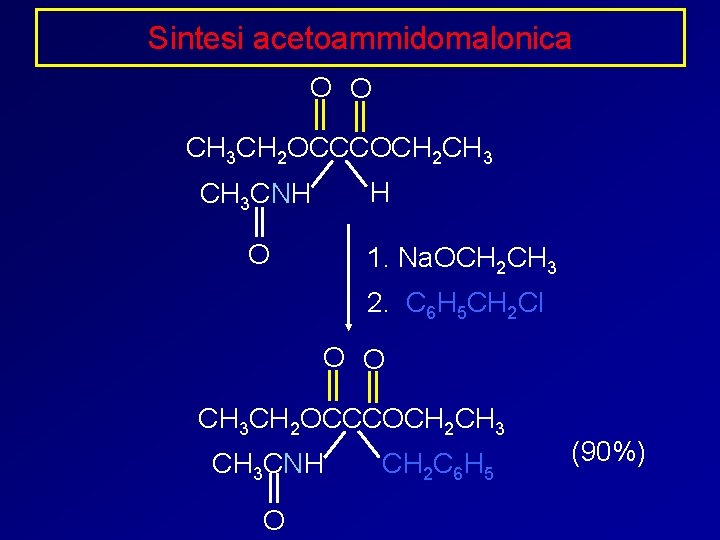
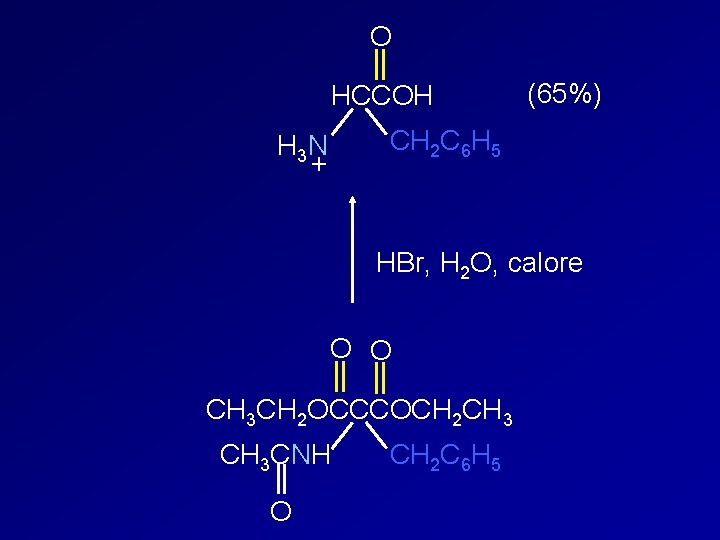
Sintesi acetoammidomalonica O O CH 3 CH 2 OCCCOCH 2 CH 3 H CH 3 CNH O 1. Na. OCH 2 CH 3 2. C 6 H 5 CH 2 Cl O O CH 3 CH 2 OCCCOCH 2 CH 3 CNH O CH 2 C 6 H 5 (90%)

O HCCOH (65%) CH 2 C 6 H 5 H 3 N + HBr, H 2 O, calore O O CH 3 CH 2 OCCCOCH 2 CH 3 CNH O CH 2 C 6 H 5

Reazioni degli Amminoacidi

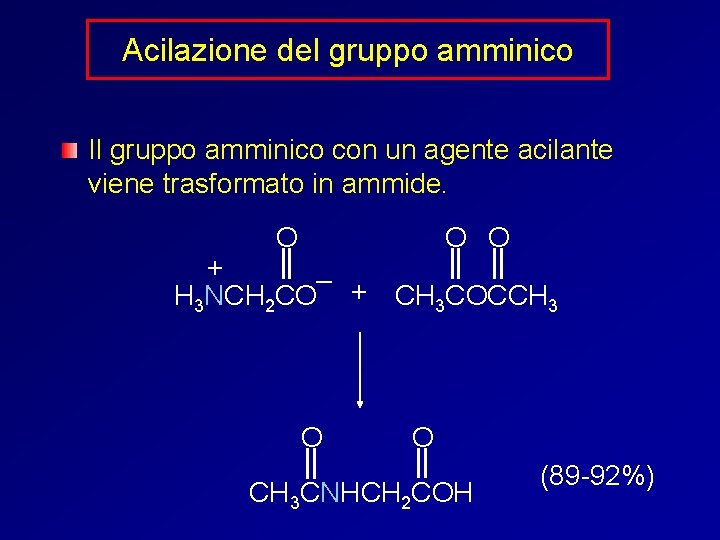
Acilazione del gruppo amminico Il gruppo amminico con un agente acilante viene trasformato in ammide. O O O + – + H 3 NCH 2 CO CH 3 COCCH 3 O O CH 3 CNHCH 2 COH (89 -92%)

Esterificazione del gruppo carbossilico O + – H 3 NCHCO CH 3 + CH 3 CH 2 OH HCl O – Cl + H 3 NCHCOCH 2 CH 3 (90 -95%)

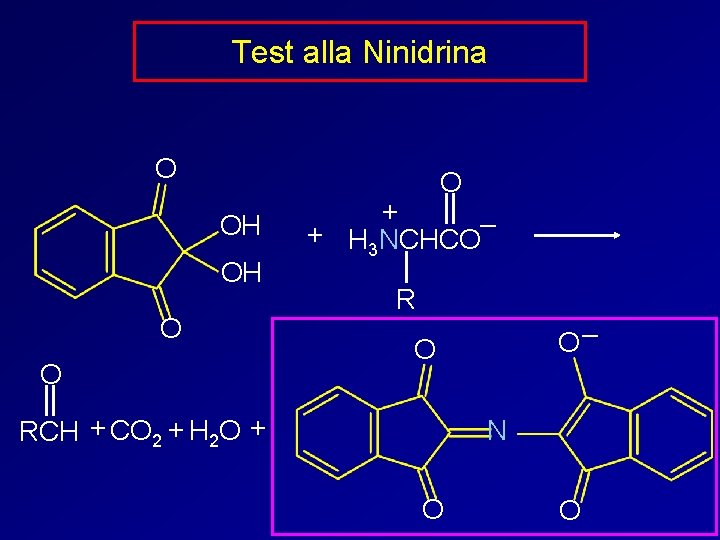
Test alla Ninidrina O O OH OH O O + + H 3 NCHCO– R O– O RCH + CO 2 + H 2 O + N O O

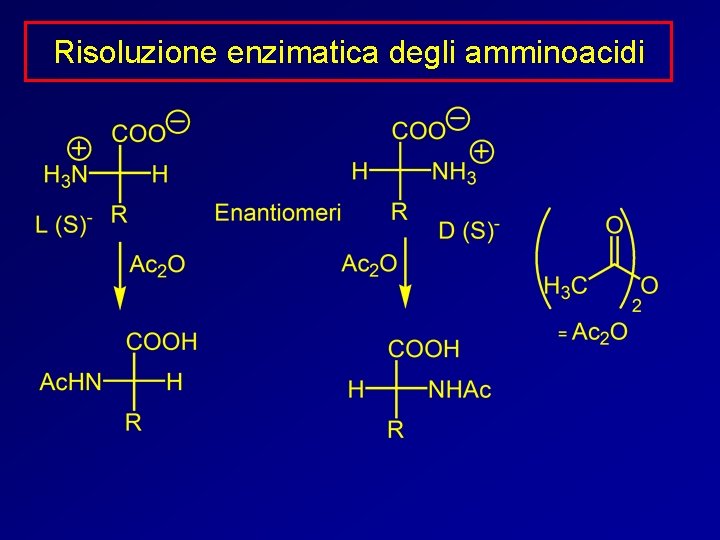
Risoluzione enzimatica degli amminoacidi


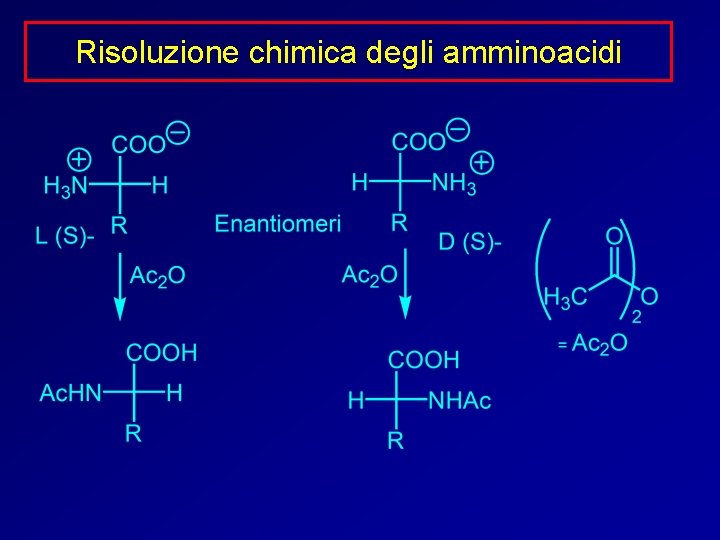
Risoluzione chimica degli amminoacidi


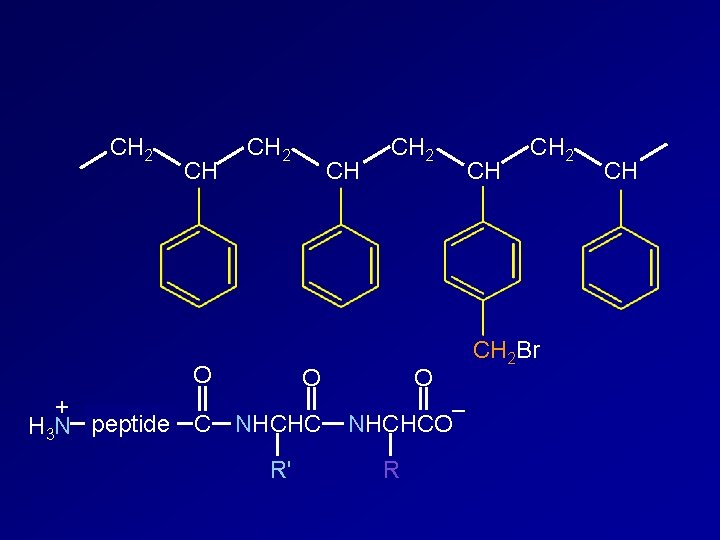
Peptidi

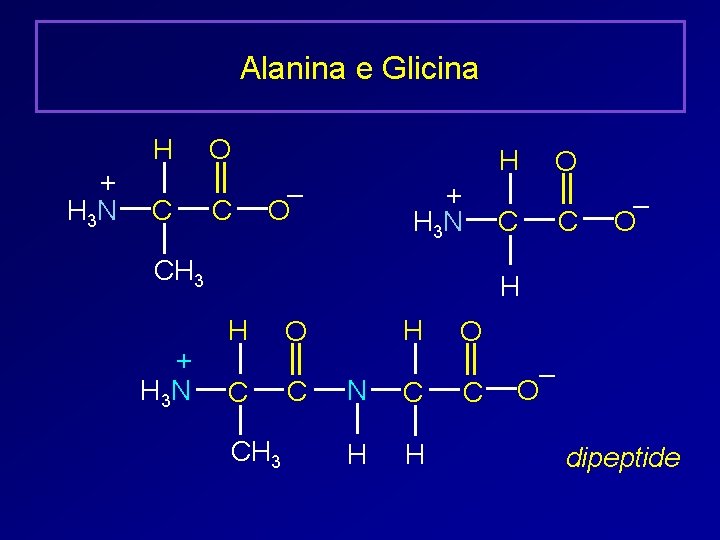
Peptidi I peptidi sono composti in cui un legame ammidico (legame peptidico) lega il gruppo amminico di un a-ammino acido con il gruppo carbossilico di un altro.

Alanina e Glicina H + H 3 N C O C H – O + H 3 N CH 3 + H 3 N O C C – O H H C CH 3 H O C N C H H O C – O dipeptide

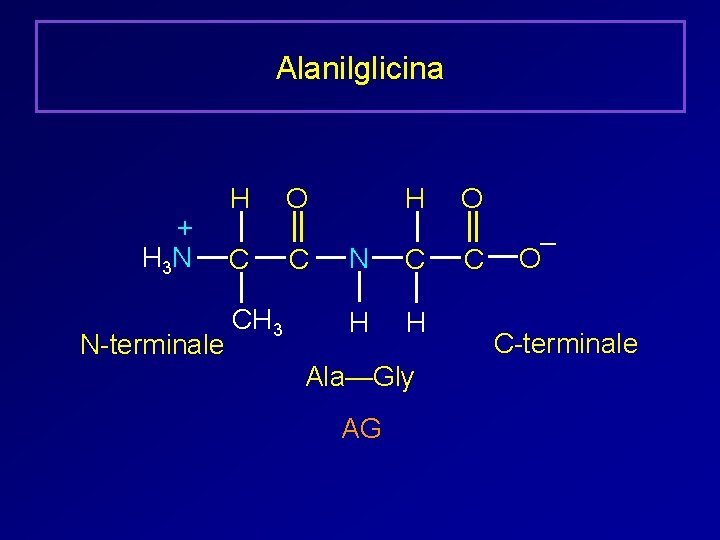
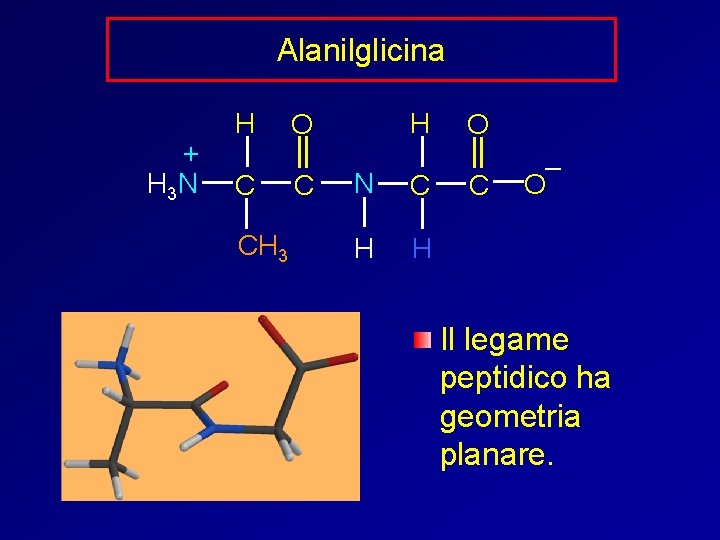
Alanilglicina + H 3 N N-terminale H C CH 3 H O C N C H H Ala—Gly AG O C – O C-terminale

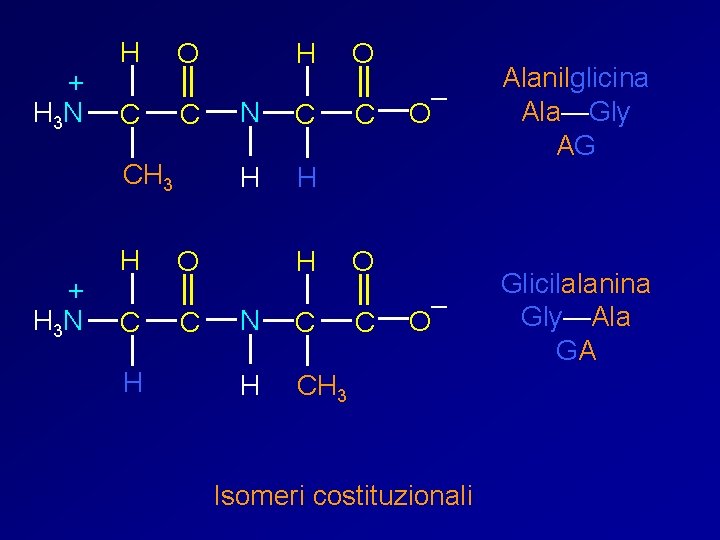
+ H 3 N H C C CH 3 + H 3 N H C H H O N C H H H O C N C H CH 3 O C – O Alanilglicina Ala—Gly AG – O Glicilalanina Gly—Ala GA O C Isomeri costituzionali

Alanilglicina + H 3 N H C CH 3 H O C N C H H O C – O Il legame peptidico ha geometria planare.



Determinazione della struttura di un Peptide

Struttura primaria La struttura primaria è data dalla sequenza di amminoacidi e dai ponti disolfuro Strategia (Sanger) Premio Nobel per la Chimica 1958 e 1980 Sequenza dei peptidi

1. Determinazione degli amminoacidi presenti e loro rapporto molare. 2. Scissione del peptide in frammenti e determinazione della composizione amminoacilica dei frammenti. 3. Identificazione degli amminoacidi Nterminale e C-terminale nel peptide e nei frammenti. 4. Organizzzione delle informazioni fino a defenire la sequenza.

L’idrolisi acida del peptide (6 M HCl, 24 hr) porta alla miscela degli amminoacidi. La miscela può essere smistata nei suoi componenti mediante cromatografia a scambio ionico, che dipende dal p. I degli amminoacidi. Gli amminoacidi sono evidenziati mediante ninidrina. Un analizzatore automatico richiede solo 10 -5 - 10 -7 g di peptide. L’idrolisi acida scinde tutti i legami peptidici, per ottenere frammenti bisogna condurre un’idrolisi parziale mediante enzimi.

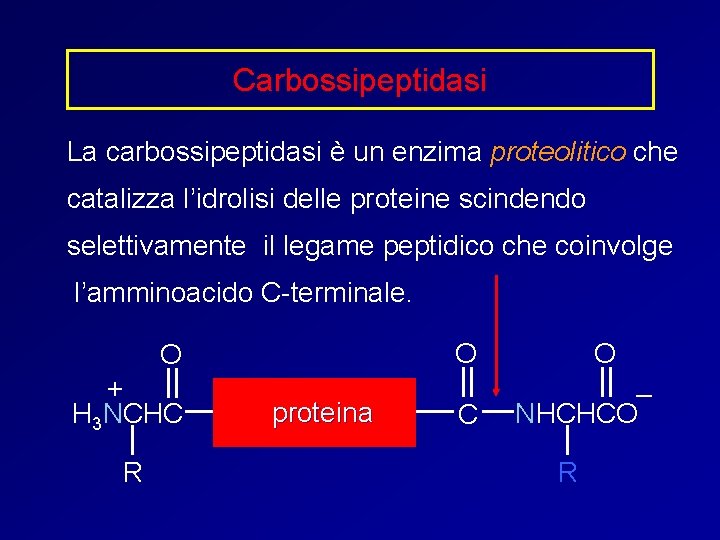
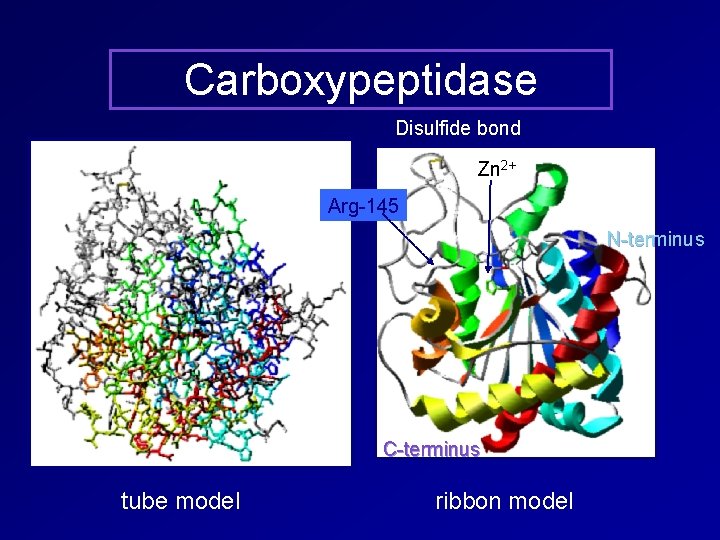
Carbossipeptidasi La carbossipeptidasi è un enzima proteolitico che catalizza l’idrolisi delle proteine scindendo selettivamente il legame peptidico che coinvolge l’amminoacido C-terminale. O O + H 3 NCHC R proteina C O – NHCHCO R

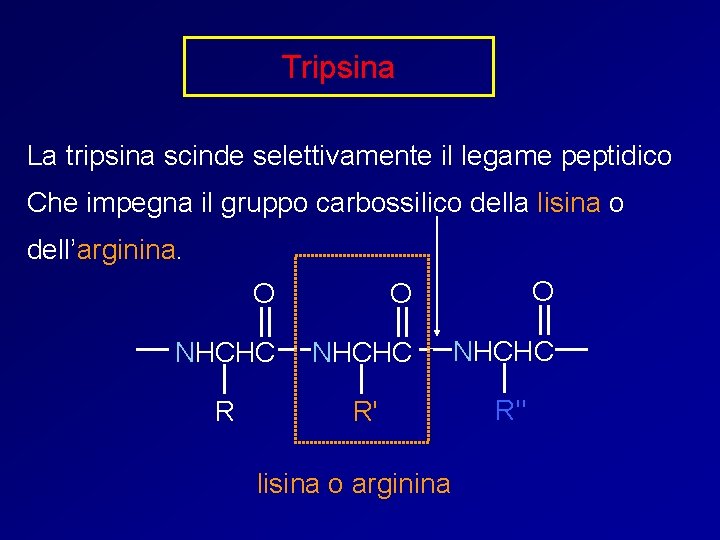
Tripsina La tripsina scinde selettivamente il legame peptidico Che impegna il gruppo carbossilico della lisina o dell’arginina. O O O NHCHC R R' R" lisina o arginina

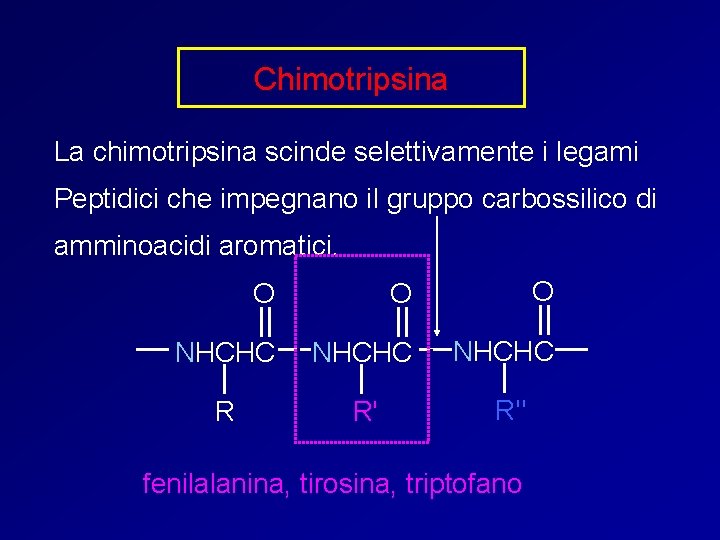
Chimotripsina La chimotripsina scinde selettivamente i legami Peptidici che impegnano il gruppo carbossilico di amminoacidi aromatici. O O O NHCHC R R' R" fenilalanina, tirosina, triptofano

Amminoacido N-terminale La sequenza amminoacilica è ambigua fino a che non si definiscono gli amminoacidi N- e Cterminali. L’amminoacido C-terminale può essere determinato mediante idrolisi enzimatica con carbossipeptidasi. E’ possibile determinare l’amminoacido Nterminale sfruttando il maggior carattere nucleofilo dedll’N terminale rispetto agli N ammidici.

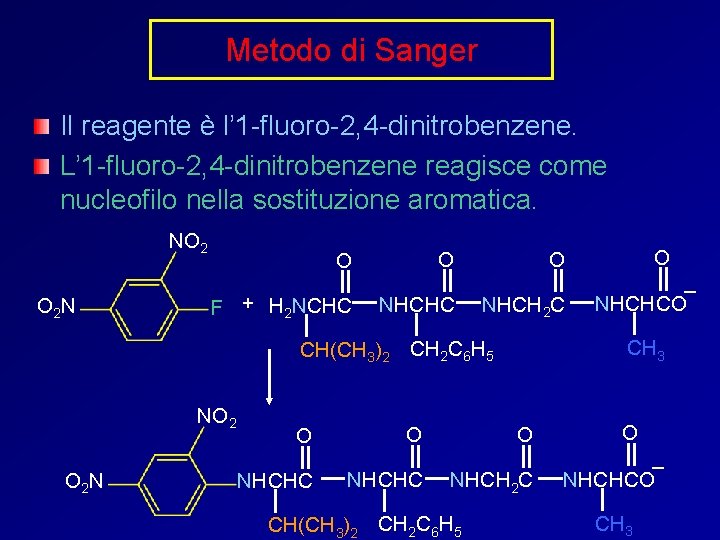
Metodo di Sanger Il reagente è l’ 1 -fluoro-2, 4 -dinitrobenzene. L’ 1 -fluoro-2, 4 -dinitrobenzene reagisce come nucleofilo nella sostituzione aromatica. NO 2 O 2 N O O F + H 2 NCHC NHCH 2 C O 2 N O O O NHCHC NHCH 2 C CH(CH 3)2 CH 2 C 6 H 5 – NHCHCO CH 3 CH(CH 3)2 CH 2 C 6 H 5 NO 2 O O O – NHCHCO CH 3

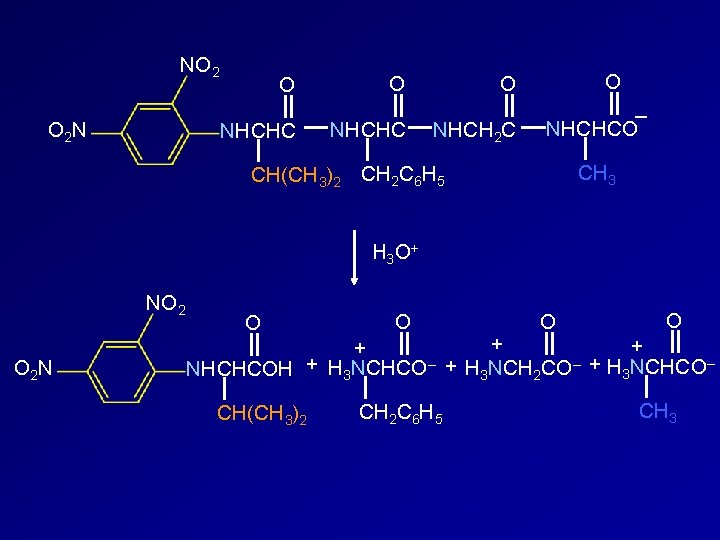
NO 2 O 2 N O O NHCHC O O NHCH 2 C – NHCHCO CH 3 CH(CH 3)2 CH 2 C 6 H 5 H 3 O + NO 2 O 2 N O O + + O O + NHCHCOH + H 3 NCHCO– + H 3 NCH 2 CO– + H 3 NCHCO– CH(CH 3)2 CH 2 C 6 H 5 CH 3

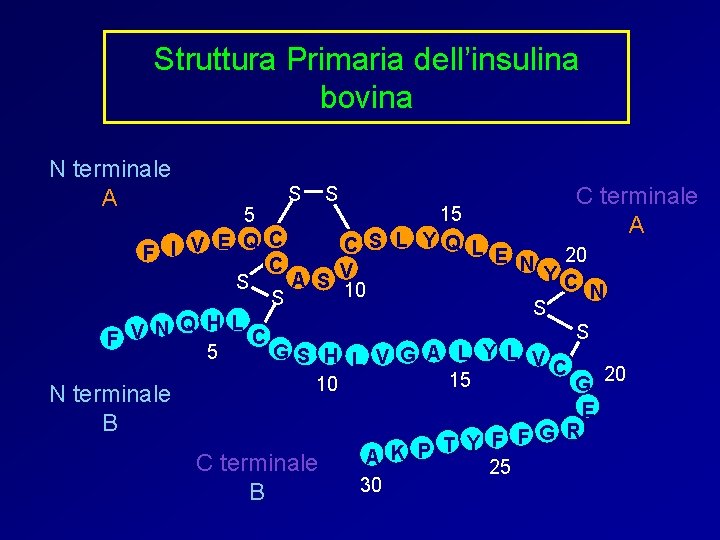
Insulina L’insulina è un polipeptide costituito da 51 amminoacidi. Ha due catene: quella A formata da 21 amminoacidi e quella B formata da 30 amminoacidi. FVNQHLCGSHLVGALYLVCGERGFFYTPKA Catena B

La fenilalanina (F) è N terminale. FVNQHLCGSHL SHLV LVGA VGAL ALY YLVC VCGERGF GFFYTPKA

Struttura Primaria dell’insulina bovina N terminale A S S C terminale A 15 5 S L Y Q L E Q C V C I F 20 E N C YC A S V 10 S N S S N Q H LC V S F 5 G S H L V G A L Y L V C 20 15 10 G N terminale E B G R F F Y K P T A C terminale 25 30 B

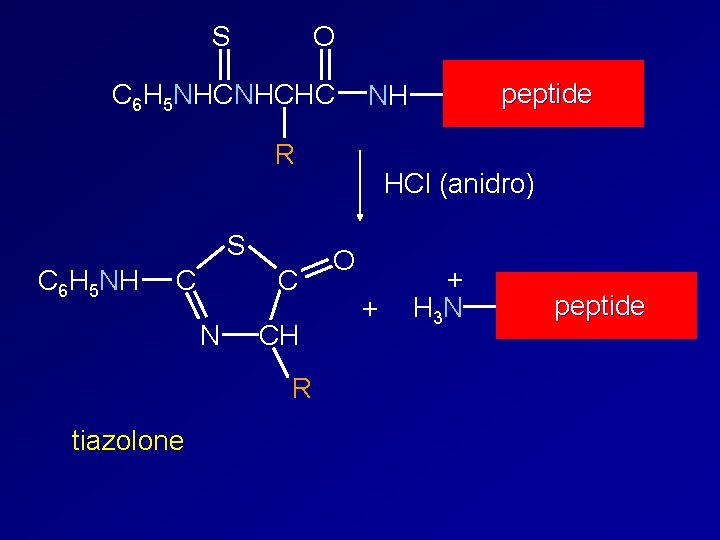
Degradazione di Edman 1. Metodo per la determinazione dell’amminoacido N-terminale. 2. Può essere utilizzato in sequenza per determinare i primi 20 amminoacidi a partire dall’N-terminale. 3. Richiede campioni di solo 10 -10 g. 4. E’ stato automatizzato. N C S Fenil isotiocianato

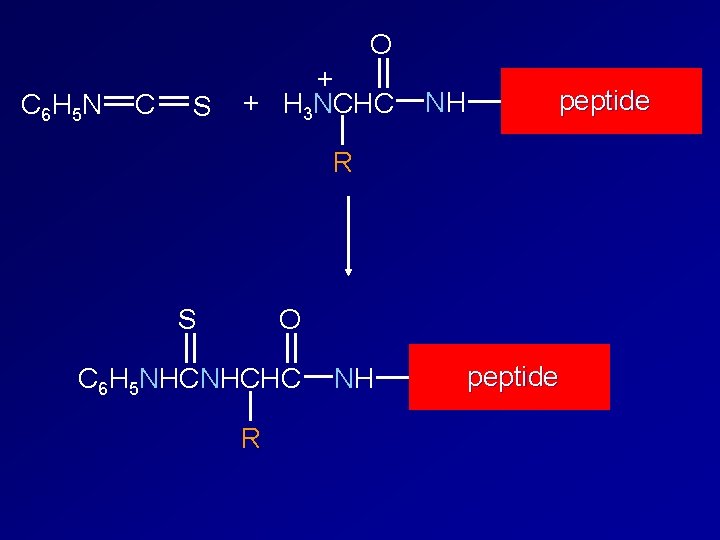
O C 6 H 5 N C S + + H 3 NCHC NH peptide R S O C 6 H 5 NHCNHCHC R NH peptide

S O C 6 H 5 NHCNHCHC R S C 6 H 5 N H C C N CH R tiazolone peptide NH HCl (anidro) O + + H 3 N peptide

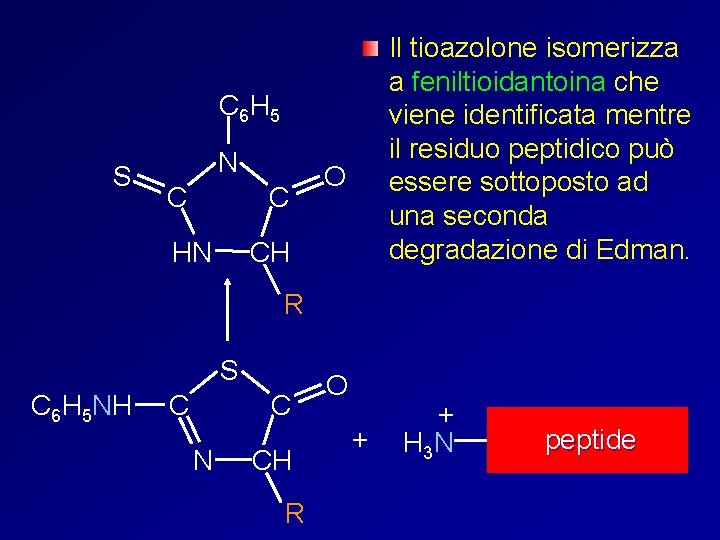
Il tioazolone isomerizza a feniltioidantoina che viene identificata mentre il residuo peptidico può essere sottoposto ad una seconda degradazione di Edman. C 6 H 5 S N C C O CH HN R S C 6 H 5 N H C C N CH R O + + H 3 N peptide

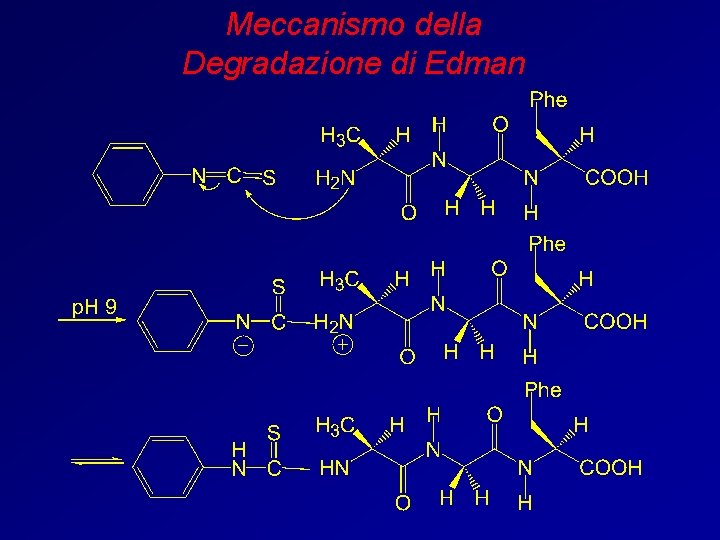
Meccanismo della Degradazione di Edman


Struttura Secondaria delle Proteine

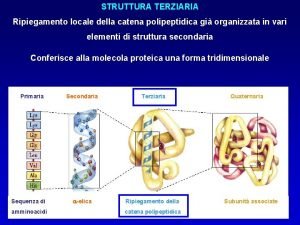
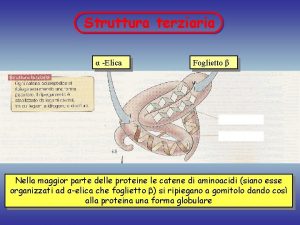
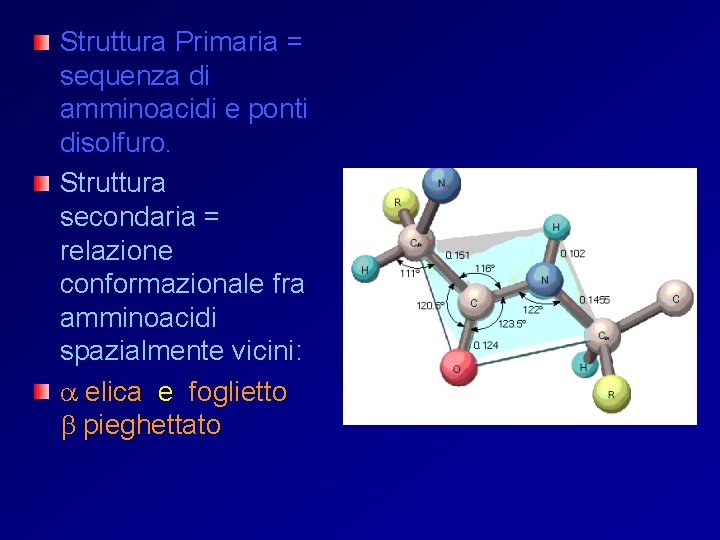
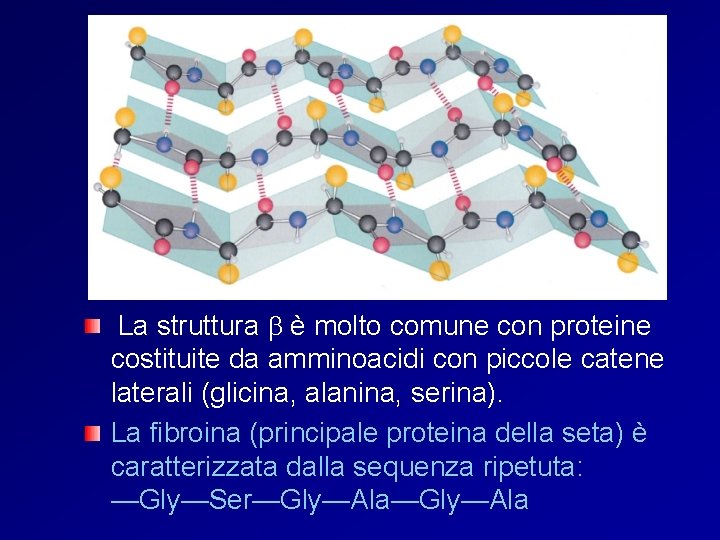
Struttura Primaria = sequenza di amminoacidi e ponti disolfuro. Struttura secondaria = relazione conformazionale fra amminoacidi spazialmente vicini: a elica e foglietto b pieghettato



La struttura b è molto comune con proteine costituite da amminoacidi con piccole catene laterali (glicina, alanina, serina). La fibroina (principale proteina della seta) è caratterizzata dalla sequenza ripetuta: —Gly—Ser—Gly—Ala

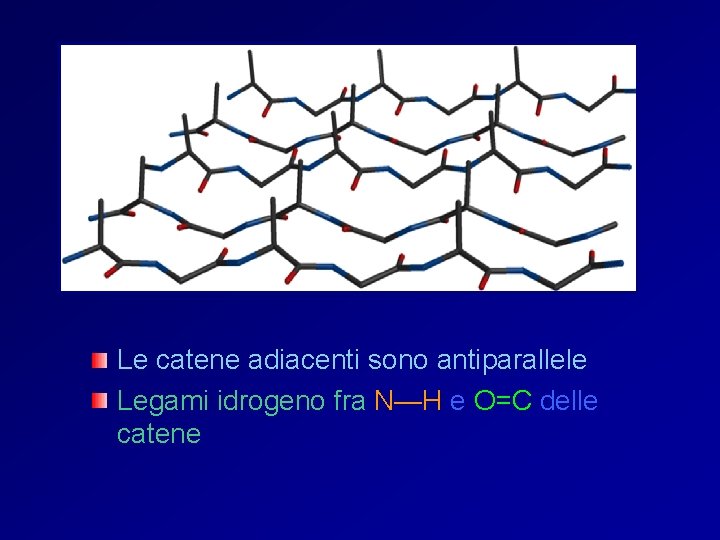
Le catene adiacenti sono antiparallele Legami idrogeno fra N—H e O=C delle catene

a Elica a elica di una proteina formata solo da L-alanina. L’elica è destrorsa con 3. 6 amminoacidi per giro. I legami idrogeno sono interni alla catena. Proteine dei muscoli (miosina) e della lana(a-cheratina) hanno una struttura a-elica.


Carboxypeptidase Disulfide bond Zn 2+ Arg-145 N-terminus C-terminus tube model ribbon model

Sintesi dei peptidi

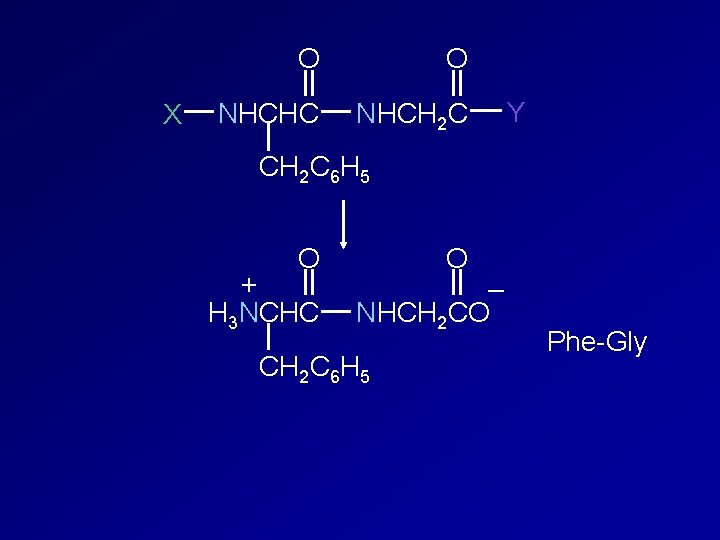
Il problema della sintesi dei peptidi è legato al fatto che devono reagire fra loro molecole bifunzionali per cui per ottenere la voluta sequenza non basta mettere insieme i due amminoacidi. Se ad esempio volendo la sequenza Phe—Gly mettessimo insieme fenil alanina e glicina otterremmo i quattro dipeptidi: Phe—Phe Gly—Gly Phe—Gly Gly— Phe Bisogna proteggere il gruppo anmminco dell’amminoacido che dovrà essere quello Nterminale ed il gruppo carbossilico di quello che sarà C-terminale

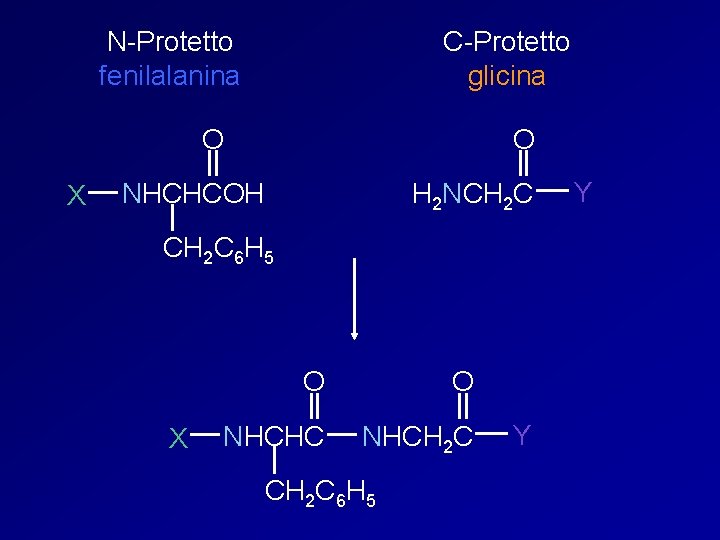
N-Protetto fenilalanina C-Protetto glicina O X O NHCHCOH H 2 NCH 2 C 6 H 5 X O O NHCHC NHCH 2 C 6 H 5 Y Y

X O O NHCHC NHCH 2 C Y CH 2 C 6 H 5 O + H 3 NCHC O – NHCH 2 CO CH 2 C 6 H 5 Phe-Gly

Protezione gruppo amminico

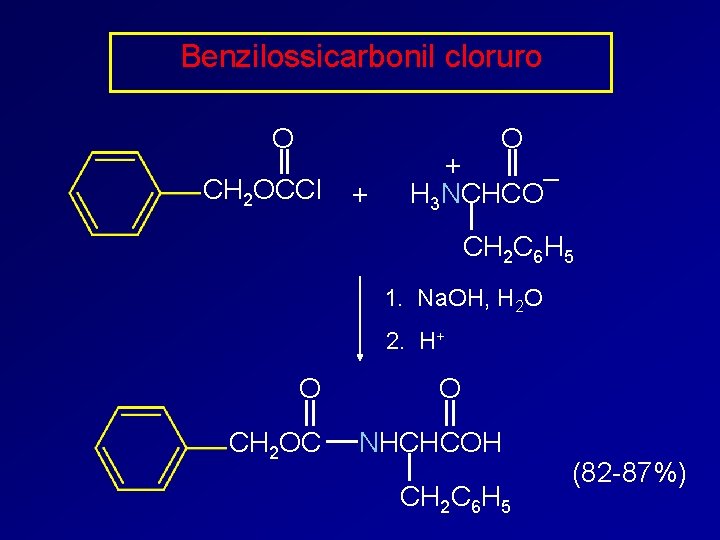
Benzilossicarbonil cloruro O O CH 2 OCCl + + – H 3 NCHCO CH 2 C 6 H 5 1. Na. OH, H 2 O 2. H+ O CH 2 OC O NHCHCOH CH 2 C 6 H 5 (82 -87%)

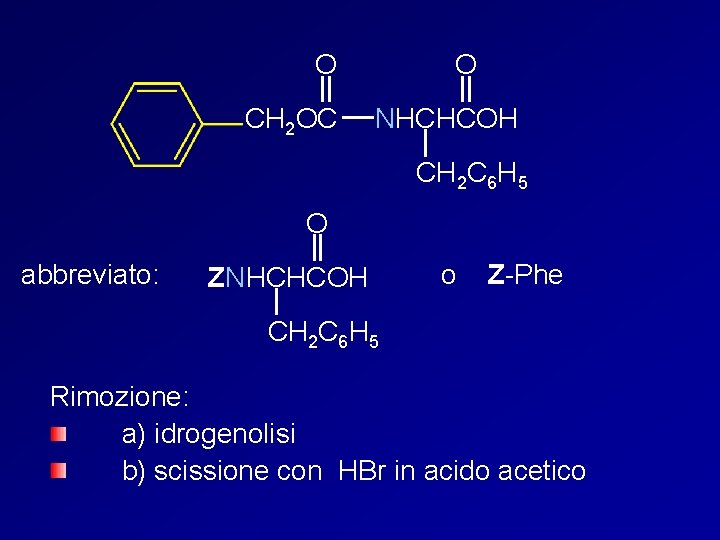
O CH 2 OC O NHCHCOH CH 2 C 6 H 5 O abbreviato: ZNHCHCOH o Z-Phe CH 2 C 6 H 5 Rimozione: a) idrogenolisi b) scissione con HBr in acido acetico

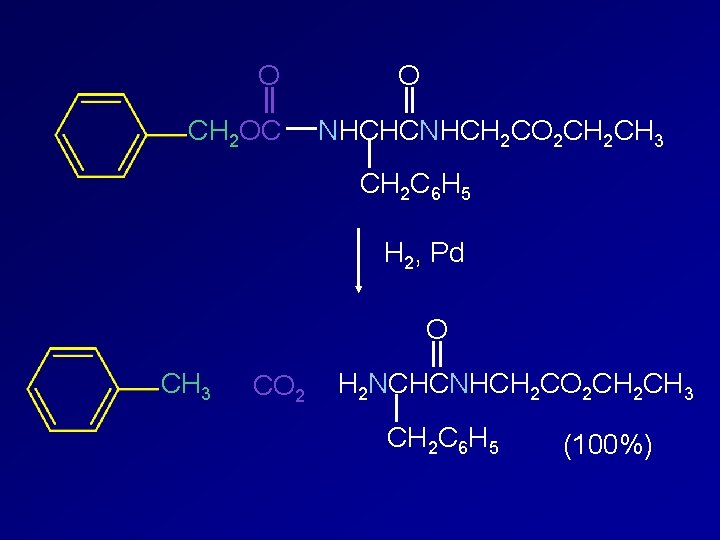
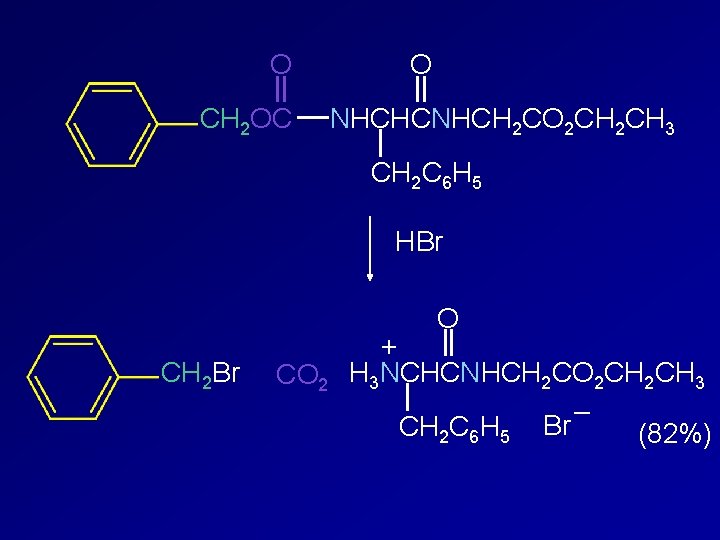
O CH 2 OC O NHCHCNHCH 2 CO 2 CH 3 CH 2 C 6 H 5 H 2, Pd O CH 3 CO 2 H 2 NCHCNHCH 2 CO 2 CH 3 CH 2 C 6 H 5 (100%)

O CH 2 OC O NHCHCNHCH 2 CO 2 CH 3 CH 2 C 6 H 5 HBr O CH 2 Br CO 2 + H 3 NCHCNHCH 2 CO 2 CH 3 – CH 2 C 6 H 5 Br (82%)

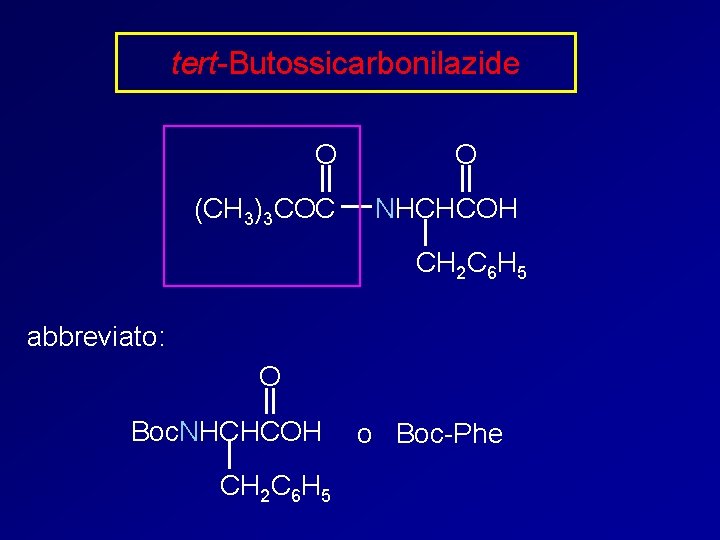
tert-Butossicarbonilazide O (CH 3)3 COC O NHCHCOH CH 2 C 6 H 5 abbreviato: O Boc. NHCHCOH CH 2 C 6 H 5 o Boc-Phe

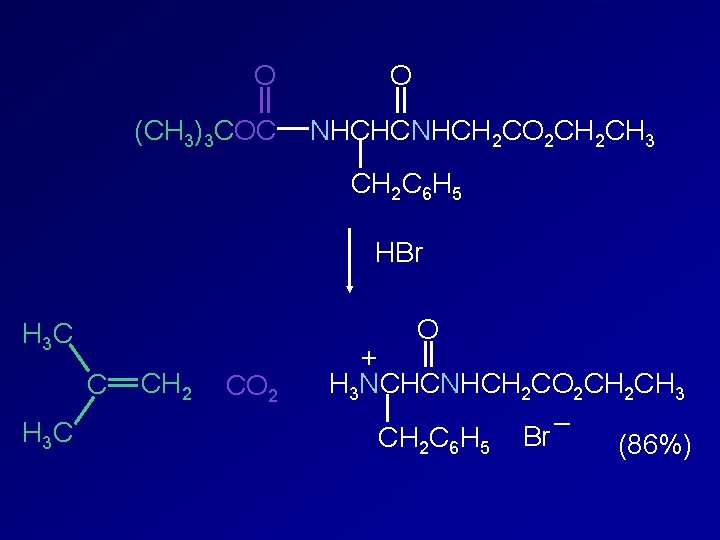
O (CH 3)3 COC O NHCHCNHCH 2 CO 2 CH 3 CH 2 C 6 H 5 HBr O H 3 C CH 2 CO 2 + H 3 NCHCNHCH 2 CO 2 CH 3 – CH 2 C 6 H 5 Br (86%)

Protezione del gruppo Carbossilico

Deprotezione degli esteri avviene per idrolisi basica. Gli esteri benzilici possono essere subire idrogenolisi. Il gruppo carbossilico viene protetto come estere.

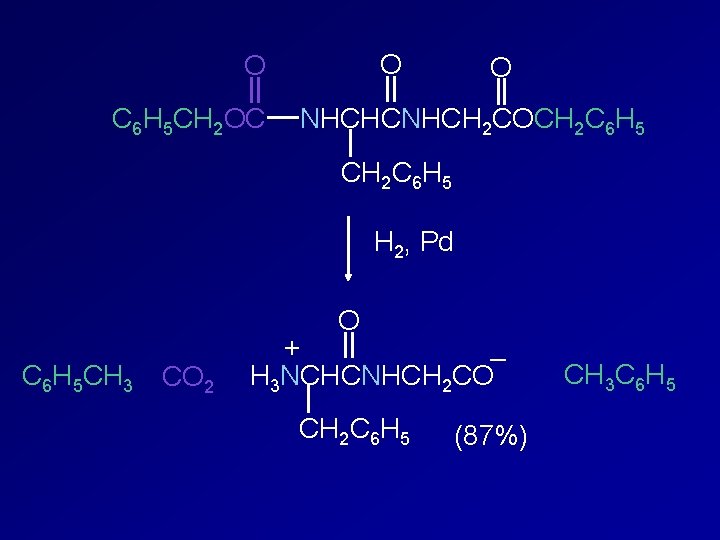
O O C 6 H 5 CH 2 OC O NHCHCNHCH 2 COCH 2 C 6 H 5 H 2, Pd O C 6 H 5 CH 3 CO 2 + – H 3 NCHCNHCH 2 CO CH 2 C 6 H 5 (87%) CH 3 C 6 H 5

Formazione del legame peptidico

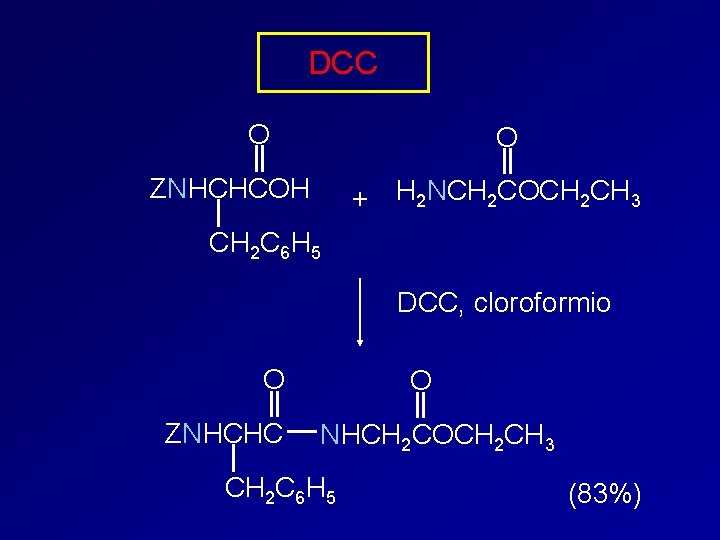
DCC O O ZNHCHCOH + H 2 NCH 2 COCH 2 CH 3 CH 2 C 6 H 5 DCC, cloroformio O ZNHCHC O NHCH 2 COCH 2 CH 3 CH 2 C 6 H 5 (83%)

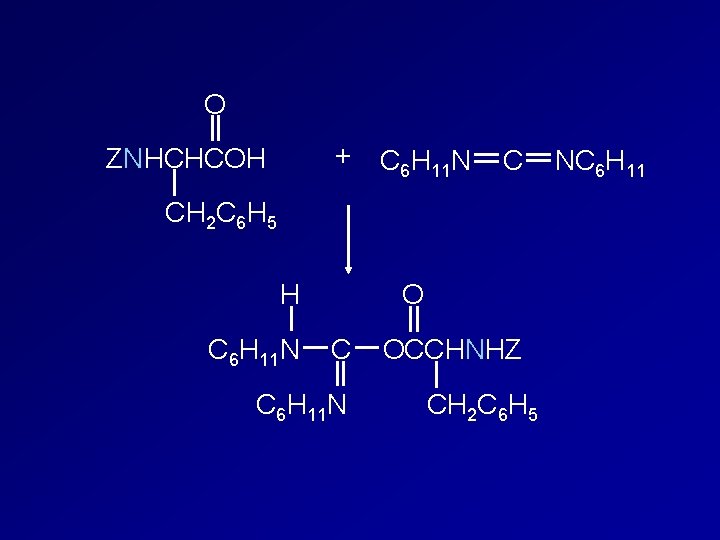
O + C 6 H 11 N ZNHCHCOH C CH 2 C 6 H 5 H C 6 H 11 N O C C 6 H 11 N OCCHNHZ CH 2 C 6 H 5 NC 6 H 11

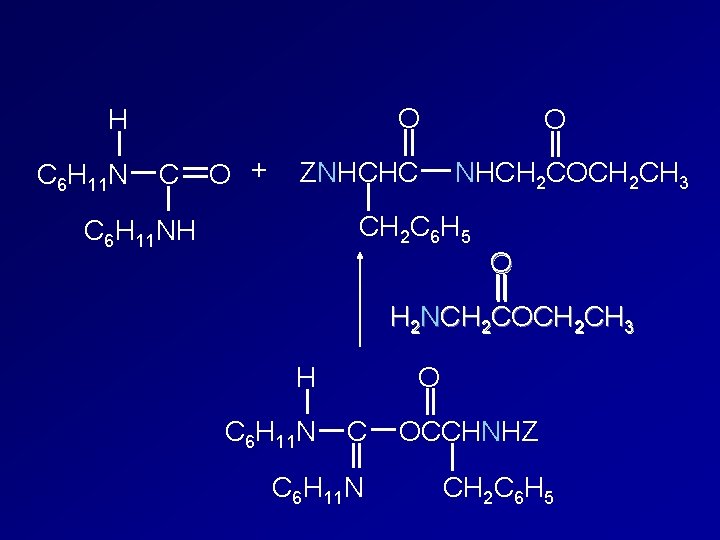
O H C 6 H 11 N C O + ZNHCHC O NHCH 2 COCH 2 CH 3 CH 2 C 6 H 5 C 6 H 11 NH O H 2 NCH 2 COCH 2 CH 3 H C 6 H 11 N O C C 6 H 11 N OCCHNHZ CH 2 C 6 H 5

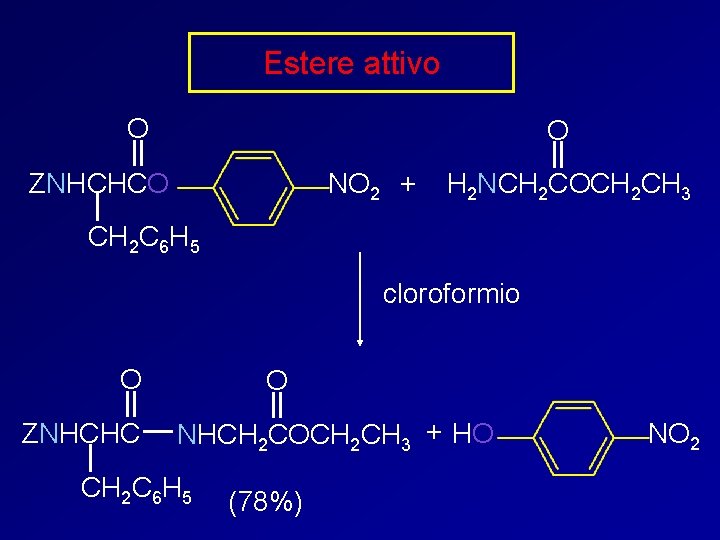
Estere attivo O O ZNHCHCO NO 2 + H 2 NCH 2 COCH 2 CH 3 CH 2 C 6 H 5 cloroformio O ZNHCHC O NHCH 2 COCH 2 CH 3 + HO CH 2 C 6 H 5 (78%) NO 2

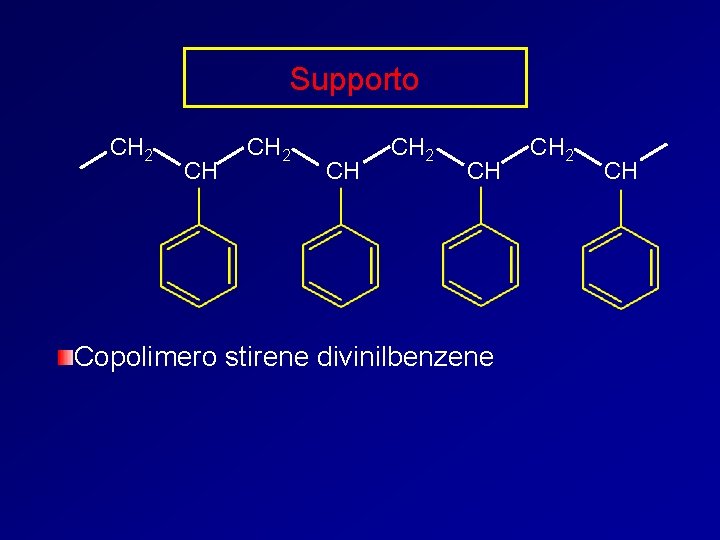
Sintesi in fase solida: Merrifield Premio Nobel in Chimica: 1984

Supporto CH 2 CH Copolimero stirene divinilbenzene CH 2 CH

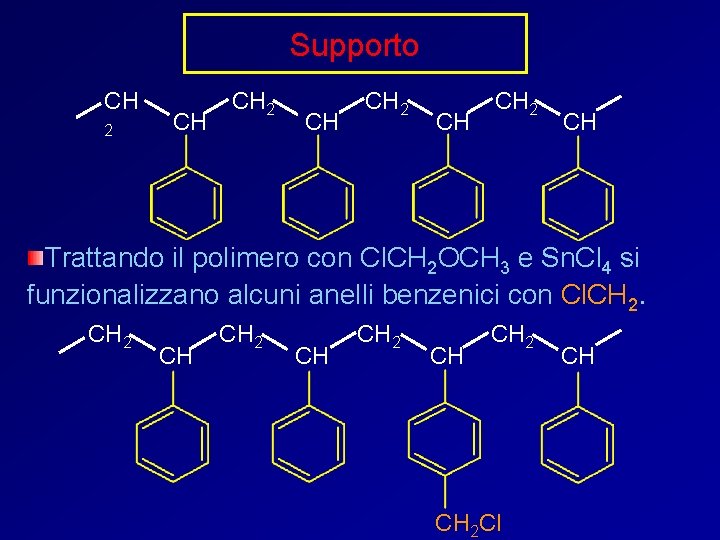
Supporto CH 2 CH Trattando il polimero con Cl. CH 2 OCH 3 e Sn. Cl 4 si funzionalizzano alcuni anelli benzenici con Cl. CH 2 CH CH 2 Cl CH

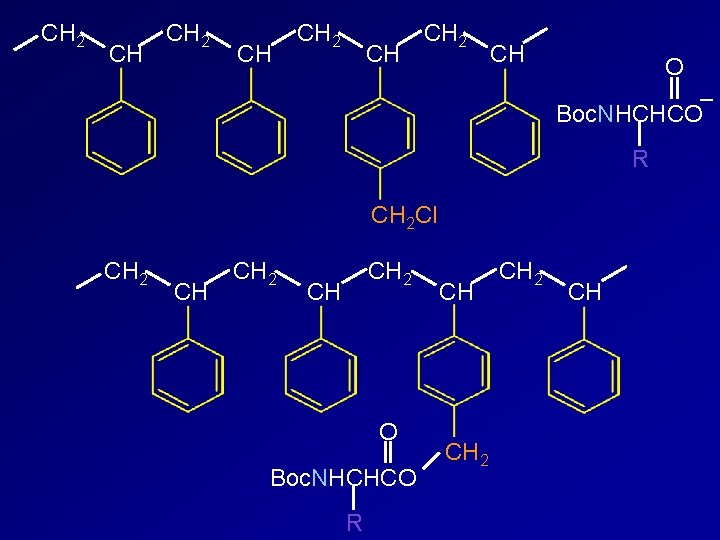
CH 2 CH O – Boc. NHCHCO R CH 2 Cl CH 2 CH O Boc. NHCHCO R CH CH 2 CH

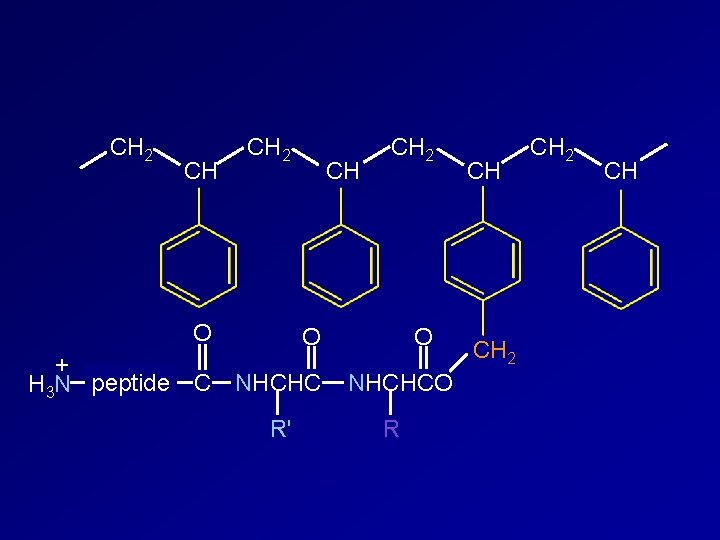
CH 2 CH CH 2 O + H 3 N peptide C NHCHC R' O NHCHCO R CH CH 2 CH

CH 2 CH CH 2 O + H 3 N peptide C NHCHC R' O – NHCHCO R CH CH 2 Br CH
 Endopeptidasi
Endopeptidasi Amminoacidi classificazione
Amminoacidi classificazione Amminoacidi classificazione
Amminoacidi classificazione Stampati paralibrari
Stampati paralibrari Proprietà periodiche mappa concettuale
Proprietà periodiche mappa concettuale Classi enzimatiche
Classi enzimatiche Ampiezza di un angolo definizione
Ampiezza di un angolo definizione Andamento elettronegatività
Andamento elettronegatività Classificazione degli alimenti
Classificazione degli alimenti Ammine
Ammine Struttura terziaria proteine
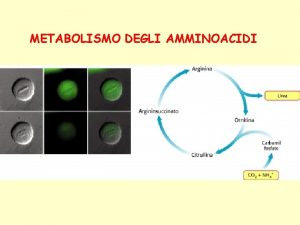
Struttura terziaria proteine Mappa concettuale sul metabolismo
Mappa concettuale sul metabolismo Se anche camminassi per una valle oscura
Se anche camminassi per una valle oscura Saliremo in questa barca anche noi testo
Saliremo in questa barca anche noi testo I rischi trasversali sono anche detti
I rischi trasversali sono anche detti Verismo verga collegamenti
Verismo verga collegamenti Ti sento vicina
Ti sento vicina Anche di lunedi sera è sempre sabato
Anche di lunedi sera è sempre sabato Glucidi cosa sono
Glucidi cosa sono I micenei erano chiamati anche
I micenei erano chiamati anche Continuerò a credere anche se tutti perdono la speranza
Continuerò a credere anche se tutti perdono la speranza Quando si mette la virgola
Quando si mette la virgola Hai disteso le tue braccia testo
Hai disteso le tue braccia testo Vietata la riproduzione anche parziale
Vietata la riproduzione anche parziale Prisma quadrangolare regolare
Prisma quadrangolare regolare Degradazione proteine
Degradazione proteine Carboidrati proteine grassi vitamine sali minerali
Carboidrati proteine grassi vitamine sali minerali Amidon masa molara
Amidon masa molara Proteine intrinseche
Proteine intrinseche Proteine anfotere
Proteine anfotere Proteine prenilate
Proteine prenilate Struttura terziaria proteine
Struttura terziaria proteine Mappa concettuale sull'obesità
Mappa concettuale sull'obesità Proteine g
Proteine g Iperlipidemie
Iperlipidemie Aufbau hühnerei
Aufbau hühnerei Proteine intrinseche
Proteine intrinseche Decarboxilarea aminoacizilor
Decarboxilarea aminoacizilor Struttura dei carboidrati
Struttura dei carboidrati Percorso benessere herbalife
Percorso benessere herbalife Proteine
Proteine Dicroismo circolare proteine
Dicroismo circolare proteine Giuseppe valitutti
Giuseppe valitutti Glukozamin protein7
Glukozamin protein7 Struttura terziaria proteine
Struttura terziaria proteine Poliadenilazione alternativa
Poliadenilazione alternativa Matrice extracelulara
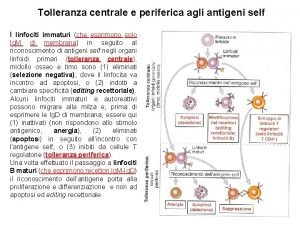
Matrice extracelulara Tolleranza centrale e periferica
Tolleranza centrale e periferica Gruppo fosfato formula
Gruppo fosfato formula Fibrilläre proteine
Fibrilläre proteine Proteine del latte
Proteine del latte Latte idrolisato spinto
Latte idrolisato spinto Cloroplasti
Cloroplasti Proteine dieta
Proteine dieta Single cell protein
Single cell protein Denaturazione proteine
Denaturazione proteine Struttura terziaria proteine
Struttura terziaria proteine Proteine dna
Proteine dna Totul despre proteine
Totul despre proteine Struttura terziaria proteine
Struttura terziaria proteine Membrana celulara
Membrana celulara Aminosuren
Aminosuren Proteine del latte
Proteine del latte Pozitif nitrojen dengesi
Pozitif nitrojen dengesi Proteine del latte
Proteine del latte Proteine baia mare
Proteine baia mare Proteine del latte
Proteine del latte Amminoacid
Amminoacid Proteine g trimeriche
Proteine g trimeriche Carboitrati
Carboitrati Proteine
Proteine Valore biologico proteine
Valore biologico proteine Gli enzimi sono proteine globulari
Gli enzimi sono proteine globulari Proteinele definitie
Proteinele definitie Le proteine sono formate da
Le proteine sono formate da Fermentazione lattica zanichelli
Fermentazione lattica zanichelli Anania saffira
Anania saffira La nascita degli imperi coloniali
La nascita degli imperi coloniali Grado degli aggettivi
Grado degli aggettivi Organizzazione politica degli etruschi
Organizzazione politica degli etruschi Ordine degli psicologi toscana
Ordine degli psicologi toscana Dichiarazione degli innocenti
Dichiarazione degli innocenti Linguaggio di pseudocodifica
Linguaggio di pseudocodifica Teoria degli errori
Teoria degli errori Invasione dorica
Invasione dorica Sistema centesimale angoli
Sistema centesimale angoli Budget flessibilizzato
Budget flessibilizzato Teorema degli incrementi finiti
Teorema degli incrementi finiti Architettura degli elaboratori univr
Architettura degli elaboratori univr Università degli studi di firenze psicologia
Università degli studi di firenze psicologia Abitudini alimentari degli studenti
Abitudini alimentari degli studenti Università degli studi roma tre mascotte
Università degli studi roma tre mascotte Il canto degli italiani
Il canto degli italiani Federigo degli alberighi giornata
Federigo degli alberighi giornata Poesia degli affetti
Poesia degli affetti Termodinamica degli stati
Termodinamica degli stati Distretto sanitario roseto
Distretto sanitario roseto Gilda insegnanti bologna
Gilda insegnanti bologna Precessione degli equinozi zanichelli
Precessione degli equinozi zanichelli Caratteristiche strumenti di misura
Caratteristiche strumenti di misura Sala degli specchi
Sala degli specchi Nodo sommatore
Nodo sommatore Nomi alcani
Nomi alcani Salone della guerra versailles
Salone della guerra versailles Ordine assistenti sociali veneto
Ordine assistenti sociali veneto Vantaggi e svantaggi del budget
Vantaggi e svantaggi del budget Formule trigonometria
Formule trigonometria Applicazione degli integrali alla fisica
Applicazione degli integrali alla fisica