La funzione delle proteine questo file stato privato














































































- Slides: 81

La funzione delle proteine (questo file è stato privato delle immagini) 1

A cosa servono le proteine? • Le proteine sono biomolecole con funzioni molto diverse fra di loro, anche se la descrizione della struttura delle proteine segue uno schema relativamente omogeneo. • Questa volta, prima di studiare la struttura chimica, proviamo a farci un’idea del ruolo funzionale di queste molecole all’interno della logica cellulare. • A questo scopo faremo una “lista” di categorie funzionali. 2

1) proteine strutturali • Molte proteine servono a costruire strutture cellulari o extracellulari. Vediamo due esempi: • - la cheratina conferisce resistenza all’epidermide e a tutti i suoi derivati. • - la fibroina forma strutture molto resistenti, come la seta, la tela dei ragni. • - il collagene si trova anch’esso nella pelle, ma è un costituente importante anche dell’apparato di sostegno (scheletro). 3

2) proteine di difesa • Gli anticorpi (immunoglobuline) presenti nel sangue per combattere le infezioni sono proteine, così come molte sostanze tossiche prodotte da piante ed animali per evitare o esercitare la predazione, come i veleni o le tossine batteriche. • Nel sangue si trovano anche le proteine della coagulazione (fibrinogeno, trombina). 4

3) proteine di nutrimento • Il latte, secreto dalle ghiandole mammarie, contiene la caseina. • I semi di molte piante accumulano proteine di nutrimento necessarie per l’accrescimento della pianta allo stato embrionale. 5

4) proteine di riserva • Nell’albume dell’uovo si trova l’albumina, che serve allo sviluppo dell’embrione. • La ferritina è presente nel sangue e serve ad immagazzinare il ferro, un elemento necessario a sua volta per formare la prossima proteina… 6

5) proteine di trasporto • L’emoglobina è presente in grande quantità nel sangue, all’interno dei globuli rossi. Serve per trasportare l’ossigeno (ma non solo). • Le lipo-proteine sono necessarie al sangue per trasportare i lipidi (insolubili!). • Molte proteine di membrana servono per consentire il passaggio di sostanze specifiche verso l’interno o verso l’esterno delle cellule. 7

6) proteine di regolazione • La maggior parte degli ormoni sono di natura proteica, come ad esempio l’insulina, o l’ormone della crescita (GH). • Impareremo a conoscere un tipo diverso di regolatori proteici, i quali hanno la funzione di regolare proprio la formazione stessa delle proteine. 8

7) enzimi digestivi • Queste proteine catalizzano l’idrolisi delle molecole alimentari nell’apparato digerente. Sono relativamente specifici, ad esempio: • - le lipasi idrolizzano i lipidi • - le amilasi idrolizzano l’amido • - le proteasi idrolizzano le proteine • - le nucleasi idrolizzano gli acidi nucleici • ( qual è la desinenza che si usa per nominare gli enzimi? ) • Gli enzimi digestivi agiscono all’esterno delle cellule (ad esempio nello stomaco). 9

8) enzimi metabolici • Abbiamo lasciato alla fine questa categoria di proteine, non perché sia la meno interessante, ma proprio per la ragione opposta. Si tratta di proteine molto specifiche, ciascuna delle quali catalizza un unico passaggio di trasformazione di una via metabolica. • Gli enzimi metabolici agiscono all’interno delle cellule. 10

Il metabolismo • Il metabolismo è l’insieme di tutte le reazioni chimiche di un organismo vivente. • Il metabolismo si può suddividere in due fasi principali: anabolismo e catabolismo. 11

L’anabolismo • È la fase di costruzione delle biomolecole. • Lo scopo dell’anabolismo è quello di ottenere le biomolecole che sono necessarie ad una determinata cellula in una determinata situazione. • È una fase endoergonica. In particolare è importante la variazione ΔS: le biomolecole sono oggetti ad alto contenuto di ordine, la loro costruzione implica una diminuzione di entropia del sistema (ΔSs < 0). 12

Il catabolismo • È la fase di scomposizione delle biomolecole. • Il catabolismo possiede due significati: • - degradazione di molecole presenti in eccesso o dannose • - degradazione di molecole al fine di ottenere energia (la respirazione cellulare è un esempio di catabolismo). • È naturale che il catabolismo rappresenti la fase esoergonica, visto che l’anabolismo è quella endoergonica. 13

Cos’è una via metabolica? • Ogni processo biochimico non avviene mediante un passaggio unico, ma implica un certo numero di reazioni che trasformano progressivamente i reagenti (R) fino ad ottenere il prodotto finale (P), passando attraverso un certo numero di intermedi (I). R→I 1→I 2→I 3→I 4→I 5→…. →P 14

Gli enzimi metabolici sono specifici • Questo è un passaggio fondamentale. • Sappiamo che un enzima è un catalizzatore, ossia una sostanza che accelera una reazione chimica. L’enzima metabolico è completamente specifico: ogni enzima metabolico catalizza esclusivamente un singolo passaggio di una via metabolica. 15

Una via metabolica è una serie di enzimi metabolici • Per realizzare una via metabolica la cellula deve possedere tutti gli enzimi specifici per ogni singolo passaggio. E 1 E 2 E 3 E 4 E 5 E 6 En R→I 1→I 2→I 3→I 4→I 5→…. →P 16

Perché i catalizzatori sono necessari? • Cosa significa che le reazioni biochimiche devono essere catalizzate? • Soffermiamoci su questo punto. • Normalmente un catalizzatore si usa per ottenere una certa quantità di prodotto in un tempo minore. Nel metabolismo il significato della catalisi è più profondo. 17

Gli enzimi controllano l’attività cellulare. • Una reazione biochimica non catalizzata avviene ad una velocità non significativa per l’attività cellulare: senza l’enzima la reazione si può considerare bloccata. • L’attivazione di un enzima da parte della cellula equivale perciò all’attivazione della reazione biochimica da esso catalizzata. 18

Le attività cellulari sono diverse • Le cellule in questo modo hanno la possibilità di controllare le proprie attività. • Ogni cellula forma solo gli enzimi adatti alla sua specifica attività: cellule diverse producono enzimi diversi per svolgere attività diverse. • Ogni cellula produce in momenti diversi enzimi diversi: le necessità di ogni cellula variano nel tempo. 19

Ciò è reso possibile dal fatto che gli enzimi sono specifici. • Se un enzima fosse in grado di catalizzare anche solo due reazioni invece di una, la cellula non avrebbe alcuno strumento a disposizione per modulare queste due reazioni in modo differenziato: l’attivazione di una reazione implicherebbe per forza l’attivazione anche dell’altra. 20

Il metabolismo è integrato • Costruire enzimi diversi per ogni passaggio metabolico rappresenta un notevole costo per la cellula. • Questo però è l’unico sistema per controllare l’attività metabolica. • Il controllo è fondamentale: tutte le attività metaboliche sono integrate (coordinate fra loro). 21

Enzimi e concentrazione • Gli enzimi, come catalizzatori, non modificano i livelli di energia ma solo la velocità di una reazione. • Come sappiamo, il valore ΔG di una reazione dipende dalle concentrazioni delle sostanze coinvolte. • Le concentrazioni dipendono a loro volta da vari fattori, ad esempio dalla disponibilità di nutrienti. 22

Gli enzimi possono lavorare in due sensi • Gli enzimi, come catalizzatori, abbassano l’energia di attivazione in entrambi i sensi della reazione. • Il verso in cui procede la reazione dipende dalle concentrazioni relative di reagenti e prodotti: la reazione procede nel verso in cui si ha ΔG < 0. 23

L’omeostasi • L’attività enzimatica e la concentrazione delle sostanze sono due fattori che interagiscono al fine di mantenere le condizioni chimiche e fisiche delle cellule all’interno di valori accettabili: questa è l’omeostasi. 24

Gli enzimi sono regolati • Un enzima viene regolato al fine di modulare la propria attività in base alla concentrazione del reagente, cioè la molecola che da esso viene trasformata (substrato), oppure di altre molecole. • Ad esempio: quando il glucosio è scarso la cellula attiva gli enzimi che operano l’ossidazione degli acidi grassi. 25

Oggi il metabolismo è conosciuto in dettaglio • Lo studio del metabolismo e dell’attività degli enzimi è molto lungo e complesso, infatti da tale attività deriva la complessità degli organismi viventi. • Noi studieremo solo alcuni esempi di vie metaboliche: • - la fotosintesi • - la respirazione cellulare • - la fermentazione 26

In conclusione. . • Si capisce a questo punto che le proteine sono biomolecole particolarmente interessanti, e fra tutte le proteine gli enzimi metabolici hanno un ruolo primario. • Noi già sappiamo che i caratteri mendeliani sono rappresentati da singole proteine: ora il significato di questa affermazione forse è un po’ più chiaro. Ad esempio le malattie ereditarie derivano spesso dalla mancanza di una singola attività enzimatica. 27

La struttura delle proteine 28

Ora ci occuperemo della struttura delle proteine • La lista di funzioni proposta è uno schema indicativo ed incompleto, che ci aiuta a comprendere un fatto molto generale: • Le proteine sono gli strumenti che tutte le cellule hanno a disposizione per svolgere le loro attività. • Le proteine offrono una grande varietà di funzioni, derivanti da una grande varietà di strutture: come sono fatte le proteine? 29

Le proteine sono polimeri • Una proteina è formata dai seguenti componenti: • - una o più catene polipeptidiche (catene lineari formate da amminoacidi legati con legami peptidici) • - alcune proteine contengono un gruppo prostetico di natura non amminoacidica. 30

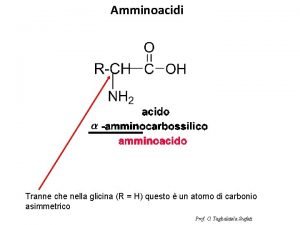
Struttura generale di un amminoacido • Un amminoacido è formato da: • 1) un atomo di carbonio centrale (carbonio α) • 2) un gruppo carbossilico (acido) • 3) un gruppo amminico • 4) un atomo di idrogeno • 5) un gruppo “R” specifico 31

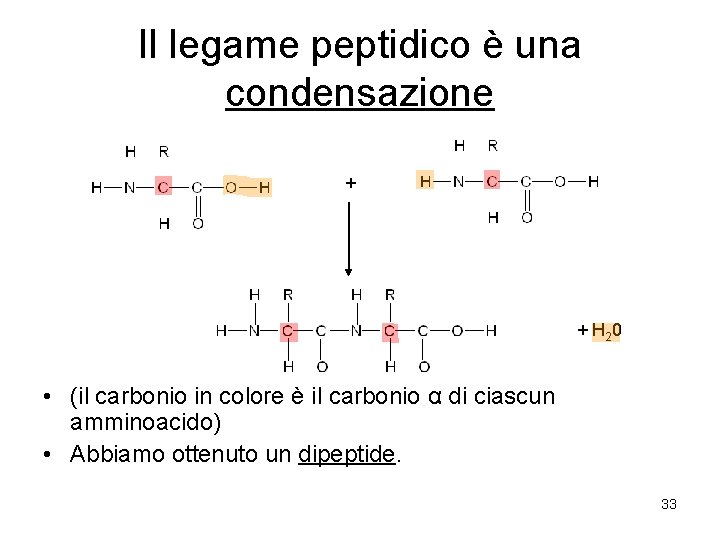
Gli amminoacidi sono i monomeri delle proteine • Gli amminoacidi sono molecole adatte a formare lunghe catene. • Il gruppo amminico di un amminoacido si lega con il gruppo carbossilico di un altro amminoacido, il quale a sua volta si può legare ad un terzo amminoacido mediante il proprio gruppo amminico, e così via. • Questo legame fra amminoacidi si chiama legame peptidico. 32

Il legame peptidico è una condensazione + + H 20 • (il carbonio in colore è il carbonio α di ciascun amminoacido) • Abbiamo ottenuto un dipeptide. 33

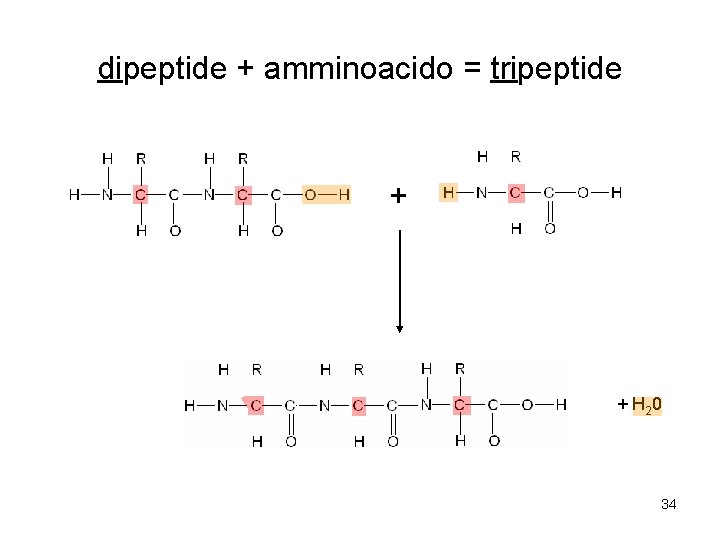
dipeptide + amminoacido = tripeptide + + H 20 34

Il polimero si chiama polipeptide • Aggiungendo altri amminoacidi uno alla volta otteniamo un polipeptide della dimensione voluta. • I polipeptidi delle proteine sono formati da decine o anche centinaia di amminoacidi. • Come vedremo ogni proteina è formata da un preciso numero di amminoacidi (nei polisaccaridi invece il numero dei monomeri è variabile). 35

Il polipeptide ha due estremità diverse • Uno dei due amminoacidi terminali possiede un gruppo amminico libero, l’altro possiede un gruppo carbossilico libero. • Il primo rappresenta l’estremità ammino-terminale (Nterminale) del polipeptide. • Il secondo è l’estremità carbossi-terminale del polipeptide (C-terminale). • I polipeptidi si accrescono in direzione N-terminale → Cterminale. 36

I gruppi R • Gli amminoacidi possono essere diversi fra loro a seconda della struttura chimica del residuo R. • Per formare le proteine le cellule utilizzano 20 amminoacidi diversi. • I gruppi R pertanto sono di 20 specie. • Questi venti amminoacidi sono gli stessi per tutte le specie di organismi. 37

Quante proteine diverse si possono formare? • Se leghiamo due amminoacidi possiamo avere 20 x 20 = 400 specie di dipeptidi diversi. • Se leghiamo tre amminoacidi possiamo avere 20 x 20 = 8000 specie di tripeptidi diversi. • Provate a calcolare il numero di peptidi diversi formati da 10 amminoacidi. 38

La variabilità delle proteine determina la varietà biologica • Quante proteine diverse si possono ottenere legando centinaia di amminoacidi per formare dei polipeptidi? • Il numero è praticamente infinito, e da questa varietà di strutture deriva una varietà di funzioni. • Questo rende possibile l’esistenza di un grande numero di forme di vita, la maggior parte delle quali formate da tipi diversi di cellule, e nelle quali ciascuna cellula svolge diverse attività a seconda del momento. 39

Studiare la biologia significa soprattutto studiare il funzionamento delle proteine • Ogni altro tipo di biomolecola si ottiene mediante l’azione di determinate proteine, interagisce con delle proteine, e le stesse proteine interagiscono con altre proteine. • Oggi si parla molto del DNA, che è una molecola importante per comprendere il funzionamento di un organismo: come vedremo il DNA non ha una propria funzione operativa, ma serve in definitiva per costruire determinate proteine, in determinate cellule, in una determinata fase della vita cellulare: il DNA è un progetto, le proteine sono la realizzazione del progetto. 40

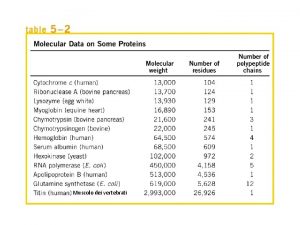
Un esempio di proteina • Val His Leu Thr Pro Glu Lys Ser Ala Val Thr Ala Leu Trp Gly Lys Val Asn Val Asp Glu Val Gly Glu Ala Leu Gly Arg Leu Val Tyr Pro Trp Thr Gln Arg Phe Glu Ser Phe Gly Asp Leu Ser Thr Pro Asp Ala Val Met Gly Asn Pro Lys Val Lys Ala His Gly Lys Val Leu Gly Ala Phe Ser Asp Gly Leu Ala His Leu Asp Asn Leu Lys Gly Thr Phe Ala Thr Leu Ser Glu Leu His Cys Asp Lys Leu His Val Asp Pro Glu Asn Phe Arg Leu Gly Asn Val Leu Val Cys Val Leu Ala His Phe Gly Lys Glu Phe Thr Pro Val Gln Ala Tyr Gln Lys Val Ala Gly Val Ala Asn Ala Leu Ala His Lys Tyr His 41

Questa è la catena β dell’emoglobina umana • La serie di simboli che abbiamo appena visto è la sequenza di amminoacidi che formano una delle quattro catene (polipeptidi) dell’emoglobina umana. • Ogni amminoacido è rappresentato da una sigla a tre lettere. Ad esempio il primo amminoacido è la valina (Val), il secondo si chiama istidina (His), e così via. 42

I simboli a lettera unica • Nei laboratori di biologia si fa molto prima a scrivere le proteine con simboli a una lettera piuttosto che a tre lettere (v. tabella a pag. 45 sul libro). Questo è possibile perché gli amminoacidi sono 20, le lettere dell’alfabeto sono più di 20. La catena β dell’emoglobina umana diventa così: • VHLTPEEKSAVTALWGKVNVDEVGGE ALGRLLVVYPWTQRFFESFGDLSTPDA VMGNPKVKAHGKKVLGAFSDGLAHLD NLKGTFATLSELHCDKLHVDPENFRLL GNVLVCVLAHHFGKEFTPPVQAAYQK VVAGVANALAHKYH 43

La sequenza di amminoacidi • La sequenza di amminoacidi descrive completamente un polipeptide: essa ne rappresenta la formula chimica. È necessario indicare il numero totale di amminoacidi e la specie di amminoacido in ciascuna posizione della catena. • La sequenza determina tutte le caratteristiche di un polipeptide, strutturali e funzionali. 44

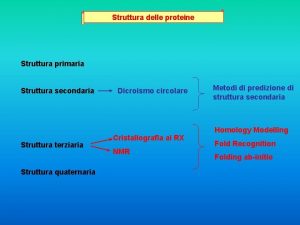
La sequenza è la struttura primaria. • In base a tutto ciò che abbiamo affermato sulle proteine, è chiara l’importanza della sequenza di amminoacidi: essa determina le caratteristiche di ogni proteina e di conseguenza le caratteristiche della cellula. • La sequenza di amminoacidi si chiama struttura primaria. 45

Quattro livelli di struttura • La funzione della proteina dipende dalla sua conformazione (struttura) complessiva, ossia dal modo in cui la catena si dispone nello spazio. La catena è flessibile e forma delle “pieghe” stabili e non casuali. • Tutto questo si descrive mediante altri tre livelli di struttura, i quali tuttavia sono completamente determinati dalla struttura primaria. 46

I legami interni della proteina • Mentre la struttura primaria descrive i legami covalenti fra gli amminoacidi (legami peptidici), le strutture superiori sono stabilizzate da interazioni più deboli (soprattutto legami idrogeno, interazioni idrofobiche). Esiste un’eccezione: due amminoacidi cisteina non consecutivi possono formare un legame covalente. 47

48

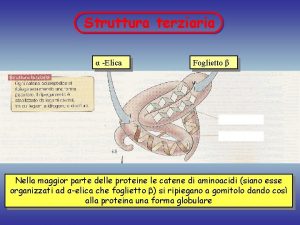
La struttura secondaria • La catena forma in alcuni tratti dei “domini” ripiegati secondo due modelli fissi (v. figure sul libro). • - α elica: la catena si avvolge come una scala a chiocciola. • - β foglietto: tratti di catena si dispongono paralleli e si piegano a “zig-zag”. 49

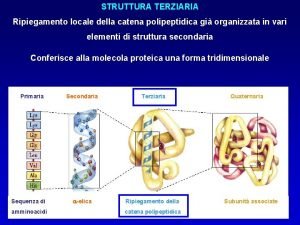
La struttura terziaria • Essa rappresenta la descrizione completa della conformazione del polipeptide nello spazio. • Si possono riconoscere due categorie principali. • - Proteine globulari, generalmente solubili. • - Proteine fibrose. 50

La mioglobina è una proteina globulare 51

La cheratina è una proteina fibrosa 52

La struttura quaternaria • Alcune proteine sono formate non da uno solo ma da più polipeptidi, la descrizione dei legami fra di essi costituisce la struttura quaternaria. • Si tratta dunque di una struttura “facoltativa”, tuttavia le proteine più interessanti sono quaternarie, il loro funzionamento dipende dal movimento reciproco dei polipeptidi di cui sono formate: queste si chiamano proteine allosteriche. 53

L’emoglobina è una proteina quaternaria • Un esempio molto comune di proteina quaternaria (ed allosterica) è l’emoglobina, che si vede nella prossima immagine. • L’emoglobina è formata da: • - 2 catene α (alfa) • - 2 catene β (beta) • - ogni catena si lega ad un gruppo “eme”, una molecola non aminoacidica che rappresenta il “cuore” della proteina, cioè il punto dove si lega l’ossigeno; ogni molecola di emoglobina può legare al massimo 4 molecole di ossigeno. 54

55

I venti amminoacidi • Sul libro è possibile osservare i gruppi “R” che distinguono i venti amminoacidi. • Ogni amminoacido nella proteina possiede una sua specificità ed un suo ruolo, in modo che la proteina nel suo insieme sia in grado di svolgere la sua funzione. • Sostituire anche un solo amminoacido con un altro determina un diverso funzionamento della proteina. 56

I gruppi “R” di tutti gli amminoacidi determinano la struttura generale. • Lo studio della struttura delle proteine è molto complesso, ma rappresenta una fase decisiva nella comprensione delle funzioni cellulari. • Un esempio semplice e molto generale di rapporto causa-effetto è dato dalla differenza fra gruppi “R” idrofili e gruppi “R” idrofobici… 57

58

Amminoacidi polari e non polari • Nelle proteine globulari la struttura è tale per cui gli amminoacidi con gruppi polari (idrofili) si dispongono “alla superficie” della proteina, a contatto con l’ambiente acquoso, mentre quelli non polari (idrofobici) all’interno della proteina. 59

I siti attivi • Le proteine come l’emoglobina possiedono uno o più siti attivi. • Un sito attivo è un insieme di amminoacidi vicini nello spazio ai quali si lega il substrato, cioè la molecola sulla quale la proteina agisce. • Ad esempio l’ossigeno è il substrato dell’emoglobina, esso si lega al gruppo eme, un gruppo prostetico presente nel sito attivo. • Il gruppo eme contiene un atomo di ferro. 60

Tutti gli enzimi possiedono il sito attivo • Nel caso degli enzimi il substrato è rappresentato dal reagente della reazione che viene catalizzata dall’enzima. • Molti enzimi possiedono anche dei siti di regolazione, dove si legano molecole la cui presenza influisce sull’attività dell’enzima. 61

62

Sostituzione puntiforme • Il sesto amminoacido della catena β dell’emoglobina umana si chiama acido glutammico (Glu). Proviamo a sostituire questo acido glutammico, uno dei 146 amminoacidi, con una valina (Val). • Questa sostituzione determina la formazione di un legame anomalo fra le molecole di emoglobina. 63

Una piccola differenza • VHLTPEEKSAVTALWGKVNVDEVGGE ALGRLLVVYPWTQRFFESFGDLSTPDA VMGNPKVKAHGKKVLGAFSDGLAHLD NLKGTFATLSELHCDKLHVDPENFRLL GNVLVCVLAHHFGKEFTPPVQAAYQK VVAGVANALAHKYH • VHLTPVEKSAVTALWGKVNVDEVGGE ALGRLLVVYPWTQRFFESFGDLSTPDA VMGNPKVKAHGKKVLGAFSDGLAHLD NLKGTFATLSELHCDKLHVDPENFRLL GNVLVCVLAHHFGKEFTPPVQAAYQK VVAGVANALAHKYH 64

65

L’anemia falciforme • La sostituzione che abbiamo visto determina una malattia. • La malattia è molto diffusa nonostante le conseguenze negli omozigoti siano gravi: perché? • Gli eterozigoti non presentano sintomi, inoltre sono protetti contro il plasmodio della malaria, quindi nelle zone malariche viene favorita la diffusione di questo gene anziché la sua selezione (eliminazione). 66

Le proteine come alimenti • Noi sappiamo che nel nostro cibo deve essere presente una componente proteica. Nell’apparato digerente, le proteine alimentari vengono scomposte nei singoli amminoacidi i quali sono poi assorbiti ed utilizzati per costruire le proteine proprie, che sono diverse da quelle degli organismi che mangiamo. 67

Ogni proteina ha una sua composizione in amminoacidi • Gli amminoacidi ottenuti con il cibo corrispondono solo in parte agli amminoacidi necessari per formare le nuove proteine. In particolare le proteine vegetali hanno una composizione in amminoacidi abbastanza diversa da quella delle nostre proteine. • Questo significa che molti amminoacidi dovranno essere eliminati: l’urea è un prodotto di scarto contenente l’azoto che deriva dal catabolismo degli amminoacidi in eccesso… 68

Nove amminoacidi sono essenziali • … e molti amminoacidi dovranno essere ottenuti mediante sintesi: le nostre cellule possono attivare le vie metaboliche adatte ad ottenere una parte degli amminoacidi mancanti. • Nove amminoacidi su venti non possono essere ottenuti dalle nostre cellule, devono necessariamente derivare dal cibo. 69

Le proteine come fonte di energia • Infine una nota sull’utilizzo delle proteine come “combustibile”. • Anche le proteine, come carboidrati e lipidi, possono essere ossidate per ricavare energia. • Questa è una fonte secondaria di energia, utile soprattutto in situazioni di particolare necessità, ossia in mancanza di riserve energetiche (trigliceridi). 70

• Le funzioni di una cellula dipendono dalle funzioni delle proteine che essa contiene. • In particolare sappiamo che ogni cellula controlla le proprie attività mediante l’attività degli enzimi metabolici. 71

Da cosa dipende la funzione di una proteina? LA FUNZIONE DI OGNI PROTEINA DIPENDE DALLA SUA STRUTTURA 72

STRUTTURA QUATERNARIA • È IL LEGAME FRA PIU’ POLIPEPTIDI NELLA FORMAZIONE DI UNA SINGOLA PROTEINA. • NON TUTTE LE PROTEINE SONO QUATERNARIE, ALCUNE SONO FORMATE DA UN SOLO POLIPEPTIDE. 73

STRUTTURA TERZIARIA • È LA FORMA GENERALE DELLA PROTEINA, DIPENDE DAL MODO CON CUI IL POLIPEPTIDE SI RIPIEGA NELLO SPAZIO, STABILIZZATO DA LEGAMI CHE SI FORMANO FRA AMINOACIDI ANCHE LONTANI NELLA SEQUENZA. 74

STRUTTURA SECONDARIA • Alcuni tratti del polipeptide assumono delle forme particolari, in particolare: • 1) alfa elica • 2) beta foglietto • Questo livello di struttura è stabilizzato da legami fra amminoacidi vicini nella sequenza. 75

Da cosa dipende la struttura di una proteina? • La struttura quaternaria, terziaria, secondaria dipendono dalla struttura primaria, cioè dalla sequenza di amminoacidi. 76

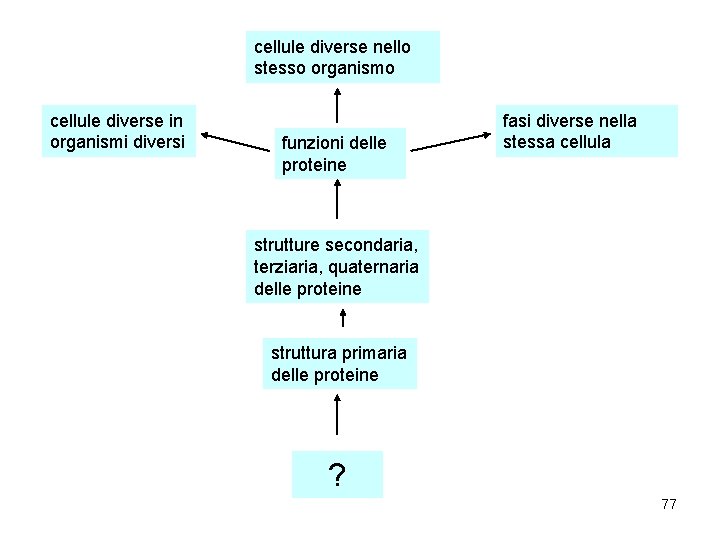
cellule diverse nello stesso organismo cellule diverse in organismi diversi funzioni delle proteine fasi diverse nella stessa cellula strutture secondaria, terziaria, quaternaria delle proteine struttura primaria delle proteine ? 77

• Questo schema ci fa vedere che tutto ciò che avviene in una cellula vivente si riconduce alla struttura primaria (sequenza) delle sue proteine. • In particolare le proteine che maggiormente influiscono nella modulazione delle attività cellulari sono gli enzimi metabolici. 78

A questo punto la domanda è: da cosa dipende la struttura primaria delle proteine presenti in una cellula? 79

• La risposta si trova in un altro tipo di molecole: gli acidi nucleici, ossia le molecole depositarie dell’informazione genetica. 80

fine 81
 Funzione delle proteine
Funzione delle proteine Funzioni dei carboidrati
Funzioni dei carboidrati Criofrattura
Criofrattura Metabolismo delle proteine
Metabolismo delle proteine Giuseppe valitutti
Giuseppe valitutti File-file yang dibuat oleh user pada jenis file di linux
File-file yang dibuat oleh user pada jenis file di linux Slidetodoc.com
Slidetodoc.com Obbligazioni mappa concettuale
Obbligazioni mappa concettuale Fonti del diritto privato
Fonti del diritto privato Accollo significato
Accollo significato Effetti del contratto diritto privato
Effetti del contratto diritto privato Lavoro pubblico e privato differenze
Lavoro pubblico e privato differenze Durc appalto privato
Durc appalto privato Compensazione diritto privato
Compensazione diritto privato Avvocato partenariato pubblico
Avvocato partenariato pubblico Dipartimento di diritto privato e critica del diritto
Dipartimento di diritto privato e critica del diritto Cartella clinica dentista privato
Cartella clinica dentista privato Diritto.reale
Diritto.reale La nascita delle lingue e delle letterature romanze
La nascita delle lingue e delle letterature romanze L'esperienza delle cose moderne e la lezione delle antique
L'esperienza delle cose moderne e la lezione delle antique L esperienza delle cose moderne e la lezione delle antique
L esperienza delle cose moderne e la lezione delle antique Fungsi dari create file pada operasi-operasi file (cont.)
Fungsi dari create file pada operasi-operasi file (cont.) Distributed file system
Distributed file system An html file is a text file containing small markup tags.
An html file is a text file containing small markup tags. Physical image vs logical image
Physical image vs logical image In a file-oriented information system, a transaction file
In a file-oriented information system, a transaction file Da questo vi riconosceranno
Da questo vi riconosceranno Sempre caro mi fu
Sempre caro mi fu Shema poesia levi
Shema poesia levi Se questo è un uomo poesia
Se questo è un uomo poesia Consecutio temporum
Consecutio temporum Da questo riconosceranno che siete miei discepoli
Da questo riconosceranno che siete miei discepoli Ho scelto questo argomento perché
Ho scelto questo argomento perché Come si chiama il negozio
Come si chiama il negozio Hai disteso le tue braccia anche per me
Hai disteso le tue braccia anche per me Fibrilläre proteine
Fibrilläre proteine Proteine baia mare
Proteine baia mare Proteine definitie
Proteine definitie Matrice extracelulara
Matrice extracelulara Proteine dieta
Proteine dieta Dicroismo circolare proteine
Dicroismo circolare proteine Legame peptidico planare
Legame peptidico planare Proteine del latte
Proteine del latte Proteine prenilate
Proteine prenilate Mioglobine
Mioglobine Mioglobina struttura secondaria
Mioglobina struttura secondaria Proteine g
Proteine g Gruppo fosfato formula
Gruppo fosfato formula Proteine ici
Proteine ici Fibrilläre proteine
Fibrilläre proteine Proteine anfotere
Proteine anfotere Splicing zanichelli
Splicing zanichelli Struttura terziaria proteine
Struttura terziaria proteine Macronutrienti
Macronutrienti Negatif nitrojen dengesi
Negatif nitrojen dengesi Omogeneizzazione
Omogeneizzazione Denaturazione proteine
Denaturazione proteine Struttura terziaria proteine
Struttura terziaria proteine Transaminare
Transaminare Tolleranza centrale e periferica
Tolleranza centrale e periferica Carboitrati
Carboitrati Valin
Valin Proteine del latte
Proteine del latte Struttura terziaria proteine
Struttura terziaria proteine Dolikol fosfat
Dolikol fosfat Le proteine sono formate da
Le proteine sono formate da Proteine
Proteine Ictrento5
Ictrento5 Proteine
Proteine Despre proteine
Despre proteine Sensibilità alle proteine del latte
Sensibilità alle proteine del latte Mappa concettuale sulla nutrizione
Mappa concettuale sulla nutrizione Lipo proteine
Lipo proteine Amminoacidi classificazione
Amminoacidi classificazione Oligoglucide
Oligoglucide Proteine intrinseche
Proteine intrinseche Proteine intrinseche
Proteine intrinseche Cloroplasti
Cloroplasti Proteine dna
Proteine dna Proteine del latte
Proteine del latte Proteine g trimeriche
Proteine g trimeriche Proteine
Proteine