11 TITRIMETRIJSKE METODE Titrimetric methods 11 1 Uvod







![U ekvivalentnoj točki: - prisutni samo Na. Cl i H 2 O [H+] = U ekvivalentnoj točki: - prisutni samo Na. Cl i H 2 O [H+] =](https://slidetodoc.com/presentation_image_h/b04fb44cea5eabb1c7798f02ba60acdb/image-8.jpg)








































![U ekvivalentnoj točki: Ø Ø Ø sav [Ca 2+] titracijom je preveden u Ca. U ekvivalentnoj točki: Ø Ø Ø sav [Ca 2+] titracijom je preveden u Ca.](https://slidetodoc.com/presentation_image_h/b04fb44cea5eabb1c7798f02ba60acdb/image-64.jpg)



![Uvrštenjem u izraz za konstantu stvaranja: [Ca 2+] = 1. 42 · 10 -10 Uvrštenjem u izraz za konstantu stvaranja: [Ca 2+] = 1. 42 · 10 -10](https://slidetodoc.com/presentation_image_h/b04fb44cea5eabb1c7798f02ba60acdb/image-68.jpg)




![Niski [Ag+] Niski [Br-] Ag+ + Br- ⇋ Ag. Br p. Ag [ili p. Niski [Ag+] Niski [Br-] Ag+ + Br- ⇋ Ag. Br p. Ag [ili p.](https://slidetodoc.com/presentation_image_h/b04fb44cea5eabb1c7798f02ba60acdb/image-73.jpg)












- Slides: 87

11. TITRIMETRIJSKE METODE (Titrimetric methods) 11. 1. Uvod Titracija: tehnika u kojoj se otopina poznate koncentracije koristi za određivanje otopine nepoznate koncentracije (analita) Ø Ø kiselo-bazne titracije (acid-base titrations) taložne titracije (precipitation titrations) kompleksometrijske titracije (complexometric titrations) oksidacijsko/redukcijske titracije (redox titrations) Odjel za kemiju

11. 2. Osnovni pojmovi Ø Ø standardna otopina/titrant (standard solution, titrant): reagens koji se koristi za titraciju analita. ekvivalentna točka (equivalence point): točka u titraciji u kojoj je količina dodanog titranta ekvivalentna količini analita. završna točka (end point): točka koja je u svezi sa nekom fizikalnom veličinom (npr. promjena boje) i služi za zaustavljanje titracije. greška titracije (titration error): Etitration = Vend point - Vequivalence point Odjel za kemiju

Ø primarni standard (primary standard): vrlo čista supstanca koja se koristi kao referentni materijal. ü ü ü Odjel za kemiju visoka čistoća stabilnost na zraku odsustvo hidratizirane vode topljivost u otopini za titraciju cijena i pristupačnost velika molekularna masa

Primjeri: Kalijev hidrogenftalat (KHP), natrijev karbonat, oksalna kiselina, natrijev oksalat… Ø sekundarni standard (secondary standard): supstance koje služe kao standardi, ali ne udovoljavaju svim gornjim kriterijima. Tražene/željene osobine standardne otopine: ü ü stabilna i ne zahtijeva restandardizaciju prije upotrebe, reagira brzo s analitom, reakcija s analitom je kompletna, a završna točka se dobro uočava, reakcija s analitom je selektivna i opisana jednostavnom jednadžbom. Odjel za kemiju

11. 3. Titracijske krivulje Titracijska krivulja: grafički prikaz volumena titranta u odnosu na neku funkciju koncentracije analita. ü volumen titranta obično se predstavlja na X-osi (Vt/m. L) ü mjereni parametar koji je funkcija koncentracije analita predstavlja se na Y-osi (p. H, p. Me, E/m. V …) Odjel za kemiju

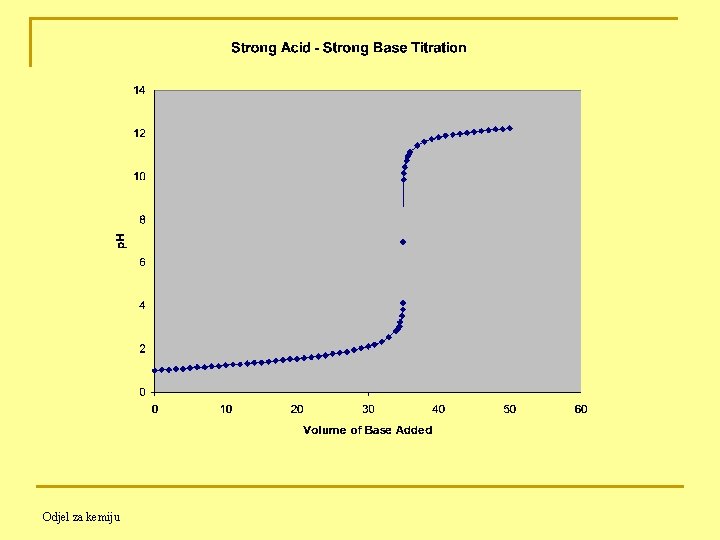
11. 4. KISELO-BAZNE TITRACIJE (acid-base titrations) 11. 4. 1. Titracija jake kiseline jakom bazom Titracija 10. 00 m. L 1. 000 M HCl s 1. 000 M Na. OH HCl + Na. OH ⇋ H 2 O + Na. Cl ili H 3 O+ + OH- ⇋ 2 H 2 O Odjel za kemiju

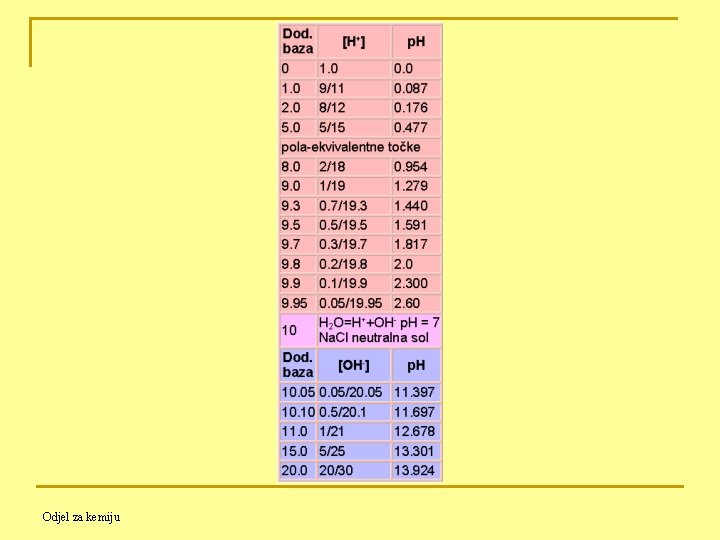
Prije početka titracije: Količina prisutne kiseline = Va ∙ Ca = 10. 0 m. L ∙ 1. 0 mol/1000 m. L = 10 mmol (mili-mol) Prije ekvivalentne točke: Količina dodane baze = Vb∙Cb Količina preostale kiseline = Va∙Ca - Vb∙Cb Koncentracija kiseline prije ekvivalentne točke (a odatle i [H+]): [H+] = na / Vtot = [Va∙Ca - Vb∙Cb] / (Va + Vb) Odjel za kemiju
![U ekvivalentnoj točki prisutni samo Na Cl i H 2 O H U ekvivalentnoj točki: - prisutni samo Na. Cl i H 2 O [H+] =](https://slidetodoc.com/presentation_image_h/b04fb44cea5eabb1c7798f02ba60acdb/image-8.jpg)
U ekvivalentnoj točki: - prisutni samo Na. Cl i H 2 O [H+] = [OH-] = 10 -7 mol/L p. H = 7 Poslije ekvivalentne točke: [OH-] = nb / Vtot = [Vb∙Cb - Va∙Ca] / (Va + Vb) Odjel za kemiju

Odjel za kemiju

Odjel za kemiju

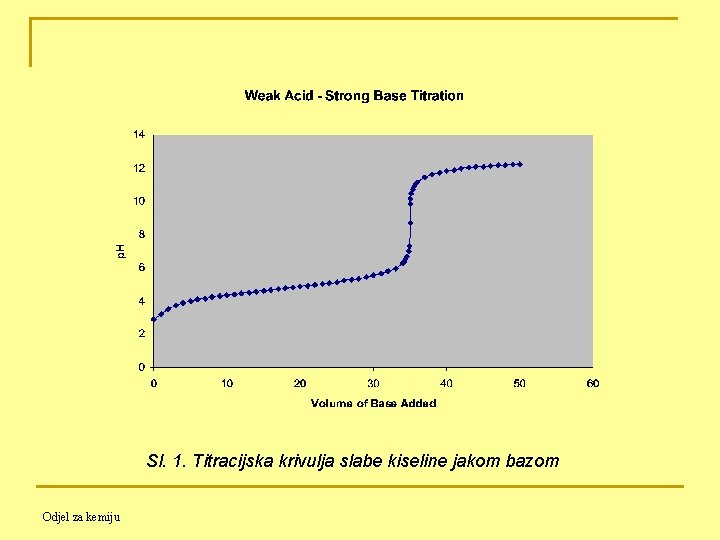
11. 4. 2. Titracija slabe kiseline jakom bazom Titracija 50. 00 m. L 0. 100 M HAc (Ka = 1. 8∙ 10 -5 ) s 0. 100 M Na. OH Prije početka titracije: - prisutna samo HAc (slaba kiselina) Znamo od prije za Ka 10 -4 pa je Odjel za kemiju jer je

Prije ekvivalentne točke: HAc + Na. OH ⇋ H 2 O + Na. Ac Dodatkom Na. OH nastaje Na. Ac i preostaje neizreagirana HAc, dakle u otopini imamo smjesu slabe kiseline i njene soli, a to je PUFER Znamo od prije ; za Ka < 10 -4 → Odjel za kemiju

U ekvivalentnoj točki: samo Na. Ac i H 2 O A Na. Ac kao sol slabe kiseline i jake baze podliježe HIDROLIZI !!!!! Znamo od prije Poslije ekvivalentne točke: - - sva HAc je potrošena, a suvišak OH spriječava hidrolizu Ac (princip Le Chatelier-a): Ac- + H 2 O ⇋ HAc + OH- pa se [OH-] izračunava kao i pri titraciji jake kiseline jakom bazom: [OH-] = nb / Vtot = [Vb∙Cb - Va∙Ca] / (Va + Vb) Odjel za kemiju

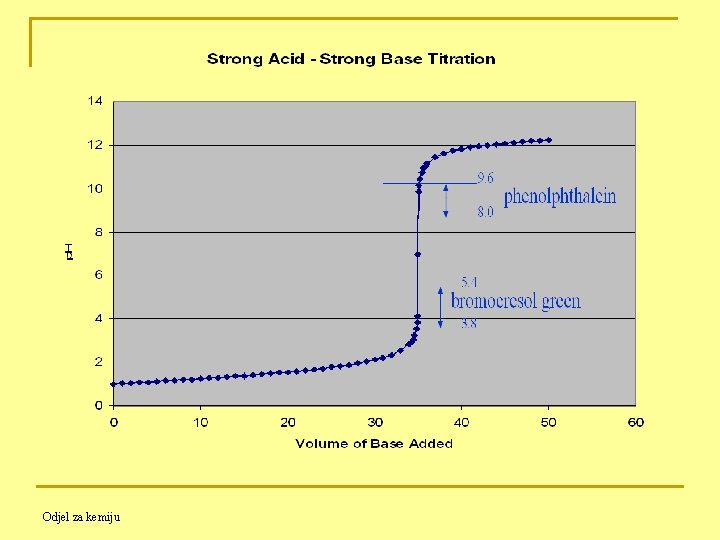
Sl. 1. Titracijska krivulja slabe kiseline jakom bazom Odjel za kemiju

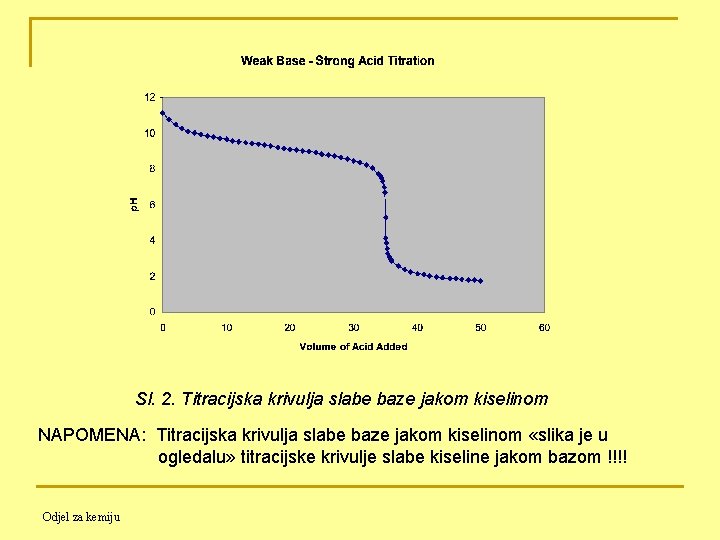
11. 4. 3. Titracija slabe baze jakom kiselinom Titracija 50. 00 m. L 0. 100 M NH 4 OH (Kb = 1. 8∙ 10 -5 ) s 0. 100 M HCl Prije početka titracije: Znamo od prije za Kb 10 -4 Odjel za kemiju prisutan samo NH 4 OH (slaba baza)

Prije ekvivalentne točke: HCl + NH 4 OH ⇋ H 2 O + NH 4 Cl Dodatkom HCl nastaje NH 4 Cl i preostaje neizreagirani NH 4 OH, dakle u otopini imamo smjesu slabe baze i njene soli, a to je……. PUFER Znamo od prije za Kb < 10 -4 → Odjel za kemiju

U ekvivalentnoj točki: samo NH 4 Cl i H 2 O A NH 4 Cl kao sol slabe baze i jake kiseline podliježe HIDROLIZI !!!!! Znamo od prije Poslije ekvivalentne točke: sav NH 4 OH je potrošen, a suvišak H+ spriječava hidrolizu NH 4+ (princip Le Chatelier-a): NH 4+ + H 2 O ⇋ NH 4 OH + H+ pa se [H+] izračunava kao i pri titraciji jake baze jakom kiselinom: [H+] = na / Vtot = [Va∙Ca – Vb∙Cb] / (Va + Vb) Odjel za kemiju

Sl. 2. Titracijska krivulja slabe baze jakom kiselinom NAPOMENA: Titracijska krivulja slabe baze jakom kiselinom «slika je u ogledalu» titracijske krivulje slabe kiseline jakom bazom !!!! Odjel za kemiju

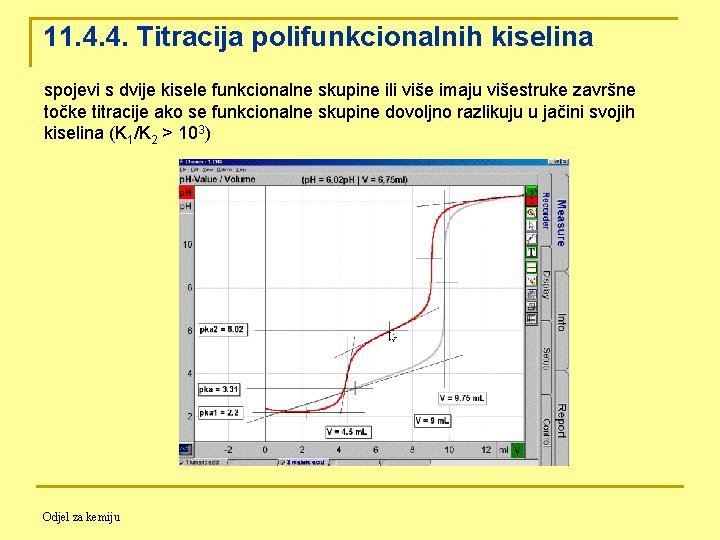
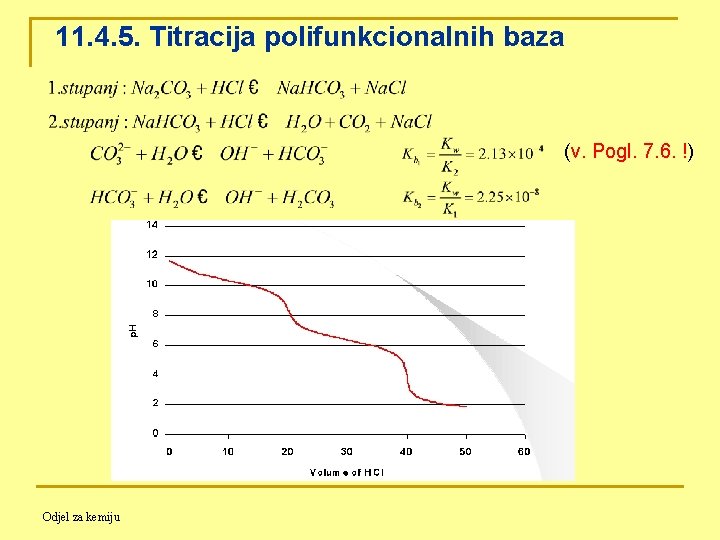
11. 4. 4. Titracija polifunkcionalnih kiselina spojevi s dvije kisele funkcionalne skupine ili više imaju višestruke završne točke titracije ako se funkcionalne skupine dovoljno razlikuju u jačini svojih kiselina (K 1/K 2 > 103) Odjel za kemiju

Primjer Izvedi krivulju za titraciju 25. 00 m. L 0. 1000 M maleinske kiseline, C 2 H 2(COOH)2, sa 0. 1000 M Na. OH. Početni p. H (samo 1. disocija bitno doprinosi Odjel za kemiju

M Prvo pufersko područje Dodatkom 5 m. L baze nastat će pufer H 2 M + Na. HM (neizreagirani dio H 2 M + neutralizacijom nastala sol Na. HM); disocija HM- u M 2 - može se zanemariti, pa je: Odjel za kemiju

tj. Uvrštenjem tih vrijednosti u izraz za što je veće od početne a to je nemoguće ! Jasno je da aproksimacija « ili ne vrijedi. No sad imamo slučaj kiseline H 2 M i njene konjugirane baze HM-, gdje vrijedi: (1) (2). Iz jedn. (1) i (2) može se izračunati bilanca masa za H 2 M i HM- : Gornje aproksimacije vrijede jer je otopina prilično kisela. Uvrštenjem gornjih izraza u izraz za K 1 : Odjel za kemiju

tj. M tj. Prva točka ekvivalencije M Ako je Odjel za kemiju > pa je (3), ali i pa je (4). otopina je bazična, a ako je < otopina je kisela.

Za otopinu Na. HM bilanca masa je: (slijedi iz j. 3. i 4. ) (5) a bilanca naboja je: Kako je pa se gornja jednadžba može napisati: (6). Da bismo riješili 5 nepoznanica treba nam još jednadžba. Za to će poslužiti ionski produkt vode: Ako od jedn. (6) oduzmemo jedn. (5): Odjel za kemiju

Nakon preuređenja prethodnog izraza dobije se kvadratna jednadžba, čije je riješenje: (7). Možemo smatrati da je: pa uvrštenjem u jedn. (7): (8). M (vrijednost za Kw se može zanemariti !) Odjel za kemiju

Drugo pufersko područje Dalji dodatak baze u otopinu stvara novi puferski sustav (HM- + M 2 -): Uvrštenjem gornjih vrijednosti u izraz za K 2: Odjel za kemiju (jedn. (3))

M Druga točka ekvivalencije Nakon dodatka 50. 00 m. L 0. 1000 M Na. OH otopina sadrži 0. 0333 M Na 2 M. Odjel za kemiju

M Područje iza druge točke ekvivalencije Dalji dodatak Na. OH potiskuje baznu disocijaciju Na 2 M. Nakon dodatka 51. 00 m. L Na. OH imamo suvišak od 1. 00 m. L Na. OH, pa je: M Odjel za kemiju

11. 4. 5. Titracija polifunkcionalnih baza (v. Pogl. 7. 6. !) Odjel za kemiju

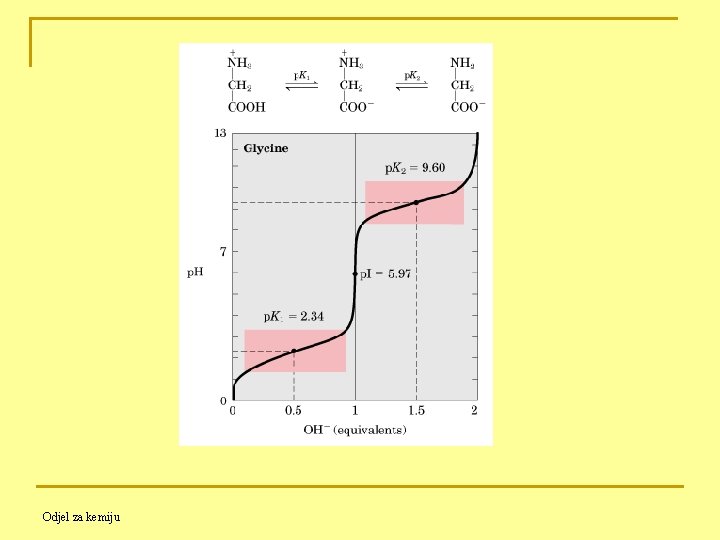
11. 4. 6. Titracija amfiprotičnih tvari - Kad se neka amfiprotična tvar otopi u prikladnom otapalu, ponaša se kao slaba kiselina i kao slaba baza, - Ako prevladava dovoljno ili kisela ili bazična značajka tog spoja, moguća je titracija istoga jakom bazom ili jakom kiselinom. Ka 2 je dovoljno velika da se može titrirati standardnom bazom ! Kb 3 je previše mala i ne može se titrirati standardnom kiselinom ! Odjel za kemiju

Ka 3 je previše mala i ne može se titrirati standardnom bazom ! Kb 2 je dovoljno velika da se može titrirati standardnom kiselinom ! Odjel za kemiju

Odjel za kemiju

Jedinke aminokiseline koje nose i pozitivan i negativan naboj nazivaju se DVOJNIM IONIMA (zwitterioni). Dvojni ion glicina je nesto jača kiselina nego baza, zato je vodena otopina glicina slabo kisela. IZOELEKTRIČNA TOČKA je p. H kod kojega aminokiselina, kad se stavi u električno polje, ne putuje. Odjel za kemiju

Dijeljenjem Ka s Kb : Odjel za kemiju

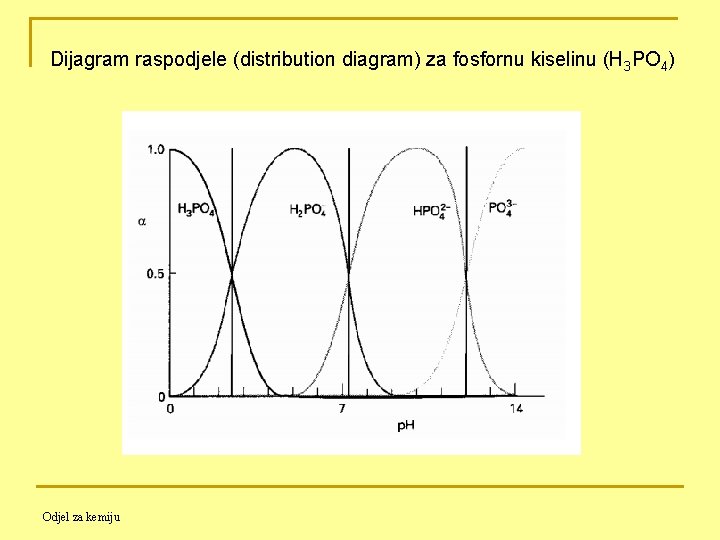
11. 4. 7. Sastav otopina poliprotičnih kiselina kao funkcija p. H Alfa vrijednosti (α, relativne koncentracije) se mogu upotrijebiti za predočavanje različitih promjena koncentracija svih specija koje se događaju tijekom titracija slabih kiselina ili baza. Odjel za kemiju

i za koju je Za slabu kiselinu HA koja disocira (1) definirajmo (2) i. Supstitucijom preuređenja dobije se: Supstitucijom (3). Očito je da je iz jedn. 1. u jedn. 2. i nakon (4). iz jedn. 1. u jedn. 3. i nakon preuređenja dobije se: (5).

Na sličan način može se doći do izraza i za polifunkcionalne kiseline i baze. Primjer: Neka je c. T zbroj molarnih koncentracija jedinki koje sadrže maleat (ili neku dvoprotonsku kiselinu H 2 A), u otopini za vrijeme titracije, alfa vrijednost za slobodnu kiselinu je : gdje je. Alfa vrijednosti za Odjel za kemiju i su

Zna se da je uvijek pa se analogno prethodnom dobije Opći izraz alfa vrijednosti Za slabu kiselinu Hn. A nazivnik za sve alfa vrijednosti ima oblik: Odjel za kemiju

Dijagram raspodjele (distribution diagram) za fosfornu kiselinu (H 3 PO 4) Odjel za kemiju

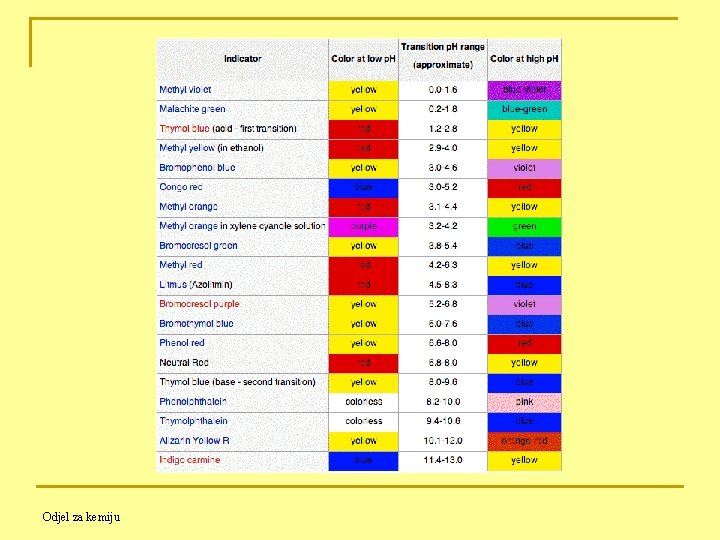
11. 5. Indikatori pri kiselo-baznim titracijama (Acid-base indicators) Kiselo-bazni indikatori (p. H indikatori) su slabe organske kiseline ili slabe organske baze koje mijenjaju boju kao posljedicu njihovog ionizacijskog stanja. Otopina koja sadrži fenolftalein prije titracije Otopina koja sadrži fenolftalein nakon titracije Odjel za kemiju

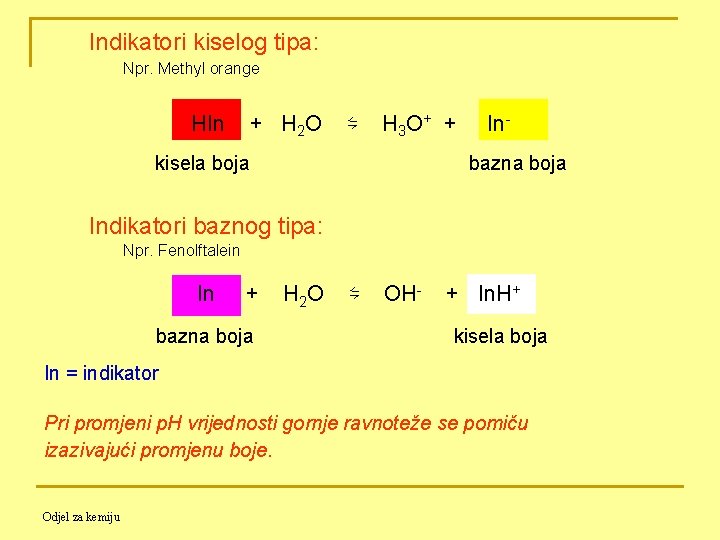
Indikatori kiselog tipa: Npr. Methyl orange HIn + H 2 O ⇋ H 3 O+ + In- kisela boja bazna boja Indikatori baznog tipa: Npr. Fenolftalein In + H 2 O ⇋ OH- + In. H+ bazna boja kisela boja In = indikator Pri promjeni p. H vrijednosti gornje ravnoteže se pomiču izazivajući promjenu boje. Odjel za kemiju

Konstante ravnoteže za prethodne disocijacije su: (1) i (2). Preuređenjem jedn. (1): (3). Ljudsko oko nije osjetljivo na razlike u boji otopina koje sadrže smjesu In- i HIn, posebno kad je odnos 0. 1 > In- /HIn >10 ! Indikator HIn imat će čistu kiselu boju za prosječno oko kad je: a baznu boju kad je:

Uvrštenjem spomenutih koncentracijskih odnosa u jedn. (3) može se dobiti raspon koncentracija koji je potreban da se dogodi potpuna promjena boje indikatora. Za potpunu kiselu boju vrijedi Dok za potpunu baznu boju imamo Negativnim logaritmiranjem gornjih izraza dobiva se raspon promjene boje indikatora: p. H (kisela boja) = - log(Ka x 10) = p. Ka - 1 p. H (bazna boja) = - log(Ka/10) = p. Ka + 1 p. H raspon indikatora = p. Ka ± 1 pa je

Odjel za kemiju

Odjel za kemiju

11. 6. KOMPLEKSOMETRIJSKE TITRACIJE (Complexation titrations) 11. 6. 1. Uvod Kompleksometrijske titracije koriste se pri titraciji kationa pomoću reagenasa koji stvaraju komplekse. (Kompleksometrija je volumetrijska analitička metoda koja se temelji na titraciji otopina metalnih iona pomoću tvari koja s njima tvori kompleksne spojeve, npr. EDTA. ) Većina metala, stvara koordinacijske komplekse s anionima ili molekulama. ⇋ Primjer : Fe 2+ + 6 CN- Fe(CN)64 Molekule/anioni koji reagiraju s metalnim ionima moraju dati/donirati slobodan par elektrona da bi formirali koordinacijsku kovalentnu vezu. Odjel za kemiju

11. 6. 2. Terminologija ô Metalni ion (ili kation) u kompleksu zove se centralni atom. ô Spoj/specija koja daje/donira elektrone zove se ligand Ligandi su molekule ili ioni koji se s centralnim metalnim ionom vezuju u kompleks. Ligandi mogu biti ioni ili molekule koji imaju slobodne elektronske parove. Ligandi se klasificiraju prema broju veza koje mogu ostvariti s centralnim atomom ô Broj veza koje centralni atom može formirati zove se koordinacijski broj. Odjel za kemiju

11. 6. 3. Ključni čimbenici pri nastajanju kompleksa A. Kompleks može nastati samo ako: Ø centralni atom prihvata elektronski par od jednog ili više liganda, Ø ligand posjeduje barem jedan elektronski par za doniranje, Ø ostvaruje se veza (koordinacijska kovalentna veza). Odjel za kemiju

B. Brojni anionski i molekularni ligandi mogu stvarati komplekse: Anionski ligandi: halogenidi, SCN-, OH-, RCOO-, S 2 -, C 2 O 42 - (oksalat), etc. Molekularni ligandi: voda, NH 3, RNH 2 (amini) C 5 H 5 N (piridin) H 2 NCH 2 NH 2 (etilendiamin), etc. Odjel za kemiju

C. Ligandi koji posjeduju (ili dijele) samo jedan elektronski par zovu se unidentatni ligandi. Primjer : amonijak je unidentatni ligand… Cu 2+ + 4 NH 3 Odjel za kemiju ⇋ Cu(NH ) 3 4 2+

D. Bidentatni ligandi dijele dva elektronska para. Bidentatni ili dvozubi ligandi imaju dva donorska atoma s nepodijeljenim elektronskim parovima koji se mogu vezati s dvije koordinacijske veze na centralni atom. Primjer bidentatnog liganda je etilendiamin. Jedna molekula etilendiamina formira dvije veze s metalnim ionom. Tako se na centralni atom s kordinacijskim brojem 4 vežu dvije molekule etilendiamina a na onaj s koordinacijskim brojem 6 tri molekule. Primjeri : Ø Glicin kompleksiran sa bakrom(II). Ø Etilendiamin kompleksiran sa cinkovim ionom. Odjel za kemiju

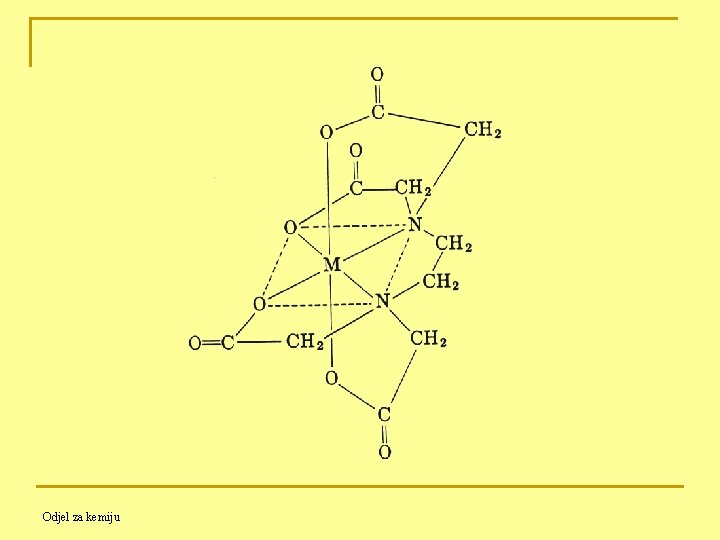
E. Multidentatni ligandi kompleksirani s metalnim ionima zovu se kelati. Kelati (kelatni kompleksi) nastaju vezivanjem polidentantnih liganada s metalnim ionom u kompleks prstenaste strukture, npr. kompleks bakra s EDTA jest kelat. Kelatni ligandi obuhvate centralni atom poput škara morskog raka. Kelatni kompleksi odlikuju se velikom stabilnošću. Primjer : EDTA Odjel za kemiju

F. Multidentatni ligandi imaju prednost kao titranti pri određivanju metalnih iona: Ø Generalno oni reagiraju mnogo kvantitativnije (imaju veće vrijednosti konstante nastajanja Kf (formation constant) dajući oštrije završne/ekvivalentne točke. Kf = 1/Kdis Ø Odjel za kemiju Općenito reagiraju u jednom koraku (nema međuprodukata).

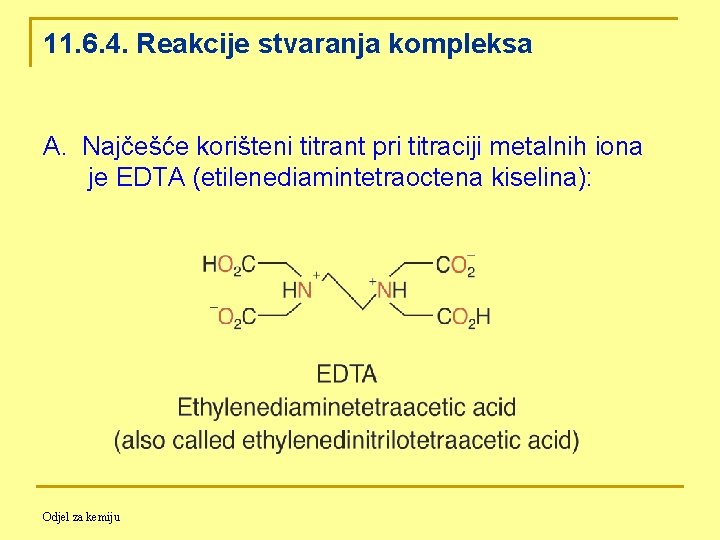
11. 6. 4. Reakcije stvaranja kompleksa A. Najčešće korišteni titrant pri titraciji metalnih iona je EDTA (etilenediamintetraoctena kiselina): Odjel za kemiju

B. EDTA je heksadentat koji daje po jedan elektronski par sa svake od dvije amino grupe i po jedan elektronski par sa svakog od četiri karboksilata na vezani metalni ion. C. EDTA stvara "kavez" oko metalnog iona. D. EDTA stvara komplekse s većinom kationa u omjeru 1 : 1 (EDTA : kation = 1 : 1) neovisno o valenciji kationa. Odjel za kemiju

Odjel za kemiju

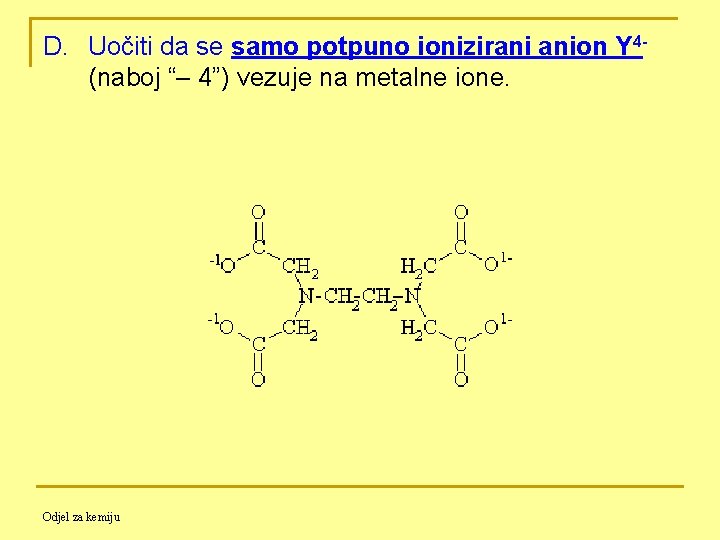
D. Uočiti da se samo potpuno ionizirani anion Y 4 - (naboj “– 4”) vezuje na metalne ione. Odjel za kemiju

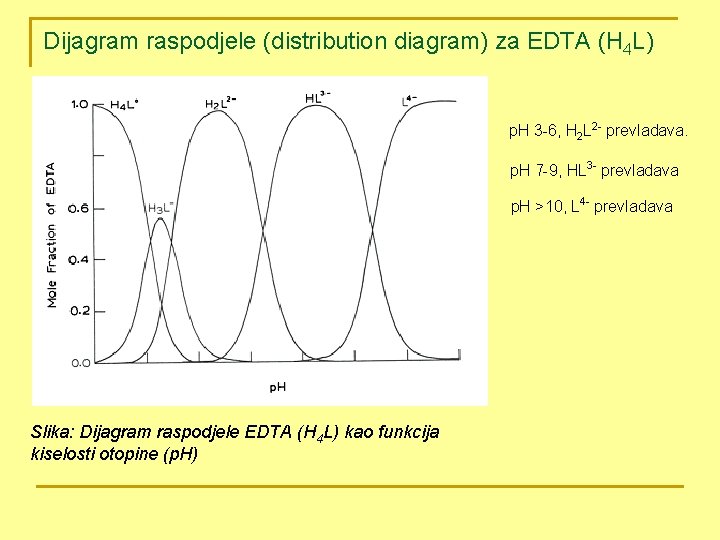
E. EDTA je tetraprotonska kiselina. Ako je H 4 Y = EDTA, onda su 4 ionizacije: Ø Između p. H 3 -6, H 2 Y 2 - prevladava. Ø Između p. H 7 -9, HY 3 - prevladava. Ø Pri p. H većem od 10, Y 4 - prevladava; stoga se titracije rutinski izvode u puferiranim otopinama oko ili iznad p. H 10. Odjel za kemiju

Dijagram raspodjele (distribution diagram) za EDTA (H 4 L) p. H 3 -6, H 2 L 2 - prevladava. p. H 7 -9, HL 3 - prevladava p. H >10, L 4 - prevladava Slika: Dijagram raspodjele EDTA (H 4 L) kao funkcija kiselosti otopine (p. H)

F. Ravnoteža Y 4 -- metalni ion: Mn+ + Y 4 - ⇋ MY(n-4)+ Konstanta nastajanja kompleksa je: Odjel za kemiju

G. Standardna otopina EDTA obično se priprema direktnim otapanjem Na 2 H 2 Y · 2 H 2 O u odmjernoj tikvici. (Napomena: Najčešće Na 2 H 2 Y · 2 H 2 O dolazi pri normalnim, atmosferskim uvjetima s 0. 3% suviška vode u kristalu. Suvišak vode mora se uzeti u obzir kod pripreme standardnih otopina. ) H. Titracijske krivulje EDTA sastoje se od grafa koji prikazuje p. M prema volumenu dodanog EDTA. Odjel za kemiju

Primjer: Titracija 50. 00 m. L 0. 00500 M Ca 2+ sa 0. 0100 M EDTA, puferirano na p. H 10. 0. Prije početka titracije: EDTA još nije dodan: p. Ca = -log([Ca 2+]) = -log(0. 00500) = 2. 3 Odjel za kemiju

Prije ekvivalentne točke: Dodano 10. 00 m. L EDTA Ca 2+ + Y 4 - ⇋ Ca. Y 2[Ca 2+] u otopini potječe od netitriranog Ca 2+ i Ca 2+ koji nastaje disocijacijom Ca. Y 2 - kompleksa. Konstanta nastajanja Kf kompleksa Ca. Y 2 - je vrlo velika, = 5. 0 · 1010 , pa se Ca 2+ koji bi nastao disocijacijom može zanemariti. Ø [Ca 2+] = n Ca 2+ / Vtot = [VCa 2+ x CCa 2+ - VEDTA x CEDTA] / (VCa 2+ + VEDTA) Ø [Ca 2+] = [50. 00 m. L x 0. 00500 M - 10. 00 m. L x 0. 0100 M] / (50. 00 + 10. 00) Ø [Ca 2+] = 2. 50 x 10 -3 M (mol/L) Ø p. Ca = -log[Ca 2+] = 2. 602 Odjel za kemiju
![U ekvivalentnoj točki Ø Ø Ø sav Ca 2 titracijom je preveden u Ca U ekvivalentnoj točki: Ø Ø Ø sav [Ca 2+] titracijom je preveden u Ca.](https://slidetodoc.com/presentation_image_h/b04fb44cea5eabb1c7798f02ba60acdb/image-64.jpg)
U ekvivalentnoj točki: Ø Ø Ø sav [Ca 2+] titracijom je preveden u Ca. Y 2 -, početni broj molova [Ca 2+] = broj molova dodanog EDTA, sav slobodni Ca 2+ u otopini potječe od disocijacije Ca. Y 2 - i mora biti jednak zbroju koncentracija svih nekompleksiranih EDTA vrsta (c. T), tj. [Ca 2+] = c. T. Napomena: Ca. Y 2 -, kao i ostali kompleksi metala i EDTA su topivi u vodi! Dakle, analitička je koncentracija [Ca. Y 2 -] : = (početni broj molova [Ca 2+] / (ukupni volumen) = (50. 00 m. L · 0. 00500 M) / (50. 00 + 25. 00) = 3. 33 · 10 -3 M

Uvrštenjem u izraz za konstantu stvaranja: jer iz slijedi gdje je ukupna koncentracija nekompleksiranog EDTA: Odjel za kemiju

Preuređenjem se dobije Izraz zove se uvjetna konstanta nastajanja kompleksa (conditional formation constant) koja ovisi o p. H vrijednosti i primjenjuje se samo za određenu p. H vrijednost ! Vrijednosti nalaze se u tablicama, i u našem slučaju pri p. H = 10: = 0. 35, = 5. 0 · 1010 Jedini izvor [Ca 2+] je disocija kompleksa i jednaka je zbroju koncentracija nekompleksiranih EDTA specija, CT. A kako je [Ca 2+] = CT to se uvrštenjem u dobije (0. 35) x (5. 0 x 1010) = (3. 33 x 10 -3 - [Ca 2+]) / ([Ca 2+] x ([Ca 2+]) [Ca 2+] = 4. 36 x 10 -7 mol/L; a p. Ca = 6. 360 Odjel za kemiju

Poslije ekvivalentne točke: (pretpostavimo da je dodano 35. 00 m. L EDTA) Sav je kalcij kompleksiran s EDTA, pa imamo = (početni broj molova [Ca 2+] / (ukupni volumen) = (50. 00 m. L · 0. 00500 M) / (50. 00 + 35. 00) = 2. 94 · 10 -3 mol/L CEDTA = (ukupno dodano molova EDTA – utrošeno molova EDTA pri titraciji) / (ukupni volumen) CEDTA = (35. 00 m. L · 0. 0100 M – 50. 00 m. L · 0. 00500 M) / (85 m. L) = 1. 18 · 10 -3 M [Ca. Y 2 -] = - [Ca 2+] ≈ 2. 94 · 10 -3 M CT = CEDTA + [Ca 2+] ≈ CEDTA = 1. 18 · 10 -3 M Odjel za kemiju
![Uvrštenjem u izraz za konstantu stvaranja Ca 2 1 42 10 10 Uvrštenjem u izraz za konstantu stvaranja: [Ca 2+] = 1. 42 · 10 -10](https://slidetodoc.com/presentation_image_h/b04fb44cea5eabb1c7798f02ba60acdb/image-68.jpg)
Uvrštenjem u izraz za konstantu stvaranja: [Ca 2+] = 1. 42 · 10 -10 mol/L p. Ca = 9. 847 Ostale točke iza točke ekvivalencije računaju se na isti način. Odjel za kemiju

11. 6. 5. Indikatori za kompleksometrijske titracije Y Y Y Organski spojevi (boje) koji s kationima metala stvaraju obojene komplekse (kelate). Do točke ekvivalencije imamo indikator koji kompleksira suvišak metalnog iona u obliku MIn-. Tijekom titracije EDTA kompleksira prvo slobodne metalne ione, a potom i one kompleksirane s indikatorom (uvijek je M-EDTA kompleks znatno stabilniji od MIn- kompleksa): MIn- + HY 3 - ⇋ HIn 2 - + MY 2 jedna boja Ø druga boja Najčešće korišteni indikatori: Eriokrom crno T, Mureksid Odjel za kemiju

11. 7. TALOŽNE TITRACIJE (Precipitation titrations) titracije tijekom kojih dolazi do stvaranja netopivog (slabo topivog) taloga. 11. 7. 1. Argentometrijske metode (Argentometric Methods) ØKao agens za taloženje (najčešće i titrant) koristi se Ag. NO 3. - - - ØKoriste se najčešće za određivanje halogenida (Cl , Br , I ). ØModelna titracija: 50. 00 m. L 0. 00500 M Na. Br titrira se sa 0. 0100 M Ag. NO 3 + - Ksp = 5. 2 · 10 -13 = [Ag ][Br ] Odjel za kemiju

Odjel za kemiju

Odjel za kemiju
![Niski Ag Niski Br Ag Br Ag Br p Ag ili p Niski [Ag+] Niski [Br-] Ag+ + Br- ⇋ Ag. Br p. Ag [ili p.](https://slidetodoc.com/presentation_image_h/b04fb44cea5eabb1c7798f02ba60acdb/image-73.jpg)
Niski [Ag+] Niski [Br-] Ag+ + Br- ⇋ Ag. Br p. Ag [ili p. Br-] Visoki [Br-] m. L Ag. NO 3 otopine Odjel za kemiju Visoki [Ag+]

11. 7. 2. Indikatori za argentometrijske titracije ü Poput kiselo-baznih indikatora i indikatori za argentometrijske titracije biraju se da izazovu promjenu boje (ponekad se javlja ili nestaje zamućenje) u ili u blizini ekvivalentne točke. Obično se indikator bira da reagira s viškom dodanog titranta (R), a ne analita (A): A + R ⇋ AR(s) In(color) + R ⇋ In. R( new color) color new color ü Kriteriji izbora indikatora za argentometrijske titracije: ü § § § niska koncentracija In. R treba izazvati nagle promjene boje, indikator ne smije znatnije ometati ravnotežnu reakciju između analita i titranta, koncentracije reaktanata trebaju biti tako odabrane da područje promjene boje indikatora potpuno pokriva promjenu p. Ag u području ekvivalentne točke. Odjel za kemiju

Odjel za kemiju

11. 8. OKSIDACIJSKO/REDUKCIJSKE TITRACIJE (Redox titrations) Ø titracije pri kojima je reakcija između analita i titranta praćena razmjenom elektrona. Odjel za kemiju

Nernstova jednadžba Za reakciju ⇋ Ox + n e- Red vrijedi Nernstova jednadžba: n n n n E = elektrodni potencijal (electrode potential), E 0 = standardni elektrodni potencijal (konstanta), n = broj elektrona u polureakciji, R = univerzalna plinska konstanta (8. 314510 J K-1 mol-1), T = temperatura (K), F = Faraday-eva konstanta (faraday) = 96500 C (kulona), ln = prirodni logaritam = 2. 303 · log. Odjel za kemiju

Primjer : titracija željeza(II) standardnom otopinom cerija(IV) ⇋ Fe 2+ + Ce 4+ Fe 3+ + Ce 3+ 1. Polureakcija oksidacije: ⇋ Fe 2+ Fe 3+ + e 2. Polureakcija redukcije: ⇋ Ce 4+ + e- Ce 3+ Odjel za kemiju

Opće napomene o redoks reakcijama i redoks titracijama: 1. Reakcije moraju biti potpuno reverzibilne (tj. sustav mora biti u ravnoteži tijekom cijele titracije). 2. Reverzibilne reakcije, znači da vrijedi Nernstova jednadžba. 3. Podatci iz titracije mogu se koristiti za izračunavanje titracijske krivulje koristeći Nernstovu jednadžbu. 4. U praksi, za gornji slučaj vrijedi: a) Prije točke ekvivalencije koncentracije Fe(III) i Fe(II) koriste se za izračunavanje Esystem. b) Poslije točke ekvivalencije koncentracije Ce(III) i Ce(IV) koriste se za izračunavanje Esystem. c) U točki ekvivalencije uvođenje pojednostavljenih pretpostavki utemeljenih na stehiometrijskim relacijama koriste se za izračunavanje Esystem. Odjel za kemiju

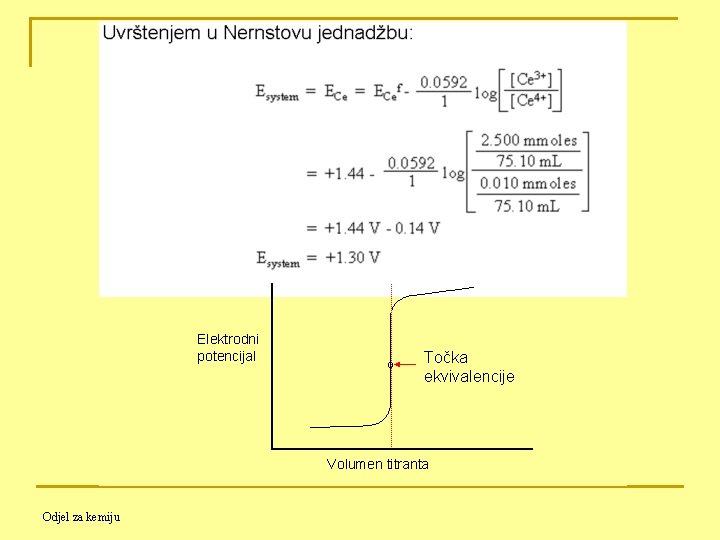
Modelna titracija: 50. 00 m. L 0. 05000 M otopine Fe 2+ titrira se sa 0. 1000 M Ce 4+ u sredini koja sadrži 1. 0 M H 2 SO 4 (otuda korištenje formalnih potencijala EFef i ECef (podatci iz literature) pri izračunavanjima). n Prije početka titracije: Ce(IV) još nije dodavan. Pošto se količina Fe 3+ ne može izračunati (u suštini je nula), i količina Ce 3+ je nula, potencijal se ne može izračunati. n Prije ekvivalentne točke: dodano je 5. 00 m. L otopine Ce 4+. Odjel za kemiju

Odjel za kemiju

Odjel za kemiju

Elektrodni potencijal Točka ekvivalencije Volumen titranta Odjel za kemiju

11. 8. 1. Indikatori za redoks titracije Najčešće se koriste dva tipa indikatora: 1. specifični indikatori Ø specije koje reagiraju s jednim od učesnika u titraciji izazivajući promjenu boje. Odjel za kemiju

Odjel za kemiju

2. redoks indikatori ( «pravi» redoks indikatori) Ø reagiraju na potencijal sustava izazivajući promjenu boje. Polureakcija redoks indikatora je : In(oxid) + ne- ⇋ In(red) Odjel za kemiju

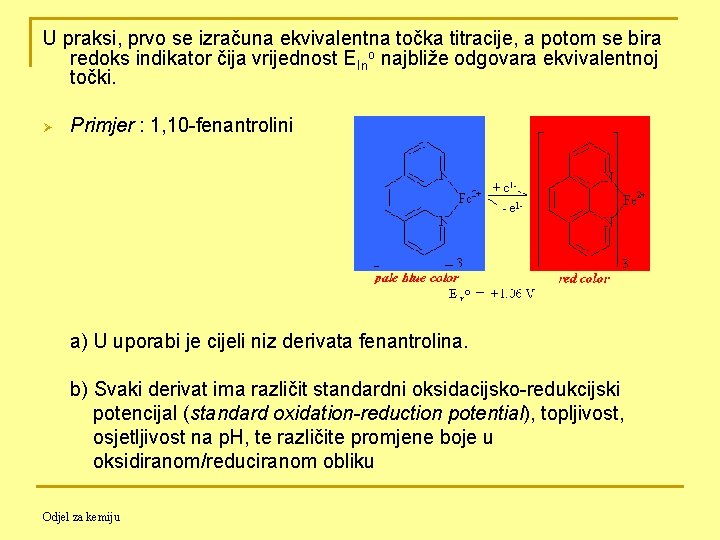
U praksi, prvo se izračuna ekvivalentna točka titracije, a potom se bira redoks indikator čija vrijednost EIno najbliže odgovara ekvivalentnoj točki. Ø Primjer : 1, 10 -fenantrolini a) U uporabi je cijeli niz derivata fenantrolina. b) Svaki derivat ima različit standardni oksidacijsko-redukcijski potencijal (standard oxidation-reduction potential), topljivost, osjetljivost na p. H, te različite promjene boje u oksidiranom/reduciranom obliku Odjel za kemiju
 Metode titrimetri adalah
Metode titrimetri adalah Inlay wax pattern fabrication
Inlay wax pattern fabrication Metode penelitian kombinasi (mixed methods)
Metode penelitian kombinasi (mixed methods) Contoh soal biseksi
Contoh soal biseksi Metode survei konsumsi pangan
Metode survei konsumsi pangan Perbedaan eksperimen dan observasi
Perbedaan eksperimen dan observasi Persamaan diferensial metode euler
Persamaan diferensial metode euler Metode tertutup metode numerik
Metode tertutup metode numerik Metode pengelolaan anggaran
Metode pengelolaan anggaran Metode-metode survei konsumsi makanan
Metode-metode survei konsumsi makanan Metode kotor dan metode bersih
Metode kotor dan metode bersih Metode bruto dan metode netto
Metode bruto dan metode netto Asas-asas pemeliharaan karyawan
Asas-asas pemeliharaan karyawan Bab 4 metode harga pokok proses lanjutan
Bab 4 metode harga pokok proses lanjutan Contoh soal analisis data berkala
Contoh soal analisis data berkala Metode metode dalam psikologi pendidikan
Metode metode dalam psikologi pendidikan Redovi i kolone
Redovi i kolone Sretni princ analiza lektire
Sretni princ analiza lektire Uvod u laboratorijski rad
Uvod u laboratorijski rad Kompozicija drame
Kompozicija drame Strah u ulici lipa uvod zaplet vrhunac rasplet
Strah u ulici lipa uvod zaplet vrhunac rasplet Plc hardware components
Plc hardware components Ritam u pjesmi 4 razred
Ritam u pjesmi 4 razred Integrativni kontroling
Integrativni kontroling Vrste ugljenikovih atoma
Vrste ugljenikovih atoma Stapicasti dijagram
Stapicasti dijagram Uvod u informacione sisteme fon
Uvod u informacione sisteme fon Uvod u programski jezik r
Uvod u programski jezik r Pravila ponasanja u laboratoriji
Pravila ponasanja u laboratoriji Uvod zapletka
Uvod zapletka Uvod u finansije
Uvod u finansije Trojica u trnju pavao pavličić
Trojica u trnju pavao pavličić Uvod u teoriju računarstva fer
Uvod u teoriju računarstva fer Okvir za tehnicko crtanje
Okvir za tehnicko crtanje Uvod u baze podataka
Uvod u baze podataka Uvod u prezentaciju
Uvod u prezentaciju Književni rodovi
Književni rodovi Uvod u rehabilitaciju
Uvod u rehabilitaciju Rad u laboratoriji
Rad u laboratoriji Zaljubljen do ušiju uvod zaplet vrhunac i rasplet
Zaljubljen do ušiju uvod zaplet vrhunac i rasplet Informatika definicija
Informatika definicija Uvod u ekologiju
Uvod u ekologiju Zakljucak za seminarski rad
Zakljucak za seminarski rad Sloh charakteristika osoby
Sloh charakteristika osoby Kako napisati uvod za maturski rad
Kako napisati uvod za maturski rad Uvod u prezentaciju
Uvod u prezentaciju Uvod zapletka vrchol obrat rozuzlenie
Uvod zapletka vrchol obrat rozuzlenie Uvod u teoriju računarstva fer
Uvod u teoriju računarstva fer Uvod u ekologiju
Uvod u ekologiju Rijeđi ili rjeđi
Rijeđi ili rjeđi Gdje se čuvaju slikovni povijesni izvori
Gdje se čuvaju slikovni povijesni izvori Znanstveni rad primjer
Znanstveni rad primjer Uvod u baze podataka pdf
Uvod u baze podataka pdf Uvod h krstu pri savici
Uvod h krstu pri savici Ja rozpravanie on rozpravanie
Ja rozpravanie on rozpravanie Fizikalna profilaksa
Fizikalna profilaksa Pojam informatika
Pojam informatika Vnútorná kompozícia textu
Vnútorná kompozícia textu Porcelanski loncic
Porcelanski loncic Razlagalni esej primer
Razlagalni esej primer A ja za ljubav samo na taj dođoh svijet
A ja za ljubav samo na taj dođoh svijet Vrste rime 5 razred
Vrste rime 5 razred Komentar na maturski rad
Komentar na maturski rad Moždanik
Moždanik Irena stojkovic fasper
Irena stojkovic fasper Uvod seminarskog rada
Uvod seminarskog rada Objektno orijentisano programiranje
Objektno orijentisano programiranje Uvod u laboratorijski rad
Uvod u laboratorijski rad Komunikacioni medijum
Komunikacioni medijum Arhitektura baze podataka
Arhitektura baze podataka Uvod u digitalnu i mikroracunarsku elektroniku
Uvod u digitalnu i mikroracunarsku elektroniku Uvod u psihologiju
Uvod u psihologiju Uvod u knjigovodstvo
Uvod u knjigovodstvo Jadranko bitenc twist na bazenu
Jadranko bitenc twist na bazenu Uvod u web dizajn
Uvod u web dizajn Uvod u geografiju
Uvod u geografiju Java math class functions
Java math class functions Data capture methods
Data capture methods Objectives of payment system
Objectives of payment system Error detection methods in data link layer
Error detection methods in data link layer Methods are commonly used to
Methods are commonly used to Introspection psychology
Introspection psychology Business research methods by zikmund
Business research methods by zikmund Using risk to balance agile and plan driven methods
Using risk to balance agile and plan driven methods Chapter 19 methods of therapy
Chapter 19 methods of therapy Introduction methods results discussion conclusion
Introduction methods results discussion conclusion Staffing
Staffing Newmark translation method
Newmark translation method