METODE ANALISIS TITRIMETRI 1 Perhitungan yang tercakup di

















- Slides: 20

METODE ANALISIS TITRIMETRI 1. Perhitungan yang tercakup di dalamnya didasarkan pada hubungan stoikiometrik dari reaksi kimia yang sederhana 2. Analisis dengan metode titrimetrik didasarkan pada reaksi kimia seperti a. A + t. T ----- produk 3. Titik ekivalen = titik dimana jumlah T (titran) secara kimiawi sama dengan A (analit). 4. Titik akhir = titik dimana indikator berubah warna, atau cara lain dengan tanda lain yang menunjukkan titik akhir. 5. Reaksi yang dipergunakan untuk titrasi meliputi : asam-basa, redoks, pengendapan dan pembentukan kompleks. Lecture note by D. Tisnadjaja 1

PERSYARATAN REAKSI DALAM TITRIMETRI 1. Reaksi harus diproses sesuai persamaan kimiawi tertentu dan tidak boleh ada reaksi samping. 2. Reaksi harus benar-benar selesai pada titik ekivalensi. Untuk ini konstanta kesetimbangan reaksi haruslah amat besar sehingga akan ada perubahan yang besar dalam konsentrasi analit atau titran pada titik ekivalensi. 3. Harus tersedia beberapa metode untuk menentukan kapan titik ekivalen tercapai, atau harus tersedia indikator atau metode instrumental agar titik ekivalen terdeteksi. 4. Reaksi harus berjalan cepat, sehingga titrasi dapat diselesaikan dalam beberapa menit. Lecture note by D. Tisnadjaja 2

STANDAR PRIMER • 1. Standar primer harus mempunyai karakteristik sebagai berikut : Harus tersedia dalam bentuk murni, atau dalam suatu tingkat kemurnian yang diketahui. Secara umum jumlah pengotor tidak boleh melebihi 0, 01 sampai 0, 02%. 2. Substansi tersebut harus stabil. Harus mudah dikeringkan dan tidak terlalu higroskopis sehingga tidak banyak menyerap air selama penimbangan. 3. Standar primer diharapkan mempunyai berat ekivalen yang cukup tinggi agar dapat meminimalisasi konsekuensi galat pada saat penimbangan. Contoh standarisasi: Sebuah sampel Na 2 CO 3, dengan berat 0, 3542 g dilarutkan dalam air dan dititrasi dengan larutan HCl. Volume HCl yang dibutuhkan untuk mencapai titik ekivalen = 30, 23 ml. Hitung molaritas dari HCl. Reaksi yang terjadi : Na 2 CO 3 + 2 HCl ------- Na. Cl + H 2 O + CO 2 Lecture note by D. Tisnadjaja 3

Penyelesaian Pada titik ekivalen : mmol HCl = 2 x mmol Na 2 CO 3 VHCl x MHCl = 2 x mg Na 2 CO 3/BM Na 2 CO 3 30, 23 x M HCl = 2 x 354, 2/106, 0 M HCl = 0, 2211 mmol/m. L Lecture note by D. Tisnadjaja 4

TITRASI ASAM – BASA (NETRALISASI) • • Titrasi asam - basa digunakan untuk menentukan kadar analit yang bersifat asam/basa atau zat yang dapat diubah menjadi asam/basa. Air umumnya digunakan sebagai pelarut karena mudah diperoleh, murah, tidak beracun dan mempunyai koefisien suhu muai yang rendah. Penentuan titik ekivalen secara umum dapat dilakukan dengan dua metode, yaitu dengan penambahan indikator (penambahan dilakukan sebelum titrasi) atau monitoring perubahan p. H dengan p. H meter selama proses titrasi berlangsung yang kemudian dilakukan plot perubahan p. H terhadap volume titran. Titik tengah dari kurva titrasi tersebut merupakan titik ekivalen. Indikator yang dipakai dalam titrasi asam basa adalah indikator yang perubahan warnanya dipengaruhi oleh p. H. Penambahan indikator diusahakan sesedikit mungkin dan umumnya adalah dua hingga tiga tetes. Pada saat titik ekuivalen maka mol-ekuivalent asam akan sama dengan mol -ekuivalent basa, maka hal ini dapat kita tulis sebagai berikut: mol-ekuivalen asam = mol-ekuivalen basa Mol ekivalen = perkalian antara Normalitas dengan volume = N x V Normalitas = Molaritas x jumlah H+ pada asam atau OH- pada basa Lecture note by D. Tisnadjaja 5

MOLARITAS • Molaritas = jumlah mol per liter larutan atau M = n/V M = molaritas, n = jumlah mol dalam larutan; V = volume larutan dalam liter n = g/BM; dimana g = gram zat terlarut; BM = berat molekul larutan maka, M = g/BM x V atau g = M x V x BM Contoh soal: Hitung molaritas larutan yang mengandung 6, 00 g Na. Cl (BM = 58, 44) dalam 200 m. L larutan. M (mol/liter) = 6, 00 g Na. Cl x 1000 m. L/liter/ 58, 44 g/mol Na. Cl x 200 m. L M = 0, 513 mol/liter. Lecture note by D. Tisnadjaja 6

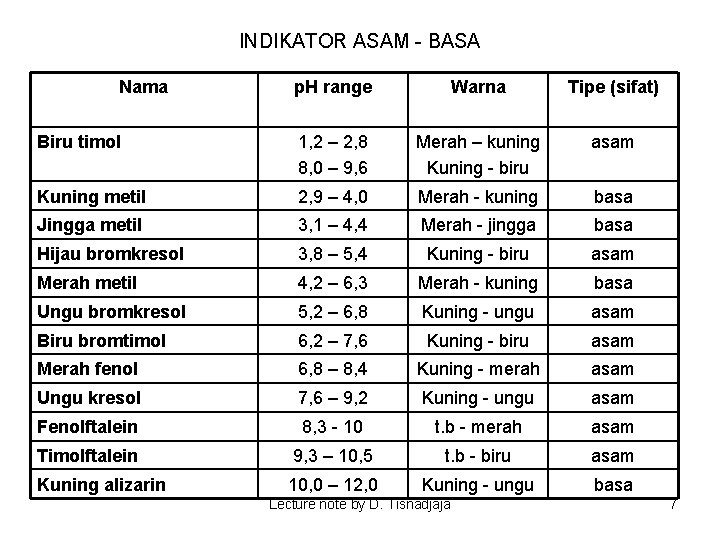
INDIKATOR ASAM - BASA Nama p. H range Warna Tipe (sifat) Biru timol 1, 2 – 2, 8 8, 0 – 9, 6 Merah – kuning Kuning - biru asam Kuning metil 2, 9 – 4, 0 Merah - kuning basa Jingga metil 3, 1 – 4, 4 Merah - jingga basa Hijau bromkresol 3, 8 – 5, 4 Kuning - biru asam Merah metil 4, 2 – 6, 3 Merah - kuning basa Ungu bromkresol 5, 2 – 6, 8 Kuning - ungu asam Biru bromtimol 6, 2 – 7, 6 Kuning - biru asam Merah fenol 6, 8 – 8, 4 Kuning - merah asam Ungu kresol 7, 6 – 9, 2 Kuning - ungu asam Fenolftalein 8, 3 - 10 t. b - merah asam Timolftalein 9, 3 – 10, 5 t. b - biru asam Kuning alizarin 10, 0 – 12, 0 Kuning - ungu basa Lecture note by D. Tisnadjaja 7

Teori perilaku indikator Indikator adalah asam dan basa organik lemah yang bentuk takterurainya dan bentuk ioniknya memiliki warna yang berbeda. Salah satu contoh adalah p-nitrofenol, yang merupakan asam lemah. Dalam bentuk tak-terurai p-nitrofenol tidak berwarna, tetapi anionnya, yang mempunyai suatu sistem pengubah ikatan tunggal dan ganda (sistem terkonjugasi) berwarna kuning. Indikator fenolftalein merupakan asam diprotik dan tidak berwarna. Pada penguraian pertama masih tetap tidak berwarna dan kemudian dengan hilangnya proton kedua, menjadi ion dengan sistem terkonjugasi dan memberikan warna merah. Metil oranye, indikator ini merupakan basa dengan warna kuning dalam bentuk molekulnya. Adanya penambahan proton menghasilkan kation berwarna merah muda. Lecture note by D. Tisnadjaja 8

Penentuan rentang Perubahan Warna Suatu Indikator • • Sebagai ilustrasi kita permisalkan Indikator asam sebagai HIn dan Indikator basa sebagai In. Persamaan penguraiannya : HIn + H 2 O H 3 O+ + In. In + H 2 O In. H+ + OH- Tetapan penguraian dari asam = Dalam bentuk logaritma : Ka = (H 3 O+)(In-)/(HIn) p. H = p. Ka – log (HIn)/(In) Diasumsikan molekul HIn berwarna merah dan ion In- berwarna kuning Warna yang terlihat tergantung pada jumlah relatif kedua bentuk itu. Pada p. H rendah, HIn asam menonjol sehingga akan terlihat merah. Dalam larutan ber p. H tinggi, In- akan menonjol sehingga terlihat kuning. Pada nilai p. H menengah dimana kedua bentuk memiliki konsentrasi hampir sama, warnanya mungkin oranye. Lecture note by D. Tisnadjaja 9

Perubahan warna indikator • • Selanjutnya kita asumsikan p. Ka dari HIn adalah 5, 00, dan larutan tampak berwarna merah bila rasio(HIn)/(In) sebesar 10 : 1, dan kuning bila rasionya 1 : 10 atau kurang. Perubahan p. H minimum untuk merubah warna indikator kita sebut sebagai Δ p. H. Hal ini bisa diperkirakan denganperhitungan sbb: Kuning : p. Hy = p. Ka + log 10/1 = 5 + 1 Merah : p. Hr = p. Ka + log 1/10 = 5 – 1 Δ p. H = p. Hy – p. Hr = 6 – 4 = 2 Ini berarti bahwa dibutuhkan perubahan p. H sebesar 2 satuan untuk terjadinya perubahan warna dari merah ke kuning. Lecture note by D. Tisnadjaja 10

KELAYAKAN TITRASI ASAM - BASA • • • Supaya reaksi kimia cocok untuk proses titrasi, reaksinya harus sempurna pada titik ekivalen. Semakin besar tetapan kesetimbangan, semakin sempurna reaksinya dan semakin besar perubahan p. H pada titik ekivalen. Tetapan kesetimbangan untuk asam kuat – basa kuat sangat besar : H 3 O+ + OH 2 H 2 O ; K = 1/Kw = 1, 0 x 1014 Konsentrasi zat yang dititrasi dan titran mempengaruhi besarnya Δp. H Diinginkan bahwa p. H berubah 1 atau 2 satuan untuk penambahan beberapa tetes titran pada titik ekivalen, jika digunakan indikator visual. Contoh perhitungan: Sebanyak 50, 0 m. L HA 0, 10 M dititrasi dengan basa kuat 0, 10 M. (a) hitung nilai K minimum agar bila 49, 95 m. L titran ditambahkan, reaksi antara HA dan OH- pada dasarnya sempurna dan p. H berubah 2 satuan pada penambahan 2 tetes lagi (0, 10 m. L) titran. (b) Ulangi perhitungan untuk Δp. H = 1 satuan. Lecture note by D. Tisnadjaja 11

Solusi (a) p. H 0, 05 m. L di luar titik ekivalen dapat dihitung sbb: (OH-) = 0, 05 x 0, 10/100, 05 = 5 x 10 -5 M p. OH = 4, 30; p. H = 9, 70 Jika Δp. H sama dengan 2 satuan, p. H 0, 05 m. L sebelum titik ekivalen harus sebesar 7, 70. Pada titik ini, jika reaksi sempurna, kita hanya memiliki 0, 005 mmol HA yang tidak bereaksi. Sehingga : p. H = p. Ka + log (A-)/(HA) 7, 70 = p. Ka + log (4, 995)/(0, 005) p. Ka = 4, 70 Ka = 2, 0 x 10 -5 K = Ka/Kw = 2, 0 x 10 -5/1, 0 x 10 -14 = 2, 0 x 109 (b) Jika Δp. H = 1, maka 8, 70 = p. Ka + log 4, 995/0, 005 p. Ka = 5, 7; Ka = 2, 0 x 10 -6; K = 2, 0 x 108 Lecture note by D. Tisnadjaja 12

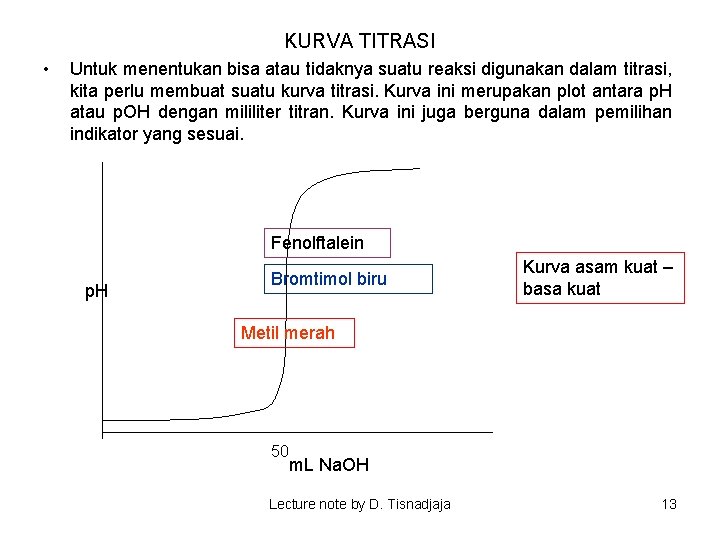
KURVA TITRASI • Untuk menentukan bisa atau tidaknya suatu reaksi digunakan dalam titrasi, kita perlu membuat suatu kurva titrasi. Kurva ini merupakan plot antara p. H atau p. OH dengan mililiter titran. Kurva ini juga berguna dalam pemilihan indikator yang sesuai. Fenolftalein p. H Bromtimol biru Kurva asam kuat – basa kuat Metil merah 50 m. L Na. OH Lecture note by D. Tisnadjaja 13

KURVA TITRASI ASAM KUAT – BASA KUAT • Contoh kasus: Sebanyak 50 m. L HCl 0, 10 M dititrasidengan Na. OH 0, 10 M. Hitung p. H pada awal titrasi dan setelah penambahan 10; 50; dan 60 m. L titran. (a) p. H awal, HCl merupakan asam kuat dan terurai sempurna. Maka (H 3 O+) = 0, 10; p. H = 1, 0 (b) p. H setelah penambahan 10, 0 m. L basa. Kita mulai dengan 50, 0 m. L x 0, 10 mmol/m. L = 5, 0 mmol HCl, dan menambahkan 10, 0 m. L x 0, 10 mmol/m. L Na. OH. Reaksinya : mmol H 3 O+ + OH 2 H 2 O Awal : 5, 0 1, 0 Berubah: -1, 0 Kesetimbangan: 4, 0 - Lecture note by D. Tisnadjaja 14

• Reaksi selesai dengan baik, karena tetapan kesetimbangannya, K, sama dengan 1/Kw atau 1, 0 x 1014. Konsentrasi H 3 O+ sama dengan (H 3 O+) = 4, 0 mmol/60, 0 m. L = 6, 67 x 10 -2 mmol/m. L p. H = 2 – log 6, 67 = 1, 18 (c) p. H pada titik ekivalen. Kita mulai dengan 50, 0 m. L x 0, 10 mmol/m. L = 5 mmol HCl dan telah menambahkan 50, 0 m. L x 0, 10 mmol/m. L = 5, 0 mmol Na. OH. Reaksinya mmol H 3 O+ + OH 2 H 2 O Awal : 5, 0 Berubah : -5, 0 Kesetimbangannya : 2 H 2 O H 3 O+ + OHdan (H 3 O+)(OH-) = Kw = 1, 0 x 1014 Karena (H 3 O+) = (OH-) ------ (H 3 O+)2 = 1, 0 x 10 -14 (H 3 O+) = 1, 0 x 10 -7 ----- p. H = 7, 0 Lecture note by D. Tisnadjaja 15

(d) p. H setelah penambahan 60, 0 m. L basa. Kita mulai dengan 50, 0 m. L x 0, 10 mmol/m. L = 5, 0 mmol HCl dan telah menambahkan 60, 0 m. L x 0, 10 mmol/m. L = 6, 0 mmol Na. OH. Reaksinya : mmol H 3 O+ + OH 2 H 2 O Awal : 5, 0 6, 0 Berubah : -5, 0 Kesetimbangan : 1, 0 Konsentrasi ion OH- adalah (OH-) = 1, 0 mmol/110 m. L = 9, 1 x 10 -3 M p. OH = 3 – log 9, 1 = 2, 04 p. H = 14, 0 – 2, 04 = 11, 96. Lecture note by D. Tisnadjaja 16

KURVA TITRASI ASAM LEMAH – BASA KUAT • (a) (b) Contoh kasus : Sebanyak 50, 0 m. L larutan 0, 10 M asam lemah, HB dengan Ka = 1, 0 x 10 -5, dititrasi dengan Na. OH 0, 10 M. Hitung p. H pada awal titrasi dan setelah penambahan 10, 0; 50, 0; dan 60, 0 m. L titran. p. H awal. Karena HB terurai dengan lemah, menghasilkan satu B- dan satu H 3 O+, HB + H 2 O H 3 O + + B Kita berasumsi bahwa (H 3 O+) ≈ (B-) dan (HB) = 0, 10 – (H 3 O+) ≈ 0, 10 Dengan mensubstitusikan nilai ini kedalam persamaan Ka, didapatkan (H 3 O+)(B-)/(HB) = Ka ------ (H 3 O+)2/0, 10 = 1, 0 x 10 -5 (H 3 O+) = 1, 0 x 10 -3 -------- p. H = 3, 00 p. H setelah penambahan 10, 0 m. L basa. Kita mulai dengan 50, 0 m. L x 0, 10 mmol/m. L = 5, 0 mmol HB dan kemudian menambahkan 10, 0 m. L x 0, 10 mmol/m. L = 1, 0 mmol OH-. Reaksi yang terjadi : Lecture note by D. Tisnadjaja 17

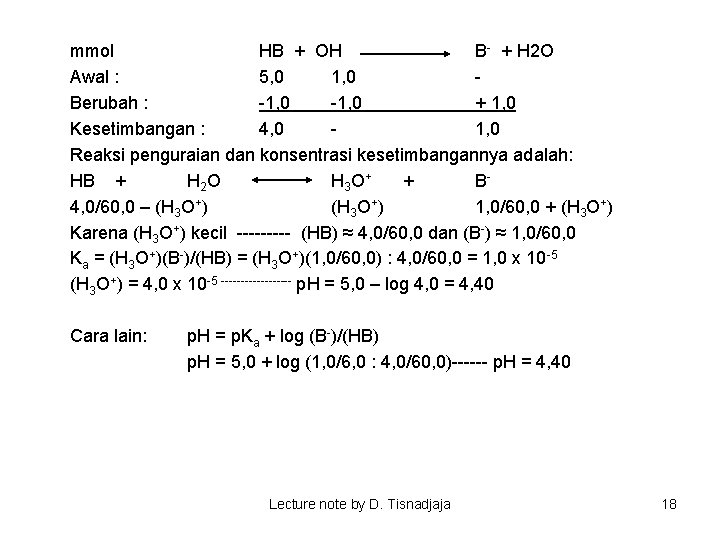
mmol HB + OH B- + H 2 O Awal : 5, 0 1, 0 Berubah : -1, 0 + 1, 0 Kesetimbangan : 4, 0 1, 0 Reaksi penguraian dan konsentrasi kesetimbangannya adalah: HB + H 2 O H 3 O + + B 4, 0/60, 0 – (H 3 O+) 1, 0/60, 0 + (H 3 O+) Karena (H 3 O+) kecil ----- (HB) ≈ 4, 0/60, 0 dan (B-) ≈ 1, 0/60, 0 Ka = (H 3 O+)(B-)/(HB) = (H 3 O+)(1, 0/60, 0) : 4, 0/60, 0 = 1, 0 x 10 -5 (H 3 O+) = 4, 0 x 10 -5 --------- p. H = 5, 0 – log 4, 0 = 4, 40 Cara lain: p. H = p. Ka + log (B-)/(HB) p. H = 5, 0 + log (1, 0/6, 0 : 4, 0/60, 0)------ p. H = 4, 40 Lecture note by D. Tisnadjaja 18

(c) p. H pada titik ekivalen. Kita mulai dengan 5, 0 mmol HB dan menambahkan 50, 0 m. L x 0, 10 mmol/m. L = 5, 0 mmol OH-. Reaksi yang terjadi : mmol HB + OHB- + H 2 O Awal : 5, 0 Berubah : -5, 0 + 5, 0 Kesetimbangan : 5, 0 B- adalah basa. Reaksi penguraian dan konsentrasi kesetimbangannya adalah: B- + H 2 O HB + OH 5, 0/100 – (OH-) (HB) (OH-) Persamaan untuk Kb : (HB)(OH-)/(B-) = Kb = Kw/Ka = 1, 0 x 10 -14/1, 0 x 10 -5 = 1, 0 x 10 -9 Karena B- adalah basa lemah, kita berasumsi bahwa (OH-) kecil (B-) = 5, 0/100 – (OH-) ≈ 0, 05 Karena penguraian menghasilkan satu HB dan satu OH- kita asumsikan : (HB) ≈ (OH-), maka (OH-)2/0, 05 = 1, 0 x 10 -9; (OH-) = 7, 1 x 10 -6 p. OH = 5, 15; dan p. H = 8, 85 Lecture note by D. Tisnadjaja 19

(d) p. H setelah penambahan 60, 0 m. L basa. Kita mulai dengan 5, 0 m. L HB dan menambahkan 60 m. L x 0, 1 mmol/m. L = 6, 0 mmol OH-. Reaksi yang terjadi : mmol HB + OHB- + H 2 O Awal : 5, 0 6, 0 Berubah : -5, 0 +5, 0 Kesetimbangan : 1, 0 5, 0 Ini berarti terdapat 1 mmol kelebihan OH- dan juga sedikit OH- yang dihasilkan oleh basa B- (kebalikan dari reaksi di atas) B- + H 2 O HB + OHNamun reaksi ini dapat diabaikan karena OH- menggeser kesetimbangan kekiri. Sehingga : (OH-) = 1, 0 mmol/110 m. L = 9, 1 x 10 -3 mmol/m. L p. OH = 2, 04 dan p. H = 11, 96 Lecture note by D. Tisnadjaja 20
 Metode titrimetri
Metode titrimetri Contoh metode semi average ganjil
Contoh metode semi average ganjil Analisis cross section
Analisis cross section Analisis yang mempertajam analisis rasio dengan memisahkan
Analisis yang mempertajam analisis rasio dengan memisahkan Metode lagrange
Metode lagrange Tabel liso
Tabel liso Perhitungan perawat menurut depkes 2005
Perhitungan perawat menurut depkes 2005 Www.ptsi.co.id
Www.ptsi.co.id Penentuan kadar glukosa dalam urine secara titrimetri
Penentuan kadar glukosa dalam urine secara titrimetri Contoh titrasi redoks
Contoh titrasi redoks Titrimetri
Titrimetri Data yang digunakan untuk operasi perhitungan adalah
Data yang digunakan untuk operasi perhitungan adalah Contoh analisis beban kerja guru
Contoh analisis beban kerja guru Kadar pusing ganti inventori maksud
Kadar pusing ganti inventori maksud Bab 10 analisis risiko: analisis rasio
Bab 10 analisis risiko: analisis rasio Pohon masalah adalah
Pohon masalah adalah Metode root cause analysis
Metode root cause analysis Gravimetri
Gravimetri Metode gravimetri adalah
Metode gravimetri adalah Prinsip analisis lemak metode soxhlet
Prinsip analisis lemak metode soxhlet Contoh root cause analysis 5 why
Contoh root cause analysis 5 why







































