VOLUMETRIJSKE TITRIMETRIJSKE METODE ANALIZE Zasnovane na merenju zapremine















- Slides: 29

VOLUMETRIJSKE (TITRIMETRIJSKE) METODE ANALIZE • • Zasnovane na merenju zapremine reagensa tačno poznate koncentracija koja je hemijski ekvivalentna sa analiziranom supstancom TITRACIJA (gore opisani postupak) -titrant (titrator)-dodavani reagens -titrand-titrovana supstanca Prednosti u donosu na gravimetrijske metode -brze (mnogo brže od gravimetrijskih) -isto toliko tačne -ne zahtevaju komplikovanu opremu -jednostavne za izvođenje -mogućnost određivanja velikog broja raznih supstanci

PODELA VOLUMETRIJSKIH METODA ANALIZE -prema vrsti hemijske reakcije na kojoj su zasnovane 1. 2. 3. 4. Metode zasnovane na kiselinsko-baznim reakcijama Metode zasnovane na reakcijama taloženja Metode zasnovane na redoks-reakcijama Metode zasnovane na rekacijama građenja kompleksa USLOVI DA BI HEMIJSKA REAKCIJA BILA PRIMENJENA U VOLUMETRIJI 1. 2. 3. 4. Reakcija mora biti kvantitativna Reakcija mora biti brza, praktično trenutna Reakcija mora imati tačno definisan stehiometrijski tok Mora postojati mogućnost određivanja ekvivalentne tačke titracije EKVIVALENTANA TAČKA ZAVRŠNA TAČKA

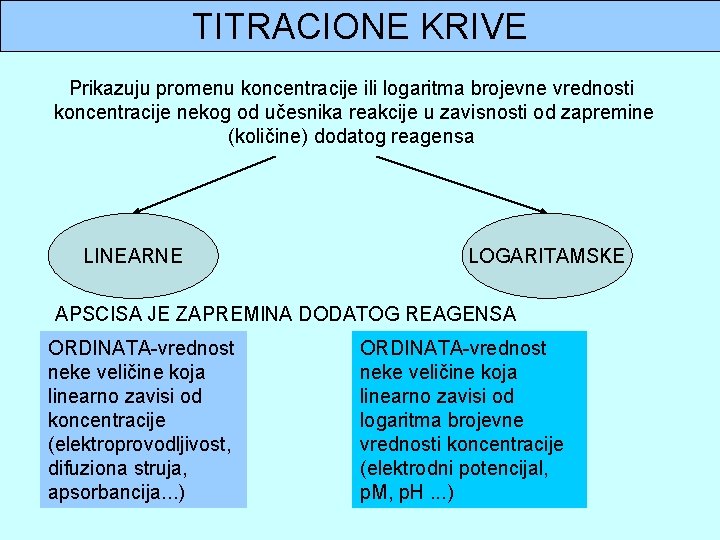
TITRACIONE KRIVE Prikazuju promenu koncentracije ili logaritma brojevne vrednosti koncentracije nekog od učesnika reakcije u zavisnosti od zapremine (količine) dodatog reagensa LINEARNE LOGARITAMSKE APSCISA JE ZAPREMINA DODATOG REAGENSA ORDINATA-vrednost neke veličine koja linearno zavisi od koncentracije (elektroprovodljivost, difuziona struja, apsorbancija. . . ) ORDINATA-vrednost neke veličine koja linearno zavisi od logaritma brojevne vrednosti koncentracije (elektrodni potencijal, p. M, p. H. . . )

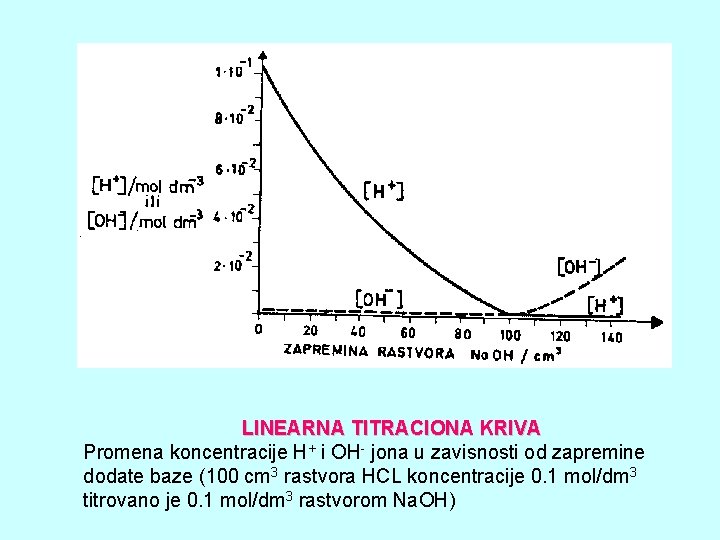
LINEARNA TITRACIONA KRIVA Promena koncentracije H+ i OH- jona u zavisnosti od zapremine dodate baze (100 cm 3 rastvora HCL koncentracije 0. 1 mol/dm 3 titrovano je 0. 1 mol/dm 3 rastvorom Na. OH)

KARAKTERISITIKE LINEARNIH TITRACIONIH KRIVIH • Do ekvivalentne tačke imaju jedan smer, a posle nje drugi, tako da se završna tačka titracije nalazi u preseku ova dva pravca različitih nagiba • Metode analize kod kojih se dobijaju linearne titracione krive ne moraju biti strogo kvantitativne (tada se završna tačka titracije dobija u preseku produženih linearnih delova različitih grana titracione krive) • Razblaživanje za vreme titracije (mora se vršiti korekcija, inače dolazi do iskrivljavanja teorijski linearnih delova krive)

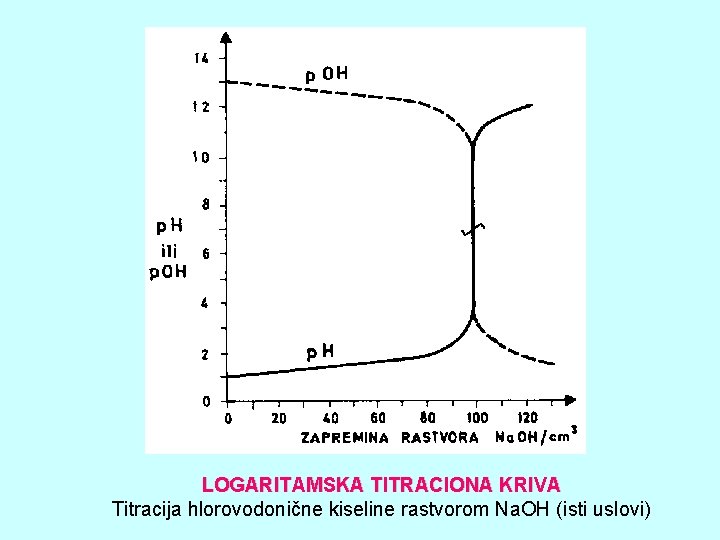
LOGARITAMSKA TITRACIONA KRIVA Titracija hlorovodonične kiseline rastvorom Na. OH (isti uslovi)

KARAKTERISTIKE LOGARITAMSKIH TITRACIONIH KRIVIH • Merena veličina se u ekvivalentnoj tački naglo menja, dok je njena promena pre i posle ekvivalentne tačke relativno mala • Što je reakcija kvantitativnija, skok merene veličine u ekvivalentnoj tački je nagliji i veći, pa kod metoda kod kojih se dobijaju logaritamske titracione krive treba koristiti dovoljno kvantitativne reakcije • Razblaženje rastvora za vreme titracije ne utiče mnogo na oblik logaritamskih krivih, pa se može zanemariti

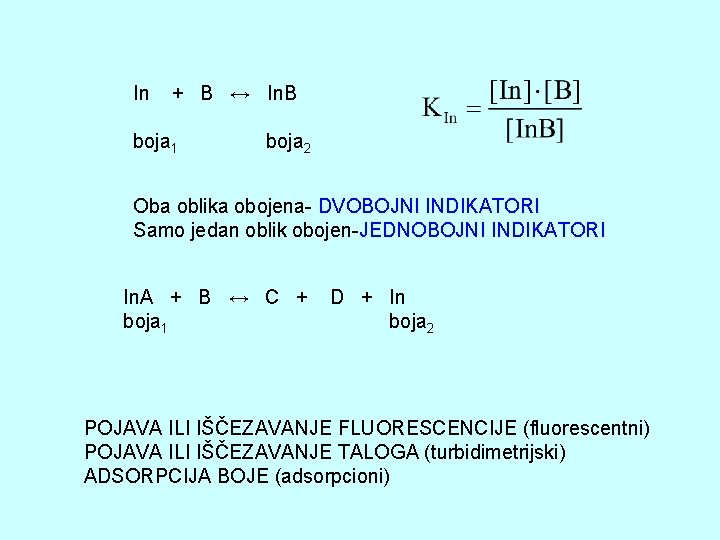
INDIKATORI U VOLUMETRIJSKOJ ANALIZI Završna tačka hemijske reakcije, predstavljene opštom jednačinom A + B → C + D In. A + B ↔ C + D + In -titrovana supstanca A nestaje In + B ↔ In. B -pojava viška slobodnog reagensa B VIZUELNO ODREĐIVANJE ZTT -samoindikacija -primena indikatora INDIKATORI-SUPSTANCE KOJE PROMENOM NEKE OSOBINE (BOJE) UKAZUJU NA ZAVRŠETAK TITRACIJE

In + B ↔ In. B boja 1 boja 2 Oba oblika obojena- DVOBOJNI INDIKATORI Samo jedan oblik obojen-JEDNOBOJNI INDIKATORI In. A + B ↔ C + boja 1 D + In boja 2 POJAVA ILI IŠČEZAVANJE FLUORESCENCIJE (fluorescentni) POJAVA ILI IŠČEZAVANJE TALOGA (turbidimetrijski) ADSORPCIJA BOJE (adsorpcioni)

USLOVI KOJE MORAJU ISPUNJAVATI INDIKATORI 1. Osetljivost –intenzivno obojene supstance u vrlo niskim koncentracijama (<100 μM) 2. Brzo uspostavljanje ravnoteže između dva oblika indikatora PODELA INDIKATORA -kiselinsko-bazni indikatori -redoks indikatori -metalo-indikatori -adsorpcioni indikatori

STANDARDNI RASTVORI U VOLUMETRIJI Rastvori reagenasa tačno poznate koncentracije Primarni standard Uslovi 1. Tačno određen hemijski sasatav i najviši stepen čistoće 2. Stabilnost (ne menja se pod uticajem atmosfere) 3. Da nije higroskopna, da ne isparava 4. Da se lako može nabaviti i da nije suviše skupa Način pripreme-tačno odmeravanje određene mase i rastvaranje u određenoj zapremini Sekundardni standard Uslovi-ne ispunjava neki od uslova za primarni standard Način pripreme-priprema se rastvor približno poznate koncentracije, a onda se tačna koncentracija određuje titracijom sa primarnim standardom (STANDARDIZACIJA)

TEHNIKE VOLUMETRIJSKIH (TITRIMETRIJSKIH) ODREĐIVANJA) DIREKTNA TITRACIJA-određivana susptanca se titruje direktno standardnim rastvorom reagensa u prisustvu pogodnog indikatora (majbolji način) POVRATNA TITRACIJA (RETITRACIJA)-ako reakcija ima malu brzinu, postoje sporedne reakcije, ne postoji pogodan indikator. . . (veća greška titracije) TITRACIJA ISTISKIVANJEM (SUPSTITUCIJOM)-titrovanjem proizvoda reakcije (veća greška titracije)


METODE ZASNOVANE NA KISELINSKO-BAZNIM REAKCIJAMA. METODE NEUTRALIZACIJE. ACIDIMETRIJA I ALKALIMETRIJA Zasnivaju se na reakcijama između kiselina i baza H 3 O+ + OH- H 2 O ACIDIMETRIJA – određivanje baza titracijom sa standardnim rastvorom kiselina (najčešće se koriste jake kiseline - HCl) ALKALIMETRIJA - određivanje kiselina titracijom sa standardnim rastvorom baza (najčešće se koriste jake baze – Na. OH, KOH) Mora postojati pogodan način za određivanje ETT

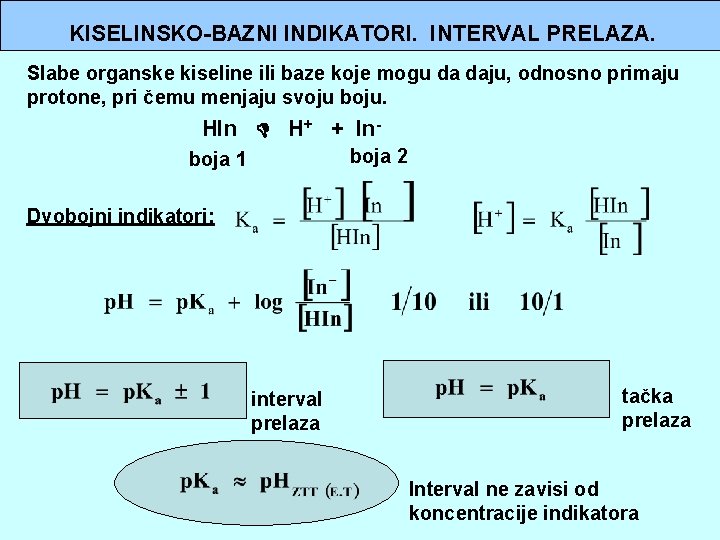
KISELINSKO-BAZNI INDIKATORI. INTERVAL PRELAZA. Slabe organske kiseline ili baze koje mogu da daju, odnosno primaju protone, pri čemu menjaju svoju boju. HIn H+ + Inboja 2 boja 1 Dvobojni indikatori: interval prelaza tačka prelaza Interval ne zavisi od koncentracije indikatora

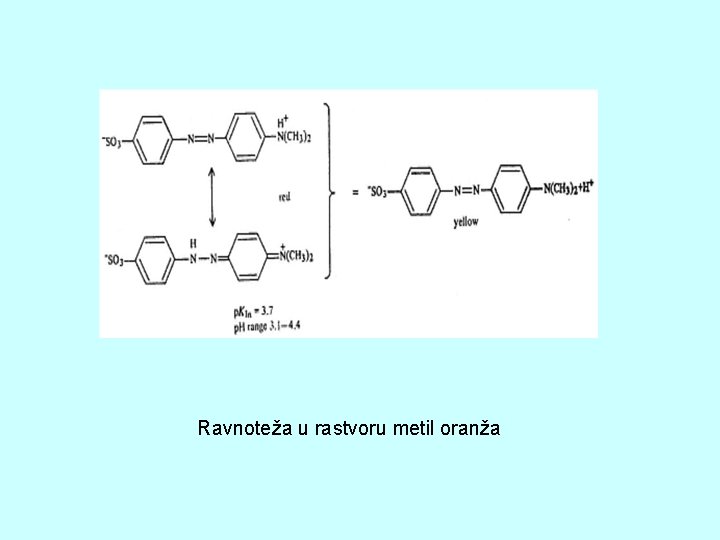
Ravnoteža u rastvoru metil oranža

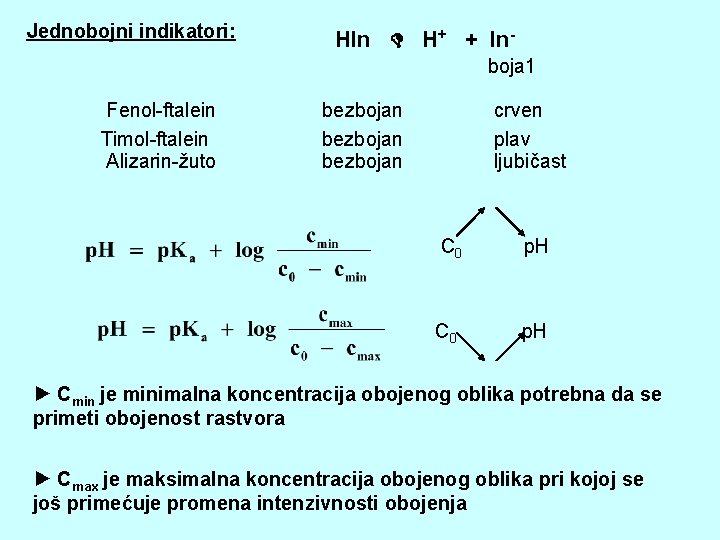
Jednobojni indikatori: HIn H+ + Inboja 1 Fenol-ftalein Timol-ftalein Alizarin-žuto bezbojan crven plav ljubičast C 0 p. H ► Cmin je minimalna koncentracija obojenog oblika potrebna da se primeti obojenost rastvora ► Cmax je maksimalna koncentracija obojenog oblika pri kojoj se još primećuje promena intenzivnosti obojenja

• Interval prelaza je interval p. H od prve pojave boje do njenog najvećeg intenziteta • Zavisi od ukupne koncentracije indikatora (Co)

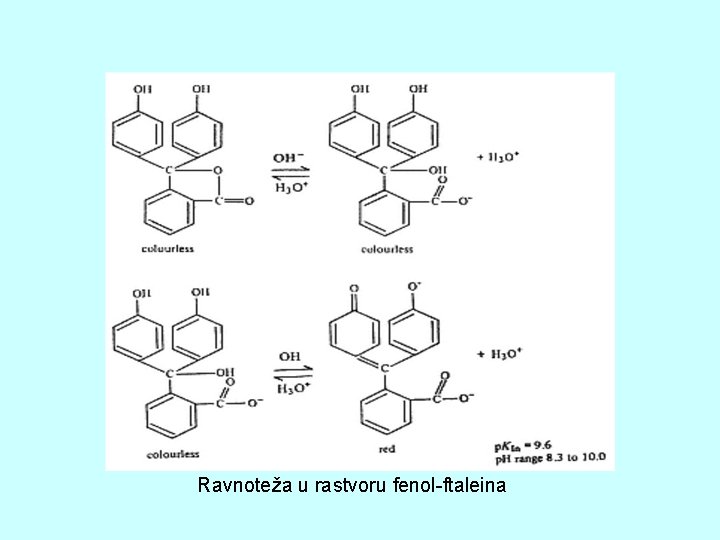
Ravnoteža u rastvoru fenol-ftaleina

Mešani indikatori: • Najjasniji prelaz boje indikatora se uočava kada dva indikatorska oblika imaju komplementarne boje, tako da se pri p. H = p. K a prekrivanjem dve komplementarne boje dobija neutralna siva boja • ZTT bi odgovarala prelazu jedne komplementarne boje u drugu preko neutralnog sivog (odnosno bezbojnog, ako je koncentracija indikatora niska) • Kod većine indikatora boje dva oblika indikatora nisu komplementarne, što se prevazilazi mešanjem indikatora

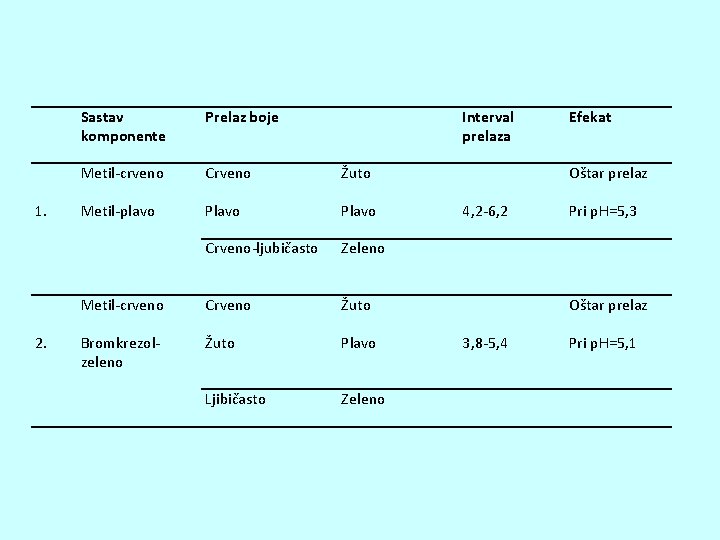
1. 2. Sastav komponente Prelaz boje Interval prelaza Metil-crveno Crveno Žuto Metil-plavo Plavo Crveno-ljubičasto Zeleno Metil-crveno Crveno Žuto Bromkrezolzeleno Žuto Plavo Ljibičasto Zeleno Efekat Oštar prelaz 4, 2 -6, 2 Pri p. H=5, 3 Oštar prelaz 3, 8 -5, 4 Pri p. H=5, 1

• ►Mešanjem više indikatora može se dobiti smeša koja će pokazivati niz promena boje preko širokog područja p. H. • ► Ovakve smeše se nazivaju UNIVERZALNIM INDIKATORIMA • ►Upotrebljavaju se za približno odreživanje p. H rastvora (0 -14), dok se u volumetrijskoj analizi ne koriste.

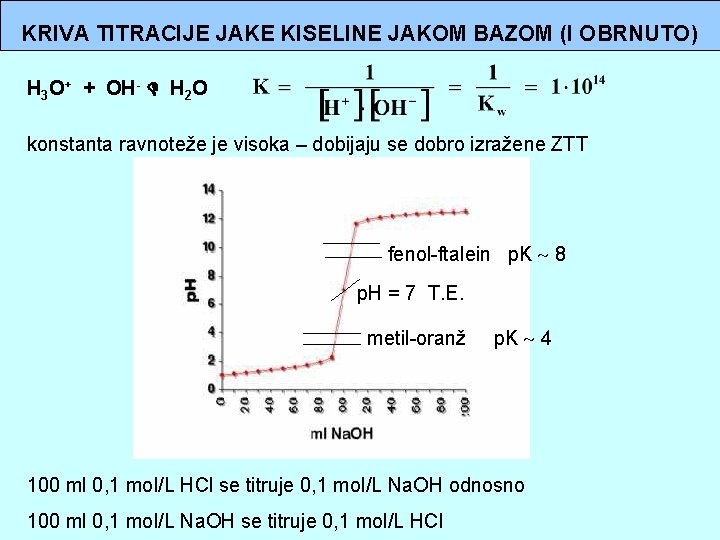
KRIVA TITRACIJE JAKE KISELINE JAKOM BAZOM (I OBRNUTO) H 3 O+ + OH- H 2 O konstanta ravnoteže je visoka – dobijaju se dobro izražene ZTT fenol-ftalein p. K 8 p. H = 7 T. E. metil-oranž p. K 4 100 ml 0, 1 mol/L HCl se titruje 0, 1 mol/L Na. OH odnosno 100 ml 0, 1 mol/L Na. OH se titruje 0, 1 mol/L HCl

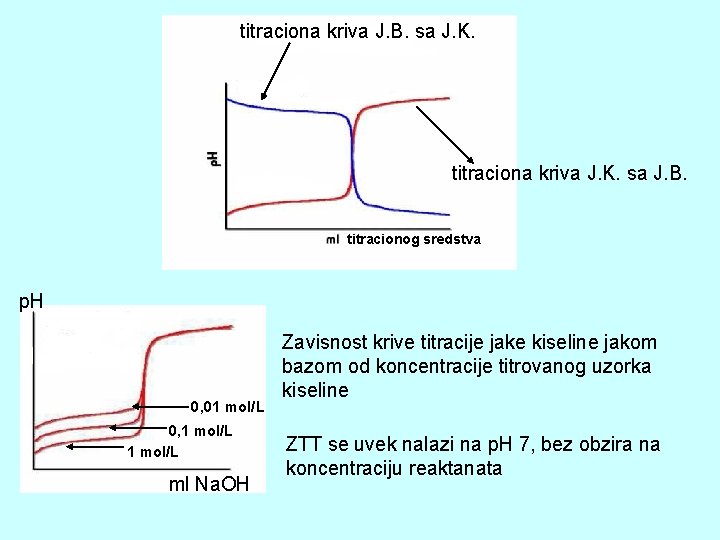
titraciona kriva J. B. sa J. K. titraciona kriva J. K. sa J. B. titracionog sredstva p. H 0, 01 mol/L 0, 1 mol/L ml Na. OH Zavisnost krive titracije jake kiseline jakom bazom od koncentracije titrovanog uzorka kiseline ZTT se uvek nalazi na p. H 7, bez obzira na koncentraciju reaktanata

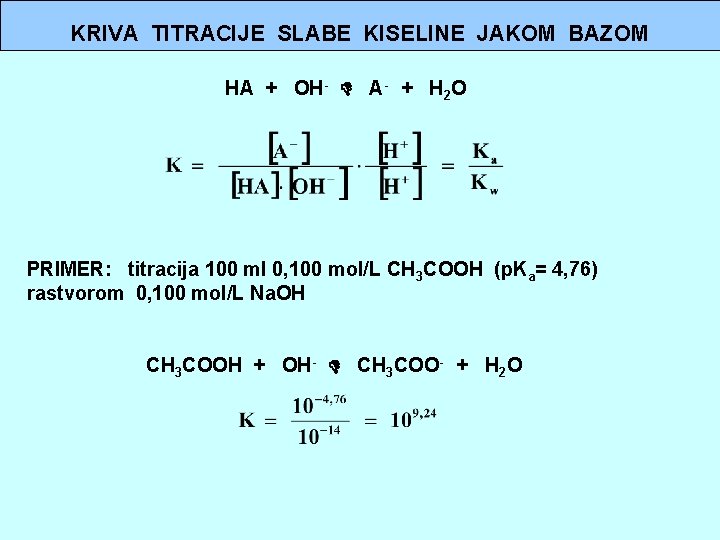
KRIVA TITRACIJE SLABE KISELINE JAKOM BAZOM HA + OH- A- + H 2 O PRIMER: titracija 100 ml 0, 100 mol/L CH 3 COOH (p. Ka= 4, 76) rastvorom 0, 100 mol/L Na. OH CH 3 COOH + OH- CH 3 COO- + H 2 O

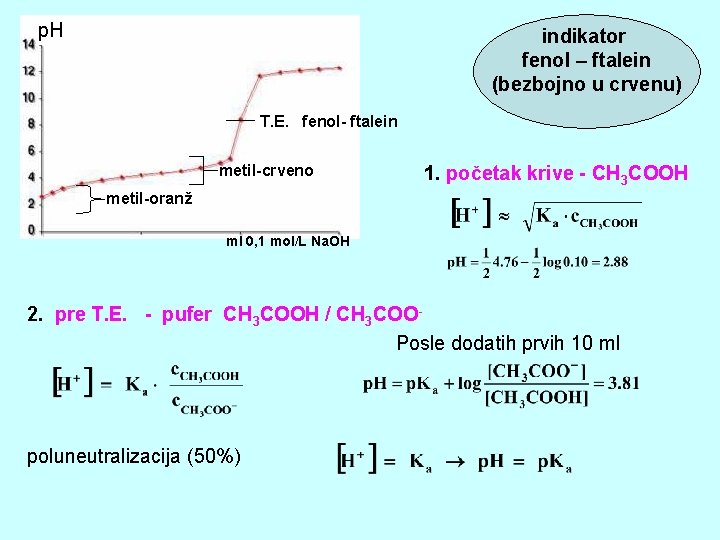
p. H indikator fenol – ftalein (bezbojno u crvenu) T. E. fenol- ftalein metil-crveno 1. početak krive - CH 3 COOH metil-oranž ml 0, 1 mol/L Na. OH 2. pre T. E. - pufer CH 3 COOH / CH 3 COOPosle dodatih prvih 10 ml poluneutralizacija (50%)

3. T. E. - so - CH 3 COO- (baza) 4. posle T. E. - jaka baza

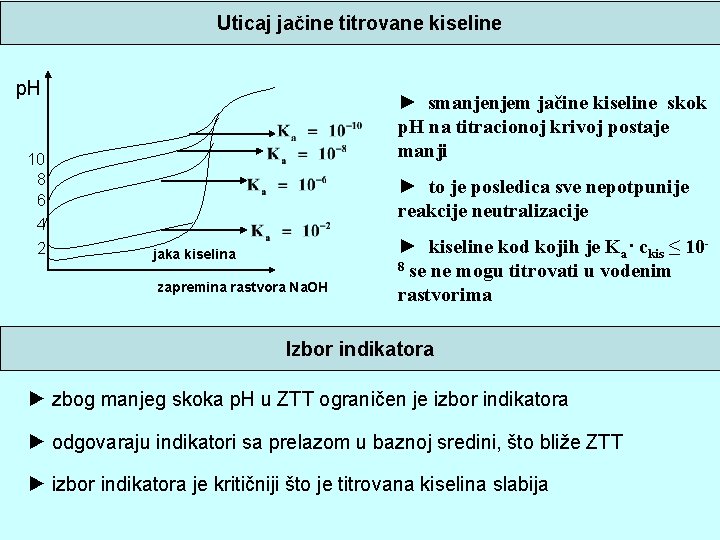
Uticaj jačine titrovane kiseline p. H 10 8 6 4 2 ► smanjenjem jačine kiseline skok p. H na titracionoj krivoj postaje manji ► to je posledica sve nepotpunije reakcije neutralizacije jaka kiselina zapremina rastvora Na. OH ► kiseline kod kojih je Ka· ckis ≤ 108 se ne mogu titrovati u vodenim rastvorima Izbor indikatora ► zbog manjeg skoka p. H u ZTT ograničen je izbor indikatora ► odgovaraju indikatori sa prelazom u baznoj sredini, što bliže ZTT ► izbor indikatora je kritičniji što je titrovana kiselina slabija

PRIPREMANJE STANDARDNIH RASTVORA -natrijum-karbonata -hlorovodonične kiseline -natrijum-hidroksida VEŽBE 1. Određivanje HCl 2. Određivanje H 2 SO 4
 Kvadar zapremina
Kvadar zapremina Analize statistice
Analize statistice Svid
Svid Maironis užtrauksme naują giesmę analizė
Maironis užtrauksme naują giesmę analizė Pavasario linksmybes analize
Pavasario linksmybes analize Dedes ir dedienes rysys su gamta
Dedes ir dedienes rysys su gamta Mano dienos nebūtin pasvirę
Mano dienos nebūtin pasvirę Ssgg
Ssgg Kavinukas su pastoralem
Kavinukas su pastoralem Campanii seo
Campanii seo Maironis mano moksladraugiams
Maironis mano moksladraugiams Viljamas šekspyras 66 sonetas
Viljamas šekspyras 66 sonetas Dainos gimimas radauskas
Dainos gimimas radauskas Ana karenina permbledhje
Ana karenina permbledhje Analiza e konkurences
Analiza e konkurences Judita vaiciunaite saulegraza
Judita vaiciunaite saulegraza Ant ezero keturiu kantonu
Ant ezero keturiu kantonu Poetams kitiems numylėta ranka
Poetams kitiems numylėta ranka Maironio trakų pilis
Maironio trakų pilis Salomeja neris seneles pasaka analize
Salomeja neris seneles pasaka analize Poterov model resavanja etickih dilema tokom analize
Poterov model resavanja etickih dilema tokom analize Thenie nga ndre mjeda
Thenie nga ndre mjeda Idpp4
Idpp4 Radviliada analize
Radviliada analize Bitė vilimaitė kada piešime perlinę vištelę
Bitė vilimaitė kada piešime perlinę vištelę Erčia kur gaivus vanduo analizė
Erčia kur gaivus vanduo analizė Analiza posla
Analiza posla Shkruaj nje ese argumentuese
Shkruaj nje ese argumentuese Metode harga pokok proses pengantar
Metode harga pokok proses pengantar Contoh analisis data berkala
Contoh analisis data berkala