KOMPLEKSI METODE ZASNOVANE NA REAKCIJAMA GRAENJA KOMPLEKSNIH JEDINJENJA

































- Slides: 47

KOMPLEKSI





METODE ZASNOVANE NA REAKCIJAMA GRAĐENJA KOMPLEKSNIH JEDINJENJA. KOMPLEKSOMETRIJSKE TITRACIJE - brzo, tačno i jednostavno određivanje gotovo svih metalnih jona - široka primena u volumetriji - najveći značaj je za određivanje tvrdoće vode - polidentatni ligandi grade helatne komplekse velike stabilnosti i stehiometrijskog sastava 1 : 1 M + L ML Veća stabilnost kompleksa znači kvantitativniju reakciju veću promenu p. M vrednosti u T. E. i veću tačnost određivanja. tj.

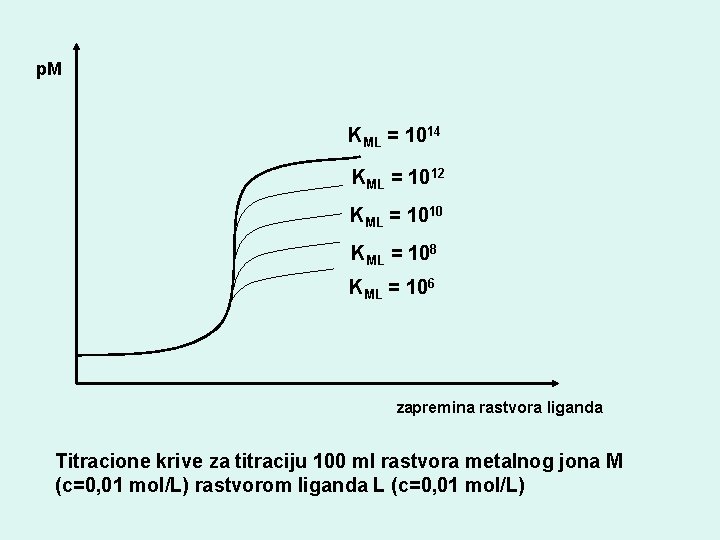
p. M KML = 1014 KML = 1012 KML = 1010 KML = 108 KML = 106 zapremina rastvora liganda Titracione krive za titraciju 100 ml rastvora metalnog jona M (c=0, 01 mol/L) rastvorom liganda L (c=0, 01 mol/L)

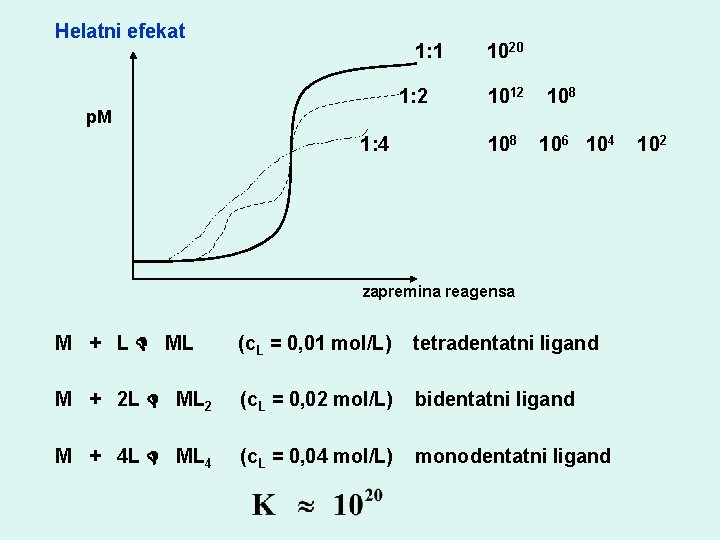
Helatni efekat 1: 1 1: 2 p. M 1: 4 1020 1012 108 106 104 zapremina reagensa M + L ML (c. L = 0, 01 mol/L) tetradentatni ligand M + 2 L ML 2 (c. L = 0, 02 mol/L) bidentatni ligand M + 4 L ML 4 (c. L = 0, 04 mol/L) monodentatni ligand 102


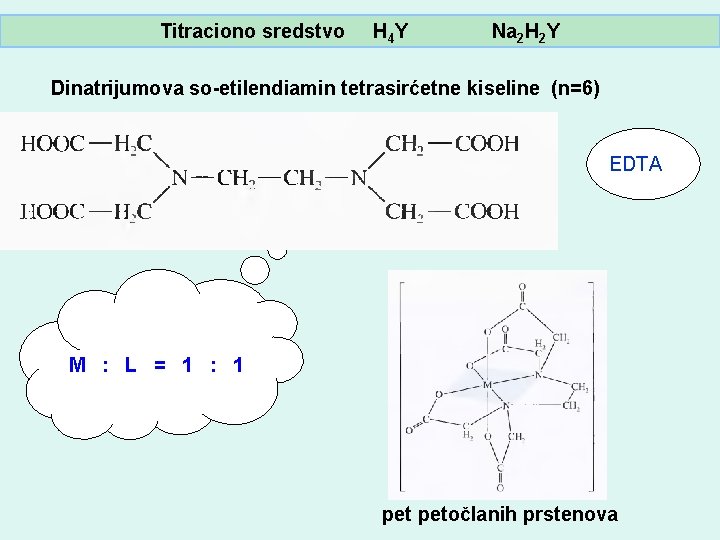
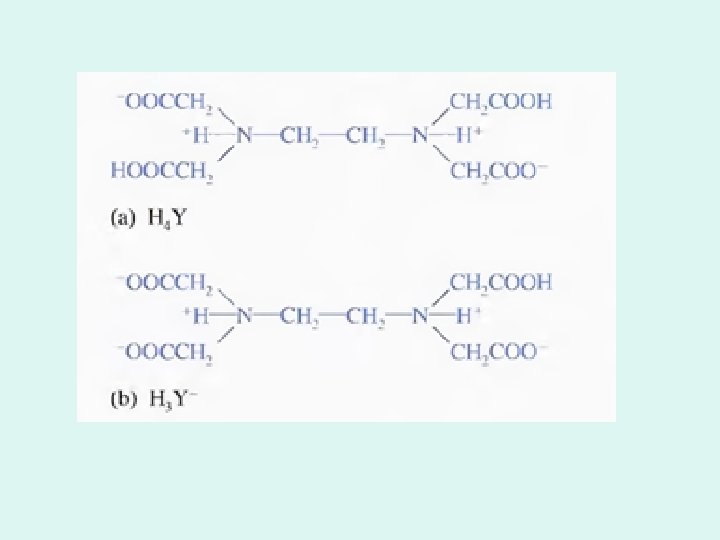
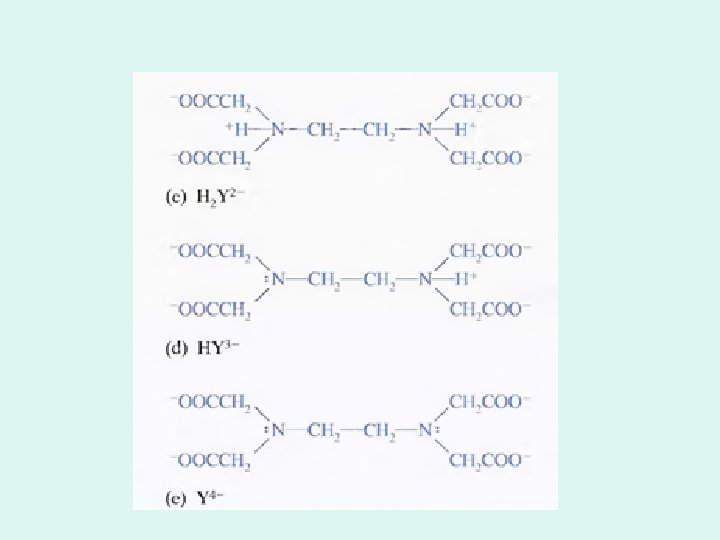
Titraciono sredstvo H 4 Y Na 2 H 2 Y Dinatrijumova so-etilendiamin tetrasirćetne kiseline (n=6) EDTA M : L = 1 : 1 petočlanih prstenova


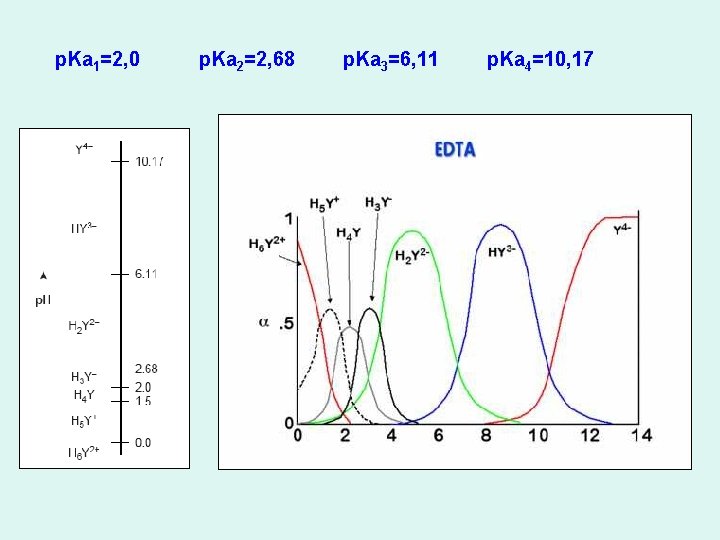
p. Ka 1=2, 0 p. Ka 2=2, 68 p. Ka 3=6, 11 p. Ka 4=10, 17







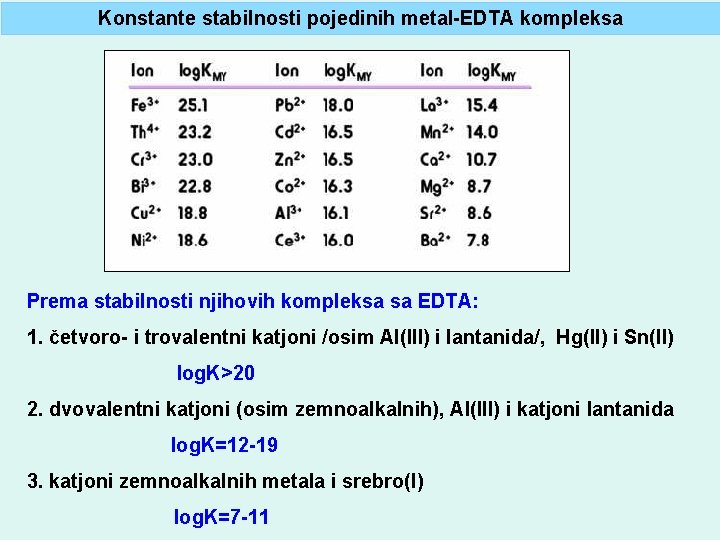
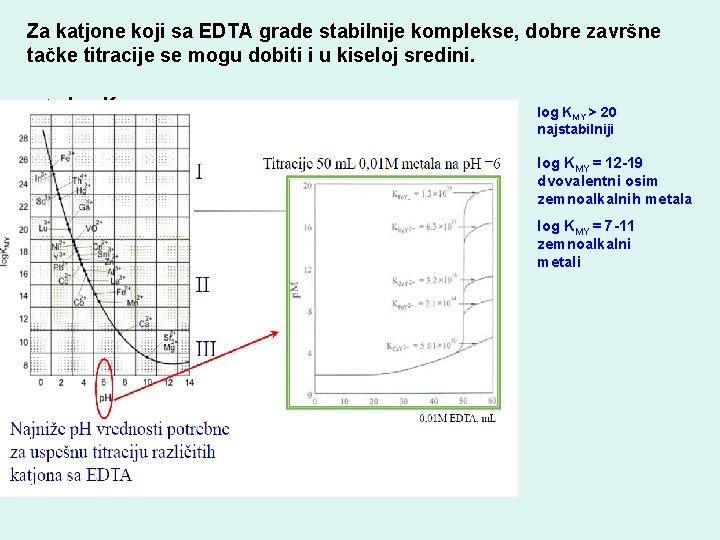
Konstante stabilnosti pojedinih metal-EDTA kompleksa Prema stabilnosti njihovih kompleksa sa EDTA: 1. četvoro- i trovalentni katjoni /osim Al(III) i lantanida/, Hg(II) i Sn(II) log. K>20 2. dvovalentni katjoni (osim zemnoalkalnih), Al(III) i katjoni lantanida log. K=12 -19 3. katjoni zemnoalkalnih metala i srebro(I) log. K=7 -11


TITRACIONE KRIVE Neophodno je uzeti u obzir uticaj SPOREDNIH REAKCIJA na ravnotežu građenja metal - EDTA kompleksa: - uticaj p. H - uticaj drugih kompleksirajućih supstanci Ovi uticaji se mogu izraziti USLOVNIM KONSTANTAMA STABILNOSTI: Ukupna koncentracija EDTA u svim njenim oblicima u rastvoru osim onog dela koji je vezan za metalni jon Ukupna koncentracija metalnog jona u svim njegovim oblicima u rastvoru izuzev onog dela koji je reagovao sa EDTA K` nije prava konstanta, jer opisuje stabilnost kompleksa samo pod određenim uslovima, ali se iz njihovih vrednosti može videti da li je posmatrana reakcija u DATIM uslovima moguća.

UTICAJ p. H - samo na Y (osim kad metal gradi hidrokso - komplekse) - u zavisnosti od p. H vrednosti rastvora EDTA se nalazi u određenom obliku (dijagram raspodele) udeo zavisi od p. H uspešno određivanje

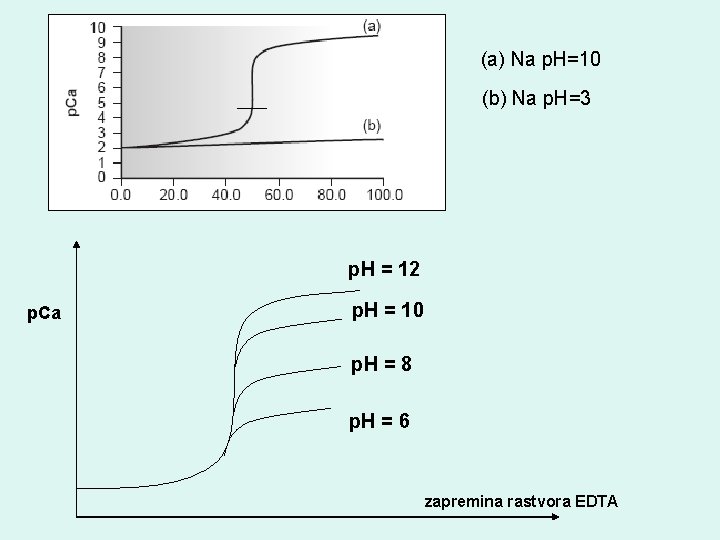
TITRACIJA Ca 2+ sa EDTA Titruje se 100, 00 ml rastvora Ca(II) c=0, 01 mol/l rastvorom EDTA c=0, 01 mol/L u rastvoru čije je p. H=10; Ks = 5, 01· 1010 ; Y = 0, 35 !!! prvo se izračunava uslovna konstanta stabilnosti (za date uslove) !!! 1. Na početku titracije 2. Do E. T. u rastvoru su samo joni Ca 2+ u rastvoru su neistitrovani joni Ca 2+ i kompleks Ca. Y 2 - VEDTA = 50, 00 ml

3. E. T. u rastvoru je samo kompleks Ca. Y 2 - VEDTA = 100, 00 ml 4. posle E. T. u rastvoru je kompleks Ca. Y 2 - i višak EDTA VEDTA = 100, 10 ml

(a) Na p. H=10 (b) Na p. H=3 p. H = 12 p. Ca p. H = 10 p. H = 8 p. H = 6 zapremina rastvora EDTA

Za katjone koji sa EDTA grade stabilnije komplekse, dobre završne tačke titracije se mogu dobiti i u kiseloj sredini. log KMY > 20 najstabilniji Fe(III) ○ In(III) log KMY = 12 -19 dvovalentni osim zemnoalkalnih metala ○ ○Th(IV) ○ Hg(II) log KMY = 7 -11 zemnoalkalni metali ○Ga(III) Ni(II)○ Pb(II)○○ Cu(II) ○ Zn(II)○○Cd(II) ○ Al(III)○Co(III) ○ La(III)○ ○ Fe(II) ○ Ca(II) Mn(II) ○ Sr(II) ○ Mg(II) p. H

UTICAJ DRUGIH KOMPLEKSIRAJUĆIH SUPSTANCI NA TITRACIJE SA EDTA Uticaj pomoćnog kompleksirajućeg sredstva (održava titrovani jon u rastvornom obliku; pufer) tretira se na isti način kao i uticaj p. H. Kvantitativnost reakcije, kao i kvalitet završne tačke titracije zavisi ne samo od p. H rastvora nego i od vrste pomoćnog liganda i njegove koncentracije. U sporednoj reakciji sa pomoćnim kompleksirajućim sredstvom učestvuje metalni jon, tako da se računa udeo slobodnog metalnog jona: Uslovna konstanta stabilnosti izražava uticaj kiselosti i uticaj drugih kompleksirajućih sredstava na ravnoteže reakcija metalnih jona sa EDTA

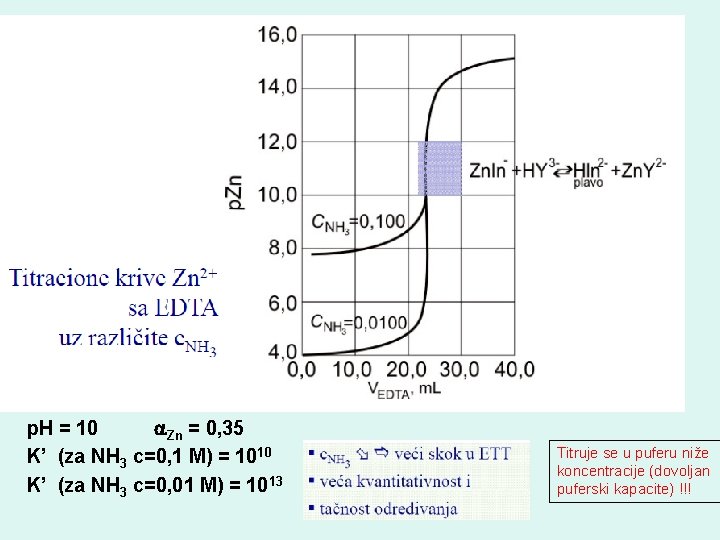
TITRACIJA Zn 2+ sa EDTA Titruje se 100, 00 ml rastvora Zn(II) c=0, 01 mol/l rastvorom EDTA c=0, 01 mol/L u amonijačnom puferskom rastvoru čije je p. H=9 u kome je koncentracija slobodnog amonijaka 0, 1 mol/l; Ks = 1016, 5 ; Y = 10 -1, 3; M = 7, 94· 10 -6 !!! prvo se izračunava uslovna konstanta stabilnosti (za date uslove) !!! 1. Na početku titracije u rastvoru su samo joni Zn 2+ Reaguje sa amonijakom gradeći komplekse, različitog sastava !!! Koncentracija slobodnih jona Zn 2+:

2. Do E. T. u rastvoru su neistitrovani joni Zn 2+ i kompleks Zn. Y 2 - U obliku slobodnih jona i u obliku različitih kompleksa sa amonijakom Možemo zanemariti neznatnu količinu Zn(II) koja nastaje disocijacijom kompleksa Zn. Y 2 VEDTA = 99, 00 ml 3. E. T. u rastvoru je samo kompleks Zn. Y 2 - VEDTA = 100, 00 ml

3. Posle E. T. u rastvoru je kompleks Zn. Y 2 - i višak EDTA VEDTA = 101, 00 ml

V (EDTA) p. H = 10 Zn = 0, 35 K’ (za NH 3 c=0, 1 M) = 1010 K’ (za NH 3 c=0, 01 M) = 1013 Titruje se u puferu niže koncentracije (dovoljan puferski kapacite) !!!


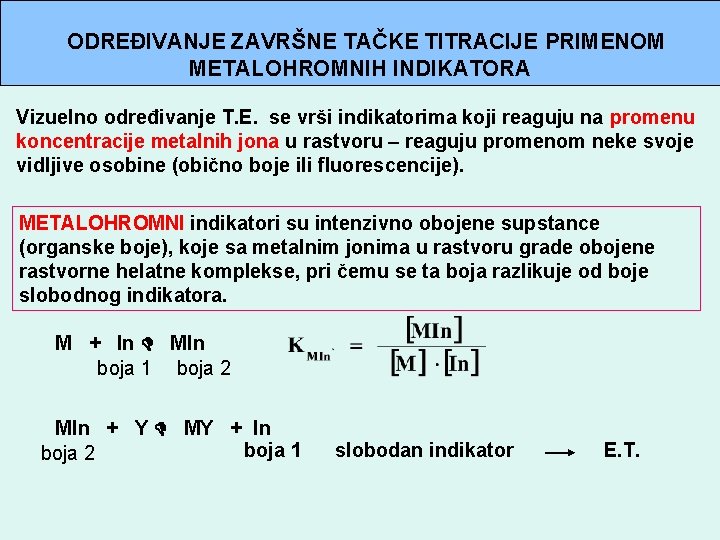
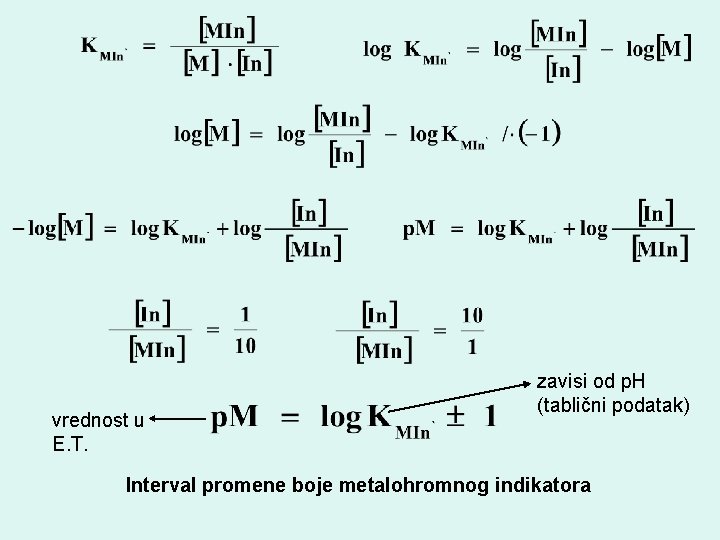
ODREĐIVANJE ZAVRŠNE TAČKE TITRACIJE PRIMENOM METALOHROMNIH INDIKATORA Vizuelno određivanje T. E. se vrši indikatorima koji reaguju na promenu koncentracije metalnih jona u rastvoru – reaguju promenom neke svoje vidljive osobine (obično boje ili fluorescencije). METALOHROMNI indikatori su intenzivno obojene supstance (organske boje), koje sa metalnim jonima u rastvoru grade obojene rastvorne helatne komplekse, pri čemu se ta boja razlikuje od boje slobodnog indikatora. M + In MIn boja 1 boja 2 MIn + Y MY + In boja 1 boja 2 slobodan indikator E. T.

vrednost u E. T. zavisi od p. H (tablični podatak) Interval promene boje metalohromnog indikatora

Uslovi koje mora da ispunjava svaki metalohromni indikator: • inače EDTA ne bi mogla da reaguje sa metalom iz kompleksa MIn (indikator bi bio ‚‚blokiran”) • inače bi E. T. bila preuranjena i razvučena • koncentracija indikatora ne sme biti suviše mala c < 0, 01·c. M • indikatorska reakcija mora biti brza i reverzibilna

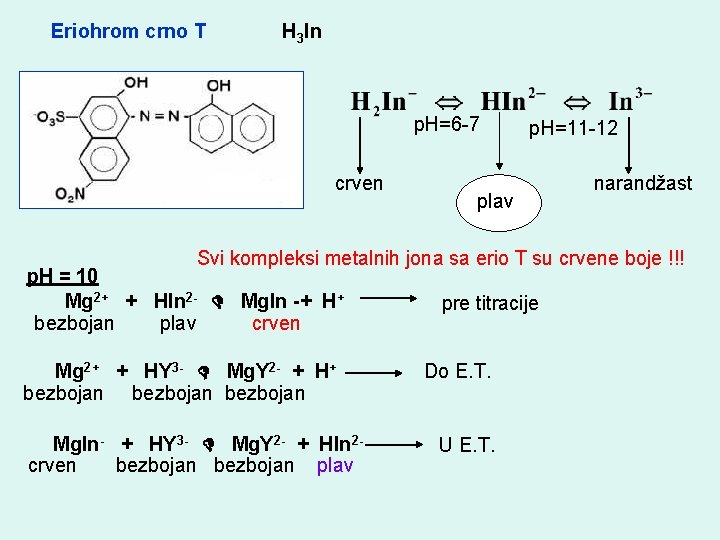
Eriohrom crno T H 3 In p. H=6 -7 crven p. H=11 -12 plav narandžast Svi kompleksi metalnih jona sa erio T su crvene boje !!! p. H = 10 Mg 2+ + HIn 2 - Mg. In -+ H+ bezbojan plav crven Mg 2+ + HY 3 - Mg. Y 2 - + H+ bezbojan Mg. In- + HY 3 - Mg. Y 2 - + HIn 2 crven bezbojan plav pre titracije Do E. T. U E. T.

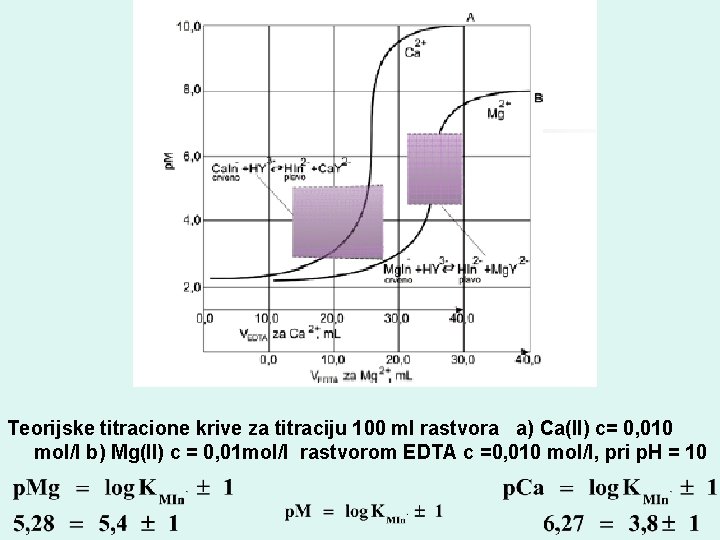
Teorijske titracione krive za titraciju 100 ml rastvora a) Ca(II) c= 0, 010 mol/l b) Mg(II) c = 0, 01 mol/l rastvorom EDTA c =0, 010 mol/l, pri p. H = 10

TEHNIKE KOMPLEKSOMETRIJSKIH TITRACIJA 1. Direktna titracija metalni jon se direktno titruje standardnim rastvorom EDTA uz primenu odgovarajućeg indikatora (najbrža i najtačnija) 2. Povratna titracija (retitracija) rastvoru metalnog jona se dodaje tačno poznata zapremina standardnog rastvora EDTA u količini većoj nego što je potrebno, a zatim se višak EDTA retitruje uz standardnim rastvorom nekog drugog metalnog jona (najčešće Mg(II), Zn(II) ili Cu(II)) uz pogodan indikator * stabilnost EDTA kompleksa sa metalnim jonom koji se određuje mora biti veća od konstante stabilnosti kompleksa sa metalnim jonom standardnog rastvora kojim se vrši retitracija ** koristi se kada: određivani metalni joni veoma sporo reaguju sa EDTA; za direktnu titraciju ne postoji pogodan indikator; metalni jon se teško održava u rastvoru u uslovima totracije

3. Titracija supstitucijom rastvoru metalnog jona se dodaje višak, najčešće Mg. Y 2 - kompleksa koji je manje stabilan, pri čemu dolazi do reakcije zamene ili istiskivanja Ca 2+ + Mg. Y 2 - Ca. Y 2 - + Mg 2+ titruje se oslobođeni Mg(II) SELEKTIVNOST KOMPLEKSOMETRIJSKIH TITRACIJA EDTA gradi komplekse sa većinom metalnih jona – nije selektivan reagens !!!! Selektivnost titracija se poboljšava: - kontrolisanjem kiselosti - maskiranjem i demaskiranjem - hemijskim odvajanjima

Kontrolisanje kiselosti ► zasniva se na zavisnosti uslovnih konstanti stabilnosti metal- EDTA kompleksa od kiselosti ► npr. Al(III), Cd(II), Co(II), Cu(II), Ni(II), Mn(II), Pb(II) i Zn(II) se mogu selektivno titrovati u prisustvu zemnoalkalnih katjona pri p. H 5 ► npr. pri p. H 1 -2 se mogu selektivno titrovati neki tro- i četvorovaletni katjoni u prisustvu dvovalentnih katjona teških metala Maskiranje i demaskiranje ► MASKIRANJE KOMPLEKSIRANJEM - metalni joni koji smetaju se vezuju u stabilne i rastvorne komplekse, stabilnije od njihovih kompleksa sa EDTA i indikatorom ► cijanid, tartarat, fluorid, trietanolamin, formaldehid. . ► u alkalnoj sredini cijanid maskira Ag+, Cd 2+, Co 2+, Cu 2+, Fe 2+, Hg 2+, Ni 2+, Pd 2+, Pt 2+, Zn 2+, Au 3+ katjoni zemnoalkalnih metala, kao i Mn 2+, Pb 2+, Al 3+, Bi 3+ sa cijanidom praktično ne reaguju

► iz cijanidnih kompleksa Zn 2+ i Cd 2+ se mogu selektivno demaskirati pomoću formaldehida (uz građenje nitrila glikolne kiseline) Zn(CN)42 - + 4 HCHO + 4 H 2 O Zn 2+ + 4 HO-CH 2 -CN + 4 OH► MASKIRANJE TALOŽENJEM - retko se primenjuje, zbog greški usled koprecipitacije i određivanja ZTT ► npr. titracija Ca 2+ u prisustvu Mg 2+ ► MASKIRANJE OKSIDOREDUKCIJOM - retko se primenjuje, jon se prevodi u oksidaciono stanje u kome ne reaguje sa EDTA Hemijska odvajanja ► odvajanje, jona koji ometaju, raznim tehnikama: ekstrakcija, jonoizmenjivačka hromatografija. .

PRIMENA KOMPLEKSOMETRIJSKIH TITRACIJA • brzo i tačno se određuje veliki broj metalnih jona • koriste se prilikom analize voda (određivanje tvrdoće), ali i pri analizi ruda. legura, cementa, keramičkih materijala. . • zbog male selektivnosti reagensa analiza kompleksnih uzoraka zahteva strigi kontrolisane uslove određivanja - kontrolisanje kiselosti sredine - primena maskirajućih i demaskirajućih reagenasa - prethodna razdvajanja EDTA -dinatrijumova so Na 2 H 2 Y· 2 H 2 O se suši, pravi rastvor i standardizuje standardnim rastvorom metalnog jona - čuva se u polietilenskim bocama (katjoni iz stakla mogu regovati)

ODREĐIVANJE Ca(II) i Mg(II) U VODI. ODREĐIVANJE TVRDOĆE VODE Tvrdoća vode – karakteristika vode ♦ razlikujemo kalcijumovu i magnezijumovu tvrdoću vode, zavisno od koncentracije soli kalcijuma, odnosno magnezijuma ♦ ukupna koncentracija ovih soli izražava se UKUPNOM TVRDOĆOM ♦ ukupna tvrdoća se deli na karbonatnu (odgovara koncentraciji hidrogenkarbonatnih soli Ca(II) i Mg(II)) i nekarbonatnu tvrdoću (odgovara koncentraciji Ca(II) i Mg(II) soli jakih kiselina) ♦ kuvanjem vode dolazi do izdvajanja CO 2 i taloga – hidrogenkarbonati prelaze u nerastvorne karbonate- pa se tvrdoća vode smanjuje; uklanja se karbonatna tvrdoća koja se zbog toga naziva i prolazna tvrdoća vode ♦ tvrdoća vode koja ostaje i posle kuvanja je permanentna tvrdoća

♦ ako se tvrdoća izrazi sadržajem Ca. CO 3: do 200 mg/L – meka voda 200 -400 mg/L – srednje tvrda 400 -600 mg/L – tvrda preko 600 mg/L – vrlo tvrda ♦ voda za piće dobrog kvaliteta sadrži Ca. CO 3 250 -350 mg/L ♦ velika količina magnezijuma – gorak ukus ♦ u tehničkom pogledu: tvrde vode u tehnološkim pogonima dovode do izdvajanja kamenca, troše mnogo sapuna, pogoršavaju kvalitet tkanina. . ♦ tvrdoća vode se danas najbrže i najjednostavnije određuje titracijama sa EDTA ♦ nemački stepen- 10 mg/dm 3 Ca. O ili 7, 19 mg/dm 3 Mg. O

ODREĐIVANJE Ca(II) i Mg(II) U SMEŠI I titracija: određivanje ukupne koncentracije Ca(II) i Mg(II) p. H = 9; amonijačni pufer; indikator: eriohrom crno T pre titracije: Mg 2+ + H 2 In 2 - Mg. In- + H+ bezbojan Do E. T. plav crven Ca 2+ + HY 3 - Ca. Y 2 - + H+ Mg 2+ + HY 3 - Mg. Y 2 - + H+ u E. T. Mg. In- + HY 3 - Mg. Y 2 - + HIn 2 crven bezbojan plav


II titracija: određivanje koncentracije Ca(II) p. H = 10 -12; natrijum-hidroksid; indikator: mureksid **** vrši se maskiranje Mg(II) sa Na. OH - taloži se u obliku Mg(OH) 2 Mg 2+ + Na. OH Mg(OH)2 Ca 2+ + pre titracije: bezbojan In plav + Na+ Ca. In + H+ crven do T. E. Ca 2+ + HY 3 - Ca. Y 2 - + H+ na T. E. Ca. In + HY 3 - Ca. Y 2 crven + bezbojan In ljubičast
 Halogenovanje alkana
Halogenovanje alkana Kompleksna jedinjenja
Kompleksna jedinjenja Nomenklatura kompleksnih jedinjenja
Nomenklatura kompleksnih jedinjenja Standardna reakcijska entalpija
Standardna reakcijska entalpija Skup imaginarnih brojeva
Skup imaginarnih brojeva Kompleksna jedinjenja
Kompleksna jedinjenja Korjenovanje zadaci
Korjenovanje zadaci Imenovanje kompleksnih spojeva
Imenovanje kompleksnih spojeva Odipal donem
Odipal donem Orojen
Orojen Cümle tamamlama
Cümle tamamlama Ekg nauhan nopeus
Ekg nauhan nopeus Kain kompleksi
Kain kompleksi Sternoklavikular
Sternoklavikular Kolestrol sentezi
Kolestrol sentezi Mannoz bağlayan lektin yolu
Mannoz bağlayan lektin yolu Karyotik
Karyotik Ghon kompleksi
Ghon kompleksi Aktin miyozin kompleksi
Aktin miyozin kompleksi Gluten kompleksi nasıl oluşur
Gluten kompleksi nasıl oluşur Miyozin hafif zincir kinaz
Miyozin hafif zincir kinaz Sinaptik vezikül
Sinaptik vezikül Pirüvat dehidrogenaz enzim kompleksi
Pirüvat dehidrogenaz enzim kompleksi Dihromatni jon
Dihromatni jon Jedinjenja bora
Jedinjenja bora Položajna izomerija
Položajna izomerija Heterociklicna jedinjenja struktura
Heterociklicna jedinjenja struktura Kiselost karboksilnih kiselina
Kiselost karboksilnih kiselina Oksidi alkalnih metala
Oksidi alkalnih metala Karbonilna grupa
Karbonilna grupa Amonoliza
Amonoliza Svojstva kiselina
Svojstva kiselina Dihromatni jon
Dihromatni jon Plemeniti gasovi
Plemeniti gasovi Propanoil
Propanoil Neproteinska azotna jedinjenja
Neproteinska azotna jedinjenja Laboratorijsko dobijanje metana
Laboratorijsko dobijanje metana Binarna jedinjenja
Binarna jedinjenja Podela alkohola
Podela alkohola Heterociklicna jedinjenja
Heterociklicna jedinjenja Kompleksna jedinjenja primeri
Kompleksna jedinjenja primeri Metode tertutup metode numerik
Metode tertutup metode numerik Metode-metode survei konsumsi makanan
Metode-metode survei konsumsi makanan Metode-metode pengelolaan anggaran
Metode-metode pengelolaan anggaran Persamaan penelitian survei dan eksperimen
Persamaan penelitian survei dan eksperimen Tujuan pemeliharaan karyawan
Tujuan pemeliharaan karyawan Metode kotor dan metode bersih
Metode kotor dan metode bersih Metode bruto dan metode netto
Metode bruto dan metode netto