Perles PEARL cliniques pour le traitement mdical des


































- Slides: 79

Perles (PEARL) cliniques pour le traitement médical des fibromes utérins

Perles (PEARL) cliniques pour le traitement medical des fibromes utérins [Inscrire le nom du conférencier] [Inscrire les titres du conférencier]

Renseignements à divulguer faculté/présentateur • Faculté : • Relations d’intérêt commerciaux : – Subventions/support de recherche : – Bureau de conférencier/honoraires : – Frais de consultation : – Autre : Ce programme est commandité par Actavis Specialty Pharmaceuticals Co

Comité éditorial Sukhbir Sony Singh, MD, FRCSC Professeur agrégé Département d’obstétrique et de gynécologie Université d’Ottawa Directeur Centre de santé pour les femmes Shirley E. Greenberg L’Hôpital d’Ottawa, ON Philippe Laberge, MD, FRCSC Professeur titulaire Chef de service de gynécologie CHUL Directeur du programme de fellowship en endoscopie Département d'obstétrique-gynécologie Québec, QC Nicholas A. Leyland, MD, MHCM, FRCSC Professeur et président Département d’obstétrique et de gynécologie Faculté des sciences de la santé École de médecine Michael G. De. Groote Université Mc. Master Hamilton, ON Joshua Polsky, MD, FRCSC Professeur auxiliaire, École de médecine Schulich Université Western Chef d’obstétrique et de gynécologie Windsor Regional Hospital Windsor, ON George Vilos, MD, FRCSC Professeur d’obstétrique et de gynécologie Université de Western Ontario London, ON Catherine Allaire, MD, FRCSC Professeure de clinique Département d’obstétrique et de gynécologie de l’UBC Directrice médicale BC Women's Centre for Pelvic Pain and Endometriosis Vancouver, BC Liane Belland, MD, MSc, FRCSC Professeure adjointe de clinique Obstétrique et gynécologie Université de Calgary, AB Claude Fortin, MD, FRCSC Professeur agrégé Université Mc. Gill Montréal, QC

Objectifs d’apprentissage Examiner l’impact des fibromes utérins et les investigations nécessaires pour confirmer le diagnostic Évaluer les différentes options pour la prise en charge des fibromes utérins, incluant les interventions conservatrices, médicales et chirurgicales Introduire les modulateurs sélectifs des récepteurs de la progestérone (SPRM) et leur rôle dans le traitement des fibromes utérins Examiner les données cliniques relatives à l’utilisation de l’acétate d’ulipristal (UPA) dans le traitement des fibromes utérins

L’impact des fibromes

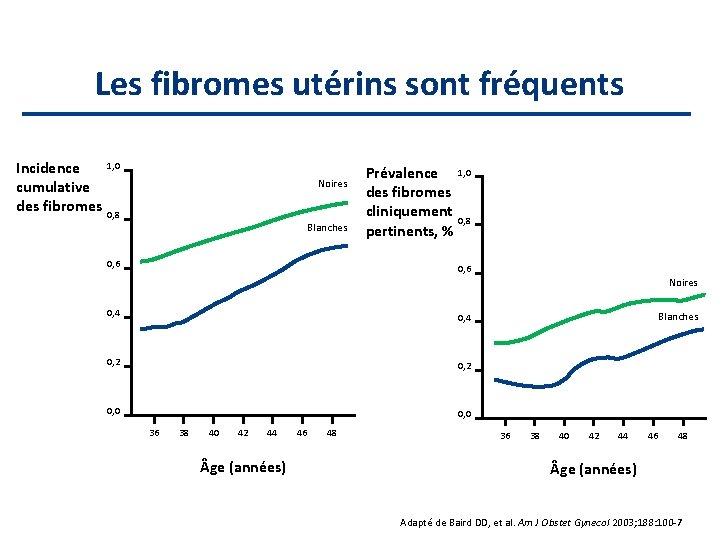
Les fibromes utérins sont fréquents Incidence cumulative des fibromes 1, 0 Noires 0, 8 Blanches 0, 6 Prévalence 1, 0 des fibromes cliniquement 0, 8 pertinents, % 0, 6 Noires 0, 4 0, 2 0, 0 36 38 40 42 44 ge (années) 46 48 Blanches 36 38 40 42 44 46 48 ge (années) Adapté de Baird DD, et al. Am J Obstet Gynecol 2003; 188: 100 -7

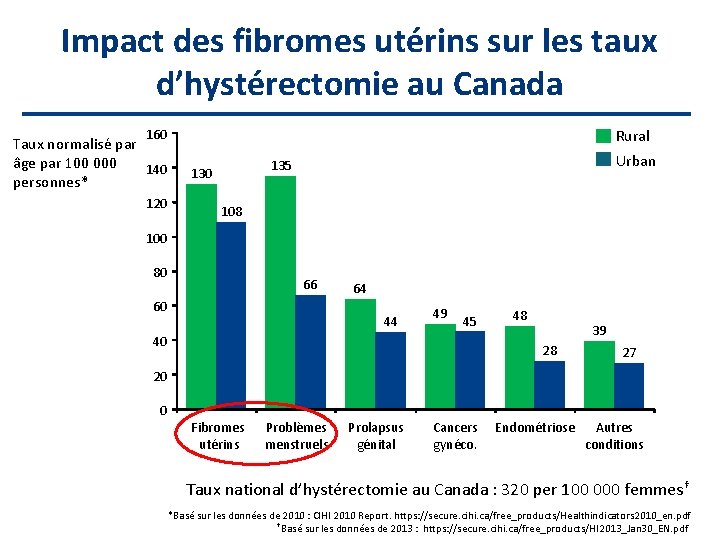
Impact des fibromes utérins sur les taux d’hystérectomie au Canada Rural 160 Taux normalisé par âge par 100 000 140 personnes* 120 Urban 135 130 108 100 80 66 60 64 44 49 45 40 48 39 28 27 20 0 Fibromes utérins Problèmes menstruels Prolapsus génital Cancers gynéco. Endométriose Autres conditions Taux national d’hystérectomie au Canada : 320 per 100 000 femmes† *Basé sur les données de 2010 : CIHI 2010 Report. https: //secure. cihi. ca/free_products/Healthindicators 2010_en. pdf †Basé sur les données de 2013 : https: //secure. cihi. ca/free_products/HI 2013_Jan 30_EN. pdf

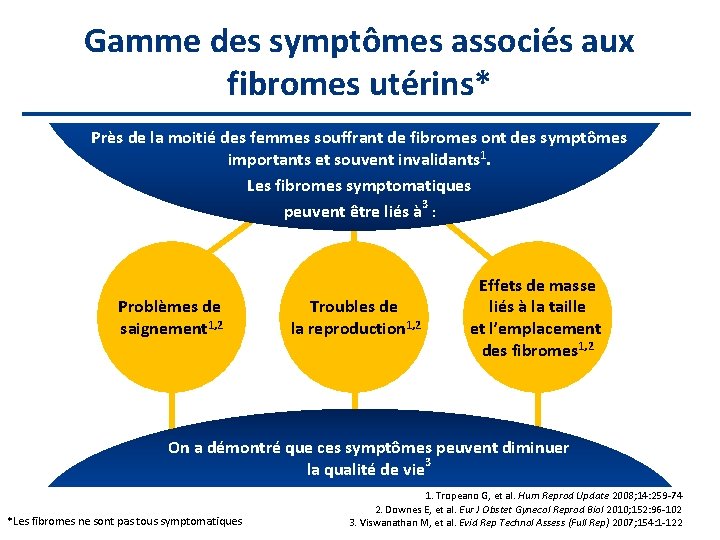
Gamme des symptômes associés aux fibromes utérins* Près de la moitié des femmes souffrant de fibromes ont des symptômes importants et souvent invalidants 1. Les fibromes symptomatiques peuvent être liés à 3 : Problèmes de saignement 1, 2 Troubles de la reproduction 1, 2 Effets de masse liés à la taille et l’emplacement des fibromes 1, 2 On a démontré que ces symptômes peuvent diminuer la qualité de vie 3 *Les fibromes ne sont pas tous symptomatiques 1. Tropeano G, et al. Hum Reprod Update 2008; 14: 259 -74 2. Downes E, et al. Eur J Obstet Gynecol Reprod Biol 2010; 152: 96 -102 3. Viswanathan M, et al. Evid Rep Technol Assess (Full Rep) 2007; 154: 1 -122

Diagnostic

Diagnostic de fibromes utérins Histoire clinique Examen physique Les symptômes comprennent l Saignements vaginaux anormaux l Symptômes de pression pelvienne affectant la vessie, le rectum ou le bas du dos l Dyspareunie Présentation atypique l Hydronéphrose l Douleur (dégénération) Déterminer l’impact sur la qualité de vie de la patiente Khan AT, et al. Int J Womens Health 2014; 6: 95 -114

Bilan diagnostique Investiguer selon la présentation clinique l Saignements menstruels anormaux 1 q q Bilan sanguin (hémoglobine, ferritine) Biopsie de l’endomètre selon les lignes directrices pour exclure une pathologie Les sarcomes utérins sont rares (3 à 7 / 10 000)2 q q L’incidence peut être plus élevée chez les femmes subissant une chirurgie 3 Aucun test diagnostique pour détecter un sarcome 1. Singh S, et al. J Obstet Gynaecol Can 2013; 35: 473 -9; 2. Brooks SE, et al. Gynecol Oncol 2004; 93: 204 -8; 3. Seidman MA, et al. PLo. S One 2012; 7: e 50058

Bilan diagnostique (suite) L’imagerie est importante pour déterminer l’emplacement des fibromes et exclure d’autres pathologies l Sous-séreux, intramuraux, sous-muqueux Échographie pelvienne : endovaginale ou transabdominale Échographie par infusion d’un agent de contraste (gel, sérum physiologique) IRM : permet de determiner l’emplacement, la taille, le nombre et la perfusion des fibromes Hystéroscopie IRM = imagerie par résonnance magnétique 1. Khan AT, et al. Int J Womens Health 2014; 6: 95 -114 2. Singh S, et al. J Obstet Gynaecol Can 2013; 35(5 e. Suppl): S 1 -S 28

La prise en charge des fibromes utérins

Les options pour la prise en charge des fibromes utérins symptomatiques Le traitement idéal devrait être en mesure de : l contrôler les signes et symptômes l produire une réduction soutenue de la taille des fibromes l préverver la fertilité s’il y a lieu ou si désiré par la patiente Le choix du traitement est influencé par : l la gravité des symptômes, le volume, la localisation l l’âge de la patiente l les besoins de la patiente (préservation de la fertilité ou de l’utérus) l l’expérience du clinicien l la disponibilité du traitement. l le coût l Le profil d’effets indésirables Miller CE. J Minim Invasive Gynecol 2009; 16: 11 -21

Les approches de traitement pour les fibromes utérins Conservatrices Médicales Chirurgicales Interventionnelles Uterine artery embolization MRI-guided focused ultrasound Brölmann H, et al. Internet J Gynecol Obstetrics 2007; 10. http: //ispub. com/IJGO/10/1/6739

Traitements médicaux présentement utilisés dans le traitement des symptômes de fibromes utérins Approche Objectif du traitement Contraceptifs oraux 1, 2* Régulariser et diminuer les saignements cycliques Progestatifs 1, 2* Peuvent régulariser et diminuer les saignements DIU libérant du lévonorgestrel 1* Régularisent et diminuent les saignements, peuvent éliminer les règles Agonistes de la Gn. RH ± traitement additif 3 Traitement pré-opératoire chez les femmes préménopausées pour rétrécir les fibromes et/ou soulager l’anémie Danazol 3* Soulagement des saignements menstruels abondants et aucun désir immédiat de grossesse Antifibrinolytiques (acide tranéxamique)4* Pour diminuer le flux pendant les règles *Non indiqué pour les fibromes utérins Gn. RH = hormone de lbération de la gonadotrophine DIU = dispositive intra-utérin 1. ACOG. Obstet Gynecol 2010; 115: 206 -18 2. Miller CE. J Minim Invasive Gynecol 2009; 16: 11 -21 3. De Leo, et al. Drug Safety 2002; 25: 759 -79 4. Naoulou B, Tsai MC. ACTA Obstet Gynecol Scand 2012; 91: 529 -37

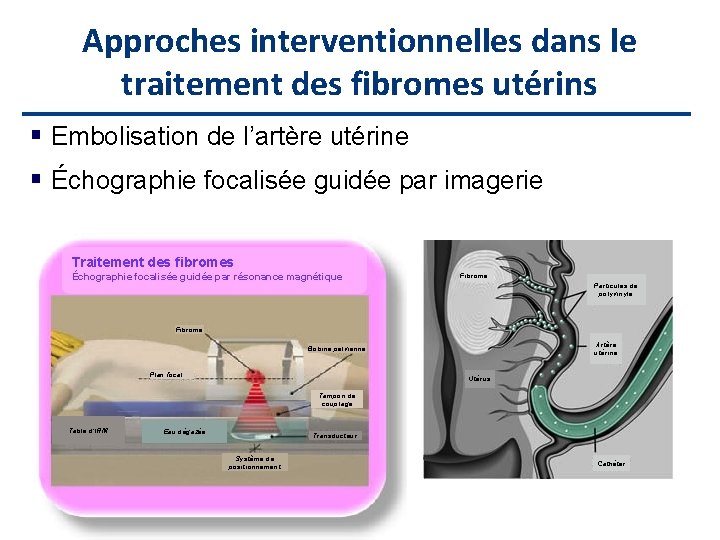
Approches interventionnelles dans le traitement des fibromes utérins Embolisation de l’artère utérine Échographie focalisée guidée par imagerie Traitement des fibromes Échographie focalisée guidée par résonance magnétique Fibrome Particules de polyvinyle Fibrome Artère utérine Bobine pelvienne Plan focal Utérus Tampon de couplage Table d’IRM Eau dégazée Transducteur Système de positionnement Cathéter

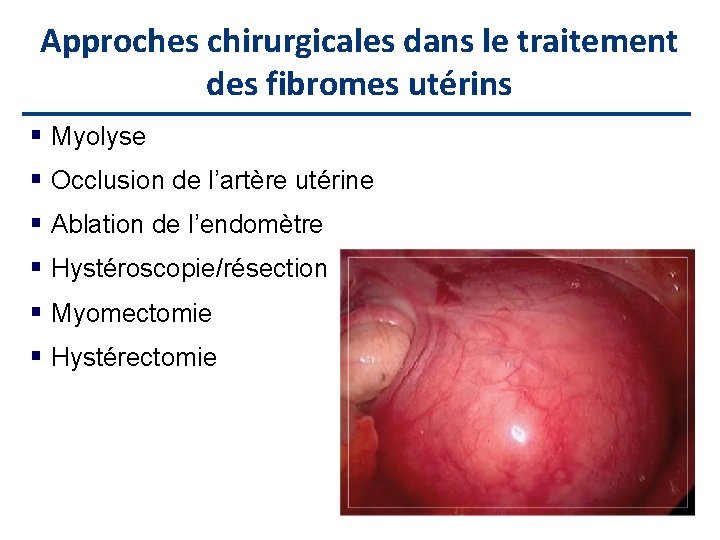
Approches chirurgicales dans le traitement des fibromes utérins Myolyse Occlusion de l’artère utérine Ablation de l’endomètre Hystéroscopie/résection Myomectomie Hystérectomie

Questions pour discussion Quels sont les besoins insatisfaits dans le traitement médical des fibromes utérins? Quelles sont les lacunes dans le traitement des symptômes de fibromes utérins? Comment décidez-vous entre un traitement médical et une intervention chirurgicale?

Pharmacologie des modulateurs sélectifs des récepteurs de la progestérone (SPRM)

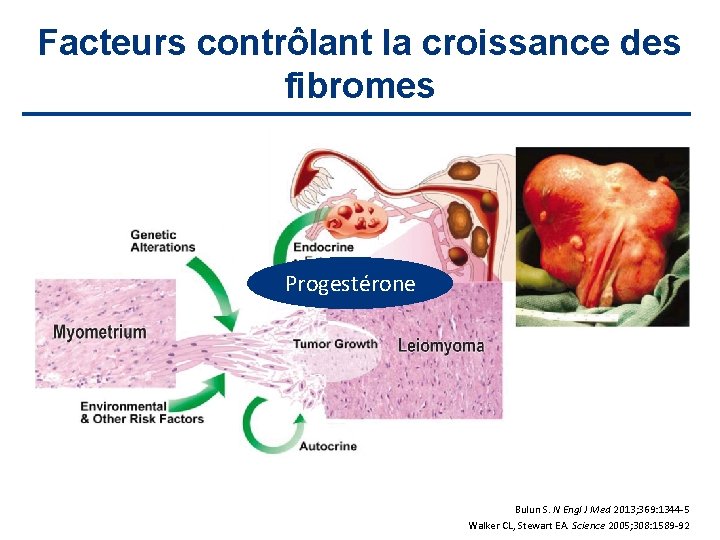
Facteurs contrôlant la croissance des fibromes Progestérone Bulun S. N Engl J Med 2013; 369: 1344 -5 Walker CL, Stewart EA. Science 2005; 308: 1589 -92

Progestérone : effets bénéfiques Progestérone RP = récepteur de la progestérone Boomsma D, et al. Int J Pharm Compd 2002; 6: 245 -9 Sastry KV. Endocrinology and Reproductive Biology. 2009

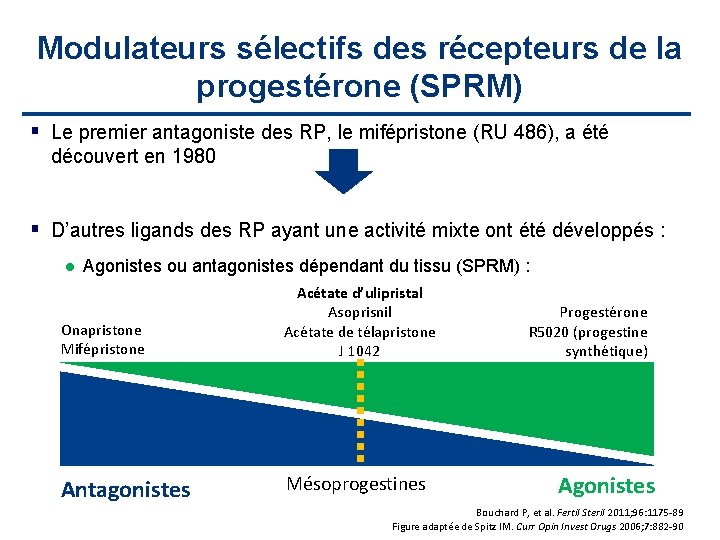
Modulateurs sélectifs des récepteurs de la progestérone (SPRM) Le premier antagoniste des RP, le mifépristone (RU 486), a été découvert en 1980 D’autres ligands des RP ayant une activité mixte ont été développés : l Agonistes ou antagonistes dépendant du tissu (SPRM) : Onapristone Mifépristone Acétate d’ulipristal Asoprisnil Acétate de télapristone J 1042 Antagonistes Mésoprogestines Progestérone R 5020 (progestine synthétique) progestin) Agonistes Bouchard P, et al. Fertil Steril 2011; 96: 1175 -89 Figure adaptée de Spitz IM. Curr Opin Invest Drugs 2006; 7: 882 -90

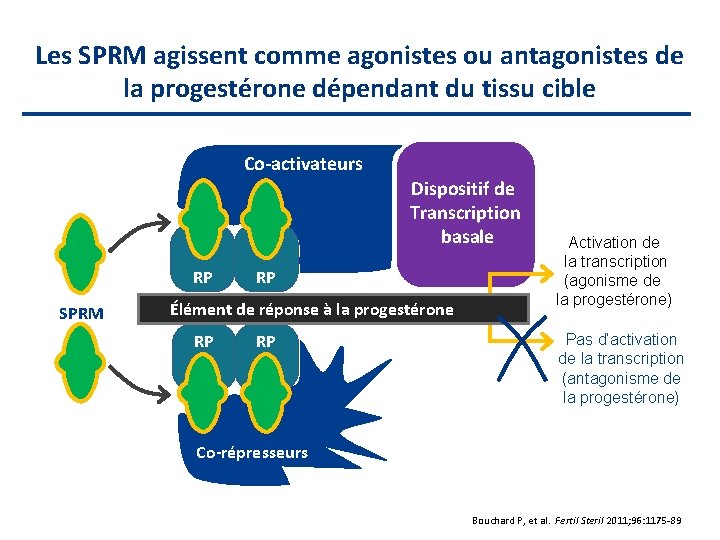
La classe des SPRM Des composés qui se lient aux récepteurs de la progestérone Ils modulent la transcription, de façon positive ou négative, de manière spécifique au tissu Effets profonds à court terme sur la prolifération endométriale Ils inhibent la prolifération et induisent l'apoptose dans des cellules de léiomyomes cultivées mais pas dans les cellules du myomètre normal Bouchard P, et al. Fertil Steril 2011; 96: 1175 -89

Les SPRM agissent comme agonistes ou antagonistes de la progestérone dépendant du tissu cible Co-activateurs Dispositif de Transcription basale RP SPRM RP Élément de réponse à la progestérone RP RP Activation de la transcription (agonisme de la progestérone) Pas d’activation de la transcription (antagonisme de la progestérone) Co-répresseurs Bouchard P, et al. Fertil Steril 2011; 96: 1175 -89

Acétate d’ulipristal (UPA)

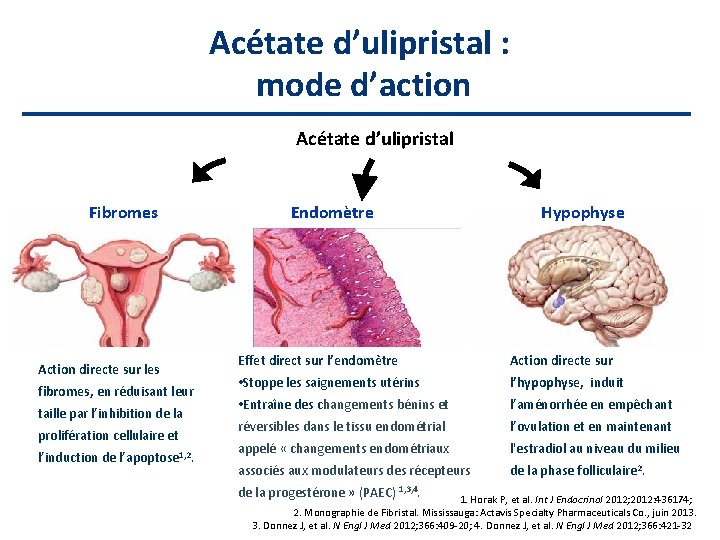
Acétate d’ulipristal : mode d’action Acétate d’ulipristal Fibromes Action directe sur les fibromes, en réduisant leur taille par l’inhibition de la prolifération cellulaire et l’induction de l’apoptose 1, 2. Endomètre Hypophyse Effet direct sur l’endomètre Action directe sur • Stoppe les saignements utérins l’hypophyse, induit • Entraîne des changements bénins et l’aménorrhée en empêchant réversibles dans le tissu endométrial l’ovulation et en maintenant appelé « changements endométriaux l'estradiol au niveau du milieu associés aux modulateurs des récepteurs de la phase folliculaire 2. de la progestérone » (PAEC) 1, 3, 4. 1. Horak P, et al. Int J Endocrinol 2012; 2012: 436174; 2. Monographie de Fibristal. Mississauga: Actavis Specialty Pharmaceuticals Co. , juin 2013. 3. Donnez J, et al. N Engl J Med 2012; 366: 409 -20; 4. Donnez J, et al. N Engl J Med 2012; 366: 421 -32

L’acétate d’ulipristal dans le traitement des fibromes utérins Le premier et le seul médicament approuvé au Canada pour le traitement des signes et symptômes modérés à graves de fibromes utérins chez les femmes adultes en âge de procréer qui sont admissibles à la chirurgie 1 Réduit rapidement les saignements menstruels abondants tout en réduisant directement la taille des fibromes 2, 3 La réduction de la taille des fibromes s’est maintenue jusqu’à six mois après un traitement de trois mois 1, 3 Bien toléré 2, 3 1. Monographie de Fibristal. MC, juin 2013 2. Donnez J, et al. NEJM 2012; 366: 409 -20 3. Donnez J, et al. NEJM 2012; 366: 421 -32

Données cliniques sur l’acétate d’ulipristal : études cliniques PEARL I et II

PEARL II *Essai de non-infériorité, avec critère co-primaire de supériorité pour l’innocuité vs l’acétate de leuprolide Donnez J, et al. N Engl J Med 2012; 366: 409 -20 Donnez J, et al. N Engl J Med 2012; 366: 421 -32

PEARL I et II : Principaux critères d’inclusion PEARL I (n = 237) PEARL II (n = 301) Femmes préménopausées (âgées de 18 à 50 ans) avec fibromes utérins Saignements utérins excessifs (score PBAC > 100 pendant les 8 premiers jours des règles) Uterus d’une taille equivalente à l’utérus d’une femme enceinte de 16 semaines ou moins Au moins 1 fibrome de 3 cm ou plus de diamètre, mais aucun fibrome mesurant plus de 10 cm de diamètre Admissibles à une intervention chirurgicale ou une procédure Anémie (≤ 10. 2 g/d. L) PBAC = Pictorial blood-loss assessment chart Anémie non requise Donnez J, et al. N Engl J Med 2012; 366: 409 -20 Donnez J, et al. N Engl J Med 2012; 366: 421 -32

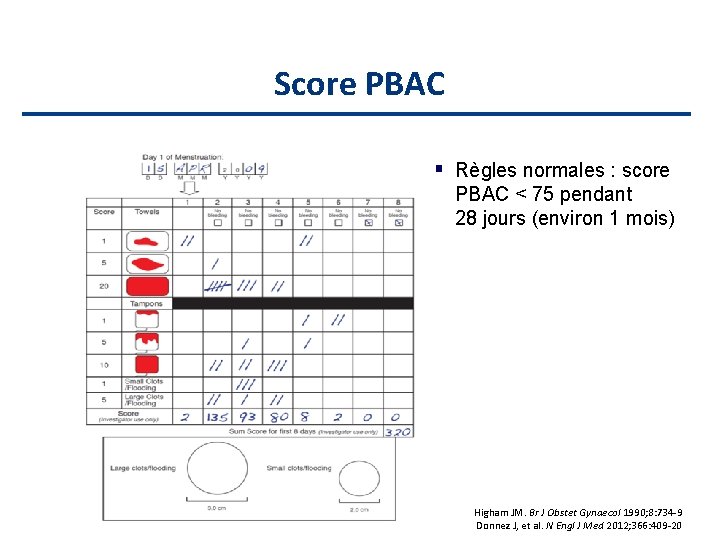
Score PBAC Règles normales : score PBAC < 75 pendant 28 jours (environ 1 mois) Higham JM. Br J Obstet Gynaecol 1990; 8: 734 -9 Donnez J, et al. N Engl J Med 2012; 366: 409 -20

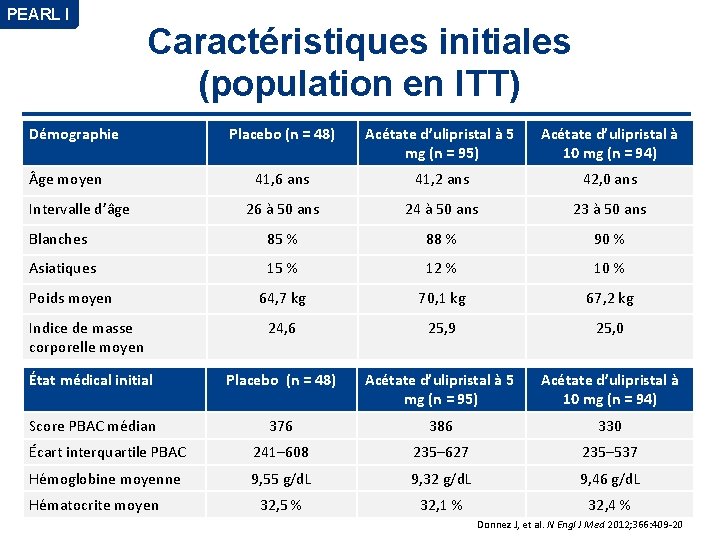
PEARL I Caractéristiques initiales (population en ITT) Démographie Placebo (n = 48) Acétate d’ulipristal à 5 mg (n = 95) Acétate d’ulipristal à 10 mg (n = 94) 41, 6 ans 41, 2 ans 42, 0 ans 26 à 50 ans 24 à 50 ans 23 à 50 ans Blanches 85 % 88 % 90 % Asiatiques 15 % 12 % 10 % 64, 7 kg 70, 1 kg 67, 2 kg Indice de masse corporelle moyen 24, 6 25, 9 25, 0 État médical initial Placebo (n = 48) Acétate d’ulipristal à 5 mg (n = 95) Acétate d’ulipristal à 10 mg (n = 94) Score PBAC médian 376 386 330 Écart interquartile PBAC 241– 608 235– 627 235– 537 Hémoglobine moyenne 9, 55 g/d. L 9, 32 g/d. L 9, 46 g/d. L 32, 5 % 32, 1 % 32, 4 % ge moyen Intervalle d’âge Poids moyen Hématocrite moyen Donnez J, et al. N Engl J Med 2012; 366: 409 -20

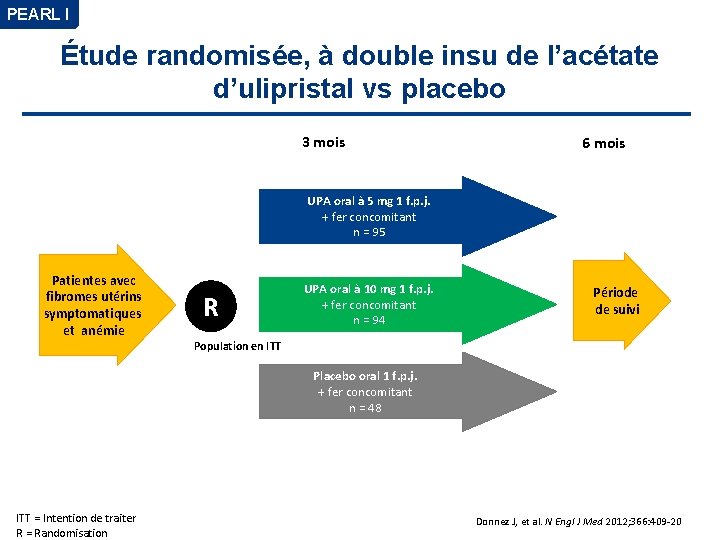
PEARL I Étude randomisée, à double insu de l’acétate d’ulipristal vs placebo 3 mois 6 mois UPA oral à 5 mg 1 f. p. j. + fer concomitant n = 95 Patientes avec fibromes utérins symptomatiques et anémie R UPA oral à 10 mg 1 f. p. j. + fer concomitant n = 94 Période de suivi Population en ITT Placebo oral 1 f. p. j. + fer concomitant n = 48 ITT = Intention de traiter R = Randomisation Donnez J, et al. N Engl J Med 2012; 366: 409 -20

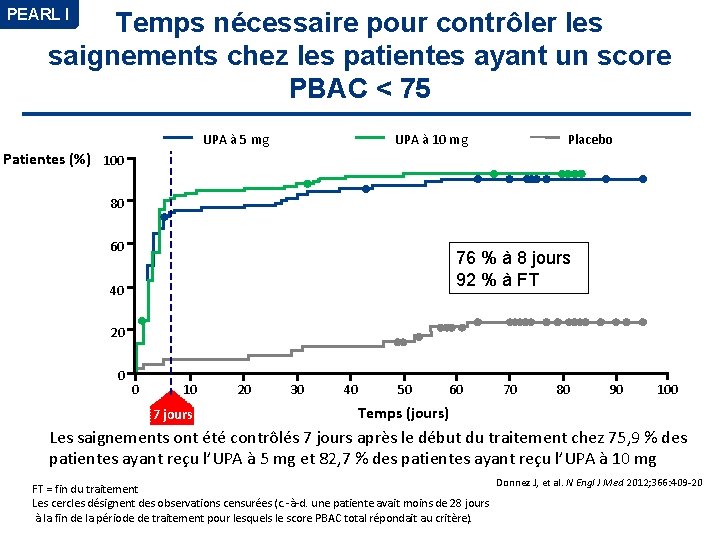
PEARL I Temps nécessaire pour contrôler les saignements chez les patientes ayant un score PBAC < 75 UPA à 10 mg UPA à 5 mg Placebo Patientes (%) 100 80 60 76 % à 8 jours 92 % à FT 40 20 0 0 10 7 jours 20 30 40 50 60 70 80 90 100 Temps (jours) Les saignements ont été contrôlés 7 jours après le début du traitement chez 75, 9 % des patientes ayant reçu l’UPA à 5 mg et 82, 7 % des patientes ayant reçu l’UPA à 10 mg FT = fin du traitement Les cercles désignent des observations censurées (c. -à-d. une patiente avait moins de 28 jours à la fin de la période de traitement pour lesquels le score PBAC total répondait au critère). Donnez J, et al. N Engl J Med 2012; 366: 409 -20

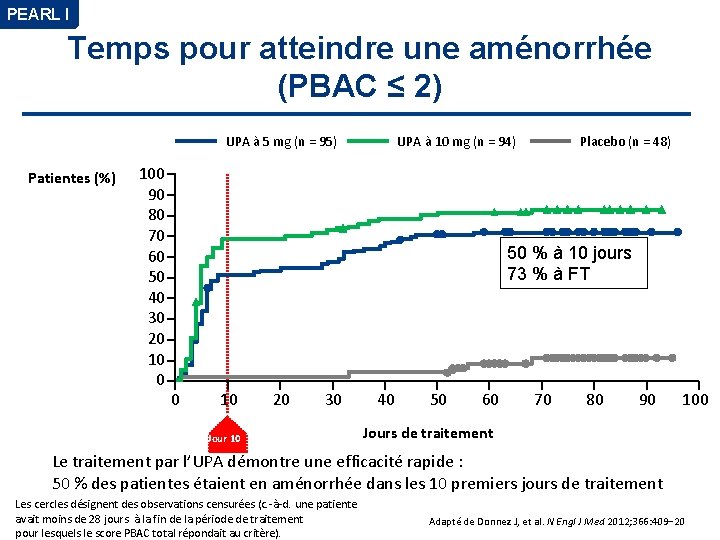
PEARL I Temps pour atteindre une aménorrhée (PBAC ≤ 2) UPA à 5 mg (n = 95) Patientes (%) 100 90 80 70 60 50 40 30 20 10 0 UPA à 10 mg (n = 94) Placebo (n = 48) 50 % à 10 jours 73 % à FT 0 10 20 30 Jour 10 40 50 60 70 80 90 100 Jours de traitement Le traitement par l’UPA démontre une efficacité rapide : 50 % des patientes étaient en aménorrhée dans les 10 premiers jours de traitement Les cercles désignent des observations censurées (c. -à-d. une patiente avait moins de 28 jours à la fin de la période de traitement pour lesquels le score PBAC total répondait au critère). Adapté de Donnez J, et al. N Engl J Med 2012; 366: 409− 20

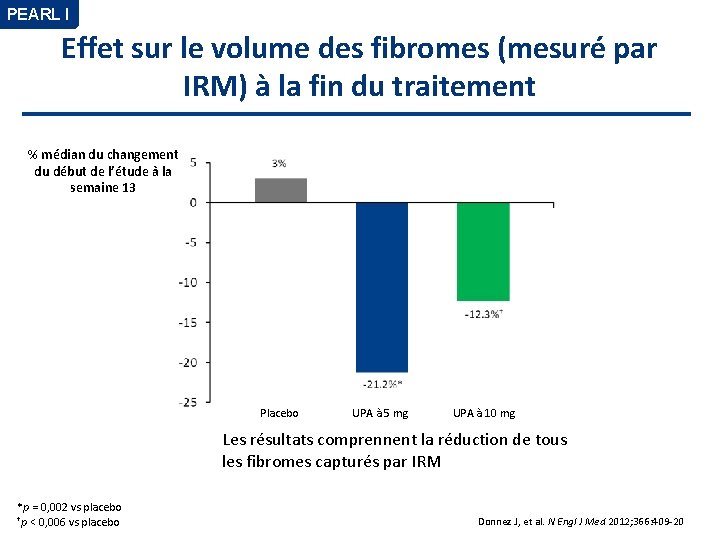
PEARL I Effet sur le volume des fibromes (mesuré par IRM) à la fin du traitement % médian du changement du début de l’étude à la semaine 13 Placebo UPA à 5 mg UPA à 10 mg Les résultats comprennent la réduction de tous les fibromes capturés par IRM *p = 0, 002 vs placebo †p < 0, 006 vs placebo Donnez J, et al. N Engl J Med 2012; 366: 409 -20

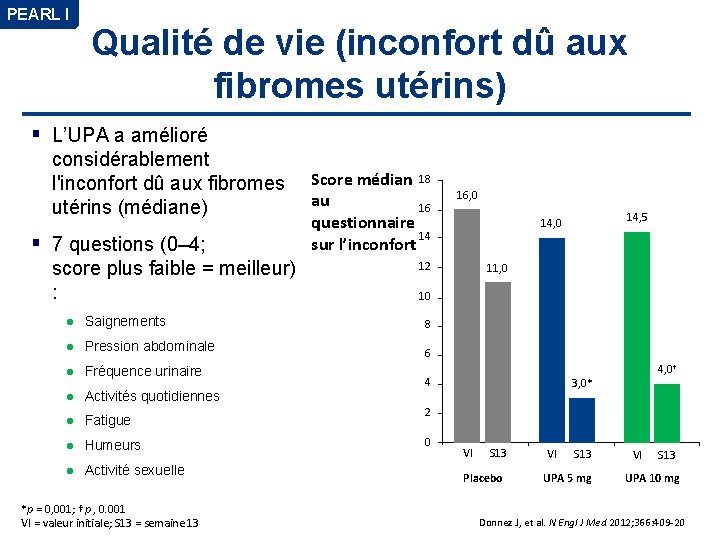
PEARL I Qualité de vie (inconfort dû aux fibromes utérins) L’UPA a amélioré considérablement l'inconfort dû aux fibromes utérins (médiane) 7 questions (0– 4; score plus faible = meilleur) : l Saignements l Pression abdominale l Fréquence urinaire l Activités quotidiennes l Fatigue l Humeurs l Activité sexuelle *p = 0, 001; †p , 0. 001 VI = valeur initiale; S 13 = semaine 13 Score médian 18 au 16 questionnaire 14 sur l’inconfort 16, 0 14, 5 14, 0 12 11, 0 10 8 6 4 4, 0† 3, 0* 2 0 VI S 13 Placebo VI S 13 UPA 5 mg VI S 13 UPA 10 mg Donnez J, et al. N Engl J Med 2012; 366: 409 -20

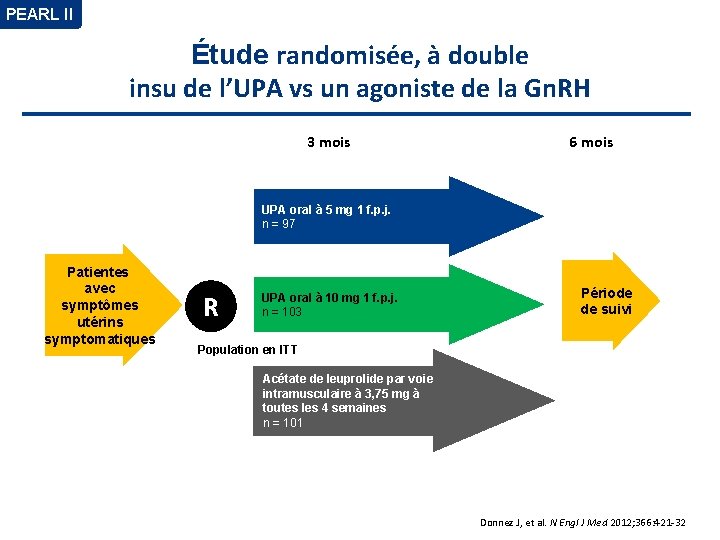
PEARL II Étude randomisée, à double insu de l’UPA vs un agoniste de la Gn. RH 3 mois 6 mois UPA oral à 5 mg 1 f. p. j. n = 97 Patientes avec symptômes utérins symptomatiques R UPA oral à 10 mg 1 f. p. j. n = 103 Période de suivi Population en ITT Acétate de leuprolide par voie intramusculaire à 3, 75 mg à toutes les 4 semaines n = 101 Donnez J, et al. N Engl J Med 2012; 366: 421 -32

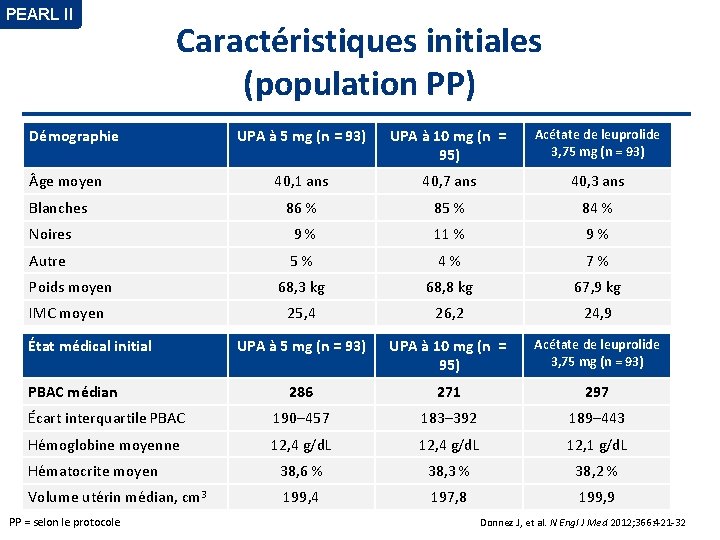
PEARL II Caractéristiques initiales (population PP) Démographie UPA à 5 mg (n = 93) UPA à 10 mg (n = 95) Acétate de leuprolide 3, 75 mg (n = 93) 40, 1 ans 40, 7 ans 40, 3 ans Blanches 86 % 85 % 84 % Noires 9 % 11 % 9 % Autre 5 % 4 % 7 % Poids moyen 68, 3 kg 68, 8 kg 67, 9 kg IMC moyen 25, 4 26, 2 24, 9 UPA à 5 mg (n = 93) UPA à 10 mg (n = 95) Acétate de leuprolide 3, 75 mg (n = 93) 286 271 297 Écart interquartile PBAC 190– 457 183– 392 189– 443 Hémoglobine moyenne 12, 4 g/d. L 12, 1 g/d. L Hématocrite moyen 38, 6 % 38, 3 % 38, 2 % Volume utérin médian, cm 3 199, 4 197, 8 199, 9 ge moyen État médical initial PBAC médian PP = selon le protocole Donnez J, et al. N Engl J Med 2012; 366: 421 -32

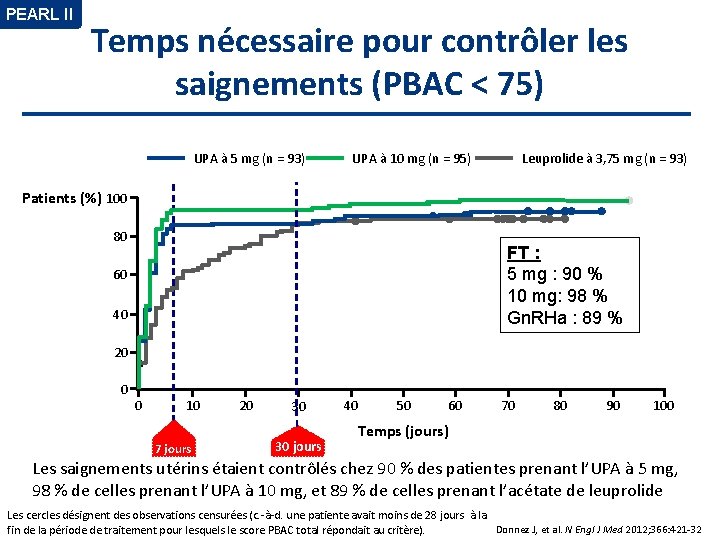
PEARL II Temps nécessaire pour contrôler les saignements (PBAC < 75) UPA à 5 mg (n = 93) UPA à 10 mg (n = 95) Leuprolide à 3, 75 mg (n = 93) Patients (%) 100 80 FT : 5 mg : 90 % 10 mg: 98 % Gn. RHa : 89 % 60 40 20 0 0 10 7 jours 20 30 30 jours 30 days 40 50 60 70 80 90 100 Temps (jours) Les saignements utérins étaient contrôlés chez 90 % des patientes prenant l’UPA à 5 mg, 98 % de celles prenant l’UPA à 10 mg, et 89 % de celles prenant l’acétate de leuprolide Les cercles désignent des observations censurées (c. -à-d. une patiente avait moins de 28 jours à la Donnez J, et al. N Engl J Med 2012; 366: 421 -32 fin de la période de traitement pour lesquels le score PBAC total répondait au critère).

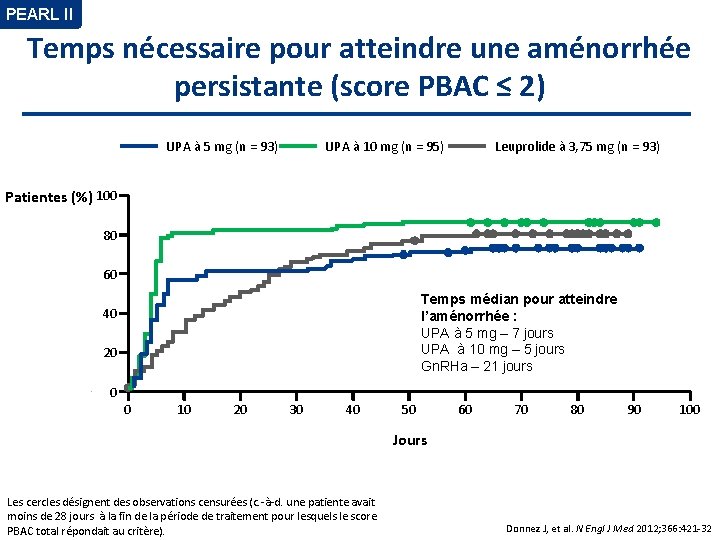
PEARL II Temps nécessaire pour atteindre une aménorrhée persistante (score PBAC ≤ 2) UPA à 5 mg (n = 93) UPA à 10 mg (n = 95) Leuprolide à 3, 75 mg (n = 93) Patientes (%) 100 80 60 Temps médian pour atteindre l’aménorrhée : UPA à 5 mg – 7 jours UPA à 10 mg – 5 jours Gn. RHa – 21 jours 40 20 0 0 10 20 30 40 50 60 70 80 90 100 Jours Les cercles désignent des observations censurées (c. -à-d. une patiente avait moins de 28 jours à la fin de la période de traitement pour lesquels le score PBAC total répondait au critère). Donnez J, et al. N Engl J Med 2012; 366: 421 -32

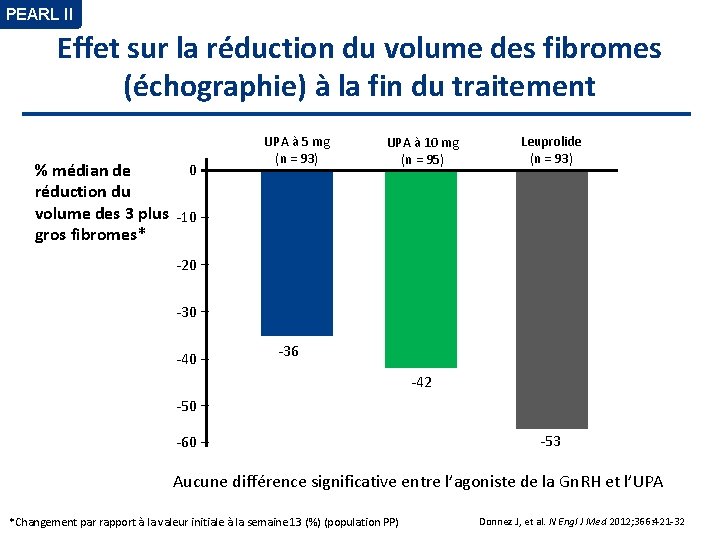
PEARL II Effet sur la réduction du volume des fibromes (échographie) à la fin du traitement 0 % médian de réduction du volume des 3 plus -10 gros fibromes* UPA à 5 mg (n = 93) UPA à 10 mg (n = 95) Leuprolide (n = 93) -20 -30 -40 -36 -42 -50 -60 -53 Aucune différence significative entre l’agoniste de la Gn. RH et l’UPA *Changement par rapport à la valeur initiale à la semaine 13 (%) (population PP) Donnez J, et al. N Engl J Med 2012; 366: 421 -32

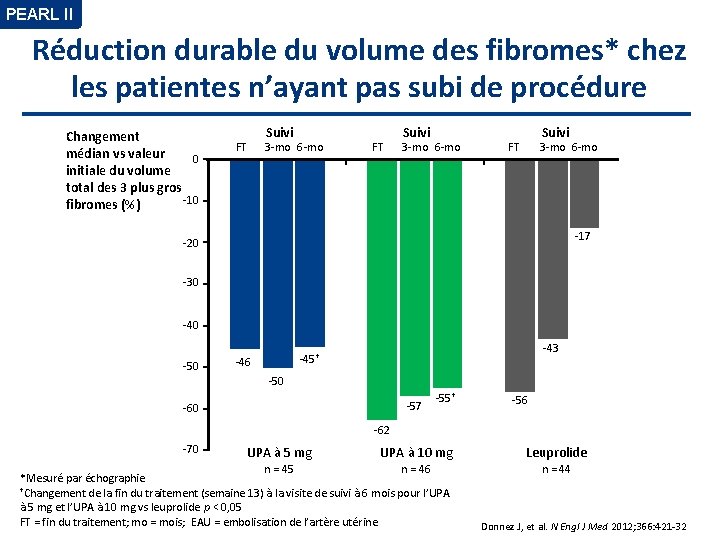
PEARL II Réduction durable du volume des fibromes* chez les patientes n’ayant pas subi de procédure Changement médian vs valeur 0 initiale du volume total des 3 plus gros -10 fibromes (%) FT Suivi 3 -mo 6 -mo Suivi FT 3 -mo 6 -mo -17 -20 -30 -40 -50 -43 -45† -46 -50 -57 -60 -55† -56 -62 -70 UPA à 5 mg UPA à 10 mg n = 45 n = 46 *Mesuré par échographie †Changement de la fin du traitement (semaine 13) à la visite de suivi à 6 mois pour l’UPA à 5 mg et l’UPA à 10 mg vs leuprolide p < 0, 05 FT = fin du traitement; mo = mois; EAU = embolisation de l’artère utérine Leuprolide n = 44 Donnez J, et al. N Engl J Med 2012; 366: 421 -32

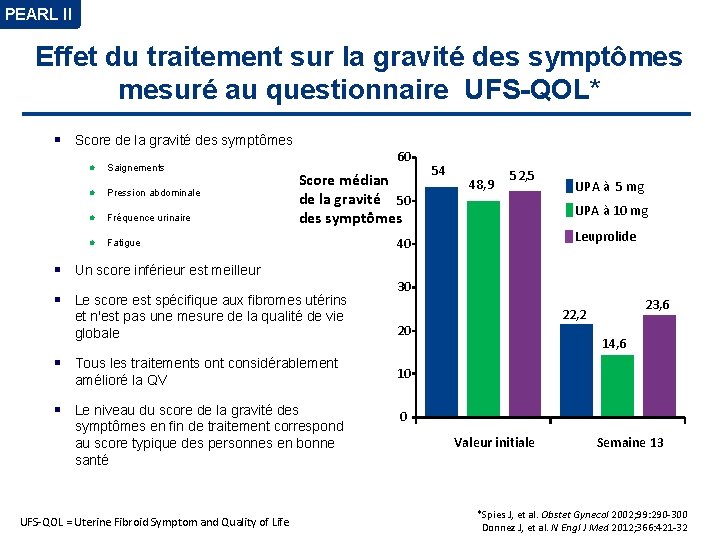
PEARL II Effet du traitement sur la gravité des symptômes mesuré au questionnaire UFS-QOL* Score de la gravité des symptômes l Saignements l Pression abdominale l Fréquence urinaire l Fatigue 60 Score médian de la gravité 50 des symptômes Un score inférieur est meilleur Le score est spécifique aux fibromes utérins et n'est pas une mesure de la qualité de vie globale Tous les traitements ont considérablement amélioré la QV Le niveau du score de la gravité des symptômes en fin de traitement correspond au score typique des personnes en bonne santé UFS-QOL = Uterine Fibroid Symptom and Quality of Life 54 48, 9 52, 5 UPA à 5 mg UPA à 10 mg Leuprolide 40 30 23, 6 22, 2 20 14, 6 10 0 Valeur initiale Semaine 13 *Spies J, et al. Obstet Gynecol 2002; 99: 290 -300 Donnez J, et al. N Engl J Med 2012; 366: 421 -32

PEARL I et II Innocuité

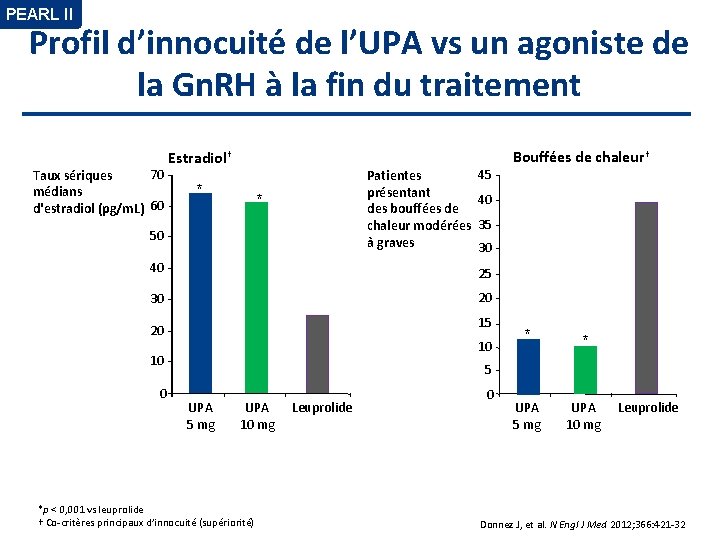
PEARL II Profil d’innocuité de l’UPA vs un agoniste de la Gn. RH à la fin du traitement 70 Taux sériques médians d'estradiol (pg/m. L) 60 Estradiol† * Patientes présentant des bouffées de chaleur modérées à graves * 50 45 40 35 30 40 25 30 20 15 20 10 10 0 Bouffées de chaleur† * * UPA 5 mg UPA 10 mg 5 UPA 5 mg UPA 10 mg *p < 0, 001 vs leuprolide † Co-critères principaux d’innocuité (supériorité) Leuprolide 0 Leuprolide Donnez J, et al. N Engl J Med 2012; 366: 421 -32

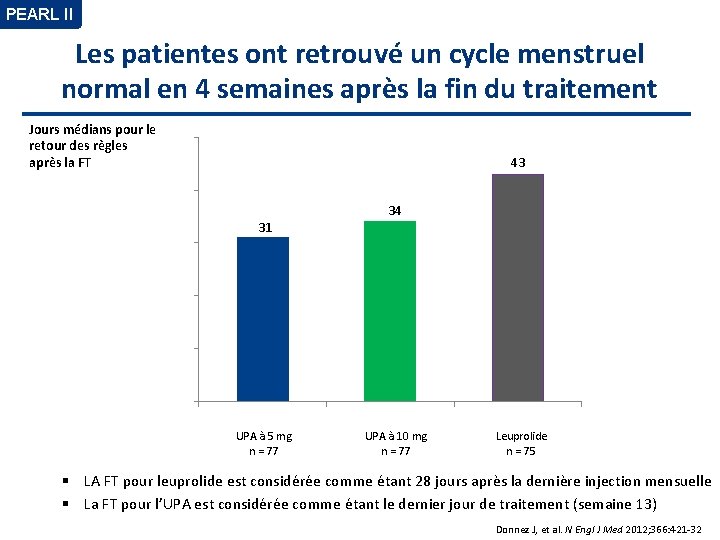
PEARL II Les patientes ont retrouvé un cycle menstruel normal en 4 semaines après la fin du traitement Jours médians pour le 50 retour des règles après la FT 43 40 30 31 34 20 10 0 UPA à 5 mg n = 77 UPA à 10 mg n = 77 Leuprolide n = 75 LA FT pour leuprolide est considérée comme étant 28 jours après la dernière injection mensuelle La FT pour l’UPA est considérée comme étant le dernier jour de traitement (semaine 13) Donnez J, et al. N Engl J Med 2012; 366: 421 -32

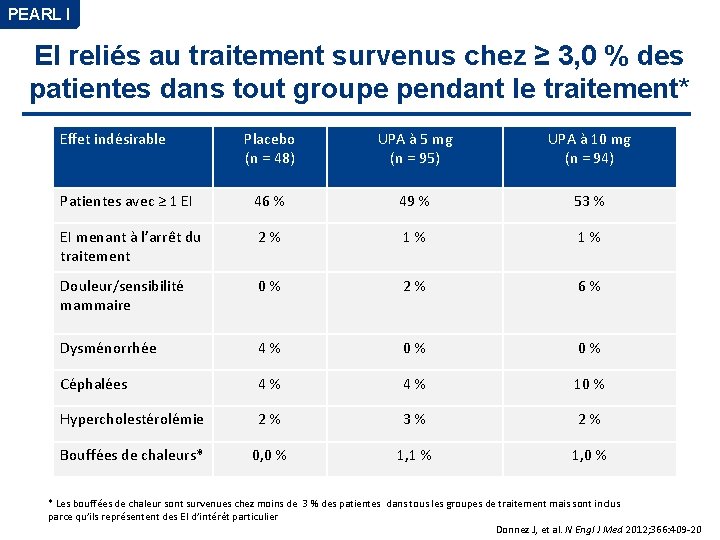
PEARL I EI reliés au traitement survenus chez ≥ 3, 0 % des patientes dans tout groupe pendant le traitement* Effet indésirable Placebo (n = 48) UPA à 5 mg (n = 95) UPA à 10 mg (n = 94) Patientes avec ≥ 1 EI 46 % 49 % 53 % EI menant à l’arrêt du traitement 2 % 1 % Douleur/sensibilité mammaire 0 % 2 % 6 % Dysménorrhée 4 % 0 % Céphalées 4 % 10 % Hypercholestérolémie 2 % 3 % 2 % Bouffées de chaleurs* 0, 0 % 1, 1 % 1, 0 % * Les bouffées de chaleur sont survenues chez moins de 3 % des patientes dans tous les groupes de traitement mais sont inclus parce qu’ils représentent des EI d’intérêt particulier Donnez J, et al. N Engl J Med 2012; 366: 409 -20

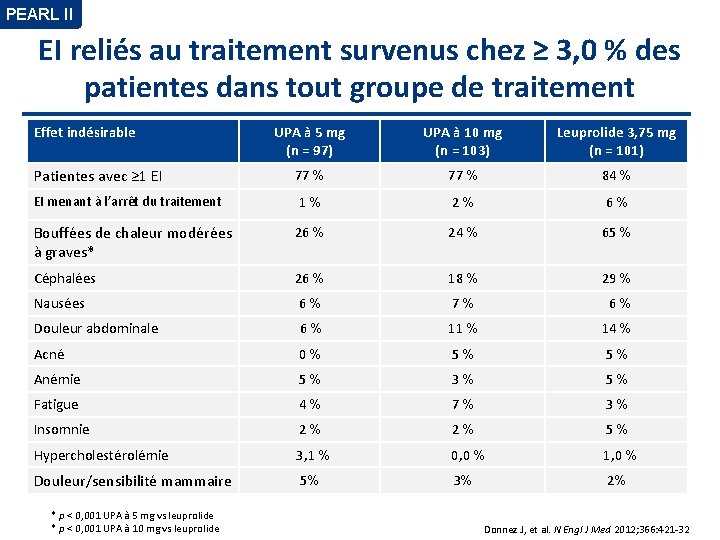
PEARL II EI reliés au traitement survenus chez ≥ 3, 0 % des patientes dans tout groupe de traitement Effet indésirable UPA à 5 mg (n = 97) UPA à 10 mg (n = 103) Leuprolide 3, 75 mg (n = 101) Patientes avec ≥ 1 EI 77 % 84 % EI menant à l’arrêt du traitement 1 % 2 % 6 % Bouffées de chaleur modérées à graves* 26 % 24 % 65 % Céphalées 26 % 18 % 29 % Nausées 6 % 7 % 6 % Douleur abdominale 6 % 11 % 14 % Acné 0 % 5 % Anémie 5 % 3 % 5 % Fatigue 4 % 7 % 3 % Insomnie 2 % 5 % 3, 1 % 0, 0 % 1, 0 % 5% 3% 2% Hypercholestérolémie Douleur/sensibilité mammaire * p < 0, 001 UPA à 5 mg vs leuprolide * p < 0, 001 UPA à 10 mg vs leuprolide Donnez J, et al. N Engl J Med 2012; 366: 421 -32

Innocuité de l’acétate d’ulipristal sur l’endomètre et changements endométriaux associés aux modulateurs des récepteurs de la progestérone (PAEC)

Les effets des SPRM sur l’endomètre Des études avec plusieurs SPRM ont montré des effets sur l'endomètre qui n'avaient pas été observés avec d'autres agents 1 Les premiers rapports ont décrit un épaississement de l'endomètre et des glandes montrant une dilatation 2 Dans certaines études, ces changements ont été mal interprétés comme étant une simple hyperplasie de l’endomètre 2 On a reconnu que l'endomètre était inactif avec de faibles niveaux de prolifération dans les glandes et le stroma 1 1. Mutter GL, et al. Mod Pathol 2008; 21: 591 -8 2. Horne FM, Blithe DL. Human Rep Update 2007; 13: 1 -14

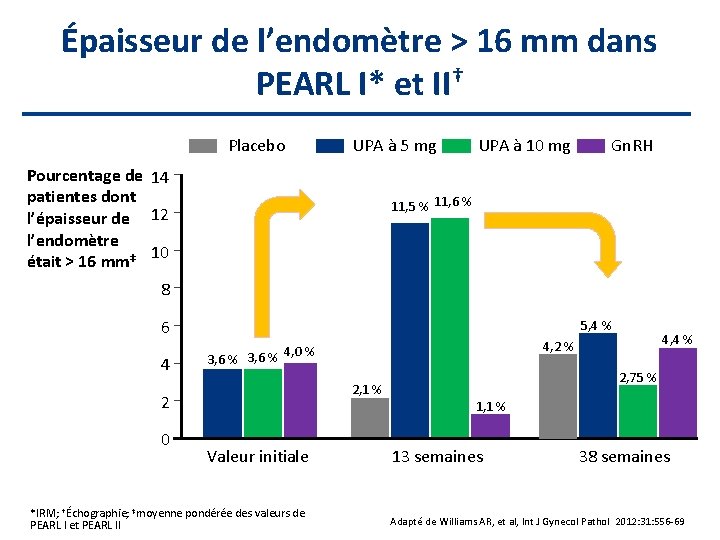
Épaisseur de l’endomètre > 16 mm dans PEARL I* et II† Placebo UPA à 5 mg Pourcentage de 14 patientes dont l’épaisseur de 12 l’endomètre 10 était > 16 mm‡ UPA à 10 mg Gn. RH 11, 5 % 11, 6 % 8 6 4 5, 4 % 2, 1 % 2 0 Valeur initiale *IRM; †Échographie; ‡moyenne pondérée des valeurs de PEARL I et PEARL II 4, 4 % 4, 2 % 4, 0 % 3, 6 % 2, 75 % 1, 1 % 13 semaines 38 semaines Adapté de Williams AR, et al, Int J Gynecol Pathol 2012: 31: 556 -69

Histologie de l’endomètre : PAEC bénins et réversibles dans PEARL I et II Des changements bénins dans l’endomètre (PAEC) comprennent 1 : l Faible activité mitotique dans les glandes et le stroma l Vacuoles intranucléaires avortées l Apoptose l Absence de dégradation stromale et adossement glandulaire l Les glandes kystiquement dilatées sont bordées par un épithélium aplati sans pseudostratification nucléaire Observés chez environ 60 % des patientes traitées par l’acétate d’ulipristal 2 Les changements sont réversibles après l’arrêt du traitement 1 Si les biopsies sont envoyées pour analyse, il est important que le gynécologue informe le pathologiste que la patiente prend l’acétate d’ulipristal, et que ces changements peuvent se produire 1 1. Williams AR, et al. Int J Gynecol Pathol 2012: 31: 556 -69 2. Monographie de Fibristal. Mississauga: Actavis Specialty Pharmaceuticals Co. , juin 2013.

Revue clinique de l’acétate d’ulipristal : sommaire

Sommaire de la revue clinique de l’UPA à 5 mg Il a arrêté rapidement les saignements excessifs : saignements menstruels normalisés chez 75 % des patientes (7 jours), aménorrhée (10 jours) chez 50 % des patientes 2 Après un traitement de 3 mois : saignements menstruels excessifs contrôlés chez 90 à 92 % des patientes, aménorrhée provoquée chez 73 à 75 % des patientes 1, 2 Il a réduit significativement le volume des trois plus gros fibromes 1 l l’effet s’est maintenu jusqu’à 6 mois après l’arrêt du traitement 1 Les règles et l’ovulation ont repris chez la majorité des 1, 2 femmes un mois après la fin du traitement 1. PEARL II Donnez J, et al. NEJM 2012; 366: 421 -32 2. PEARL I Donnez J, et al. NEJM 2012; 366: 409 -20

Sommaire de la revue clinique de l’UPA à 5 mg (suite) Comparé à un agoniste de la Gn. RH, l’UPA : a contrôlé les saignements plus rapidement a maintenu la réduction du volume des fibromes jusqu’à 6 mois Avait un profil supérieur d’effets indésirables Donnez J, et al. NEJM 2012; 366: 421 -32

Sommaire de la revue clinique de l’UPA à 5 mg (suite) Un épaississement réversible de l'endomètre se produit chez une minorité de cas (10 à 15 % des patientes) Des changements bénins et réversibles de l'endomètre (PAEC) ont été observés chez 60 % des patientes traitées avec l‘UPA pendant 3 mois l Les changements sont revenus à la normale 6 mois après la fin du traitement Donnez J, et al. N Engl J Med 2012; 366: 409 -20 Monographie de Fibristal®. juin 2013

Acétate d’ulipristal : indication Indication l Fibristal. MC (acétate d’ulipristal) est indiqué pour le traitement des signes et symptômes modérés à graves de fibromes utérins chez les femmes adultes en âge de procréer qui sont admissibles à la chirurgie. La durée du traitement est limitée à 3 mois. Contre-indications l Pendant la grossesse et chez les femmes qui allaitent l Chez les femmes ayant des saignements génitaux d'étiologie inconnue ou pour des raisons autres que des fibromes utérins. l Chez les femmes atteintes d’un cancer de l'utérus, du col utérin, de l'ovaire ou du sein Monographie de Fibristal. MC, juin 2013

Acétate d’ulipristal : Mises en garde et précautions pertinentes L’utilisation concomitante de contraceptifs hormonaux n’est pas recommandée Suggérer l'utilisation d'une méthode contraceptive de barrière (p. ex. , des préservatifs) Non recommandé chez les patientes : l présentant une insuffisance hépatique sauf si la patiente est suivie de près l souffrant d'insuffisance rénale modérée ou grave l atteintes d'asthme grave insuffisamment contrôlé par des glucocorticoïdes oraux Investiguer si l’épaississement de l’endomètre persiste encore 3 mois après la fin du traitement avec l’acétate d’ulipristal L’utilisation concomitante d’inhibiteurs modérés ou puissants du CYP 3 A 4, d’inducteurs du CYP 3 A 4 et de puissants inducteurs enzymatiques n’est pas recommandée Si les saignements excessifs persistent après les 10 premiers jours de traitement, la patiente devrait en informer son médecin Monographie de Fibristal. MC, juin 2013

Acétate d’ulipristal : posologie Posologie l La posologie habituelle est d'un comprimé à 5 mg par jour, pendant 3 mois d'utilisation continue l Peut être pris avec ou sans nourriture. Conditionnement (Fibristal. MC [acétate d’ulipristal] à 5 mg) l Les boîtes de plaquettes alvéolées contiennent 30 comprimés Pour de plus amples informations : l Pour de plus amples informations concernant les effets indésirables, les interactions médicamenteuses et la posologie, veuillez consulter la monographie du produit à www. fibristal. ca. La monographie est également disponible en appellant Actavis au 1‑ 855 -892 -8766. Monographie de Fibristal. MC, juin 2013

Questions?

Diapositives de réserve

Bilan des saignements utérins anormaux : antécédents Distinguer entre saignements anovulatoires et ovulatoires Symptômes évocateurs d'une anémie Histoire sexuelle et reproductive Impact sur le fonctionnement social et sexuel et la qualité de vie Symptômes évocateurs de causes systémiques des saignements Symptômes associés comme des pertes vaginales ou des odeurs, des douleurs pelviennes ou de la pression Antécédents familiaux de troubles de la coagulation hérités, SOPK, ou de cancer de l'endomètre ou côlon Affections concomitantes qui pourraient influencer les options de traitement Médicaments qui pourraient interférer avec l'ovulation ou autrement être associée à des saignements Singh S, et al. J Obstet Gynaecol Can 2013; 35(5 e. Suppl): S 1–S 28

Bilan des saignements utérins anormaux : examen physique Examen général Examen gynécologique Signes vitaux Inspection : vulve, vagin, col Poids/IMC Examen de la thyroïde Examen de la peau (pâleur, ecchymoses, stries, hirsutisme, pétéchies) Examen abdominal (masse, hépatosplénomégalie) de l’utérus, anus et urètre Examen bimanuel de l'utérus et des structures annexielles Toucher rectal si des saignements du rectum sont soupçonnés ou si risque de pathologie concomitante Test : test Pap, cultures du col de l’utérus si risque d'infection sexuellement transmissible Singh S, et al. J Obstet Gynaecol Can 2013; 35(5 e. Suppl): S 1–S 28

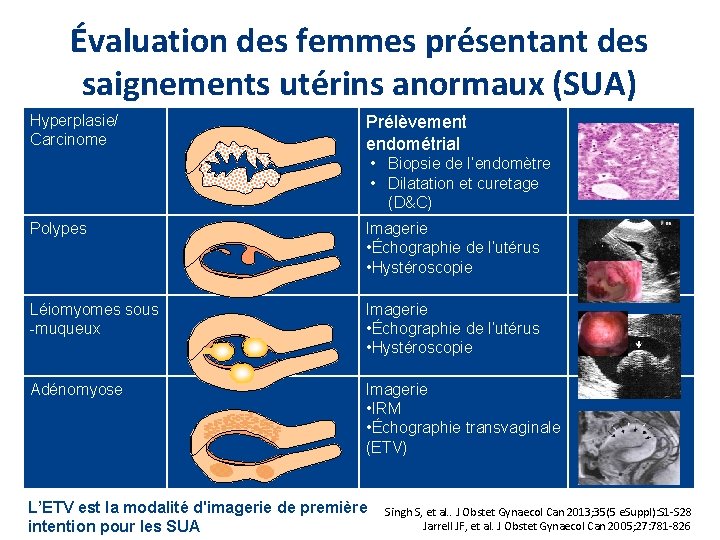
Évaluation des femmes présentant des saignements utérins anormaux (SUA) Hyperplasie/ Carcinome Prélèvement endométrial • Biopsie de l’endomètre • Dilatation et curetage (D&C) Polypes Imagerie • Échographie de l’utérus • Hystéroscopie Léiomyomes sous -muqueux Imagerie • Échographie de l’utérus • Hystéroscopie Adénomyose Imagerie • IRM • Échographie transvaginale (ETV) L’ETV est la modalité d'imagerie de première intention pour les SUA Singh S, et al. . J Obstet Gynaecol Can 2013; 35(5 e. Suppl): S 1 -S 28 Jarrell JF, et al. J Obstet Gynaecol Can 2005; 27: 781 -826

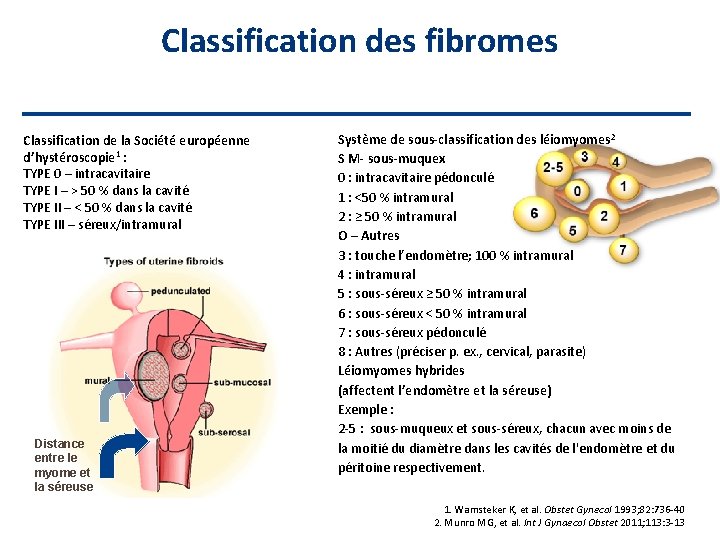
Classification des fibromes Classification de la Société européenne d’hystéroscopie 1 : TYPE 0 – intracavitaire TYPE I – > 50 % dans la cavité TYPE II – < 50 % dans la cavité TYPE III – séreux/intramural Distance entre le myome et la séreuse Système de sous-classification des léiomyomes 2 S M- sous-muquex 0 : intracavitaire pédonculé 1 : <50 % intramural 2 : ≥ 50 % intramural O – Autres 3 : touche l’endomètre; 100 % intramural 4 : intramural 5 : sous-séreux ≥ 50 % intramural 6 : sous-séreux < 50 % intramural 7 : sous-séreux pédonculé 8 : Autres (préciser p. ex. , cervical, parasite) Léiomyomes hybrides (affectent l’endomètre et la séreuse) Exemple : 2 -5 : sous-muqueux et sous-séreux, chacun avec moins de la moitié du diamètre dans les cavités de l'endomètre et du péritoine respectivement. 1. Wamsteker K, et al. Obstet Gynecol 1993; 82: 736 -40 2. Munro MG, et al. Int J Gynaecol Obstet 2011; 113: 3 -13

Antifibrinolytiques (acide tranéxamique) Réduit les pertes de sang menstruel de 40 à 59 %1, 2 Inefficace contre la dysménorrhée Posologie : l 1 g aux 6 heures est la posologie la plus fréquente l Une dose unique de 4 g est également efficace 3 l La dose aiguë est de 10 mg/kg IV aux 6 heures Les effets indésirables sont légers et consistent en nausées, vomissement, diarrhée et céphalées Peut augmenter le risque d’événements thromboemboliques 4 1. Gleeson N, et al. Acta Obstet Gynecol Scand 1994; 73: 274 -7. ; 2. Lethaby A, et al. Cochrane Database Syst Rev 2000; 4: CD 000249. ; g YL, et al. Haemophilia 1998; 4: 63– 5. ; 4. Wellington K, et al. Drugs 2003; 63: 1417 -33.

Les contraceptifs oraux pour traiter les fibromes utérins Réduisent le risque de fibromes d’environ 30 %1 Utilisés pour traiter les problèmes de saignement 2 Ne réduisent pas la taille des fibromes 2 Contre-indiqués chez les patientes présentant des facteurs de risque (femmes de plus de 35 ans qui fument)3 -5 Non indiqués pour le traitement des fibromes utérins 3 -5 1. Ross RK, et al. Br Med J (Clin Res Ed) 1986; 293: 359 -62 2. ACOG. Obstet Gynecol 2010; 115: 206 -18 3. Monographie d’Alesse 21 et Alesse 28, novembre 2010 4. Monographie de Yaz®, novembre 2011 5. Monographie de Tri-Cyclen®, décembre 2012

Les dispositifs intra-utérins (DIU) pour traiter les fibromes utérins Contre-indiqués en présence de fibromes sous-muqueux 1 Le DIU libérant le lévonorgestrel peut être utilisé pour réduire les symptômes chez les patientes qui n’ont pas un gros utérus déformé par des fibromes Cependant : l Risque élevé d’expulsion du DIU (jusqu’à 20 %)2 l L’impact sur la réduction du volume des fibromes est controversé 3 Non indiqué pour le traitement des fibromes utérins 1 1. Monographie de Mirena®, juillet 2013 2. Zapata LB, et al. Contraception 2010; 821: 41 -55 3. ACOG. Obstet Gynecol 2010; 115: 206 -18

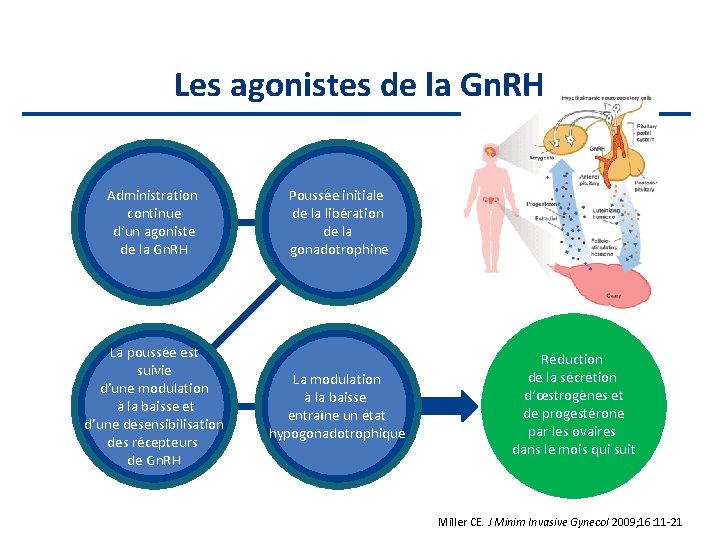
Les agonistes de la Gn. RH Administration continue d‘un agoniste de la Gn. RH La poussée est suivie d’une modulation à la baisse et d’une désensibilisation des récepteurs de Gn. RH Poussée initiale de la libération de la gonadotrophine La modulation à la baisse entraîne un état hypogonadotrophique Réduction de la sécrétion d‘œstrogènes et de progestérone par les ovaires dans le mois qui suit Miller CE. J Minim Invasive Gynecol 2009; 16: 11 -21

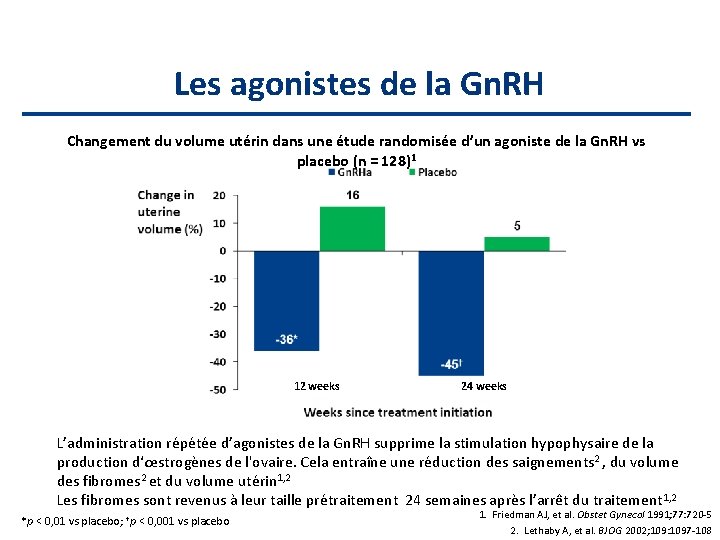
Les agonistes de la Gn. RH Changement du volume utérin dans une étude randomisée d’un agoniste de la Gn. RH vs placebo (n = 128)1 12 weeks 24 weeks L’administration répétée d’agonistes de la Gn. RH supprime la stimulation hypophysaire de la production d‘œstrogènes de l'ovaire. Cela entraîne une réduction des saignements 2 , du volume des fibromes 2 et du volume utérin 1, 2 Les fibromes sont revenus à leur taille prétraitement 24 semaines après l’arrêt du traitement 1, 2 *p < 0, 01 vs placebo; †p < 0, 001 vs placebo 1. Friedman AJ, et al. Obstet Gynecol 1991; 77: 720 -5 2. Lethaby A, et al. BJOG 2002; 109: 1097 -108

Effets des fibromes utérins sur la qualité de vie (QV) Les fibromes utérins diminuent considérablement la qualité de vie liée à la santé (HRQOL)1 Fardeau sociétal : absentéisme, baisse de productivité et pertes économiques 1. Les saignements menstruels abondants sont une cause majeure de visites aux médecins et de pertes de jours de travail 2. De nos jours, les femmes qui souhaitent concevoir sont plus susceptibles de présenter des fibromes utérins, principalement en raison du retard dans la procréation dans notre société 3 1. Downes E, et al. Eur J Obstet Gynecol Reprod Biol 2010; 152: 96 -102 2. Collins J, Crosignani PG. Hum Reprod Update 2007; 13: 421 -31 3. Gambadauro P. J Obstet Gynaecol 2012; 32: 210 -6

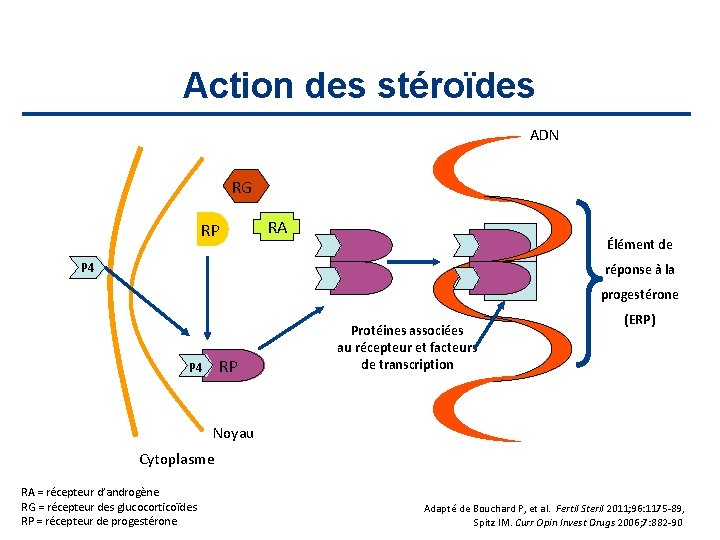
Action des stéroïdes ADN RG RP RA Élément de P 4 réponse à la progestérone RP P 4 Protéines associées au récepteur et facteurs de transcription (ERP) Noyau Cytoplasme RA = récepteur d’androgène RG = récepteur des glucocorticoïdes RP = récepteur de progestérone Adapté de Bouchard P, et al. Fertil Steril 2011; 96: 1175 -89, Spitz IM. Curr Opin Invest Drugs 2006; 7: 882 -90

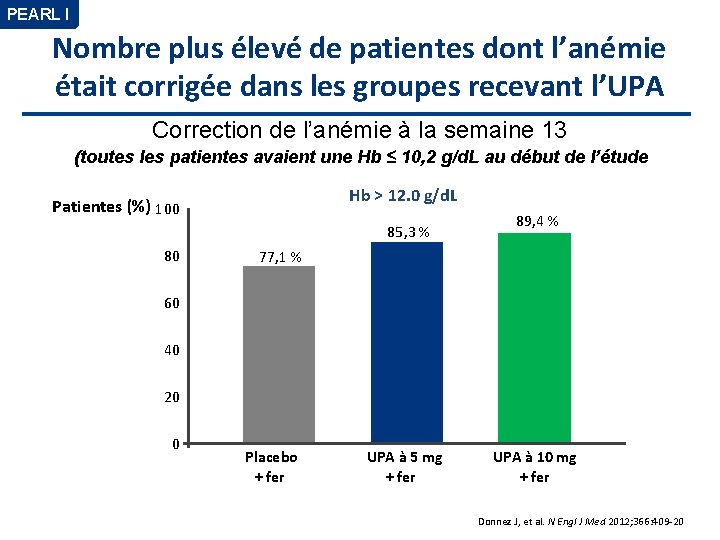
PEARL I Nombre plus élevé de patientes dont l’anémie était corrigée dans les groupes recevant l’UPA Correction de l’anémie à la semaine 13 (toutes les patientes avaient une Hb ≤ 10, 2 g/d. L au début de l’étude Hb > 12. 0 g/d. L Patientes (%) 100 85, 3 % 80 89, 4 % 77, 1 % 60 40 20 0 Placebo + fer UPA à 5 mg + fer UPA à 10 mg + fer Donnez J, et al. N Engl J Med 2012; 366: 409 -20

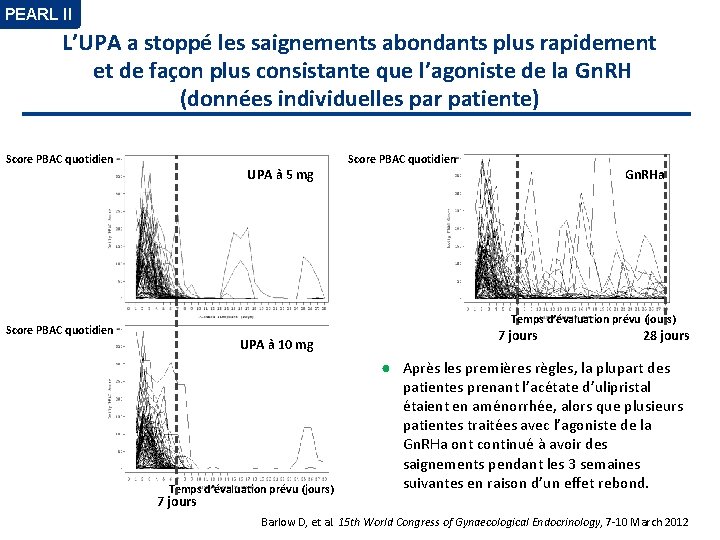
PEARL II L’UPA a stoppé les saignements abondants plus rapidement et de façon plus consistante que l’agoniste de la Gn. RH (données individuelles par patiente) Score PBAC quotidien UPA à 5 mg Gn. RHa Temps d’évaluation prévu (jours) Score PBAC quotidien UPA à 10 mg Temps d’évaluation prévu (jours) 7 jours 28 jours ● Après les premières règles, la plupart des patientes prenant l’acétate d’ulipristal étaient en aménorrhée, alors que plusieurs patientes traitées avec l’agoniste de la Gn. RHa ont continué à avoir des saignements pendant les 3 semaines suivantes en raison d’un effet rebond. 7 jours Barlow D, et al. 15 th World Congress of Gynaecological Endocrinology, 7 -10 March 2012

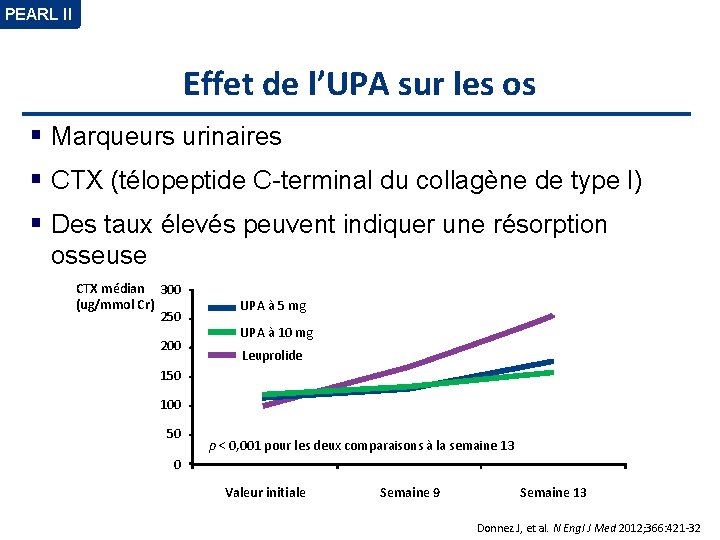
PEARL II Effet de l’UPA sur les os Marqueurs urinaires CTX (télopeptide C-terminal du collagène de type I) Des taux élevés peuvent indiquer une résorption osseuse CTX médian 300 (ug/mmol Cr) 250 200 UPA à 5 mg UPA à 10 mg Leuprolide 150 100 50 p < 0, 001 pour les deux comparaisons à la semaine 13 0 Valeur initiale Semaine 9 Semaine 13 Donnez J, et al. N Engl J Med 2012; 366: 421 -32

PEARL I et II : Évaluation de l’endomètre Biopsies de l’endomètre : l Valeur initiale (début de l’étude) l Semaine 13 (fin du traitement) l Semaine 38 (après 6 mois de suivi sans traitement) Pathologistes : l 3 pathologistes gynécologiques indépendants, en aveugle l Familiers avec les PAEC (participants à l’atelier de la NICHD) Évaluation l Échelle pré-conçue, basée sur l'histologie conventionnelle et les PAEC NICDH = National Institute of Child Health and Human Development Donnez J, et al. N Engl J Med 2012; 366: 409 -20 Donnez J, et al. N Engl J Med 2012; 366: 421− 32
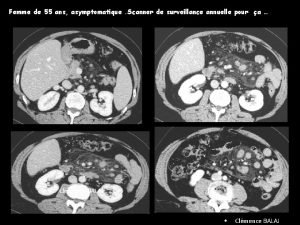
 Cas clinique chirurgie digestive
Cas clinique chirurgie digestive Clinique les perles
Clinique les perles Perles de parents
Perles de parents Il existe des personnes qui sont des lumières pour tous
Il existe des personnes qui sont des lumières pour tous What does the pearl symbolize in the pearl
What does the pearl symbolize in the pearl Traitement des objections vente
Traitement des objections vente Traitement automatique des langues
Traitement automatique des langues Coop pour toi et pour moi
Coop pour toi et pour moi Des des des
Des des des Des cartes pour comprendre le monde
Des cartes pour comprendre le monde Provision pour dépréciation des titres
Provision pour dépréciation des titres Quand je t'ouvre mon coeur je te vois seigneur
Quand je t'ouvre mon coeur je te vois seigneur Chant jeunesse adventiste
Chant jeunesse adventiste Henri dès pour toi maman
Henri dès pour toi maman Phrases avec le subjonctif
Phrases avec le subjonctif Texte transposé
Texte transposé 13 conseil de la vie
13 conseil de la vie Filtre de canny
Filtre de canny Cerclage rotule
Cerclage rotule Tinu syndrome traitement
Tinu syndrome traitement Asthme traitement
Asthme traitement Traitement
Traitement Traitement heuristique et systématique
Traitement heuristique et systématique Les flagellés intestinaux
Les flagellés intestinaux Pneumothorax
Pneumothorax Traitement antibiotique longue durée
Traitement antibiotique longue durée Examen du coude
Examen du coude Syndrome de chilaiditi traitement
Syndrome de chilaiditi traitement Asthme traitement
Asthme traitement Mycobacterium avium traitement naturel
Mycobacterium avium traitement naturel Celine duperron
Celine duperron Fibrome ossifiant traitement
Fibrome ossifiant traitement Traitement acidose lactique metformine
Traitement acidose lactique metformine Gepar
Gepar Welcome chorus pro
Welcome chorus pro Adhérence préputiale traitement
Adhérence préputiale traitement Infection urinaire leucocytes
Infection urinaire leucocytes Tp traitement de signal
Tp traitement de signal Condrolyse
Condrolyse Signe du halo graisseux
Signe du halo graisseux Fibrose pulpaire
Fibrose pulpaire Tdd clinique
Tdd clinique Clinique traitement ibogaïne
Clinique traitement ibogaïne Gastropathie réactionnelle
Gastropathie réactionnelle Color 22092009
Color 22092009 Tige pituitaire
Tige pituitaire Traitement didactique course d'orientation
Traitement didactique course d'orientation Myringite
Myringite Normothymique
Normothymique Station de traitement d'eau potable
Station de traitement d'eau potable Enthésique
Enthésique Seuillage otsu
Seuillage otsu Traitement dimage
Traitement dimage Cours traitement de texte open office
Cours traitement de texte open office Apiphobie traitement
Apiphobie traitement Modèle conceptuel de traitement analytique
Modèle conceptuel de traitement analytique Traitement thyroxinique
Traitement thyroxinique Stargardt traitement
Stargardt traitement Granulome à cholestérine apex pétreux
Granulome à cholestérine apex pétreux Traitement de lerreur en classe
Traitement de lerreur en classe Dyshidrose traitement dakin
Dyshidrose traitement dakin Zona otitique traitement
Zona otitique traitement Traitement de signal
Traitement de signal Muriel lenoir
Muriel lenoir Asthme traitement
Asthme traitement Traitement eaux blanches laiterie
Traitement eaux blanches laiterie Lymphome traitement
Lymphome traitement Critatine
Critatine Filtre rii
Filtre rii Traitement hypertension
Traitement hypertension Traitement du signal
Traitement du signal Synéchie utérine traitement naturel
Synéchie utérine traitement naturel Traitement de lerreur en classe
Traitement de lerreur en classe Clostridioses
Clostridioses Lymphangiome kystique cervical traitement
Lymphangiome kystique cervical traitement Ldme
Ldme Kyste hydatique pulmonaire traitement
Kyste hydatique pulmonaire traitement Hémangiopéricytome
Hémangiopéricytome Rétrécissement foraminal l5-s1 traitement
Rétrécissement foraminal l5-s1 traitement Des attacks
Des attacks