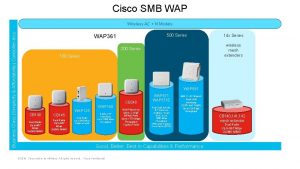
VO CHE 361 Spezielle Aspekte der Hauptgruppenelementchemie Teil




















![Þ polysilanes exhibit pronounced substituent effects ( - -hyperconjugation) ionization energy [e. V] max Þ polysilanes exhibit pronounced substituent effects ( - -hyperconjugation) ionization energy [e. V] max](https://slidetodoc.com/presentation_image_h/838df3d7518284022ff2abfc01556c0b/image-86.jpg)





- Slides: 107

VO CHE. 361 Spezielle Aspekte der Hauptgruppenelementchemie Teil 1: Ao. -Univ. Prof. Dr. Ferdinand Belaj Teil 2: Ao. -Univ. Prof. Dr. Harald Stüger

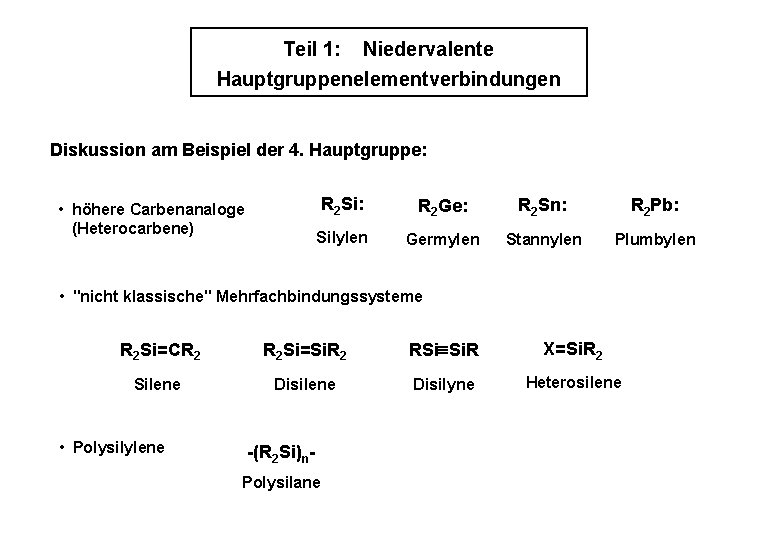
Teil 1: Niedervalente Hauptgruppenelementverbindungen Diskussion am Beispiel der 4. Hauptgruppe: • höhere Carbenanaloge (Heterocarbene) R 2 Si: R 2 Ge: R 2 Sn: R 2 Pb: Silylen Germylen Stannylen Plumbylen • "nicht klassische" Mehrfachbindungssysteme R 2 Si=CR 2 R 2 Si=Si. R 2 RSi Si. R X=Si. R 2 Silene Disilyne Heterosilene • Polysilylene -(R 2 Si)n. Polysilane

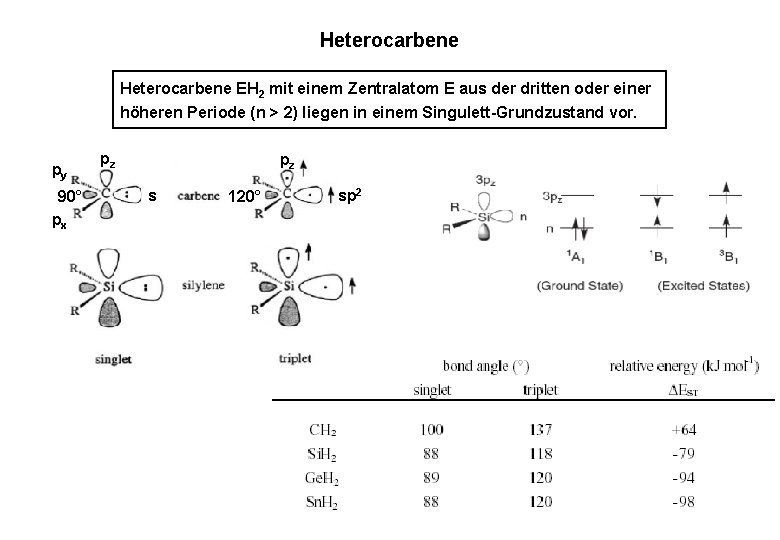
Heterocarbene EH 2 mit einem Zentralatom E aus der dritten oder einer höheren Periode (n > 2) liegen in einem Singulett-Grundzustand vor. py 90° px pz pz s 120° sp 2

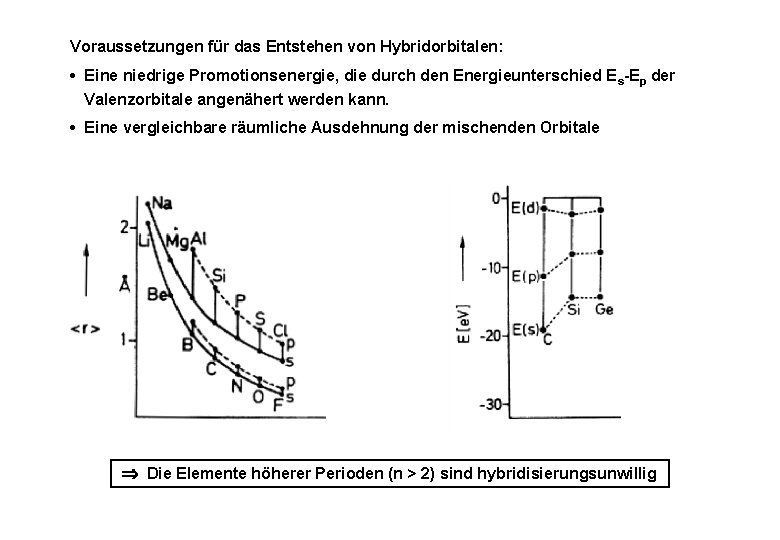
Voraussetzungen für das Entstehen von Hybridorbitalen: • Eine niedrige Promotionsenergie, die durch den Energieunterschied E s-Ep der Valenzorbitale angenähert werden kann. • Eine vergleichbare räumliche Ausdehnung der mischenden Orbitale Die Elemente höherer Perioden (n > 2) sind hybridisierungsunwillig


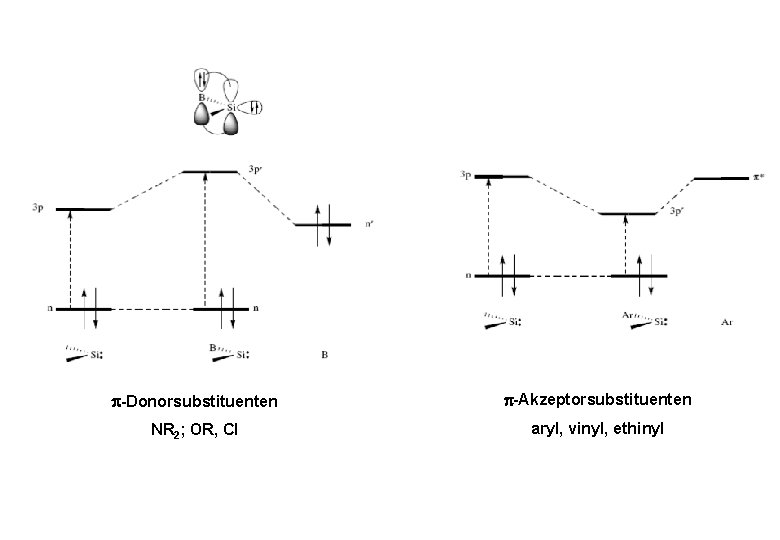
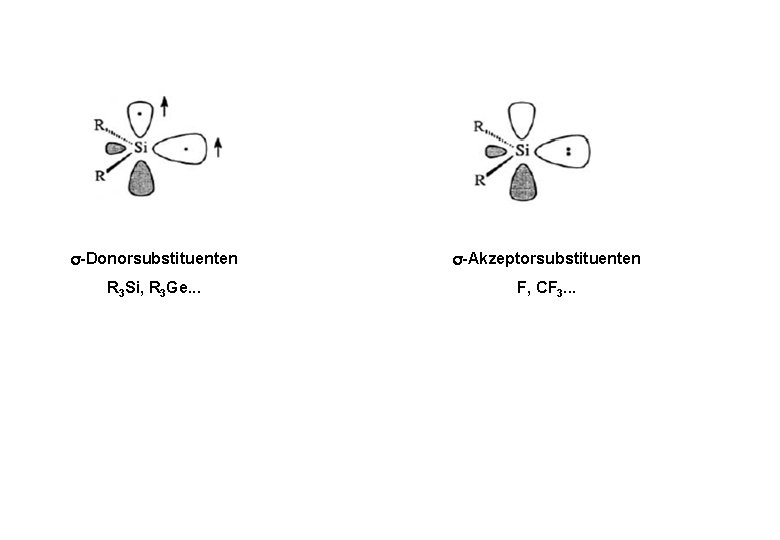
-Donorsubstituenten -Akzeptorsubstituenten NR 2; OR, Cl aryl, vinyl, ethinyl

-Donorsubstituenten -Akzeptorsubstituenten R 3 Si, R 3 Ge. . . F, CF 3. . .

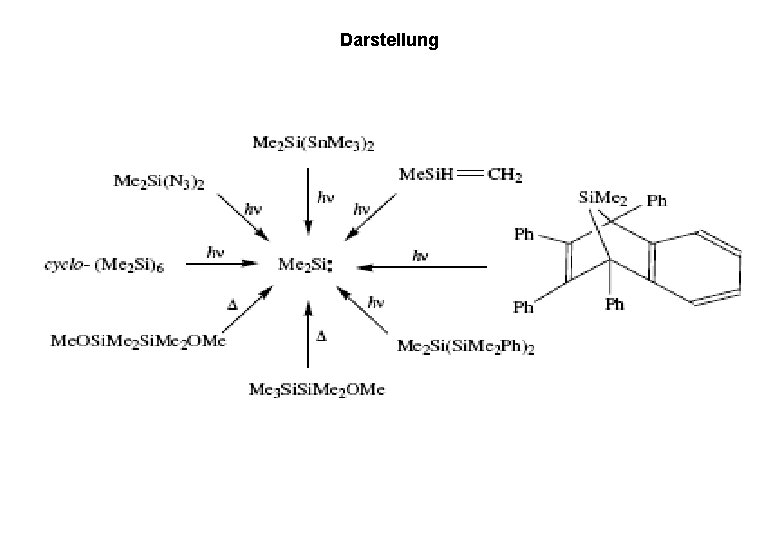
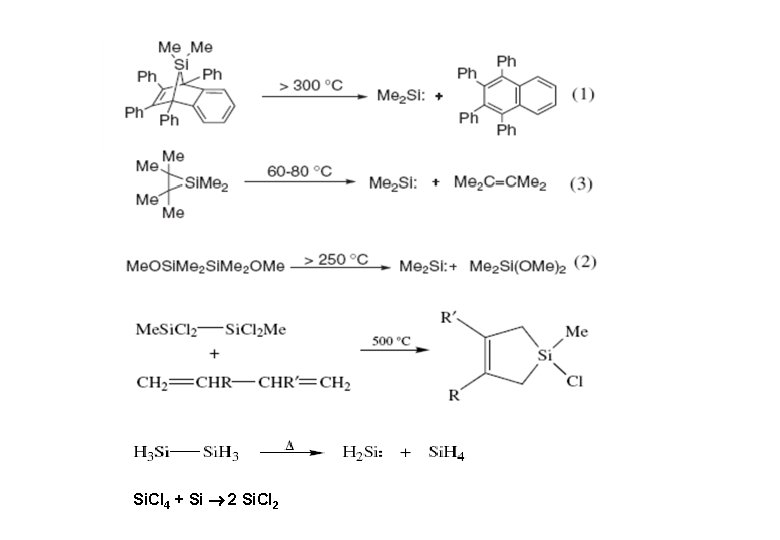
Darstellung

Si. Cl 4 + Si 2 Si. Cl 2



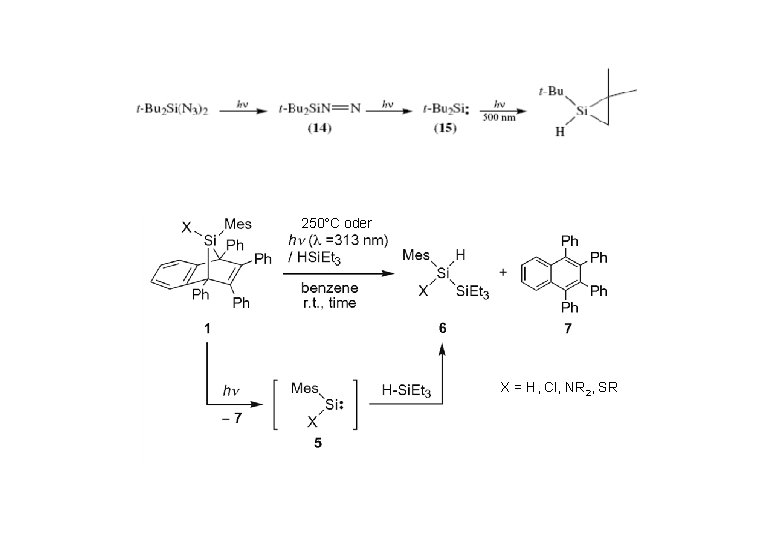
250°C oder X = H, Cl, NR 2, SR

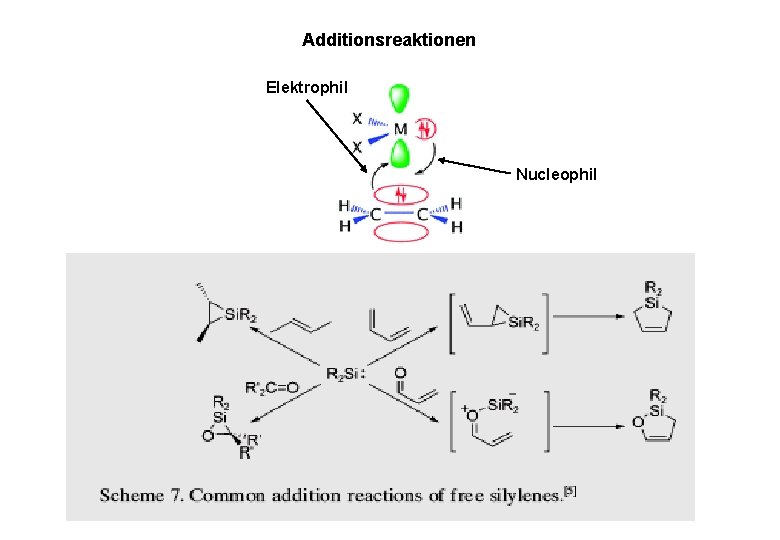
Additionsreaktionen Elektrophil Nucleophil

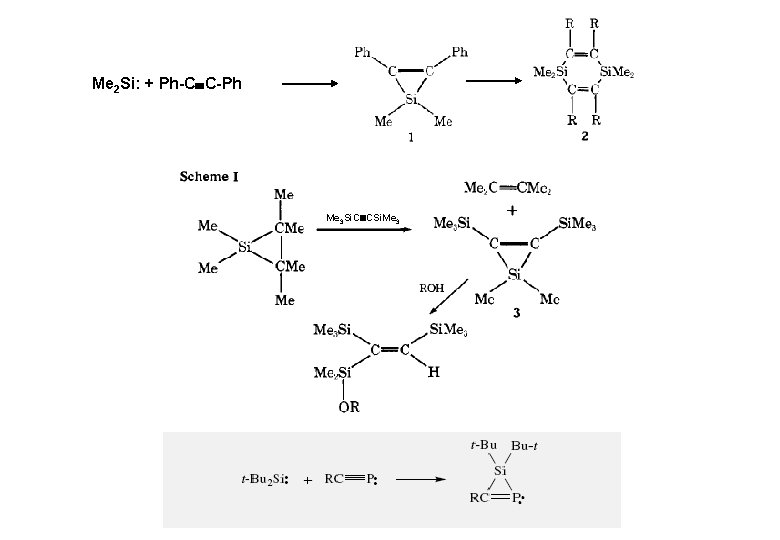
Me 2 Si: + Ph-C C-Ph Me 3 Si. C CSi. Me 3

29

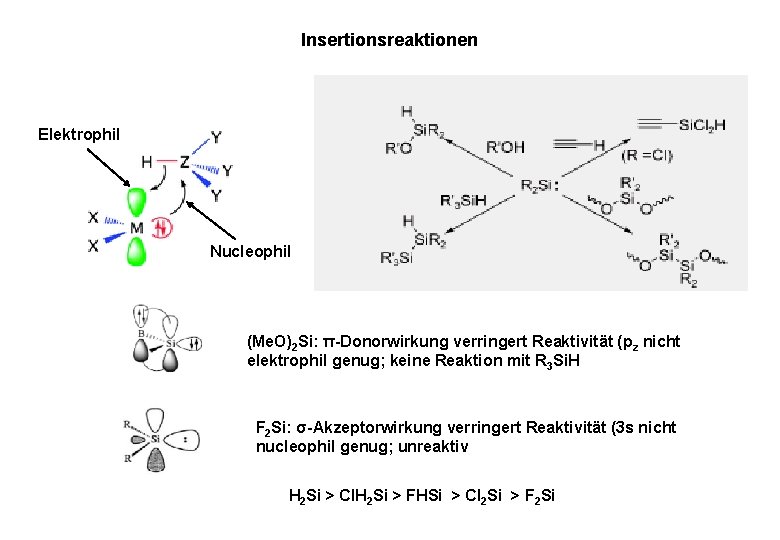
Insertionsreaktionen Elektrophil Nucleophil (Me. O)2 Si: π-Donorwirkung verringert Reaktivität (pz nicht elektrophil genug; keine Reaktion mit R 3 Si. H F 2 Si: σ-Akzeptorwirkung verringert Reaktivität (3 s nicht nucleophil genug; unreaktiv H 2 Si > Cl. H 2 Si > FHSi > Cl 2 Si > F 2 Si

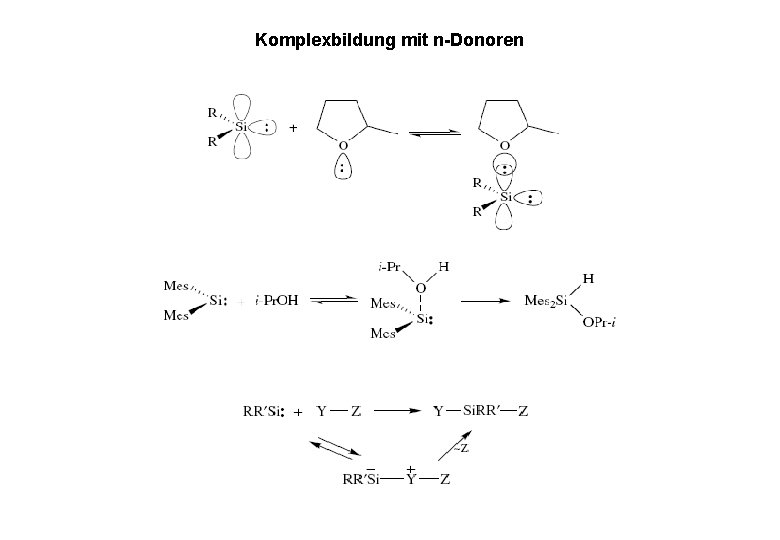
Komplexbildung mit n-Donoren


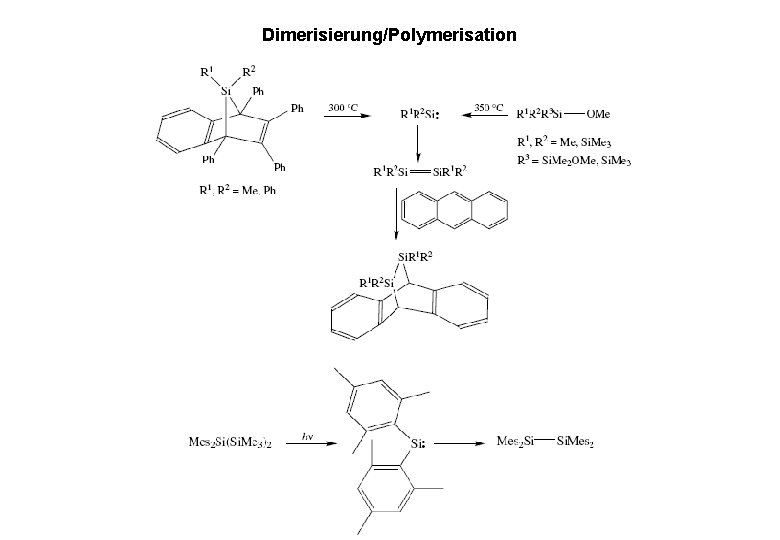
Dimerisierung/Polymerisation

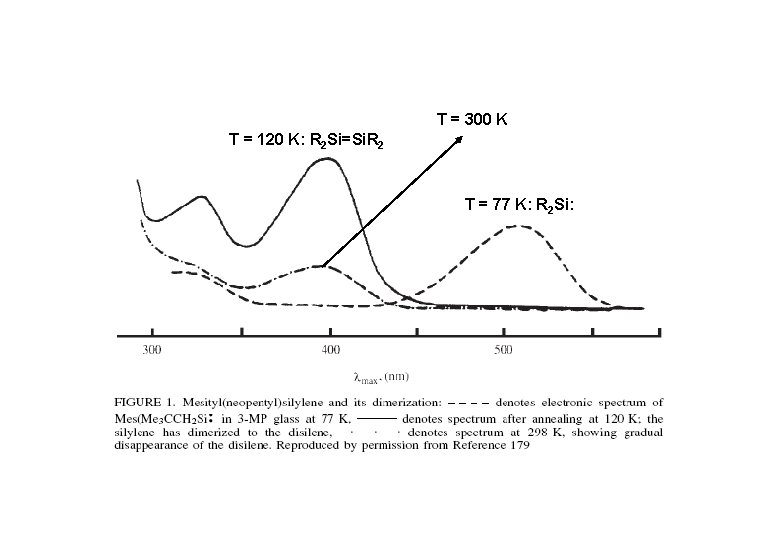
T = 300 K T = 120 K: R 2 Si=Si. R 2 T = 77 K: R 2 Si:


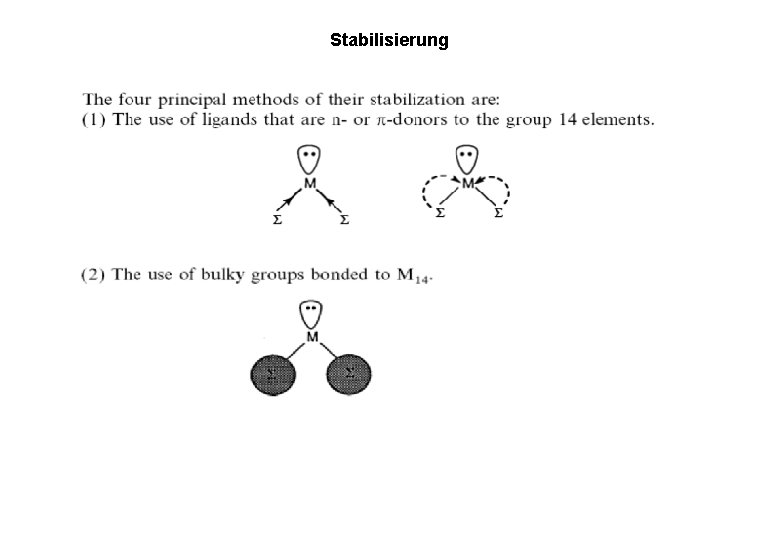
Stabilisierung

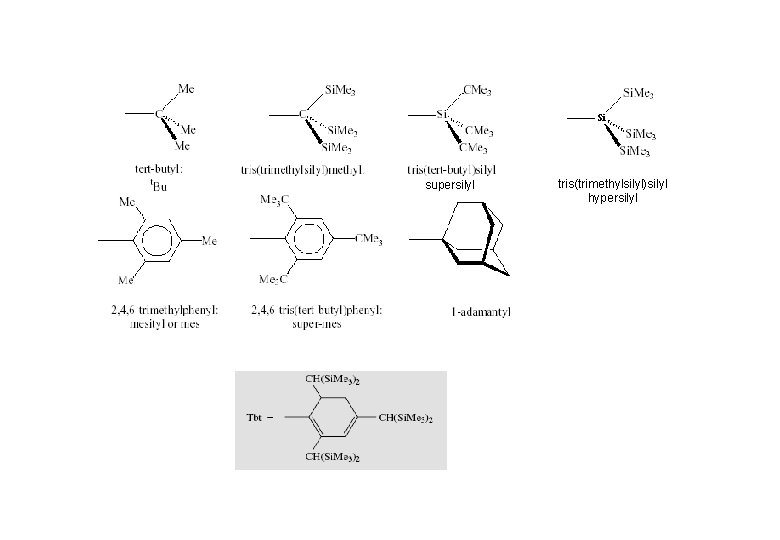
Si supersilyl tris(trimethylsilyl)silyl hypersilyl


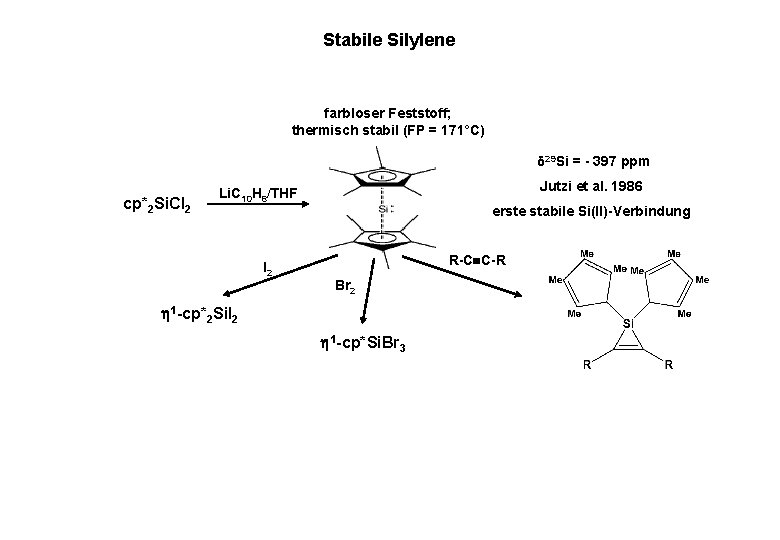
Stabile Silylene farbloser Feststoff; thermisch stabil (FP = 171°C) δ 29 Si = - 397 ppm cp*2 Si. Cl 2 Jutzi et al. 1986 Li. C 10 H 8/THF erste stabile Si(II)-Verbindung R-C C-R I 2 Br 2 1 -cp*2 Si. I 2 1 -cp*Si. Br 3

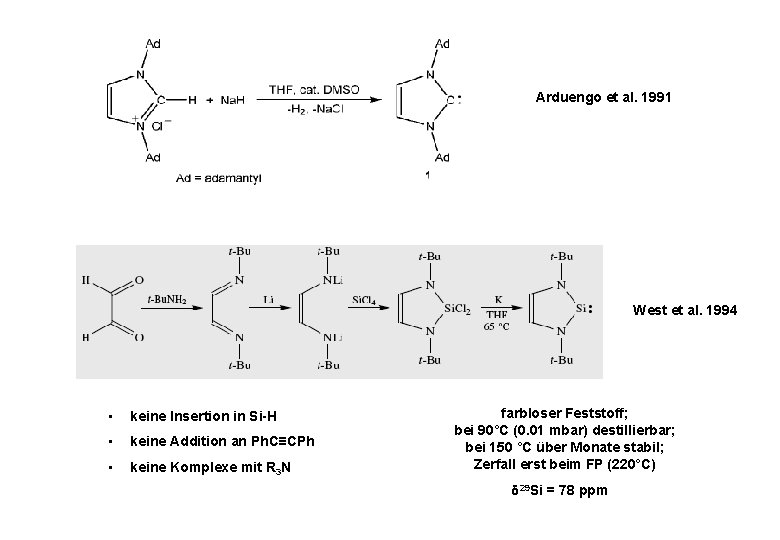
Arduengo et al. 1991 West et al. 1994 • keine Insertion in Si-H • keine Addition an Ph. C≡CPh • keine Komplexe mit R 3 N farbloser Feststoff; bei 90°C (0. 01 mbar) destillierbar; bei 150 °C über Monate stabil; Zerfall erst beim FP (220°C) δ 29 Si = 78 ppm

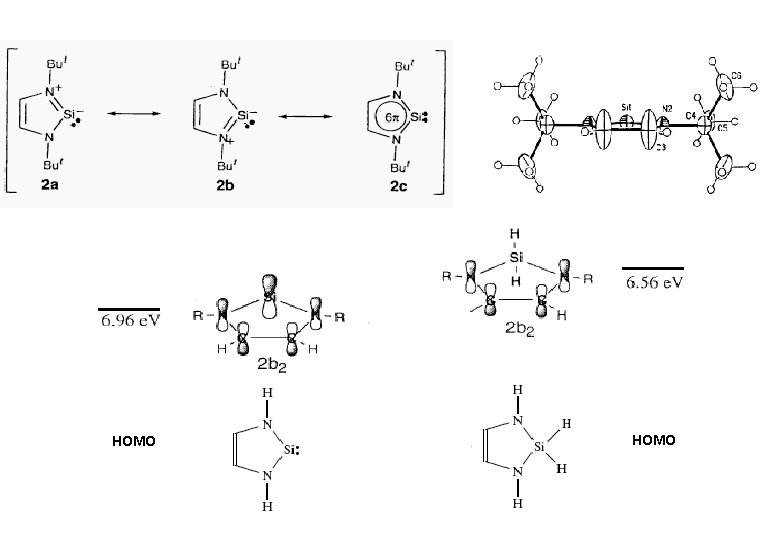
HOMO

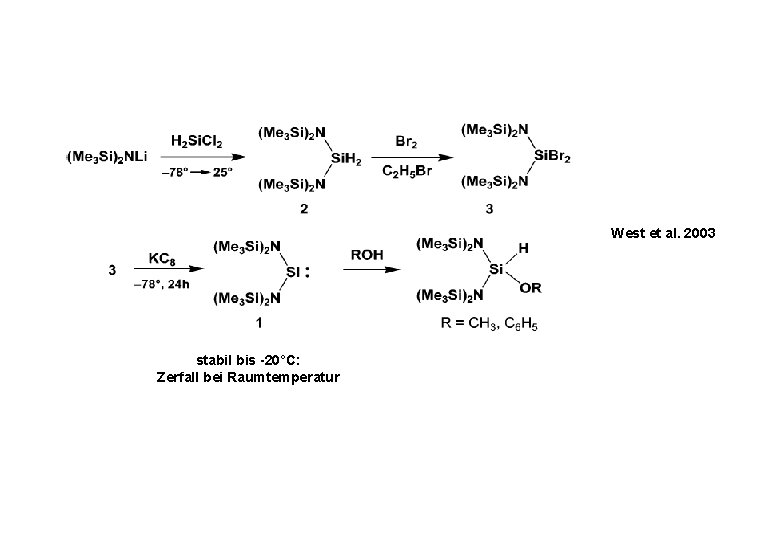
West et al. 2003 stabil bis -20°C: Zerfall bei Raumtemperatur

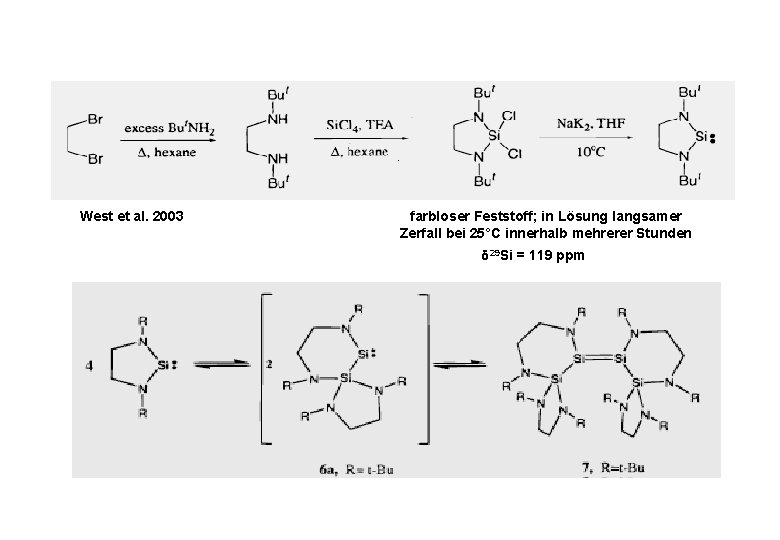
West et al. 2003 farbloser Feststoff; in Lösung langsamer Zerfall bei 25°C innerhalb mehrerer Stunden δ 29 Si = 119 ppm

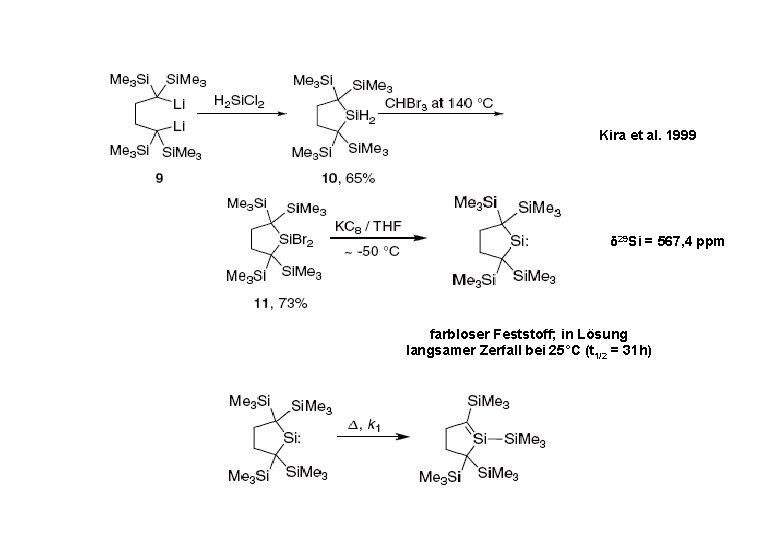
Kira et al. 1999 δ 29 Si = 567, 4 ppm farbloser Feststoff; in Lösung langsamer Zerfall bei 25°C (t 1/2 = 31 h)


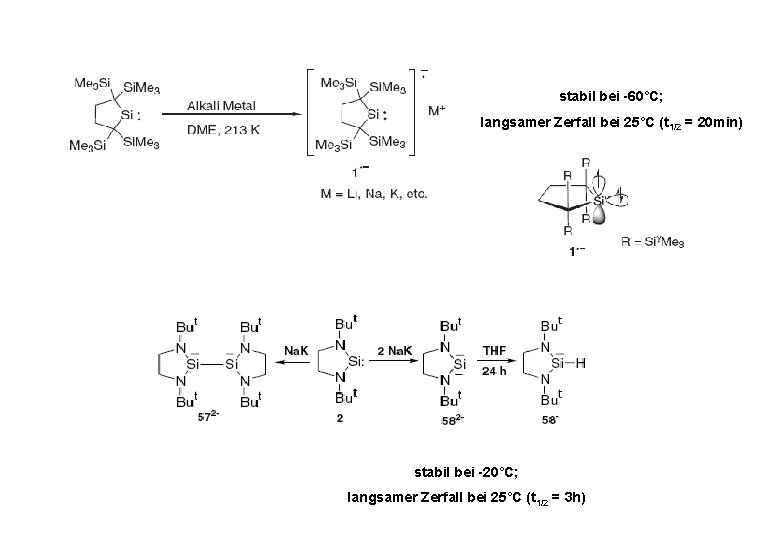
stabil bei -60°C; langsamer Zerfall bei 25°C (t 1/2 = 20 min) stabil bei -20°C; langsamer Zerfall bei 25°C (t 1/2 = 3 h)


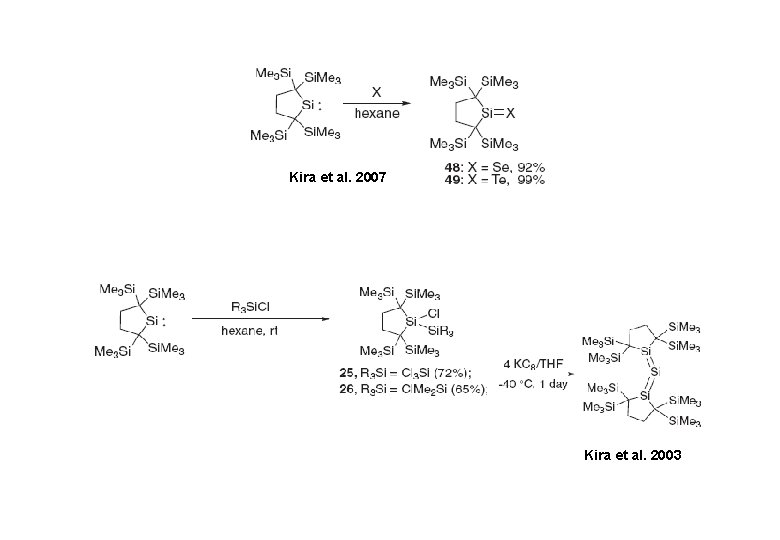
Kira et al. 2007 Kira et al. 2003

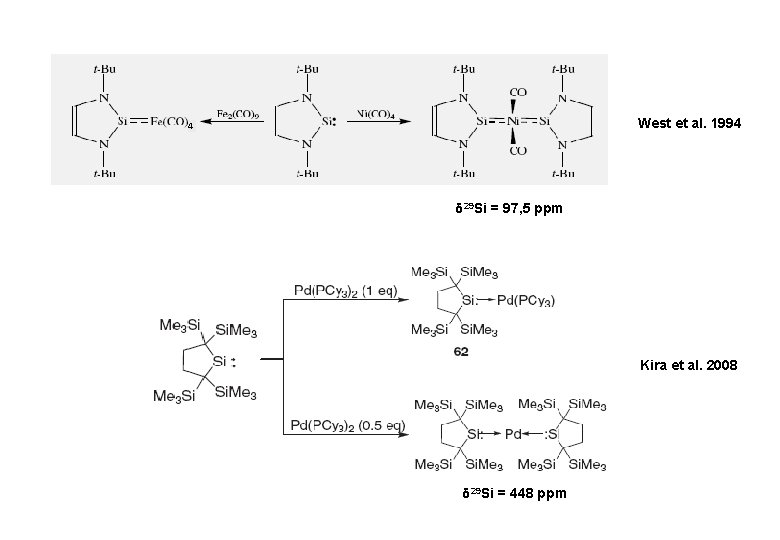
West et al. 1994 4 δ 29 Si = 97, 5 ppm Kira et al. 2008 δ 29 Si = 448 ppm

Roesky et al. 2009 stable at room temperature δ 29 Si = 19, 6 ppm Roesky et al. 2010 δ 29 Si = 43, 2 ppm

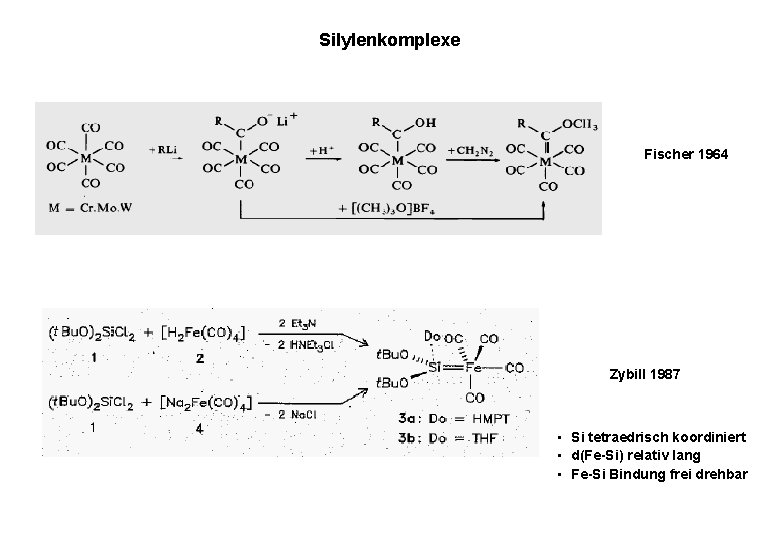
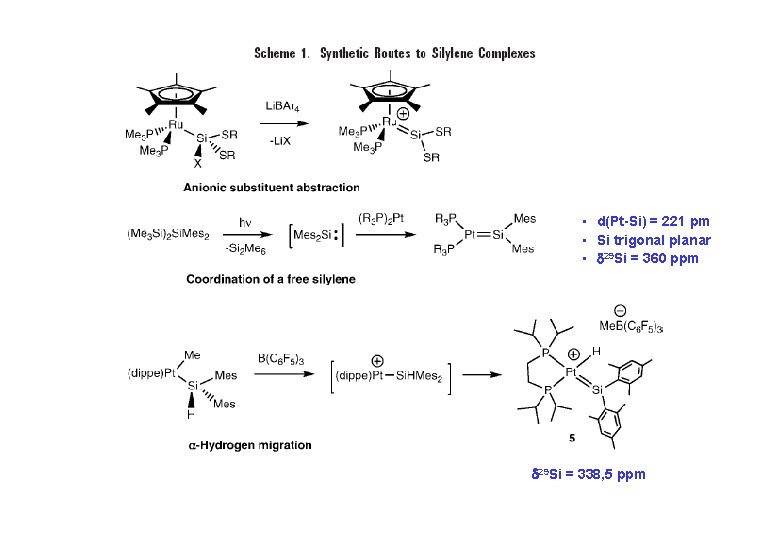
Silylenkomplexe Fischer 1964 Zybill 1987 • Si tetraedrisch koordiniert • d(Fe-Si) relativ lang • Fe-Si Bindung frei drehbar

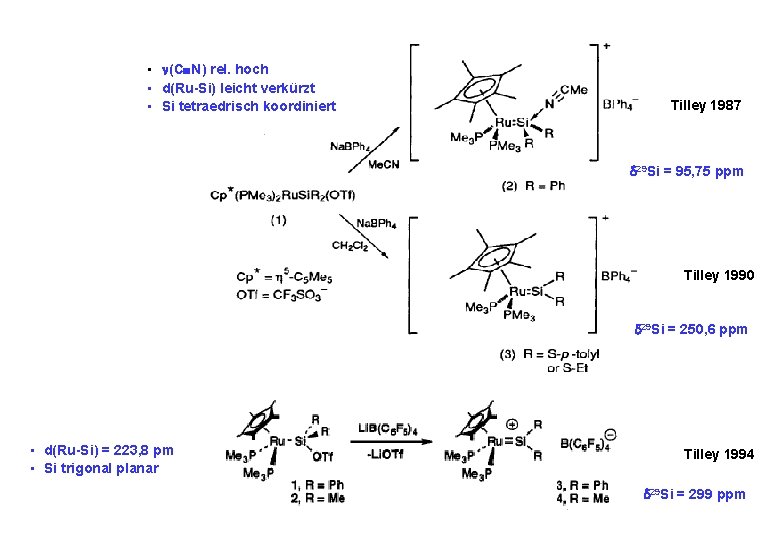
• (C N) rel. hoch • d(Ru-Si) leicht verkürzt • Si tetraedrisch koordiniert Tilley 1987 29 Si = 95, 75 ppm Tilley 1990 29 Si = 250, 6 ppm • d(Ru-Si) = 223, 8 pm • Si trigonal planar Tilley 1994 29 Si = 299 ppm

• d(Pt-Si) = 221 pm • Si trigonal planar • 29 Si = 360 ppm 29 Si = 338, 5 ppm


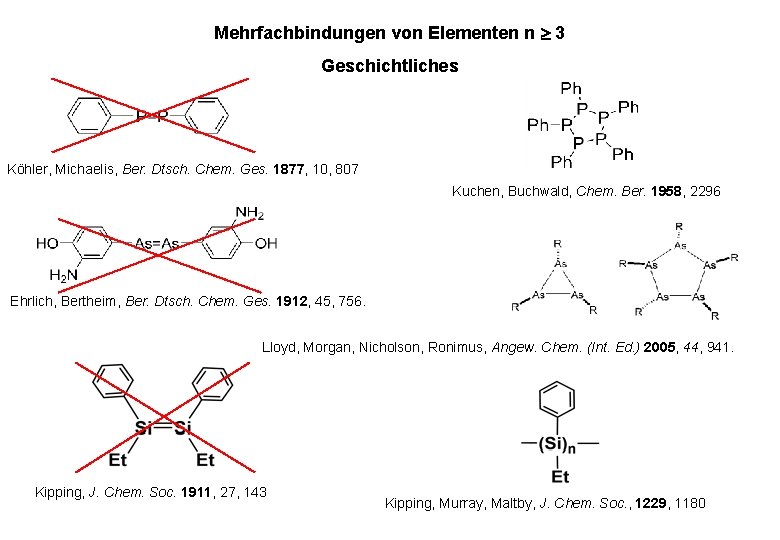
Mehrfachbindungen von Elementen n 3 Geschichtliches Köhler, Michaelis, Ber. Dtsch. Chem. Ges. 1877, 10, 807 Kuchen, Buchwald, Chem. Ber. 1958, 2296 Ehrlich, Bertheim, Ber. Dtsch. Chem. Ges. 1912, 45, 756. Lloyd, Morgan, Nicholson, Ronimus, Angew. Chem. (Int. Ed. ) 2005, 44, 941. Kipping, J. Chem. Soc. 1911, 27, 143 Kipping, Murray, Maltby, J. Chem. Soc. , 1229, 1180

Doppelbindungs Regel: Elemente jenseits der zweiten Periode des PSE bilden keine Mehrfachbindungen mit sich oder anderen Elementen. Becker 1976 Niecke 1973 Yoshifuji 1981 meanwhile. . . Brook, 1981 Bickelhaupt, 1984 Appel, 1983 West, 1981 Lappert, 1973/1986 Lappert, 1986 Cowley, 1983 Pietschnig, 2004 Sekiguchi, 2004 and many more. . .

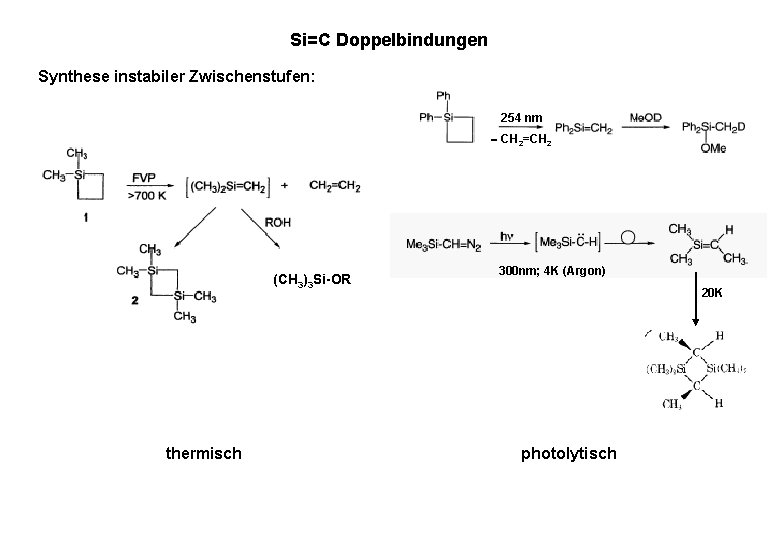
Si=C Doppelbindungen Synthese instabiler Zwischenstufen: 254 nm CH 2=CH 2 (CH 3)3 Si-OR thermisch 300 nm; 4 K (Argon) 20 K photolytisch

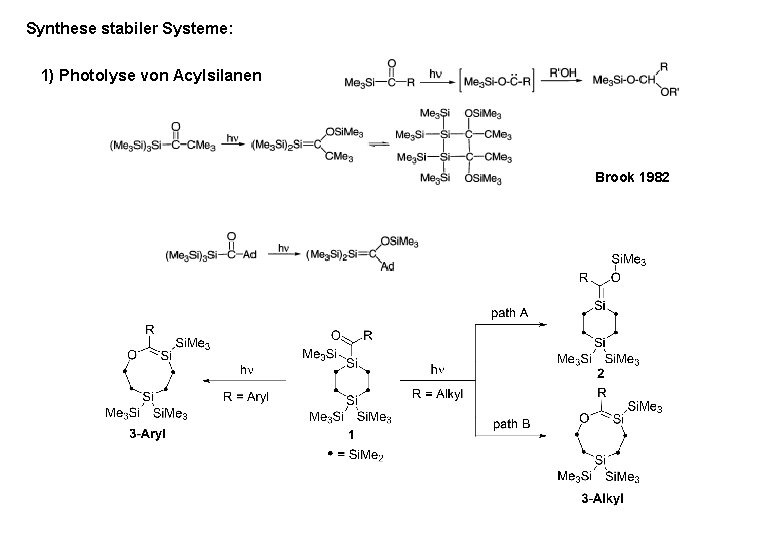
Synthese stabiler Systeme: 1) Photolyse von Acylsilanen Brook 1982

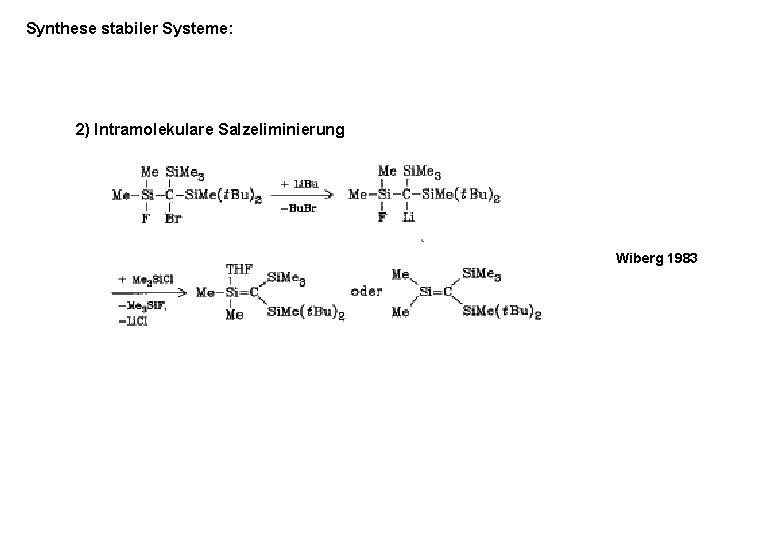
Synthese stabiler Systeme: 2) Intramolekulare Salzeliminierung Wiberg 1983

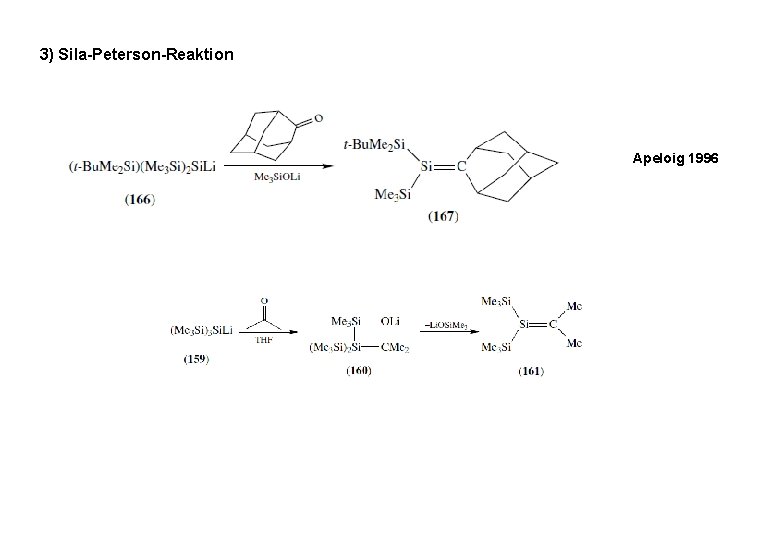
3) Sila-Peterson-Reaktion Apeloig 1996

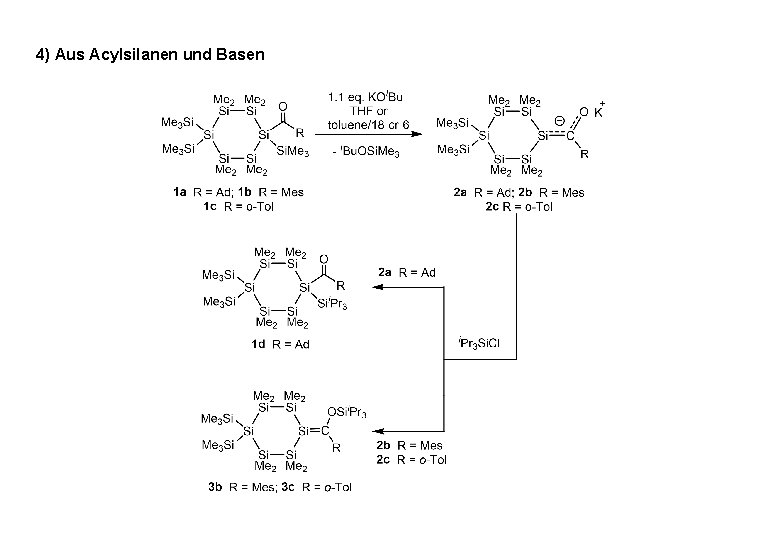
4) Aus Acylsilanen und Basen

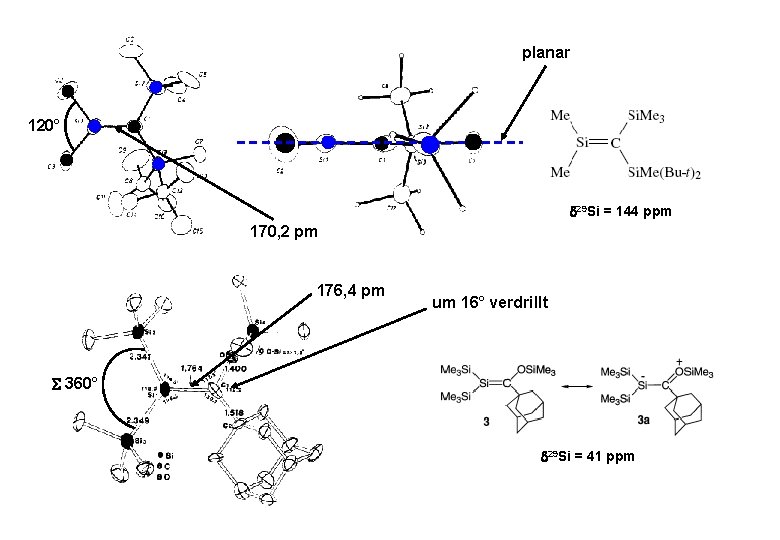
planar 120° 29 Si = 144 ppm 170, 2 pm 176, 4 pm um 16° verdrillt 360° 29 Si = 41 ppm

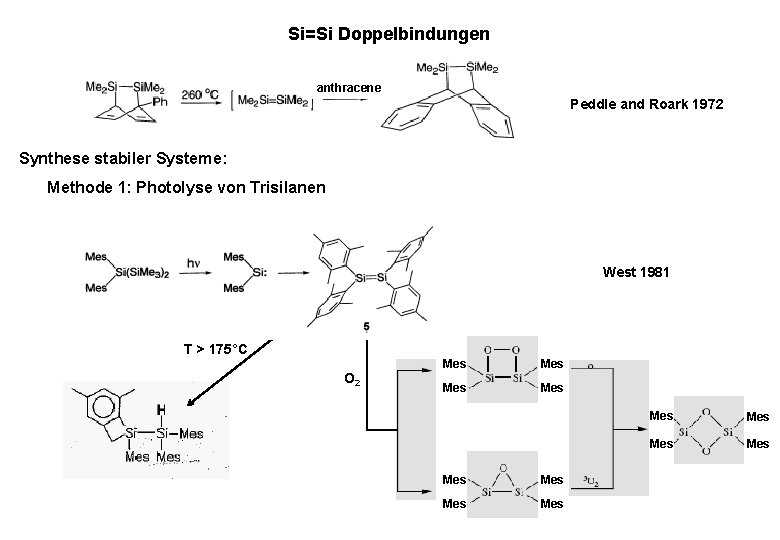
Si=Si Doppelbindungen anthracene Peddle and Roark 1972 Synthese stabiler Systeme: Methode 1: Photolyse von Trisilanen West 1981 T > 175°C O 2 Mes Mes Mes

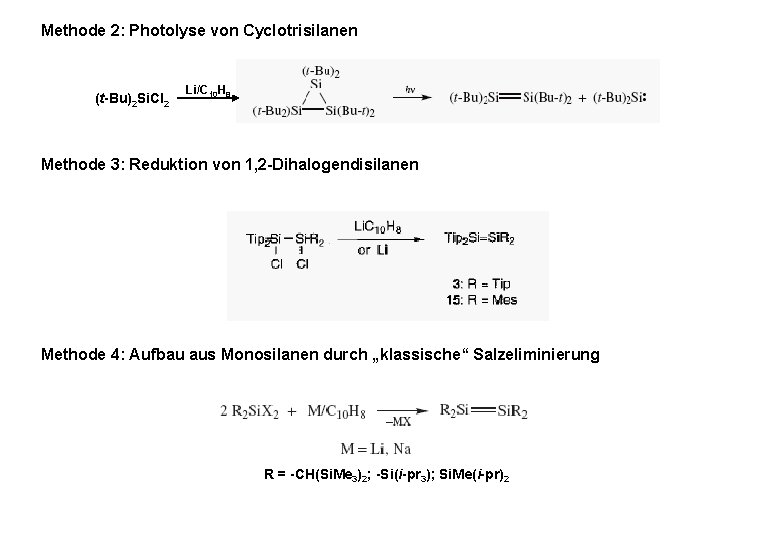
Methode 2: Photolyse von Cyclotrisilanen (t-Bu)2 Si. Cl 2 Li/C 10 H 8 Methode 3: Reduktion von 1, 2 -Dihalogendisilanen Methode 4: Aufbau aus Monosilanen durch „klassische“ Salzeliminierung R = -CH(Si. Me 3)2; -Si(i-pr 3); Si. Me(i-pr)2

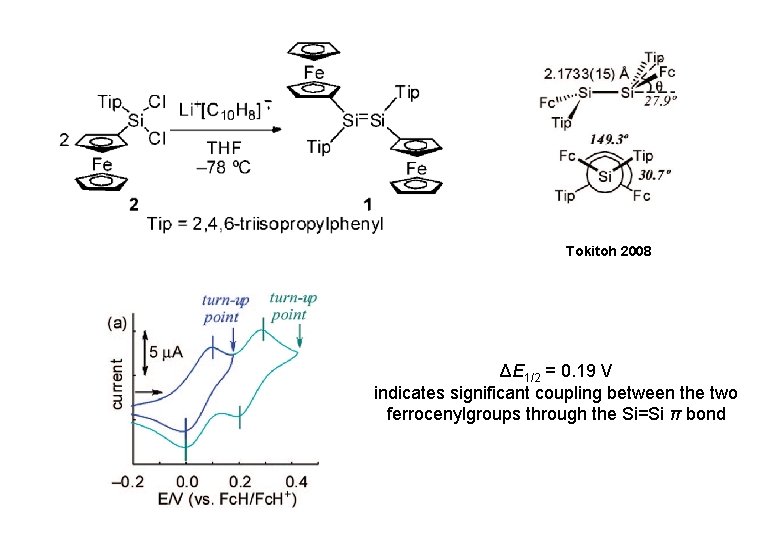
Tokitoh 2008 ΔE 1/2 = 0. 19 V indicates significant coupling between the two ferrocenylgroups through the Si=Si π bond

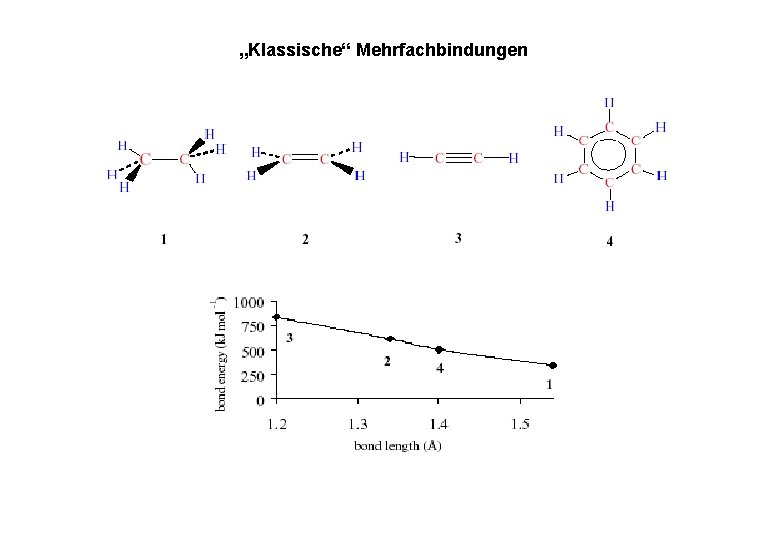
„Klassische“ Mehrfachbindungen

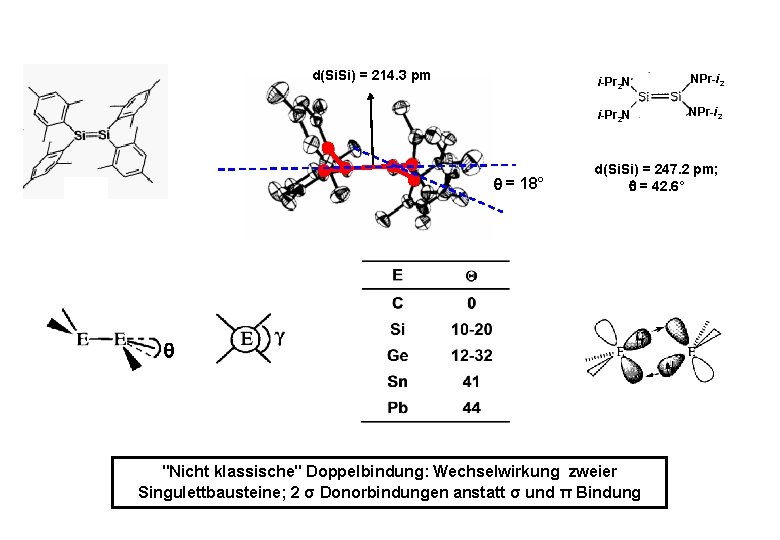
d(Si. Si) = 214. 3 pm = 18° i-Pr 2 N NPr-i 2 d(Si. Si) = 247. 2 pm; = 42. 6° "Nicht klassische" Doppelbindung: Wechselwirkung zweier Singulettbausteine; 2 σ Donorbindungen anstatt σ und π Bindung

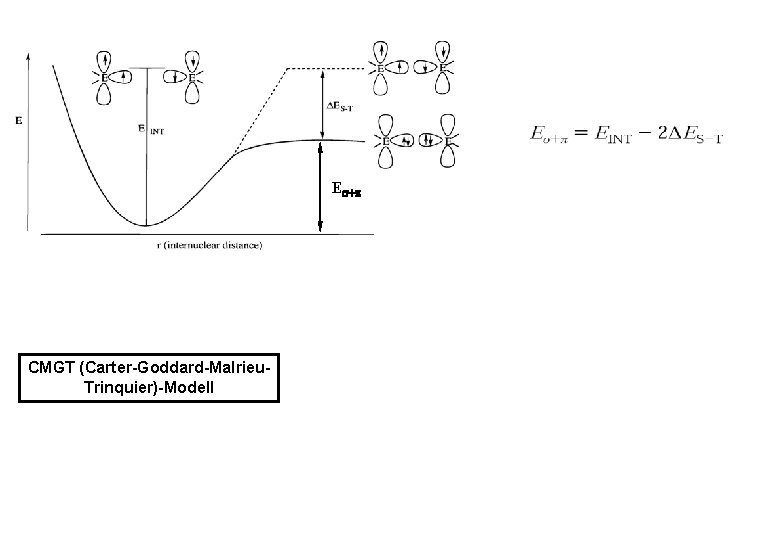
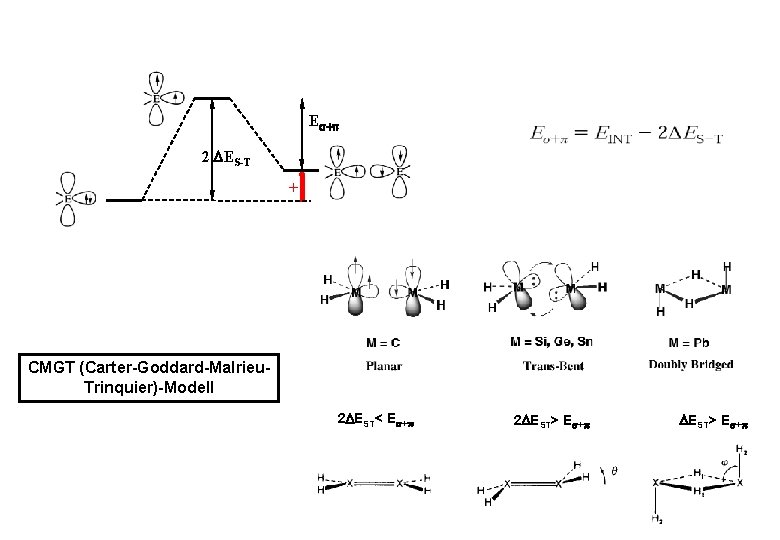
E + CMGT (Carter-Goddard-Malrieu. Trinquier)-Modell

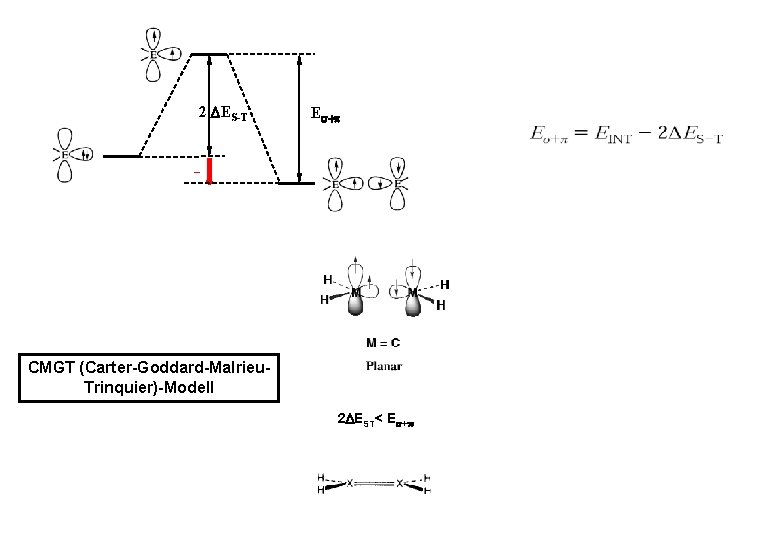
2 ES-T E + - CMGT (Carter-Goddard-Malrieu. Trinquier)-Modell 2 EST< E +

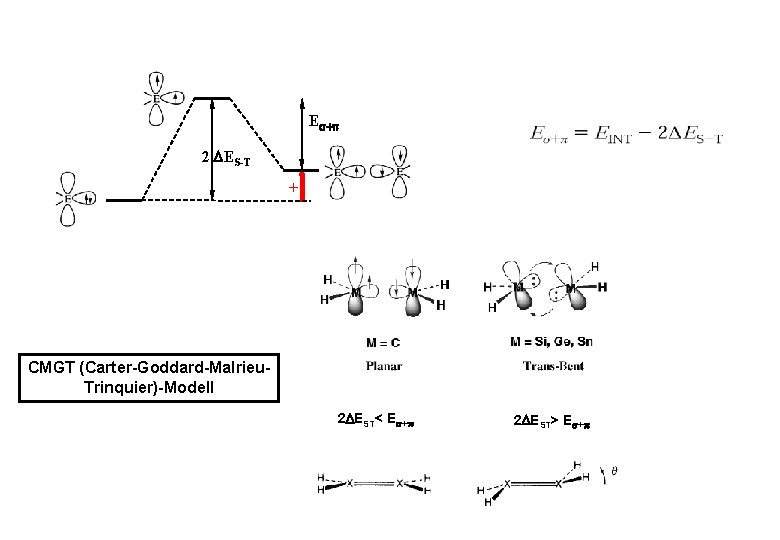
E + 2 ES-T + CMGT (Carter-Goddard-Malrieu. Trinquier)-Modell 2 EST< E + 2 EST> E +

E + 2 ES-T + CMGT (Carter-Goddard-Malrieu. Trinquier)-Modell 2 EST< E + 2 EST> E +

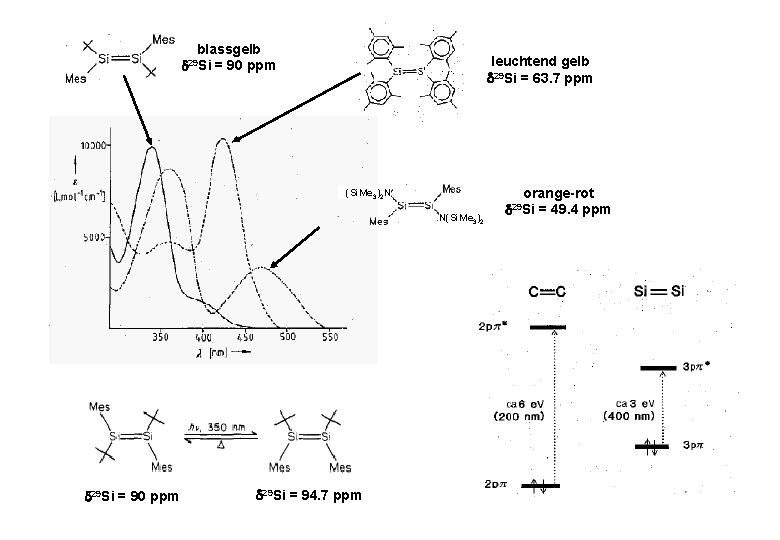
blassgelb leuchtend gelb 29 Si = 63. 7 ppm 29 Si = 90 ppm orange-rot (Si. Me 3)2 N N(Si. Me 3)2 29 Si = 90 ppm 29 Si = 94. 7 ppm 29 Si = 49. 4 ppm

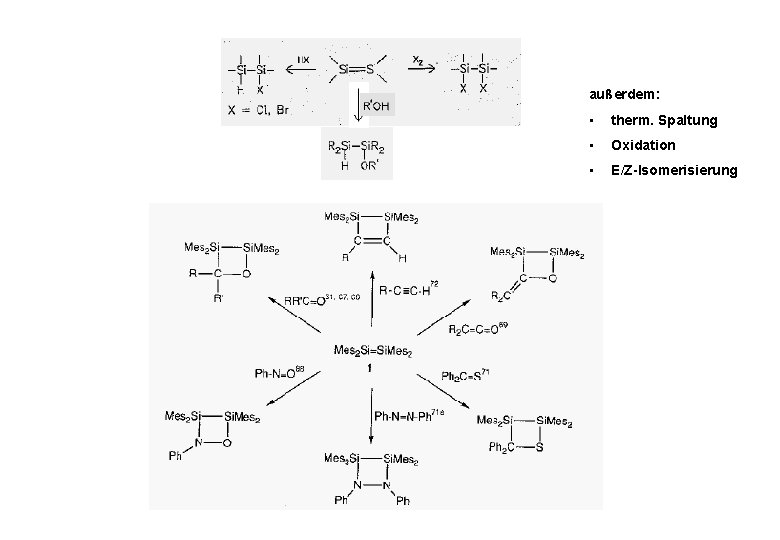
außerdem: • therm. Spaltung • Oxidation • E/Z-Isomerisierung

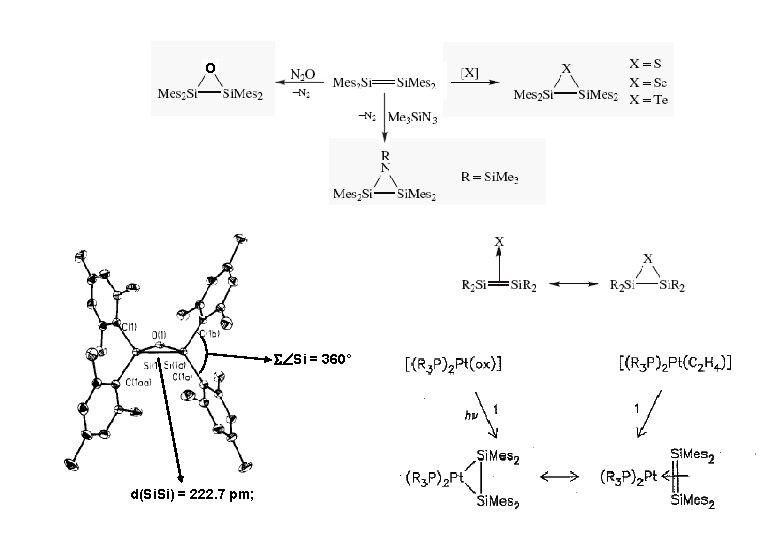
O Si = 360° d(Si. Si) = 222. 7 pm;

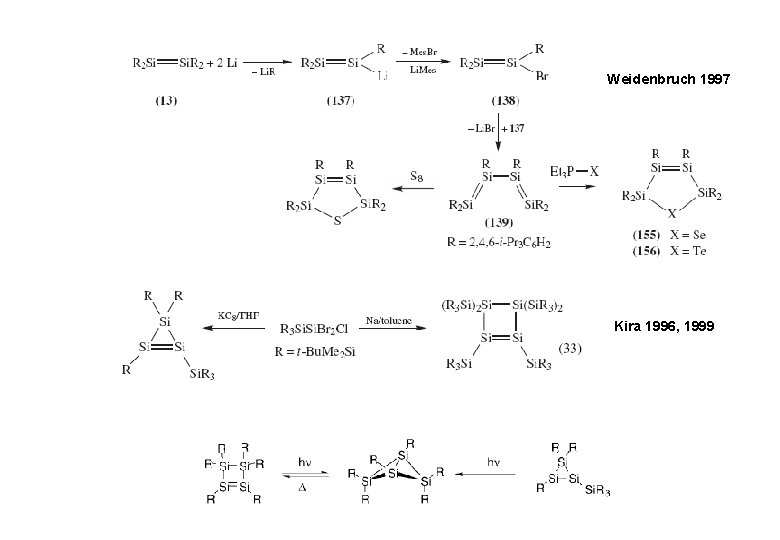
Weidenbruch 1997 Kira 1996, 1999

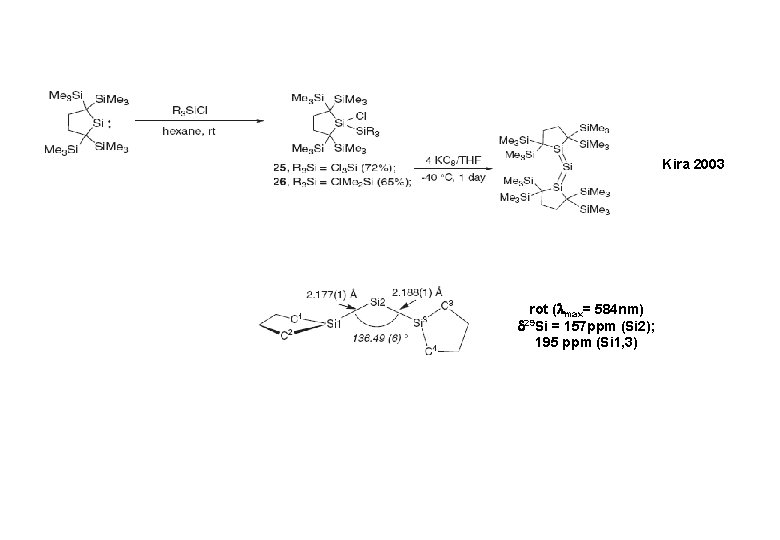
Kira 2003 rot ( max= 584 nm) 29 Si = 157 ppm (Si 2); 195 ppm (Si 1, 3)

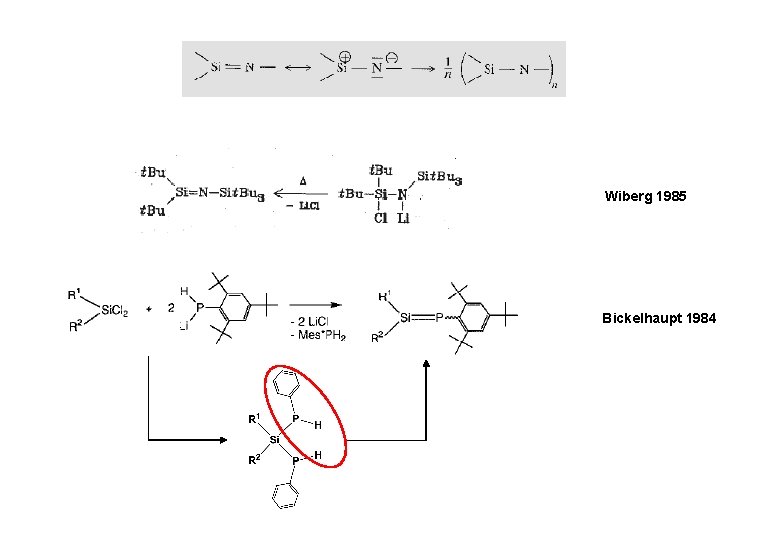
Wiberg 1985 Bickelhaupt 1984

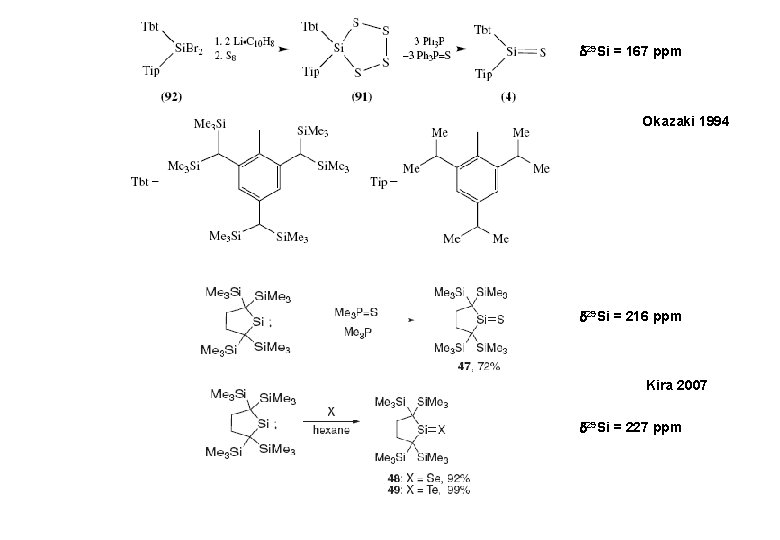
29 Si = 167 ppm Okazaki 1994 29 Si = 216 ppm Kira 2007 29 Si = 227 ppm

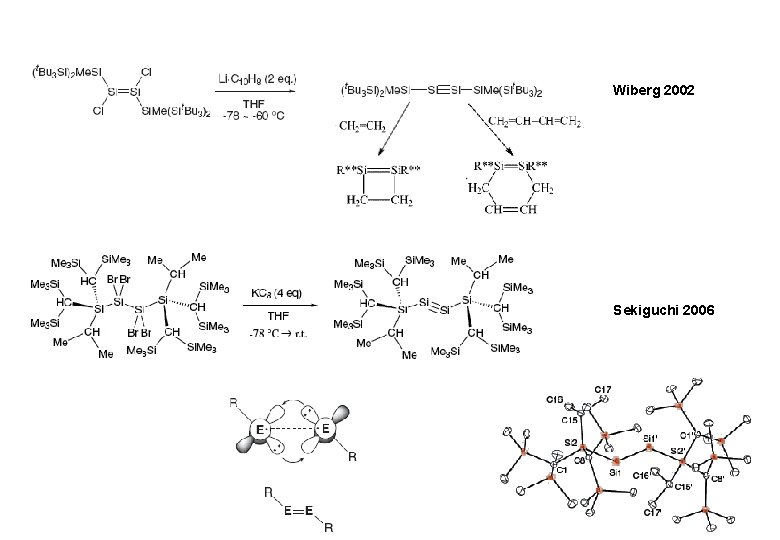
Wiberg 2002 Sekiguchi 2006



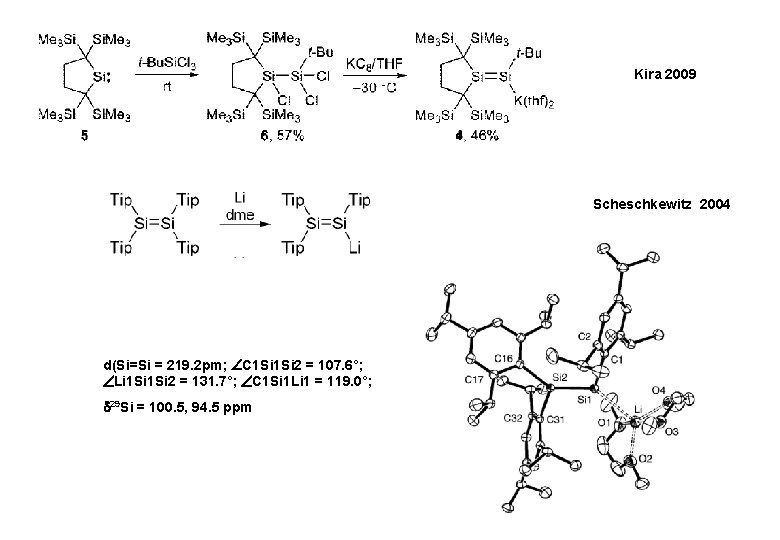
Kira 2009 Scheschkewitz 2004 d(Si=Si = 219. 2 pm; C 1 Si 2 = 107. 6°; Li 1 Si 2 = 131. 7°; C 1 Si 1 Li 1 = 119. 0°; 29 Si = 100. 5, 94. 5 ppm

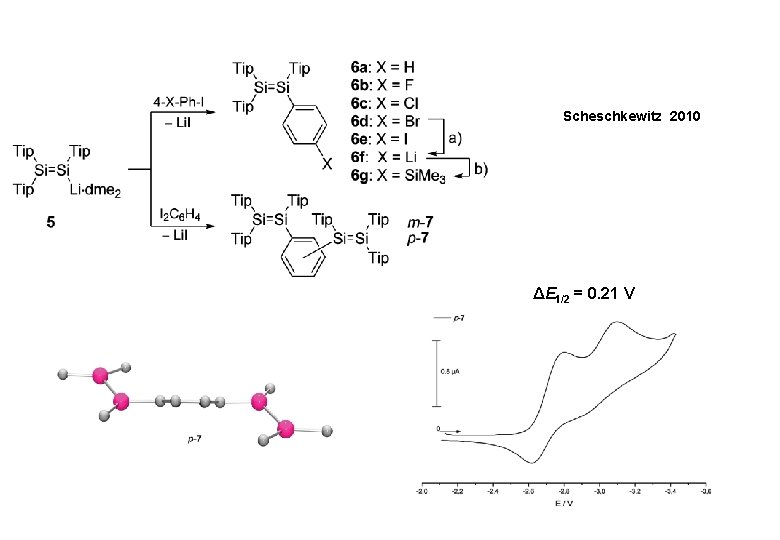
Scheschkewitz 2010 ΔE 1/2 = 0. 21 V

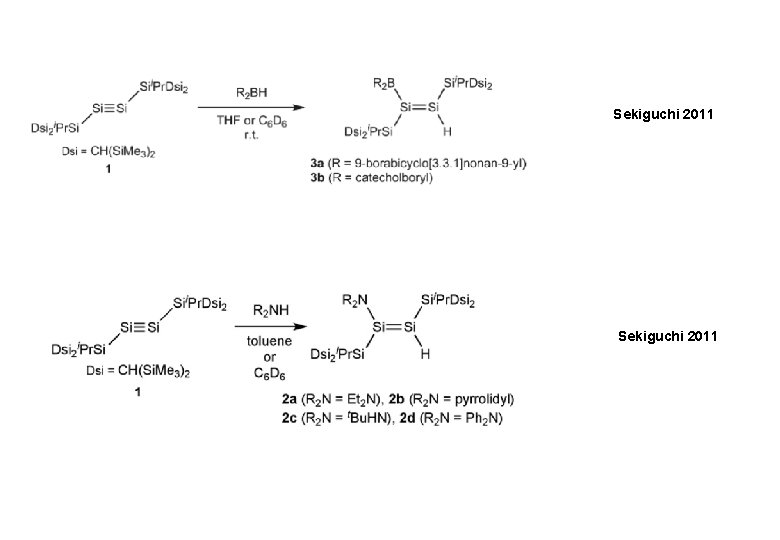
Sekiguchi 2011


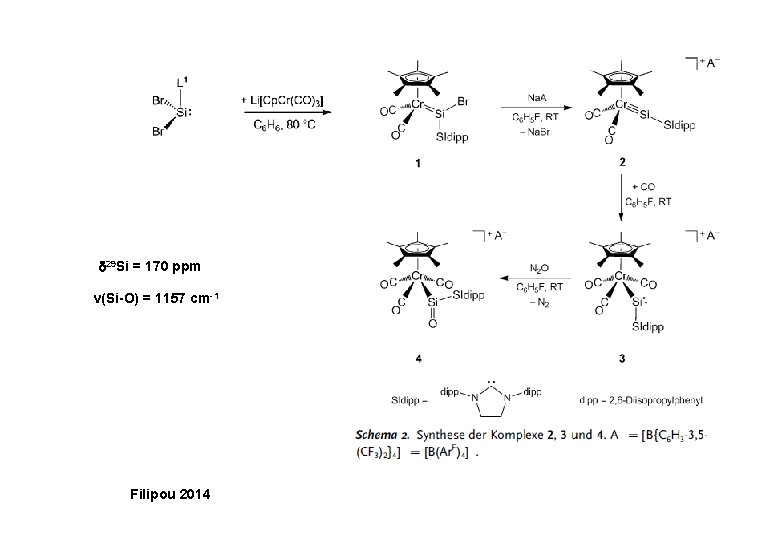
29 Si = 170 ppm ν(Si-O) = 1157 cm-1 Filipou 2014

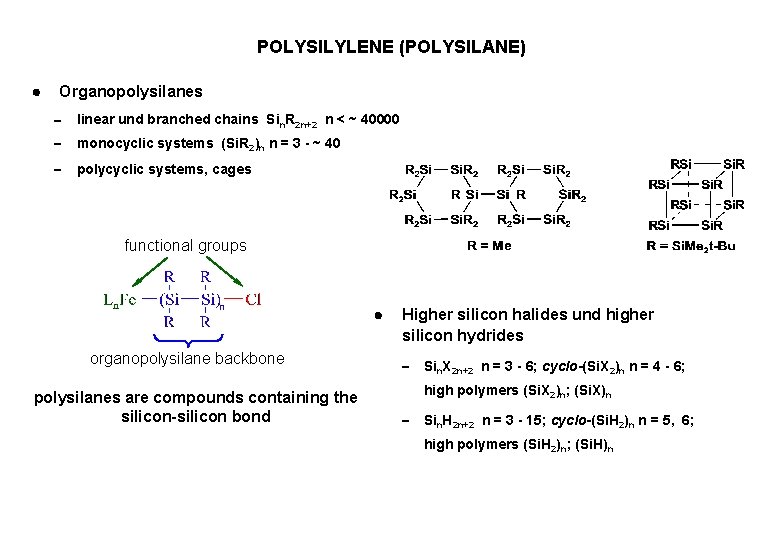
POLYSILYLENE (POLYSILANE) Organopolysilanes linear und branched chains Sin. R 2 n+2 n < ~ 40000 monocyclic systems (Si. R 2)n n = 3 - ~ 40 polycyclic systems, cages functional groups organopolysilane backbone polysilanes are compounds containing the silicon-silicon bond Higher silicon halides und higher silicon hydrides Sin. X 2 n+2 n = 3 - 6; cyclo-(Si. X 2)n n = 4 - 6; high polymers (Si. X 2)n; (Si. X)n Sin. H 2 n+2 n = 3 - 15; cyclo-(Si. H 2)n n = 5, 6; high polymers (Si. H 2)n; (Si. H)n

Metallorganische Chemie der 4. Hauptgruppe • Elektronegativitätsdifferenz E-C • energetisch passende leere Orbitale verfügbar

Si-C- Bindungsspaltung • Si-C-Bindungen sind nucleophil und elektrophil spaltbar • Reaktivität hängt vom Substrat und von den Substituenten am Si ab

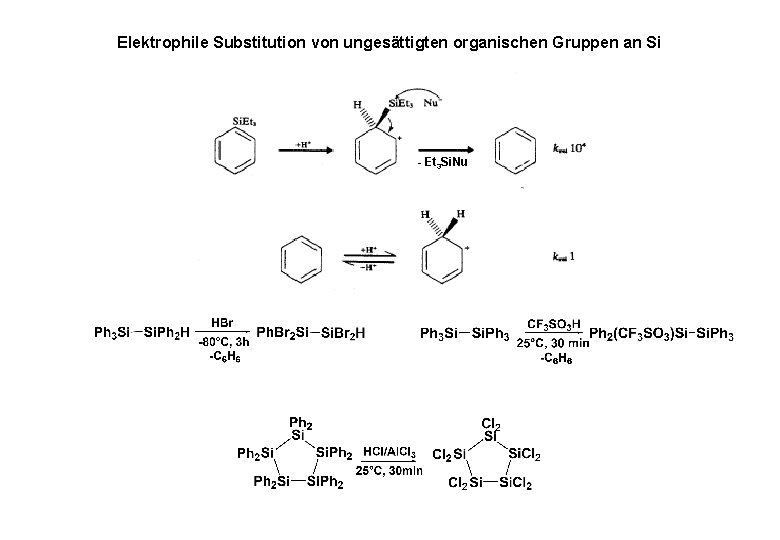
Elektrophile Substitution von ungesättigten organischen Gruppen an Si - Et 3 Si. Nu

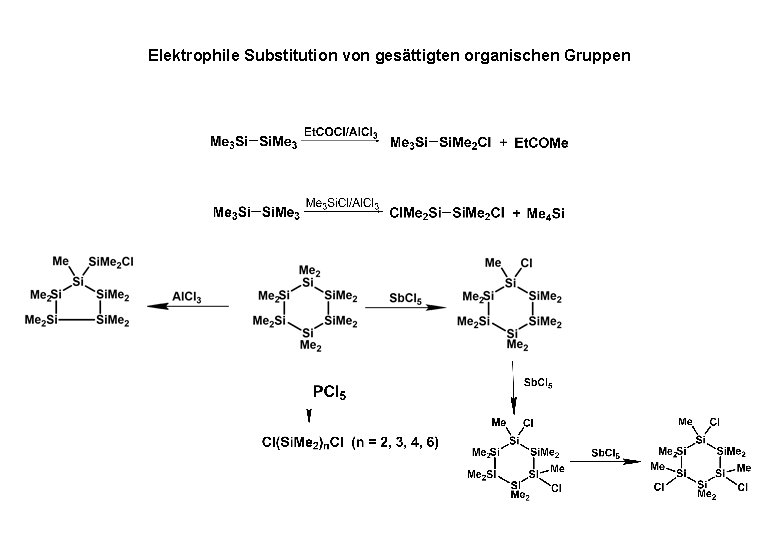
Elektrophile Substitution von gesättigten organischen Gruppen

Si-X- Bindungsspaltung silicon is coordinatively unsaturated nucleophilic substitution at Si occurs much more facile hypervalent transition states Chlorosilanes, aminosilanes and silyl ethers hydrolytically unstable Polysilanes unstable under basic conditions Chlorosilanes are valuable precursors

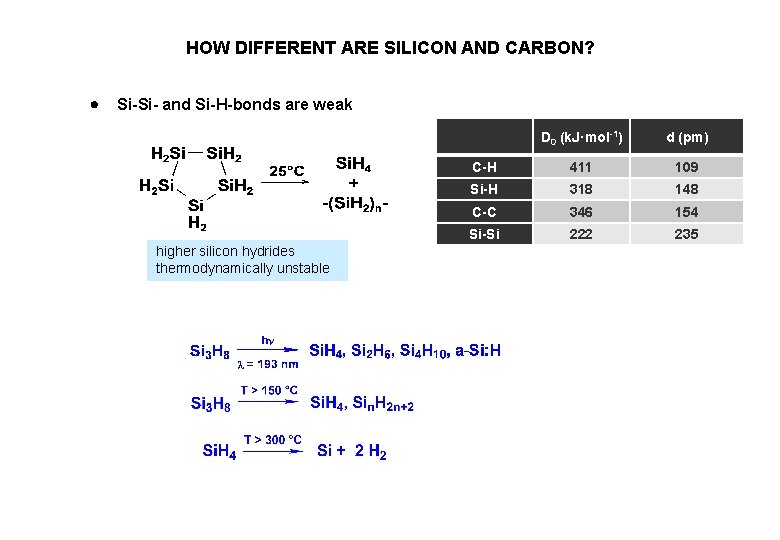
HOW DIFFERENT ARE SILICON AND CARBON? Si-Si- and Si-H-bonds are weak higher silicon hydrides thermodynamically unstable D 0 (k. J·mol-1) d (pm) C-H 411 109 Si-H 318 148 C-C 346 154 Si-Si 222 235

HOW DIFFERENT ARE SILICON AND CARBON? the polarity of the Si-H bond is reversed H is a good leaving group Electronegativity (Pauling) silicon hydrides are easily oxidized and often pyrophoric in air H 2. 2 C 2. 55 Si 1. 9 silanes react readily with H 2 O and O 2 silicon hydrides are pyrophoric in air and unstable upon storage in glass vessels

HOW DIFFERENT ARE SILICON AND CARBON? multiple bonds to silicon are weak, while certain single bonds Si-X (X = O, Cl, F. . . ) are unusually strong

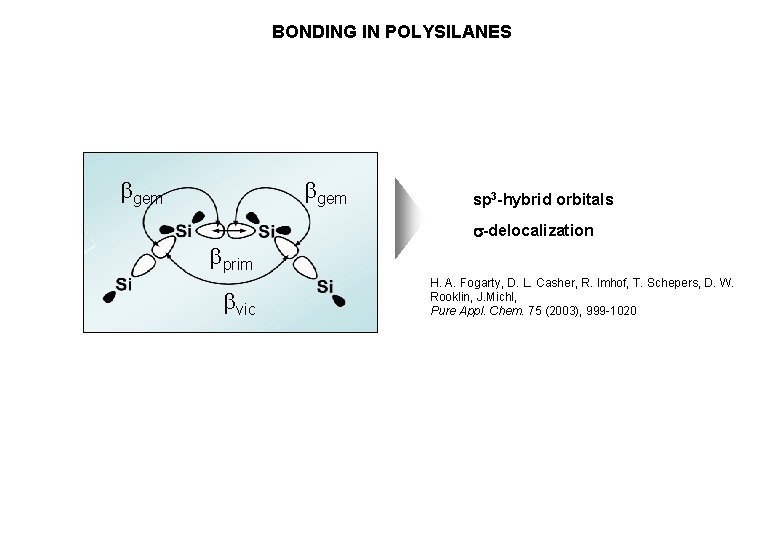
BONDING IN POLYSILANES gem prim vic sp 3 -hybrid orbitals -delocalization H. A. Fogarty, D. L. Casher, R. Imhof, T. Schepers, D. W. Rooklin, J. Michl, Pure Appl. Chem. 75 (2003), 999 -1020

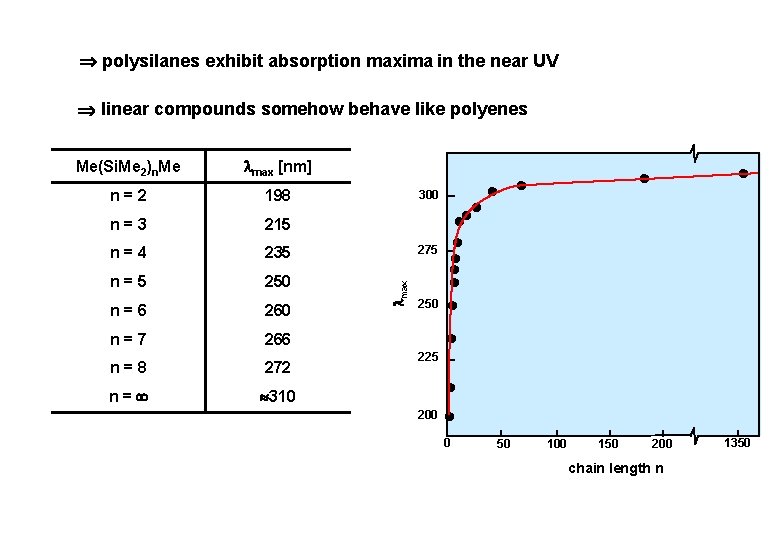
polysilanes exhibit absorption maxima in the near UV linear compounds somehow behave like polyenes max [nm] n = 2 198 n = 3 215 n = 4 235 n = 5 250 n = 6 260 n = 7 266 n = 8 272 n = 310 300 max Me(Si. Me 2)n. Me 275 250 225 200 0 50 100 150 200 chain length n 1350

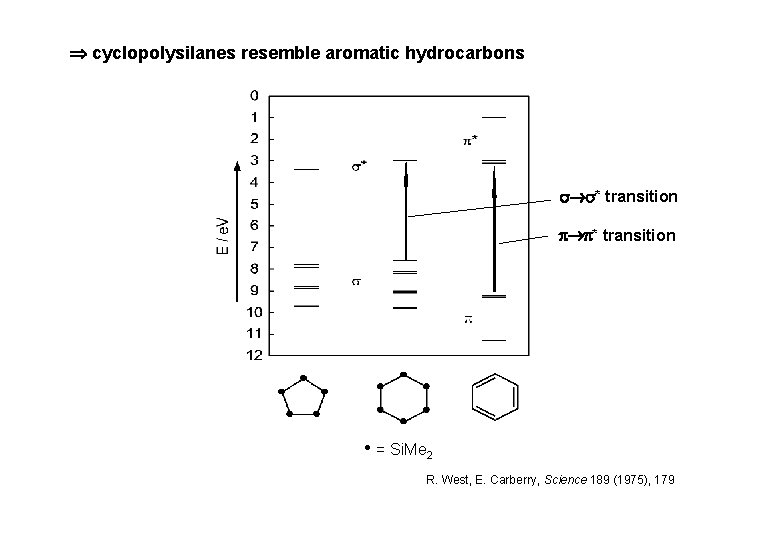
cyclopolysilanes resemble aromatic hydrocarbons * transition • = Si. Me 2 R. West, E. Carberry, Science 189 (1975), 179

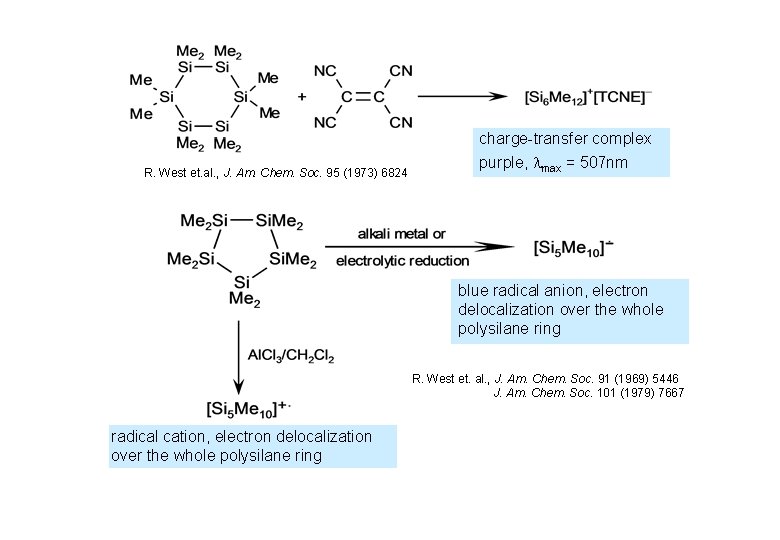
R. West et. al. , J. Am. Chem. Soc. 95 (1973) 6824 charge-transfer complex purple, max = 507 nm blue radical anion, electron delocalization over the whole polysilane ring R. West et. al. , J. Am. Chem. Soc. 91 (1969) 5446 J. Am. Chem. Soc. 101 (1979) 7667 radical cation, electron delocalization over the whole polysilane ring
![Þ polysilanes exhibit pronounced substituent effects hyperconjugation ionization energy e V max Þ polysilanes exhibit pronounced substituent effects ( - -hyperconjugation) ionization energy [e. V] max](https://slidetodoc.com/presentation_image_h/838df3d7518284022ff2abfc01556c0b/image-86.jpg)
Þ polysilanes exhibit pronounced substituent effects ( - -hyperconjugation) ionization energy [e. V] max [nm] ( ) 8. 35 s + (Si-Si) 9. 25 (e 1 g) 9. 07 as 8. 69 (Si-Si) Me 3 Si. Me 3 198 (8000) Ph. Me 2 Si. Me 3 231 (11000) Ph. Me 2 Si. Me 2 Ph 236 (18000) Ph 3 Si. Ph 3 246 (32000) Si. Me 3 Si. Me 2 10. 03 s - (Si-Si) - hyperconjugation X Si. Me 3 Si. Me 2 -n hyperconjugation

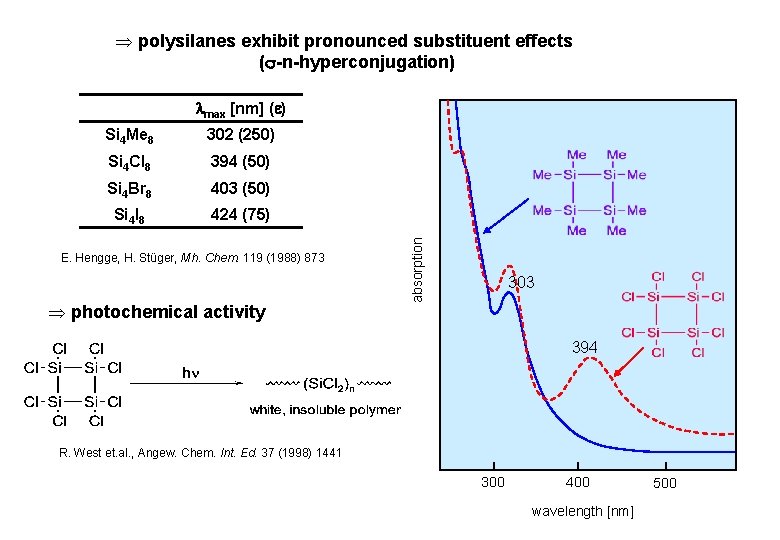
Þ polysilanes exhibit pronounced substituent effects ( -n-hyperconjugation) Si 4 Me 8 302 (250) Si 4 Cl 8 394 (50) Si 4 Br 8 403 (50) Si 4 I 8 424 (75) E. Hengge, H. Stüger, Mh. Chem. 119 (1988) 873 Þ photochemical activity absorption max [nm] ( ) 303 394 R. West et. al. , Angew. Chem. Int. Ed. 37 (1998) 1441 300 400 wavelength [nm] 500

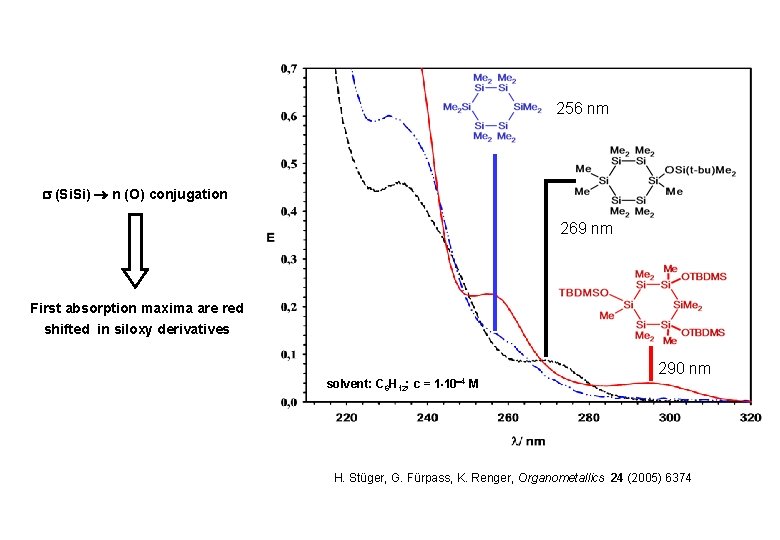
256 nm (Si. Si) n (O) conjugation 269 nm First absorption maxima are red shifted in siloxy derivatives solvent: C 6 H 12; c = 1 10 4 M 290 nm H. Stüger, G. Fürpass, K. Renger, Organometallics 24 (2005) 6374

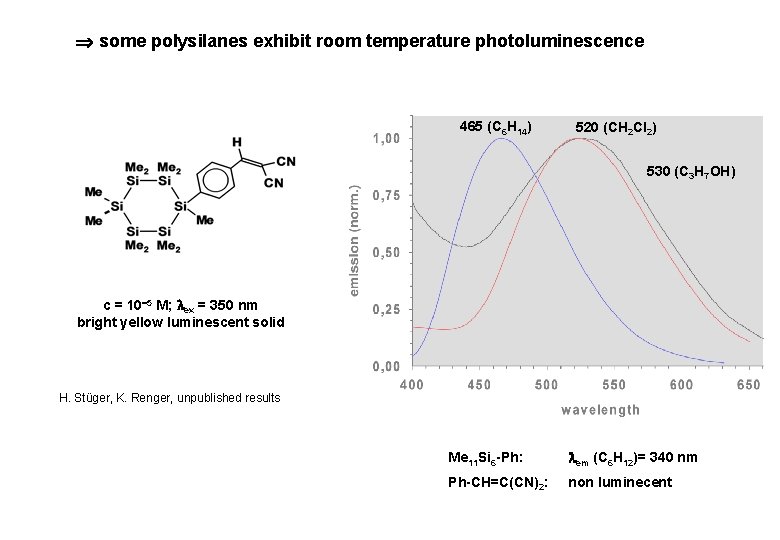
some polysilanes exhibit room temperature photoluminescence 465 (C 6 H 14) 520 (CH 2 Cl 2) 530 (C 3 H 7 OH) c = 10 5 M; ex = 350 nm bright yellow luminescent solid H. Stüger, K. Renger, unpublished results Me 11 Si 6 -Ph: em (C 6 H 12)= 340 nm Ph-CH=C(CN)2: non luminecent

polysilanes exhibit properties with technological potential starting materials for Si/N-, Si/C- or metal silicide ceramics or fibers; near UV photoresists; photo and charge conducting materials, emissive layers in integrated circuits etc. properties may be tuned by variation of backbone structure and/or substituents Yajima et. al. , (1976) -silicon carbide (Ph. Me. Si)n; (hexyl. Me. Si)n are soluble, meltable; can be used without prepyrolysis West et. al. , (1982)

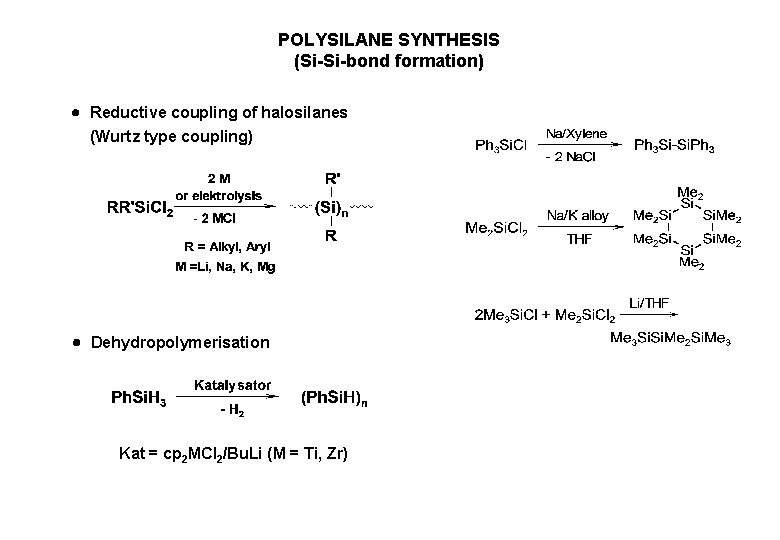
POLYSILANE SYNTHESIS (Si-Si-bond formation) Reductive coupling of halosilanes (Wurtz type coupling) Dehydropolymerisation Kat = cp 2 MCl 2/Bu. Li (M = Ti, Zr)

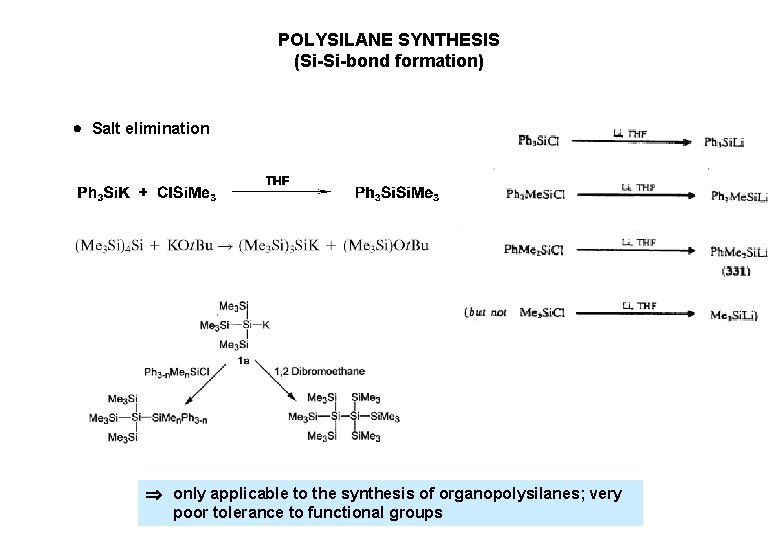
POLYSILANE SYNTHESIS (Si-Si-bond formation) Salt elimination only applicable to the synthesis of organopolysilanes; very poor tolerance to functional groups

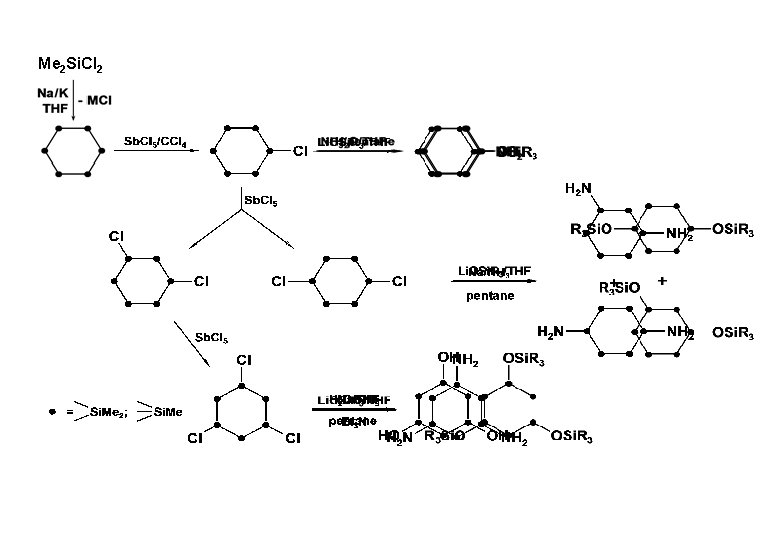
POLYSILANE SYNTHESIS (Functionalization) Halogenation of Organopolysilanes e. g. by electrophilic cleavage of Si-aryl or Si-alkyl-bonds Nucleophilic substitution of Si-X (Cl) bonds functional polysilane derivatives

Me 2 Si. Cl 2 +

Higher Silicon Hydrides | Synthesis Hydrolysis of Metal Silicides • reasonable yield in a semi-technical scale (80 kg Mg 2 Si afford 2. 8 l crude silane / day) • large amounts of salt (200 kg Mg. Cl 2 from 80 kg Mg 2 Si) • complex product mixtures • tedious synthetic procedure Fehér, F. ; Schinkitz, F. D. ; Schaaf, J. Z. anorg. allgem. Chem. 1971, 383, 303 Universität Frankfurt, 11. November 2015 95

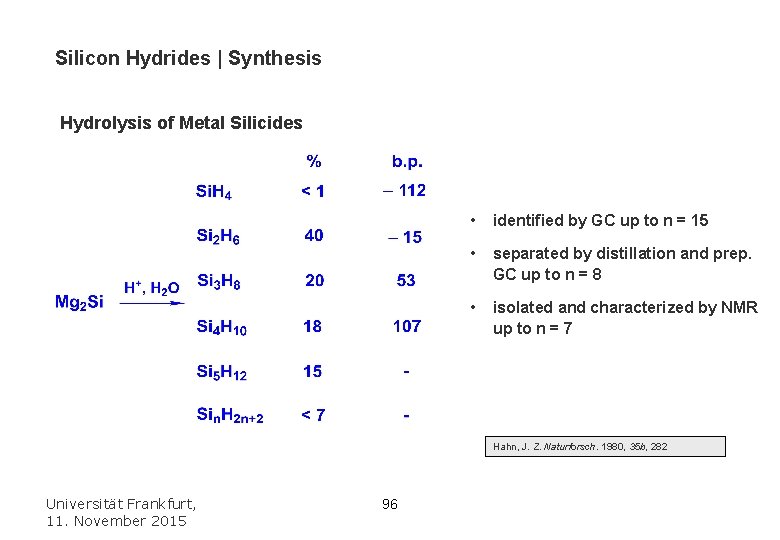
Silicon Hydrides | Synthesis Hydrolysis of Metal Silicides • identified by GC up to n = 15 • separated by distillation and prep. GC up to n = 8 • isolated and characterized by NMR up to n = 7 Hahn, J. Z. Naturforsch. 1980, 35 b, 282 Universität Frankfurt, 11. November 2015 96

Silicon Hydrides | Synthesis electrode from Monosilane gas in/out • technical production of di- and trisilane • problem: formation of considerable amounts of solid Sin. Hm Spanier, E. J. ; Mac. Diarmid, A. G. Inorg. Chem. 1962, 1, 432 Gokhale, S. D. ; Drake, J. E. ; Jolly, W. L. J. Inorg. Nucl. Chem. 1965, 27, 1911 Akhtar, M. Synth. React. Inorg. Metal-Org. Chem. 1986, 16, 729 cooling fluid electrode cooling fluid gas in/out Universität Frankfurt, 11. November 2015 97

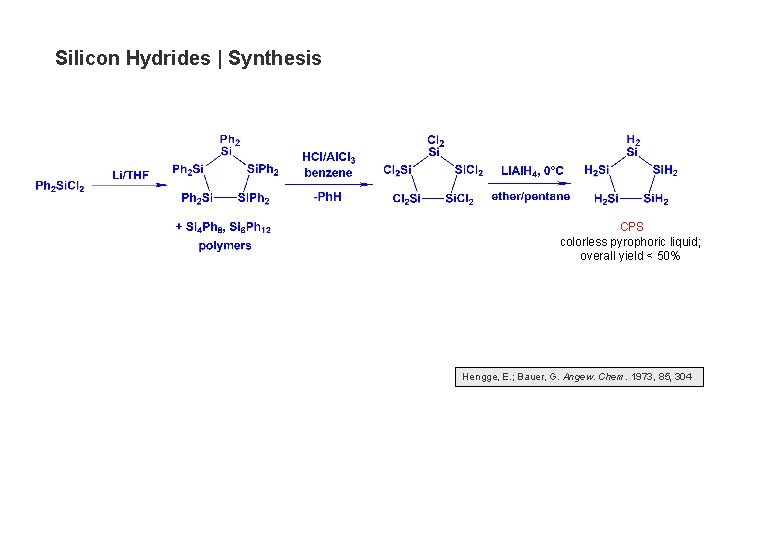
Silicon Hydrides | Synthesis CPS colorless pyrophoric liquid; overall yield < 50% Hengge, E. ; Bauer, G. Angew. Chem. 1973, 85, 304

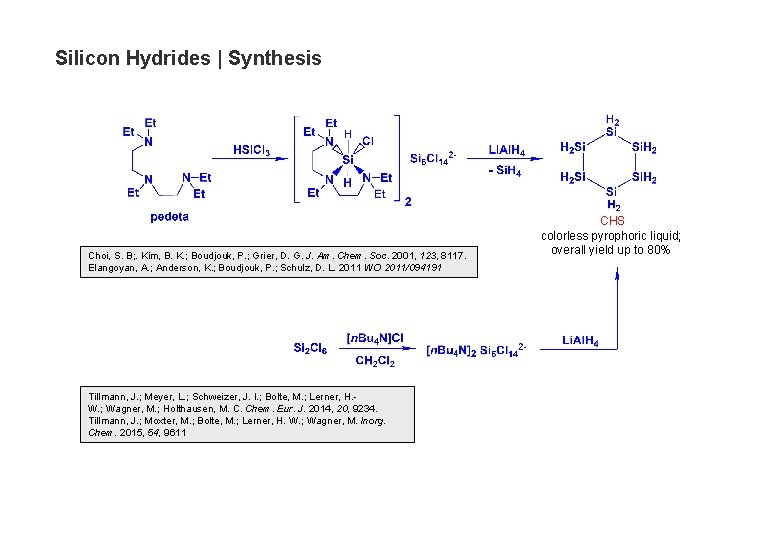
Silicon Hydrides | Synthesis Choi, S. B; . Kim, B. K. ; Boudjouk, P. ; Grier, D. G. J. Am. Chem. Soc. 2001, 123, 8117. Elangoyan, A. ; Anderson, K. ; Boudjouk, P. ; Schulz, D. L. 2011 WO 2011/094191 Tillmann, J. ; Meyer, L. ; Schweizer, J. I. ; Bolte, M. ; Lerner, H. W. ; Wagner, M. ; Holthausen, M. C. Chem. Eur. J. 2014, 20, 9234. Tillmann, J. ; Moxter, M. ; Bolte, M. ; Lerner, H. W. ; Wagner, M. Inorg. Chem. 2015, 54, 9611 CHS colorless pyrophoric liquid; overall yield up to 80%

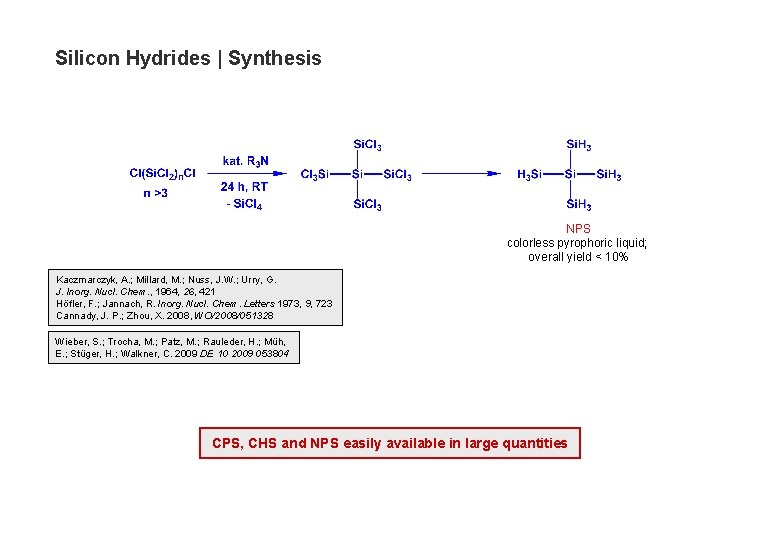
Silicon Hydrides | Synthesis NPS colorless pyrophoric liquid; overall yield < 10% Kaczmarczyk, A. ; Millard, M. ; Nuss, J. W. ; Urry, G. J. Inorg. Nucl. Chem. , 1964, 26, 421 Höfler, F. ; Jannach, R. Inorg. Nucl. Chem. Letters 1973, 9, 723 Cannady, J. P. ; Zhou, X. 2008, WO/2008/051328 Wieber, S. ; Trocha, M. ; Patz, M. ; Rauleder, H. ; Müh, E. ; Stüger, H. ; Walkner, C. 2009 DE 10 2009 053804 CPS, CHS and NPS easily available in large quantities

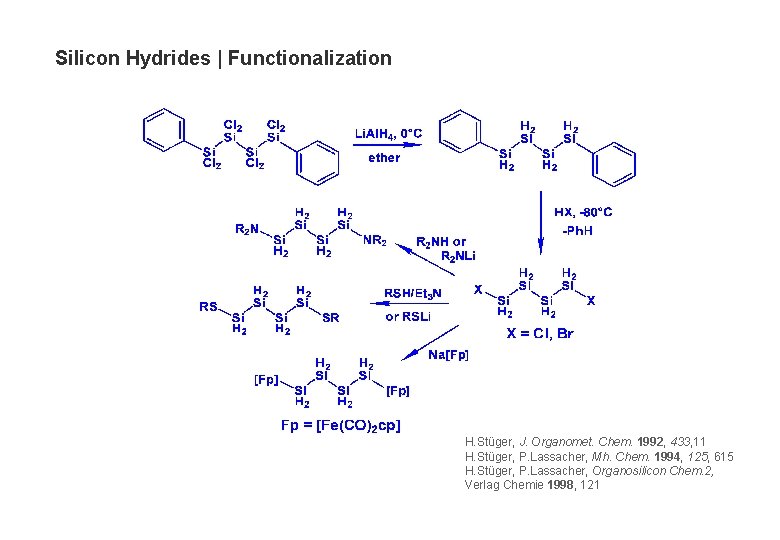
Silicon Hydrides | Functionalization H. Stüger, J. Organomet. Chem. 1992, 433, 11 H. Stüger, P. Lassacher, Mh. Chem. 1994, 125, 615 H. Stüger, P. Lassacher, Organosilicon Chem. 2, Verlag Chemie 1998, 121

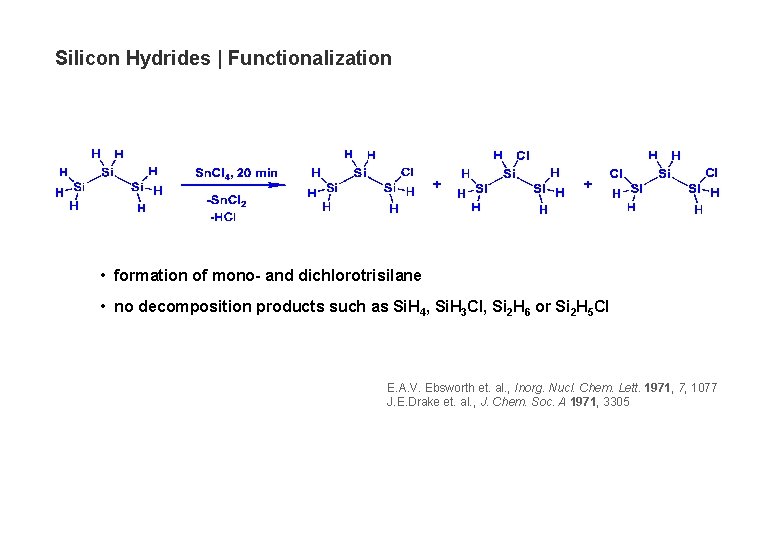
Silicon Hydrides | Functionalization • formation of mono- and dichlorotrisilane • no decomposition products such as Si. H 4, Si. H 3 CI, Si 2 H 6 or Si 2 H 5 CI E. A. V. Ebsworth et. al. , Inorg. Nucl. Chem. Lett. 1971, 7, 1077 J. E. Drake et. al. , J. Chem. Soc. A 1971, 3305

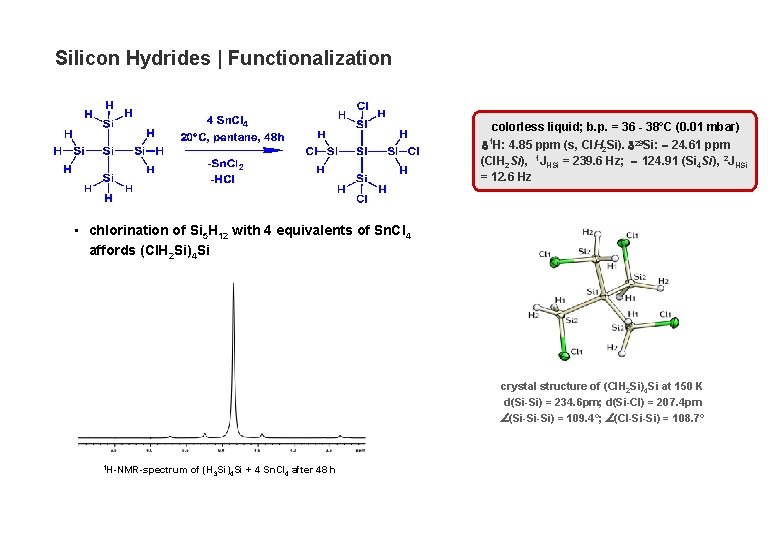
Silicon Hydrides | Functionalization colorless liquid; b. p. = 36 - 38°C (0. 01 mbar) 1 H: 4. 85 ppm (s, Cl. H 2 Si). 29 Si: 24. 61 ppm (Cl. H 2 Si), 1 JHSi = 239. 6 Hz; 124. 91 (Si 4 Si), 2 JHSi = 12. 6 Hz • chlorination of Si 5 H 12 with 4 equivalents of Sn. Cl 4 affords (Cl. H 2 Si)4 Si crystal structure of (Cl. H 2 Si)4 Si at 150 K d(Si-Si) = 234. 6 pm; d(Si-Cl) = 207. 4 pm (Si-Si-Si) = 109. 4°; (Cl-Si-Si) = 108. 7° 1 H-NMR-spectrum of (H 3 Si)4 Si + 4 Sn. Cl 4 after 48 h

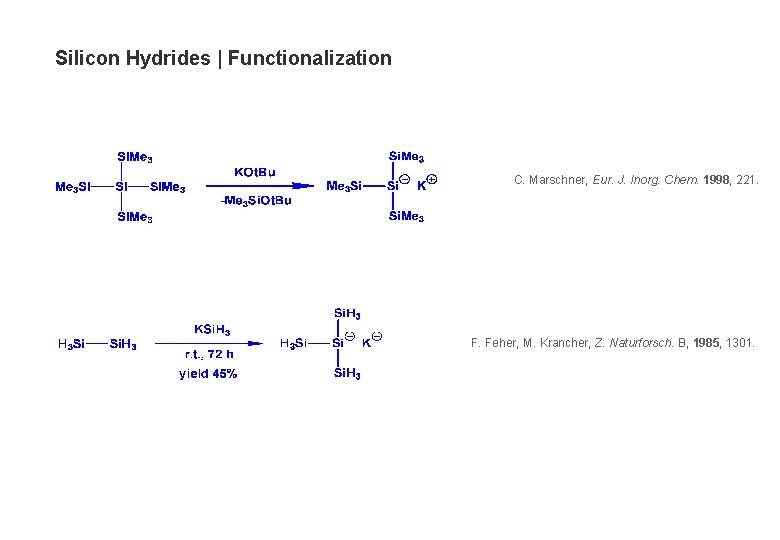
Silicon Hydrides | Functionalization C. Marschner, Eur. J. Inorg. Chem. 1998, 221. F. Feher, M. Krancher, Z. Naturforsch. B, 1985, 1301.

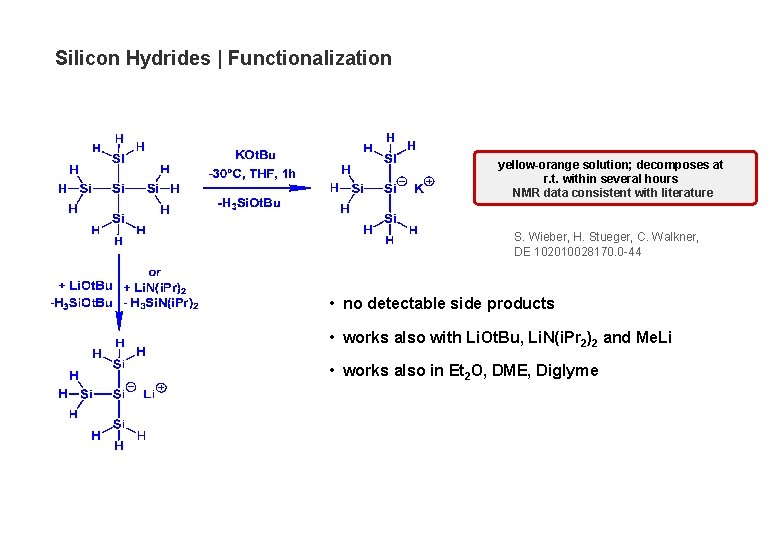
Silicon Hydrides | Functionalization yellow-orange solution; decomposes at r. t. within several hours NMR data consistent with literature S. Wieber, H. Stueger, C. Walkner, DE 102010028170. 0 -44 • no detectable side products • works also with Li. Ot. Bu, Li. N(i. Pr 2)2 and Me. Li • works also in Et 2 O, DME, Diglyme

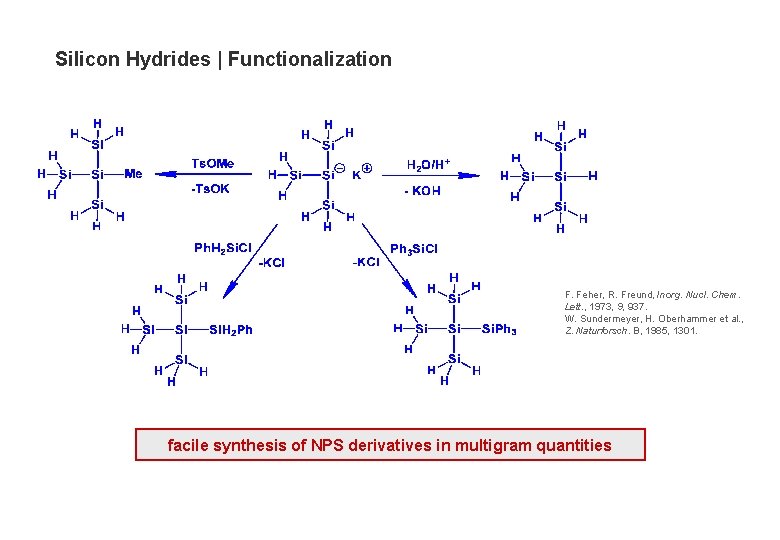
Silicon Hydrides | Functionalization F. Feher, R. Freund, Inorg. Nucl. Chem. Lett. , 1973, 9, 937. W. Sundermeyer, H. Oberhammer et al. , Z. Naturforsch. B, 1985, 1301. facile synthesis of NPS derivatives in multigram quantities

Silicon Hydrides | Application • application of higher silanes as precursor materials for liquid phase Si-film deposition in electronics industry ("printed electronics") (thin film transistor, flexible large area displays, photovoltaics etc. ) processing from liquid sources • Shimoda, T. ; Matsuki, Y. ; Furusawa, M. ; Aoki, T. ; Yudasaka, I. ; Tanaka, H. ; Iwasawa, H. ; Wang, D. ; Miyasaka, M. ; Takeuchi, Y. Nature 2006, 440, 783 desired property: Han, S. ; Dai, X. ; Loy, P. ; Lovaasen, J. ; Huether, J. ; Hoey, J. M. ; Wagner, A. ; Sandstrom, J. ; Bunzow, D. ; Swenson, O. F. ; Akhatov, I. S. ; Schulz, D. L. J. Non-Cryst. Solids 2008, 354, 2623. decomposition prior to evaporation Sontheimer, T. ; Amkreutz, D. ; Schulz, K. ; Wöbkenberg, P. H. ; Guenther, C. ; Bakumov, V. ; Erz, J. ; Mader, C. ; Traut, S. ; Ruske, F. ; Moshe Weizman, M. ; Schnegg, A. ; Patz, M. ; Trocha, M. ; Wunnicke, O. ; Rech, B. Adv. Mater. Interfaces 2014, 1300046.
 Teil 1 teil 2
Teil 1 teil 2 Embacher spezielle relativitätstheorie
Embacher spezielle relativitätstheorie Embacher spezielle relativitätstheorie
Embacher spezielle relativitätstheorie Besondere linien im dreieck
Besondere linien im dreieck Unternehmenskauf steuerliche aspekte
Unternehmenskauf steuerliche aspekte Gedig met 14 versreels
Gedig met 14 versreels Kurzen text über heimat
Kurzen text über heimat Ece 361
Ece 361 Wind energy source
Wind energy source Washington rx services
Washington rx services Ece 361
Ece 361 Csc 361
Csc 361 Computer architecture
Computer architecture Stats 361
Stats 361 Comp 361
Comp 361 Mngt 361 exam 1
Mngt 361 exam 1 Hymn 361
Hymn 361 Wap 571
Wap 571 La vita che avrai non sarà mai distante dall'amore che dai
La vita che avrai non sarà mai distante dall'amore che dai Che che kooley
Che che kooley Facesti come quei che va di notte che porta il lume
Facesti come quei che va di notte che porta il lume Frase subordinata oggettiva
Frase subordinata oggettiva Prüfungsmappe friseure teil 2 lösungen
Prüfungsmappe friseure teil 2 lösungen Emploi cr��teil
Emploi cr��teil Din 14530-5
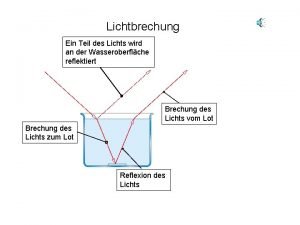
Din 14530-5 Teil des lichts
Teil des lichts Truppmann teil 1 brennen und löschen
Truppmann teil 1 brennen und löschen Teil 4
Teil 4 Schutzbereich dusche
Schutzbereich dusche Beschreibung
Beschreibung Bruch als teil mehrerer ganzer
Bruch als teil mehrerer ganzer Josef bei potifar grundschule
Josef bei potifar grundschule Theoretischer rahmen bachelorarbeit
Theoretischer rahmen bachelorarbeit Truppmann teil 2 thüringen
Truppmann teil 2 thüringen Leseverstehen teil 1
Leseverstehen teil 1 Truppmannausbildung teil 2
Truppmannausbildung teil 2 Mittelalter burg aufbau
Mittelalter burg aufbau Wer ist der gründer der modernen türkei
Wer ist der gründer der modernen türkei Georg heym der gott der stadt text
Georg heym der gott der stadt text Gegenstand der arbeitspsychologie
Gegenstand der arbeitspsychologie Der erste tag der woche
Der erste tag der woche Der seele heimat ist der sinn
Der seele heimat ist der sinn Das ist der daumen der pflückt die pflaumen
Das ist der daumen der pflückt die pflaumen Brustkorbverletzung lagerung
Brustkorbverletzung lagerung At eternity's gate painting
At eternity's gate painting Ezekiel 25 17 der pfad der gerechten
Ezekiel 25 17 der pfad der gerechten Geschichte vom frosch und skorpion
Geschichte vom frosch und skorpion Dr khairul anuar che azmi
Dr khairul anuar che azmi Che cos'è una carta tematica
Che cos'è una carta tematica Cos'è un testo teatrale
Cos'è un testo teatrale Linea spezzata aperta intrecciata
Linea spezzata aperta intrecciata Subordinata concessiva
Subordinata concessiva Signore fai di me uno strumento
Signore fai di me uno strumento Ciò
Ciò đèo ngang chế
đèo ngang chế Tassonomia batterica
Tassonomia batterica Pesce spada scheletro
Pesce spada scheletro Le sostanze che colorano la fiamma
Le sostanze che colorano la fiamma L'uomo che amava i fiori
L'uomo che amava i fiori Curro paradigma
Curro paradigma Aggettivi esclamativo
Aggettivi esclamativo Articolo partitivo
Articolo partitivo Bambino nella culla la luna e il sol
Bambino nella culla la luna e il sol Che colori confondono i daltonici
Che colori confondono i daltonici Constable pittoresco
Constable pittoresco Schede con gla gle gli glo glu
Schede con gla gle gli glo glu Proemio tasso
Proemio tasso Pronomi personali forma forte e debole
Pronomi personali forma forte e debole Progetto la città che vorrei
Progetto la città che vorrei Che cosè
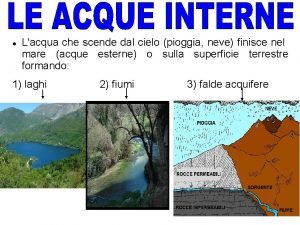
Che cosè Dove si trova la pianura padana?
Dove si trova la pianura padana? Neve che scende dal cielo
Neve che scende dal cielo Che
Che Dico che quando l'anima mal nata
Dico che quando l'anima mal nata Paulo coelho le cose che ho imparato dalla vita
Paulo coelho le cose che ho imparato dalla vita Luce che sorgi
Luce che sorgi Introduzione al testo poetico
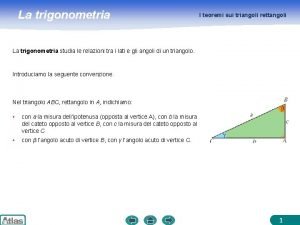
Introduzione al testo poetico Risoluzione triangoli qualsiasi
Risoluzione triangoli qualsiasi Prodotto tra logaritmi
Prodotto tra logaritmi Volgeranno lo sguardo a colui che hanno trafitto
Volgeranno lo sguardo a colui che hanno trafitto L'uomo che amava i fiori
L'uomo che amava i fiori Complementi di luogo
Complementi di luogo La leggenda narra che
La leggenda narra che Democrito che il mondo a caso pone
Democrito che il mondo a caso pone Che cose lepica
Che cose lepica Non c'e amore piu sincero che quello per il cibo
Non c'e amore piu sincero che quello per il cibo Criterio di specialita
Criterio di specialita Due segmenti si dicono consecutivi se
Due segmenti si dicono consecutivi se Consumo e produzione responsabile agenda 2030
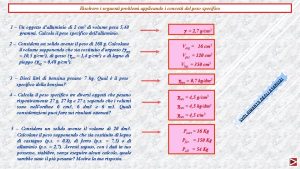
Consumo e produzione responsabile agenda 2030 Problemi con peso specifico
Problemi con peso specifico Figura equiestesa significato
Figura equiestesa significato Santo do amor
Santo do amor Il galles è una nazione
Il galles è una nazione S'amor non è che dunque è quel ch'io sento
S'amor non è che dunque è quel ch'io sento Voi che per gli occhi mi passaste il core
Voi che per gli occhi mi passaste il core La verità non è sempre ciò che appare
La verità non è sempre ciò che appare La carta geografica è una rappresentazione
La carta geografica è una rappresentazione Che 205
Che 205 Caratteristiche del testo teatrale
Caratteristiche del testo teatrale Community health evangelism
Community health evangelism Il mondo è quel disastro che vedete
Il mondo è quel disastro che vedete Statuto albertino cos'è
Statuto albertino cos'è Global che network
Global che network Geniale analisi grammaticale
Geniale analisi grammaticale Quadrilateri con 2 lati paralleli
Quadrilateri con 2 lati paralleli Sii il cambiamento che vuoi vedere nel mondo
Sii il cambiamento che vuoi vedere nel mondo Tanto gentile e tanto onesta pare
Tanto gentile e tanto onesta pare Quy trình sản xuất viên nang cứng
Quy trình sản xuất viên nang cứng