Beschreibung der energetischen Zustnde der Elektronen Wellengleichung SchrdingerGleichung

Beschreibung der energetischen Zustände der Elektronen Ø Ø Wellengleichung Schrödinger-Gleichung Lösungsansätze für Schrödinger-Gleichung Formale Analogie zwischen der klassischen und Quantenmechanik Ø Lösung der Schrödinger-Gleichung für Ø Ø Ø Freies Elektron im Potentialtopf Elektron im Potential eines harmonischen Oszillators Potentialbarriere Doppelte Potentialbarriere Wasserstoffatom 1

Die Wellengleichung Mathematische Beschreibung einer harmonischen Welle: Ableitung nach x: De Broglie-Gleichung: Ableitung nach Zeit: Plancksche Gleichung: 2

Die Schrödinger-Gleichung in einer Dimension … Potentialenergie = 0 freies Teilchen … Gesamtenergie / kinetische Energie H … Hamilton-Operator 3

Dreidimensionale Schrödinger. Gleichung Impuls und der entsprechende Operator 3 D-Schrödinger-Gleichung für N Teilchen 4

Lösungsansatz für die Schrödinger. Gleichung Mathematischer Ansatz: Linke Seite t-abhängig Separation der Variablen Rechte Seite x-abhängig 5

Lösungsansatz für die Schrödinger. Gleichung Linke Seite: Rechte Seite: C … Separationskonstante 6

Die Schrödinger-Gleichung Zeitunabhängige (stationäre) Form harmonische Schwingungen Sie wird verwendet, wenn das Potential von der Zeit nicht abhängt E … Gesamtenergie des Systems 7

Die Schrödinger-Gleichung Zeitabhängige Form Wellengleichung 8

Formale Analogie zwischen der KM und QM 9

Lösung der Schrödinger-Gleichung Falls V von der Zeit nicht abhängt, wird die zeitunabhängige (stationäre) Schrödinger-Gleichung gelöst. Die Schrödinger-Gleichung ist eine partielle Differentialgleichung - Lösung erfolgt für bestimmte (Anfangs-) und Randbedingungen Die Wellenfunktion hat keine physikalische Bedeutung, * entspricht der Aufenthaltswahrscheinlichkeit des Elektrons Energiebereiche, für die eine Lösung der Schrödinger-Gleichung gefunden werden kann, definieren das Energie-Spektrum (Frequenzspektrum) des Systems. 10

Mathematische Eigenschaften der Wellenfunktion Die Schrödinger-Gleichung ist konsistent mit p = ħk und E = ħ Die Schrödinger-Gleichung ist linear Wenn 1 und 2 zwei Lösungen der Schrödinger-Gleichung sind, ist auch eine lineare Kombination von 1 und 2 eine Lösung der Schrödinger-Gleichung Ein Wellenpaket stellt ebenfalls eine Lösung der Schrödinger-Gleichung dar 11

Mathematische Eigenschaften der Wellenfunktion Aufenthaltswahrscheinlichkeit des Teilchens, Elektronendichte … in 3 D Erwartungswert (Mittelwert über viele Beobachtungen) 12

Hermitesche Operatoren Analogie zwischen KM und QM Messgröße KM-Beschreibung QM-Operator Ort Impuls Kinetische Energie Drehimpuls 13

Übung Analogie: 14
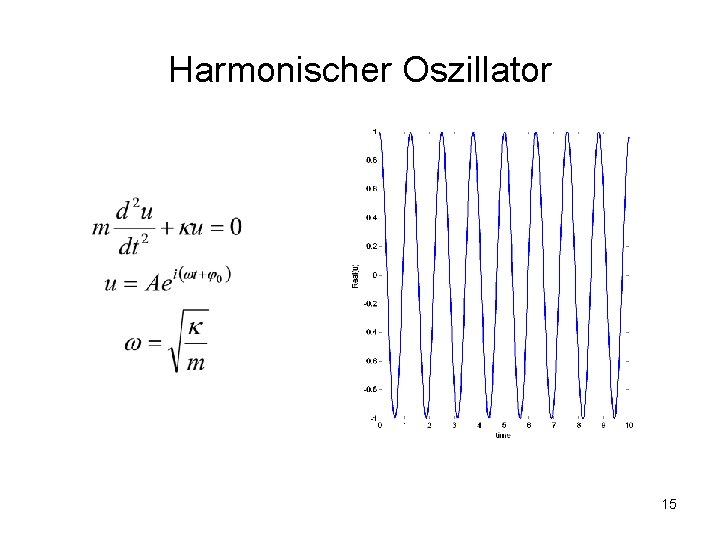
Harmonischer Oszillator 15
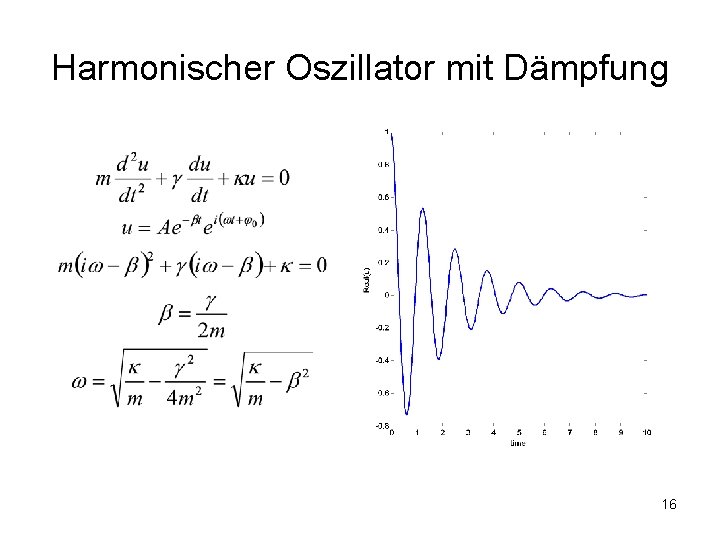
Harmonischer Oszillator mit Dämpfung 16
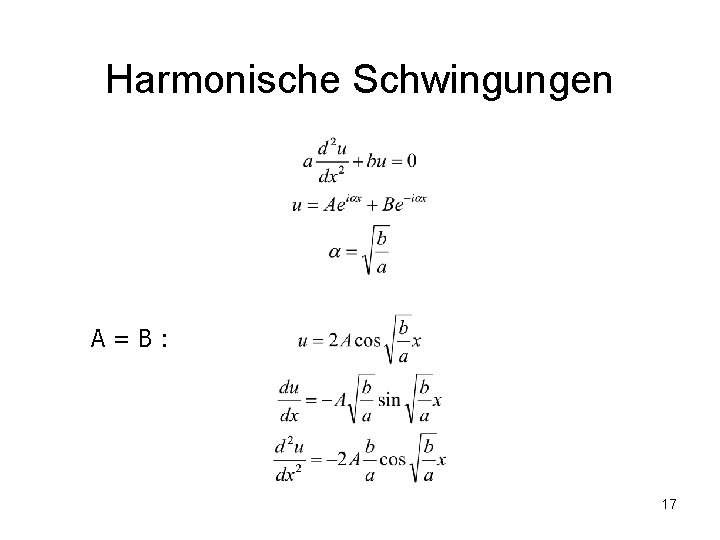
Harmonische Schwingungen A=B: 17

Gedämpfte Schwingungen 18
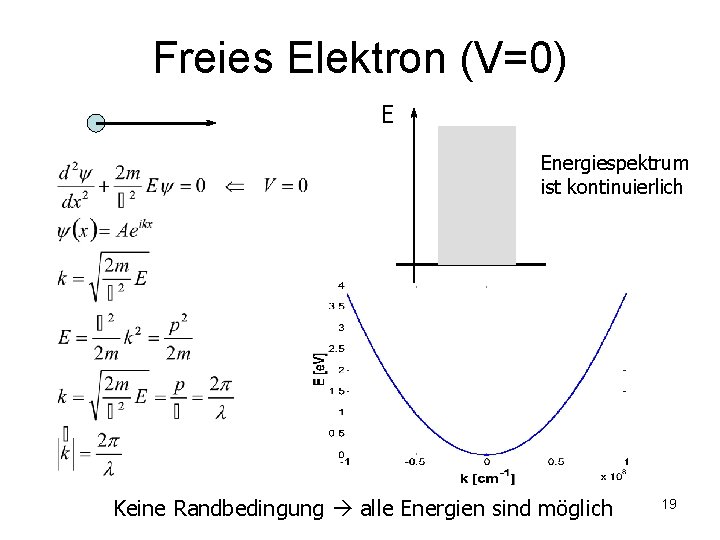
Freies Elektron (V=0) E Energiespektrum ist kontinuierlich Keine Randbedingung alle Energien sind möglich 19

Elektron im Potentialtopf (1 D) V ∞ ∞ V=0 freies Elektron 0 x a Energie-Spektrum E n 25 C 5 16 C 4 9 C 3 4 C 1 C 2 1 Randbedingung Energiespektrum ist diskret 20
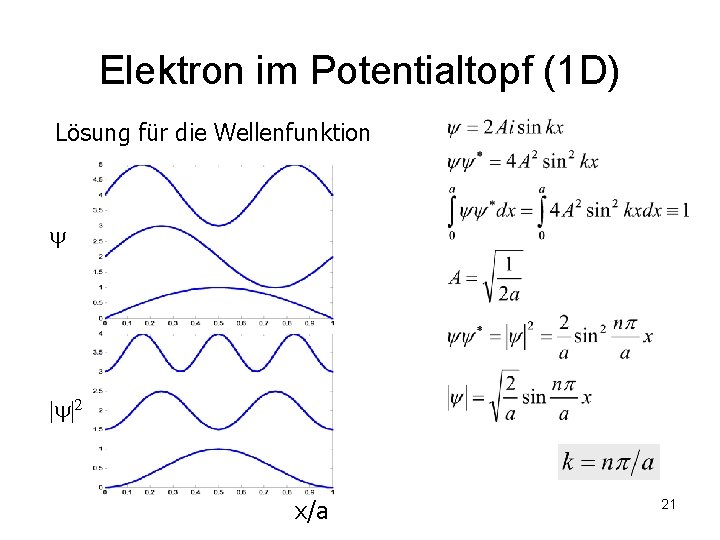
Elektron im Potentialtopf (1 D) Lösung für die Wellenfunktion | |2 x/a 21

Elektron im Potentialtopf (3 D) Orthogonale Lösung 22
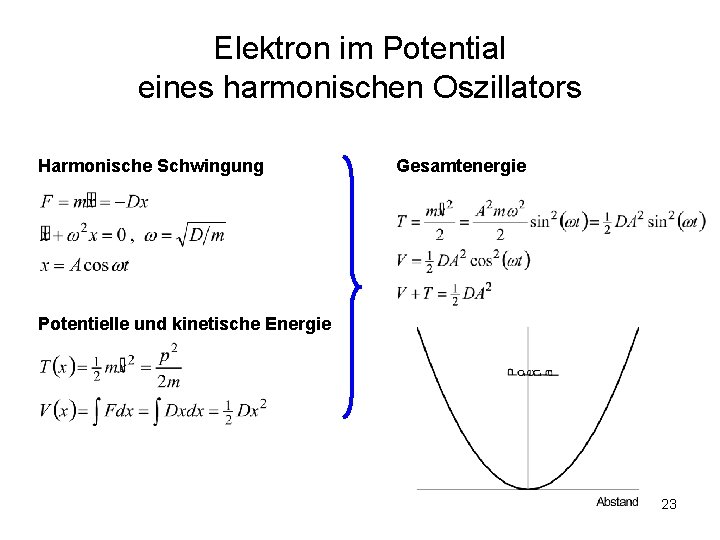
Elektron im Potential eines harmonischen Oszillators Harmonische Schwingung Gesamtenergie Potentielle und kinetische Energie 23

Elektron im Potential eines harmonischen Oszillators Energie-Spektrum E n 9/2 ħ 4 7/2 ħ 3 5/2 ħ 2 3/2 ħ 1 ½ ħ 0 Energieniveaus sind voneinander equidistant entfernt, E = ħ 24
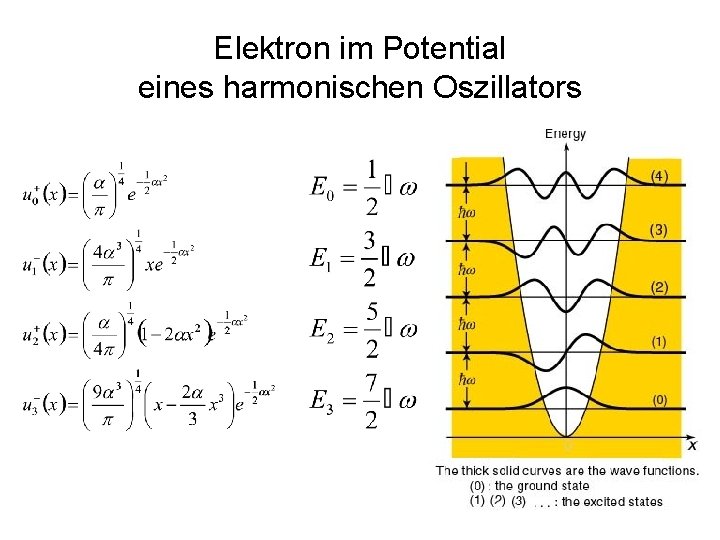
Elektron im Potential eines harmonischen Oszillators 25
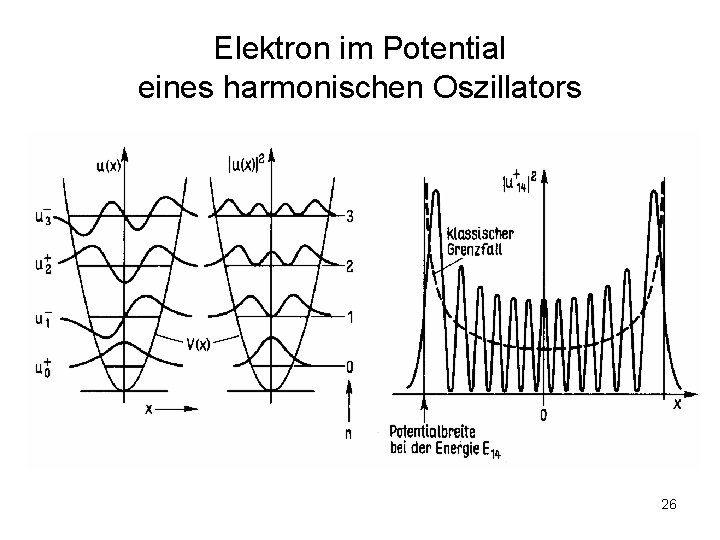
Elektron im Potential eines harmonischen Oszillators 26
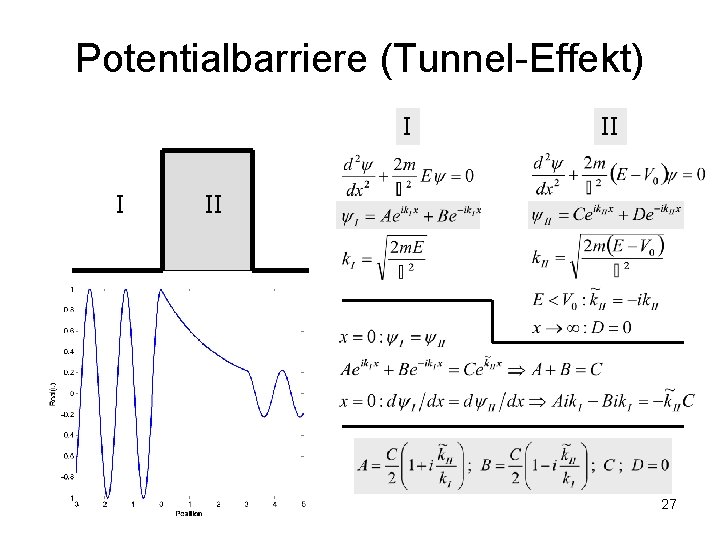
Potentialbarriere (Tunnel-Effekt) I I II II 27
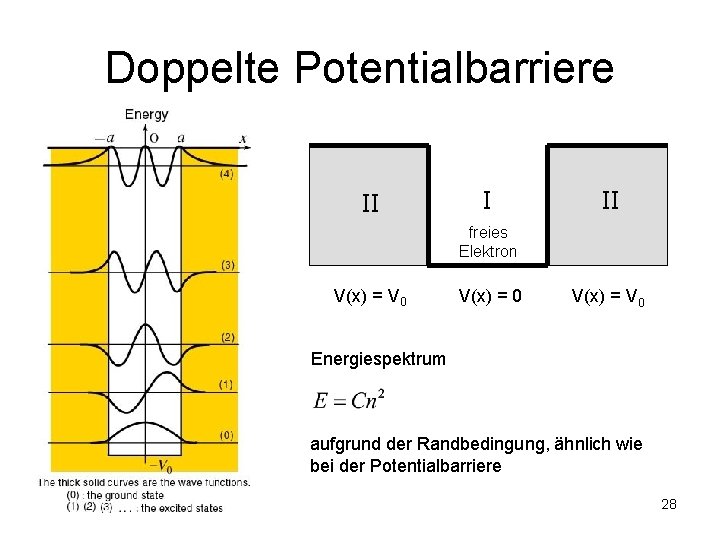
Doppelte Potentialbarriere II I II freies Elektron V(x) = V 0 Energiespektrum aufgrund der Randbedingung, ähnlich wie bei der Potentialbarriere 28

Tunnel-Effekt Ø Quanten-mechanischer Effekt Ø Klassisch: nur I (einfache Welle und ihre Reflexion) Ø Anwendung Ø Tunnel-Diode Ø STM (Rastertunnelmikroskopie) Ø QW („quantum wall“) 29
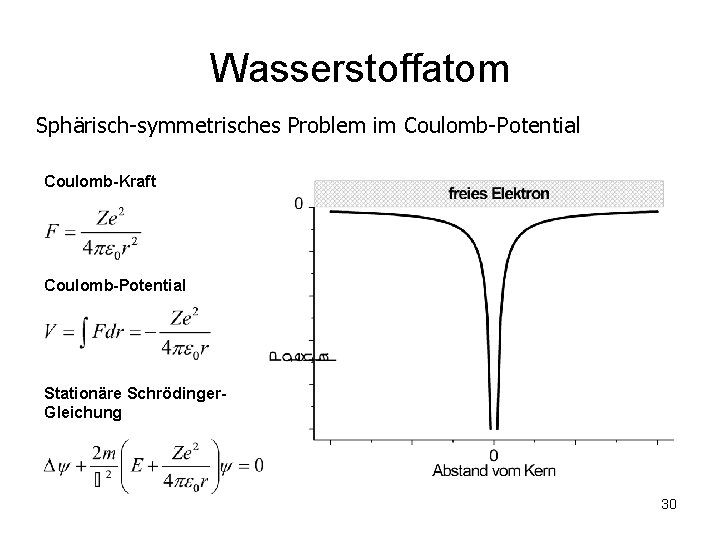
Wasserstoffatom Sphärisch-symmetrisches Problem im Coulomb-Potential Coulomb-Kraft Coulomb-Potential Stationäre Schrödinger. Gleichung 30

Wasserstoffatom Sphärische Koordinaten Radiusabhängig Winkelabhängig 31

Wasserstoffatom Winkelabhängiger Teil … Separationskonstante ℓ(ℓ+1) Separation der Variablen; Separationskonstante m² Azimutalgleichung, ( ) Polargleichung, ( ) Beide Gleichungen sind im Zentralfeld vom Potential V(r) unabhängig 32

Wasserstoffatom Azimutalgleichung, ( ) Spezielle Lösung für ( ) – 2 -periodisch (m … ganze Zahlen) Normierung Ergebnis m … magnetische Quantenzahl 33

Wasserstoffatom Polargleichung, ( ) … Legendresche Differentialgleichung Verknüpft die Separationskonstanten ℓ(ℓ+1) und m² Lösung existiert nur für ℓ(ℓ+1) = 0, 2, 6, 12, 20, … (d. h. für ℓ = 0, 1, 2, 3, 4, …) ℓ … ganze Zahlen (Nebenquantenzahl, Bahndrehimpuls-Quantenzahl) Bedingung für m: … insgesamt (2ℓ+1) Werte 34

Wasserstoffatom Lösung der Polargleichung, ( ) für m = 0 Legendre-Polynome: für m 0 zugeordnete Legendre-Polynome: 35

Wasserstoffatom Lösung der Polargleichung, ( ), normiert Winkelabhängiger Teil, Yℓm( , ) 36

Wasserstoffatom Radialgleichung … Separationskonstante ℓ(ℓ+1) Effektives Potential Lösung Ln, l … Laguerre Polynome 37
- Slides: 37