Professora Paula Melo Silva 1 Metais e ligas






































































- Slides: 87

Professora Paula Melo Silva 1. Metais e ligas metálicas Química 12ºano

1. 1. Estrutura e propriedades dos metais 1. 2. Degradação dos metais 1. 3. Metais, Ambiente e Vida Metais

1. Metais e ligas metálicas 1. 1. Estrutura e propriedades dos metais Objetivo geral Compreender a estrutura e as propriedades dos metais, comparando-as com as de sólidos iónicos, moleculares e covalentes. • • • 1. 1. 1. Um outro olhar sobre a Tabela Periódica dos elementos 1. 1. 2. Ligação química nos metais e noutros sólidos 1. 1. 3. Corrosão: uma oxidação indesejada 1. 1. 4. Pilhas e baterias: uma oxidação útil 1. 1. 5. Proteção de metais 1. 1. 6. Metais, complexos e cor 1. 1. 7. Os metais no organismo humano 1. 1. 8. Os metais como catalisadores AL 1. 2 – Um ciclo do cobre APL 1 – Construção de uma pilha com determinada diferença de potencial elétrico AL 1. 5 – A cor e a composição quantitativa de soluções com iões metálicos AL 1. 6 – Funcionamento de um sistema tampão

1. 1. Estrutura e propriedades dos metais 1. 1. 1. Um outro olhar sobre a Tabela Periódica dos Elementos • Importância dos metais em ligas e compostos. • Elementos metálicos na Tabela Periódica (Blocos s, p, d e f) – Afinidade eletrónica • Metais de transição: a especificidade das orbitais d


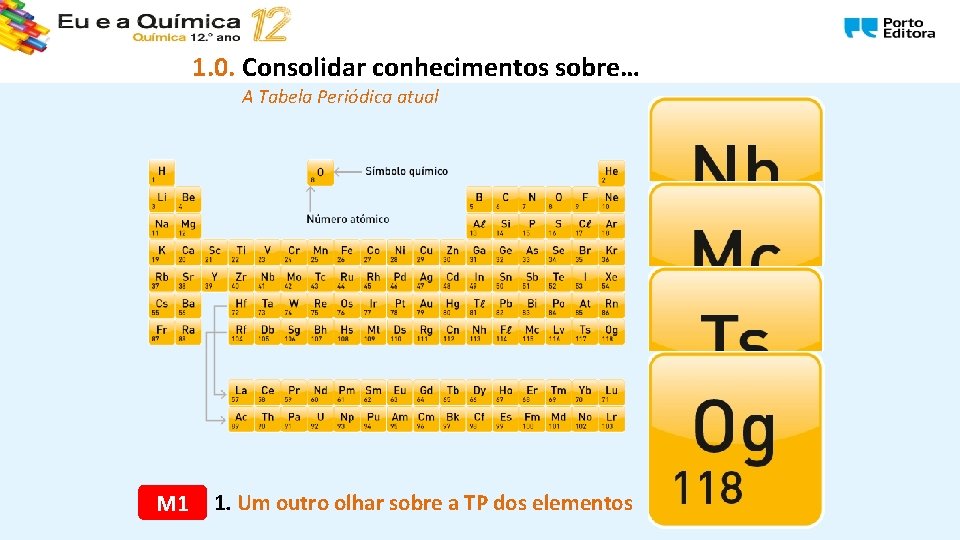
1. 0. Consolidar conhecimentos sobre… A Tabela Periódica atual M 1 1. Um outro olhar sobre a TP dos elementos

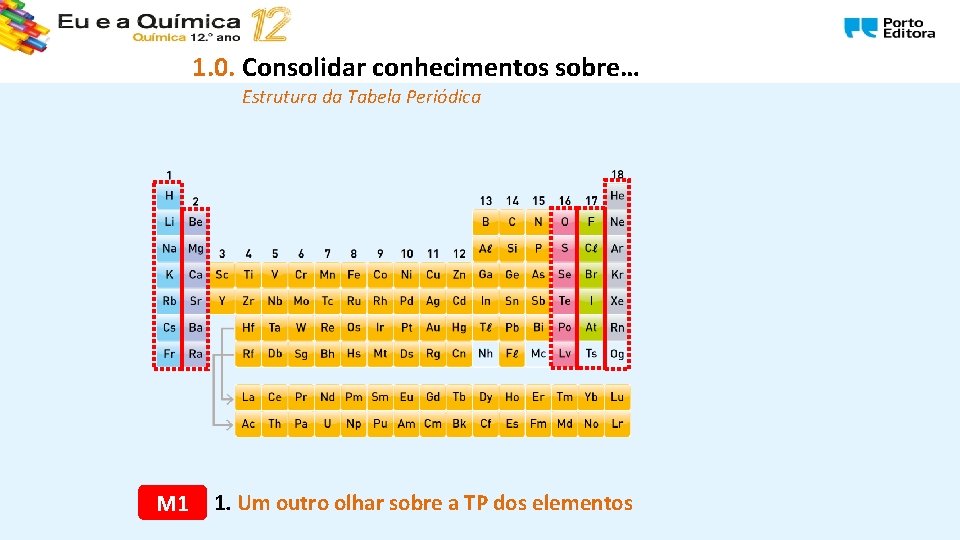
1. 0. Consolidar conhecimentos sobre… Estrutura da Tabela Periódica M 1 1. Um outro olhar sobre a TP dos elementos

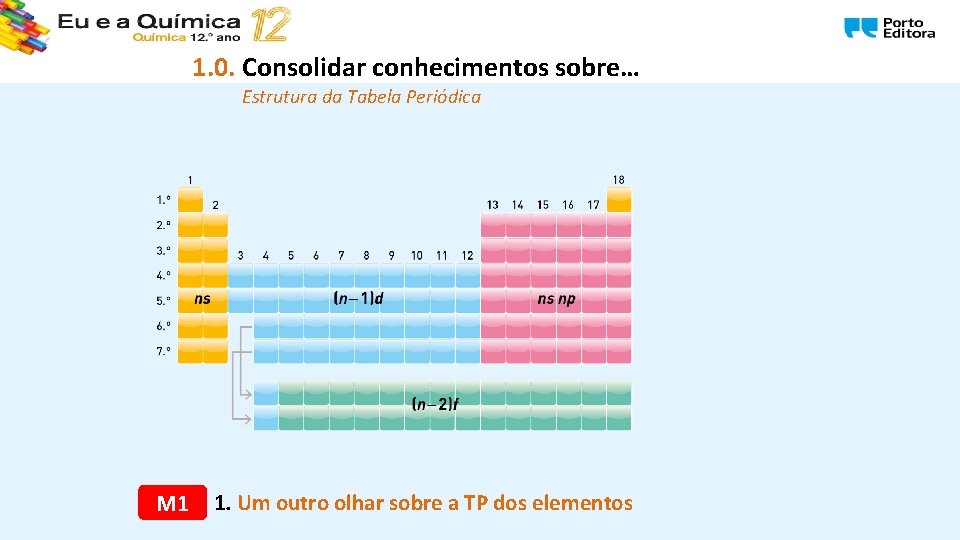
1. 0. Consolidar conhecimentos sobre… Estrutura da Tabela Periódica M 1 1. Um outro olhar sobre a TP dos elementos

1. 0. Consolidar conhecimentos sobre… Estrutura da Tabela Periódica M 1 1. Um outro olhar sobre a TP dos elementos

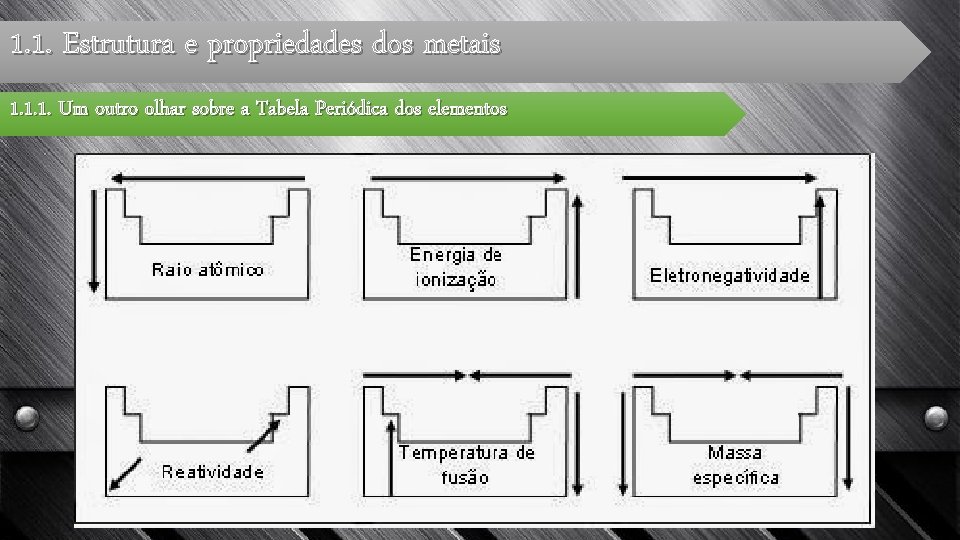
1. 0. Consolidar conhecimentos sobre… Propriedades periódicas dos elementos representativos As variações das propriedades ao longo da TP devem-se ao facto de, predominantemente: • ao longo de um grupo, aumentar o número de camadas eletrónicas; • ao longo de um período, aumentar a carga nuclear. M 1 1. Um outro olhar sobre a TP dos elementos

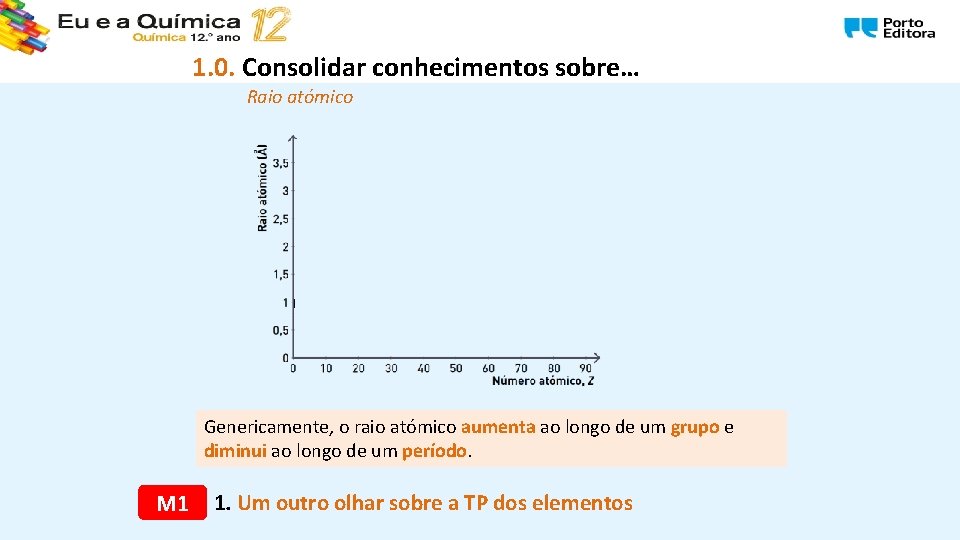
1. 0. Consolidar conhecimentos sobre… Raio atómico Genericamente, o raio atómico aumenta ao longo de um grupo e diminui ao longo de um período. M 1 1. Um outro olhar sobre a TP dos elementos

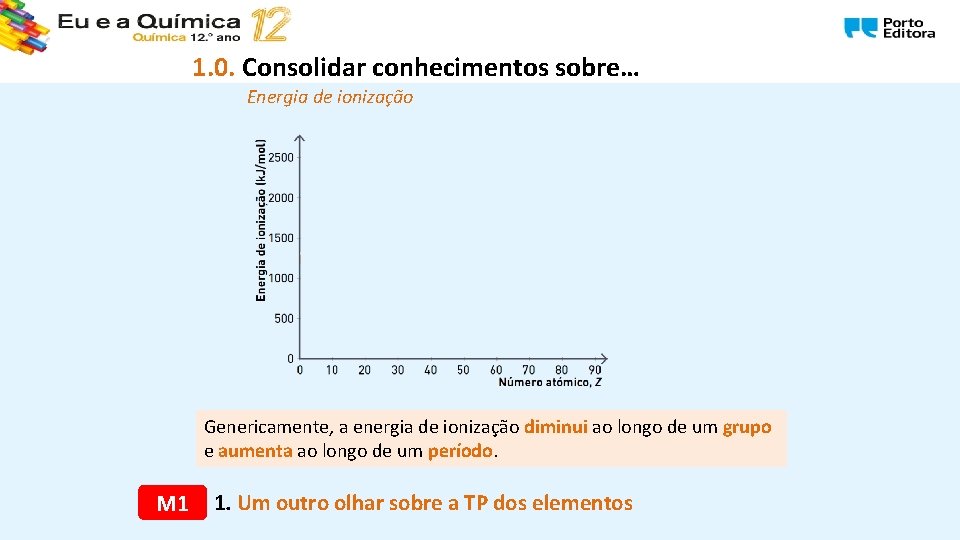
1. 0. Consolidar conhecimentos sobre… Energia de ionização Genericamente, a energia de ionização diminui ao longo de um grupo e aumenta ao longo de um período. M 1 1. Um outro olhar sobre a TP dos elementos

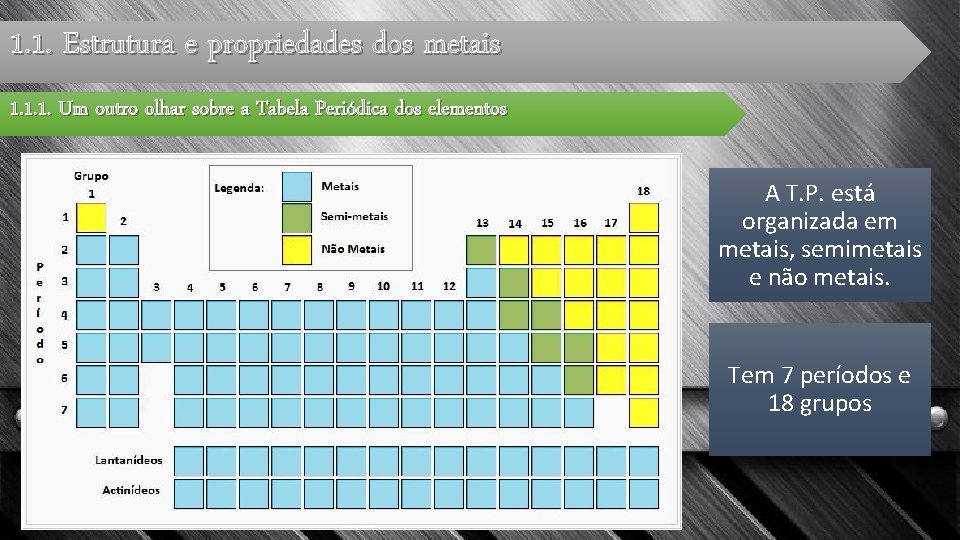
1. 1. Estrutura e propriedades dos metais 1. 1. 1. Um outro olhar sobre a Tabela Periódica dos elementos A T. P. está organizada em metais, semimetais e não metais. Tem 7 períodos e 18 grupos

1. 1. Estrutura e propriedades dos metais 1. 1. 1. Um outro olhar sobre a Tabela Periódica dos elementos A Equação de Schrödinger permite tratar o eletrão como onda e como partícula e desta forma obtém-se, através da resolução da mesma, informações sobre a energia do eletrão no átomo e sobre a sua probabilidade de posição em torno do núcleo. Não vamos resolver a equação de Schrödinger mas sim trabalhar com as soluções desta equação: os números quânticos (n, l, e ml) que estão interrelacionados uns com os outros. O n é o número quântico principal e dá-nos o nível de energia em que o eletrão se encontra, ou seja, o valor de energia do eletrão no átomo. Matematicamente n = 1, 2, 3, 4, 5, 6, …

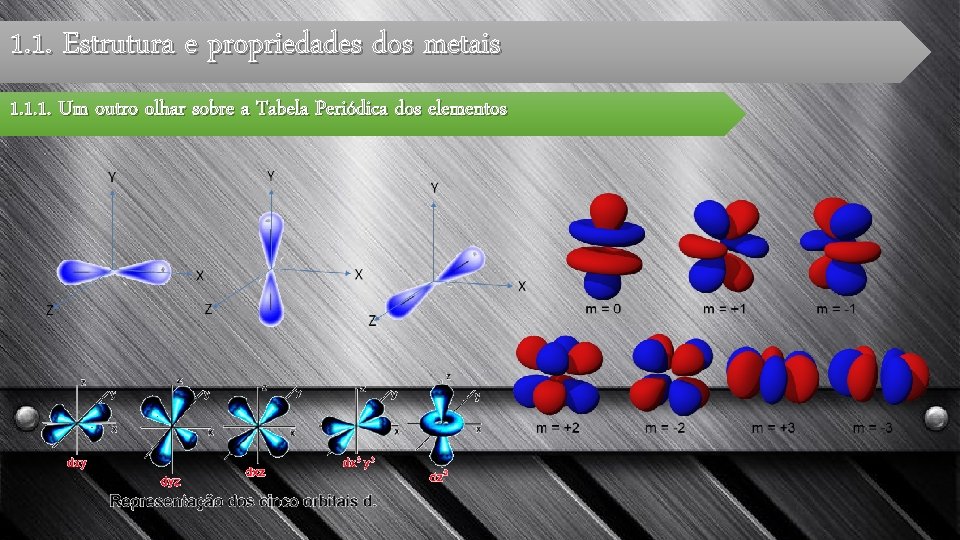
1. 1. Estrutura e propriedades dos metais 1. 1. 1. Um outro olhar sobre a Tabela Periódica dos elementos O l é o número quântico secundário (azimutal ou angular) e dá-nos informações sobre a energia do eletrão e a forma da orbital (atenção que orbital não é a trajetória do eletrão mas sim onde é mais provável encontrar o eletrão). Matematicamente depende do valor do número quântico principal l = 0, 1, 2, … (n – 1). Quando l = 0 diz-se que a orbital é do tipo s e tem forma esférica; quando l = 1 a orbital será do tipo p; quando l = 2 a orbital será do tipo d; quando l = 3 a orbital será do tipo f. O ml, número quântico magnético, dá-nos informações sobre a orientação espacial da orbital e desta forma depende da forma da orbital: ml = - l, …, 0, … +l. Desta forma podemos concluir que a orbital s só permite uma orientação espacial, a orbital p permite 3 orientações daí falar-se em três orbitais p (px, py e pz).

1. 1. Estrutura e propriedades dos metais 1. 1. 1. Um outro olhar sobre a Tabela Periódica dos elementos A energia dos eletrões no átomo depende dos dois primeiros números quânticos, contudo para as espécies químicas com apenas um eletrão (ex: átomo de hidrogénio) a energia depende apenas do número quântico principal dado que não existe repulsões entre eletrões não vale a pena falar de variações no valor de energia devido à forma da orbital. Com a informação dada pelos números quânticos podemos fazer a distribuição eletrónica dos átomos tendo em conta a energia e a probabilidade de posição dos eletrões. Para uma correta distribuição eletrónica temos que ter em conta: O Diagrama de Pauling que permite distribuir os eletrões pelo princípio da energia mínima. O princípio da exclusão de Pauli – cada orbital leva no máximo 2 eletrões. A regra de Hund – quando tivermos eletrões para distribuir por orbitais que têm a mesma energia (orbitais degeneradas) devemos ocupar o maior número de orbitais pois é assim que temos a mínima energia possível.

1. 1. Estrutura e propriedades dos metais 1. 1. 1. Um outro olhar sobre a Tabela Periódica dos elementos

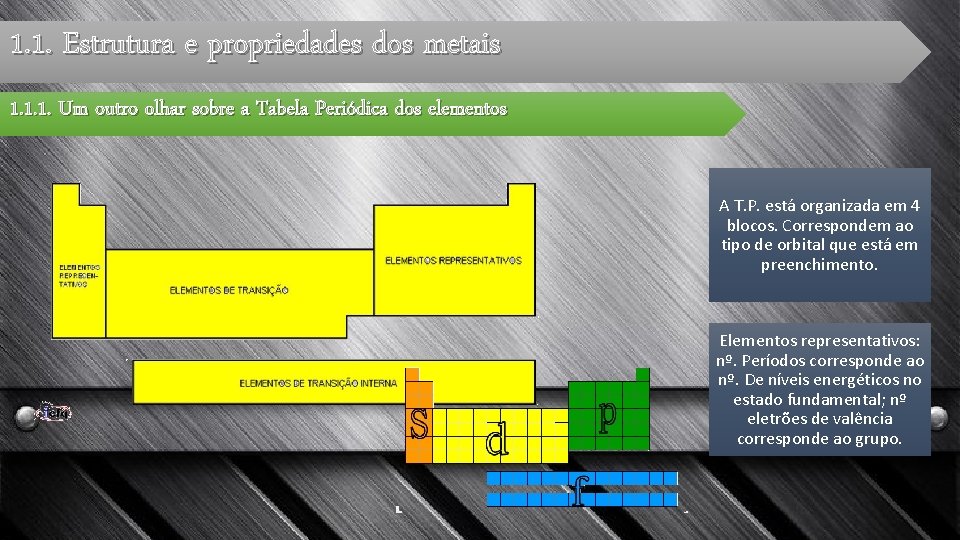
1. 1. Estrutura e propriedades dos metais 1. 1. 1. Um outro olhar sobre a Tabela Periódica dos elementos A T. P. está organizada em 4 blocos. Correspondem ao tipo de orbital que está em preenchimento. Elementos representativos: nº. Períodos corresponde ao nº. De níveis energéticos no estado fundamental; nº eletrões de valência corresponde ao grupo.

1. 1. Estrutura e propriedades dos metais 1. 1. 1. Um outro olhar sobre a Tabela Periódica dos elementos Elemento de transição definido pela IUPAC (International Union of Pure and Applied Chemistry) como um elemento cujo átomo tem uma orbital d incompleta ou que pode originar catiões com orbitais d incompletas.

1. 1. Estrutura e propriedades dos metais 1. 1. 1. Um outro olhar sobre a Tabela Periódica dos elementos Raio atómico: aumenta ao longo do grupo pois o efeito dominante é o aumento do nº de níveis pelos quais os eletrões estão distribuídos. Raio atómico: diminui ao longo do período pois o efeito dominante é o aumento da carga nuclear o que aumenta a força de atração aos eletrões.

1. 1. Estrutura e propriedades dos metais 1. 1. 1. Um outro olhar sobre a Tabela Periódica dos elementos Energia de ionização regra geral aumenta ao longo do período. Energia de ionização regra geral diminui ao longo do grupo. Quanto menor o átomo mais difícil é retirar um eletrão.

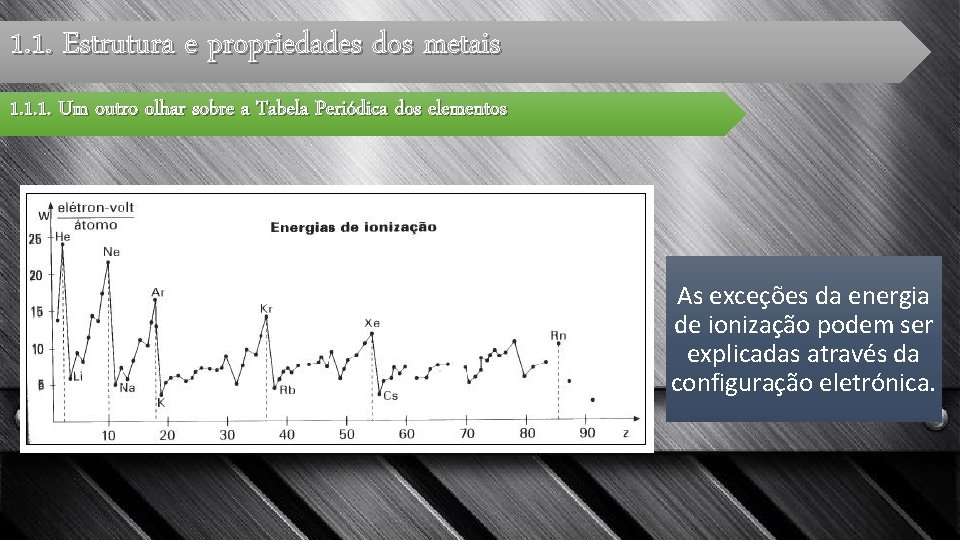
1. 1. Estrutura e propriedades dos metais 1. 1. 1. Um outro olhar sobre a Tabela Periódica dos elementos As exceções da energia de ionização podem ser explicadas através da configuração eletrónica.

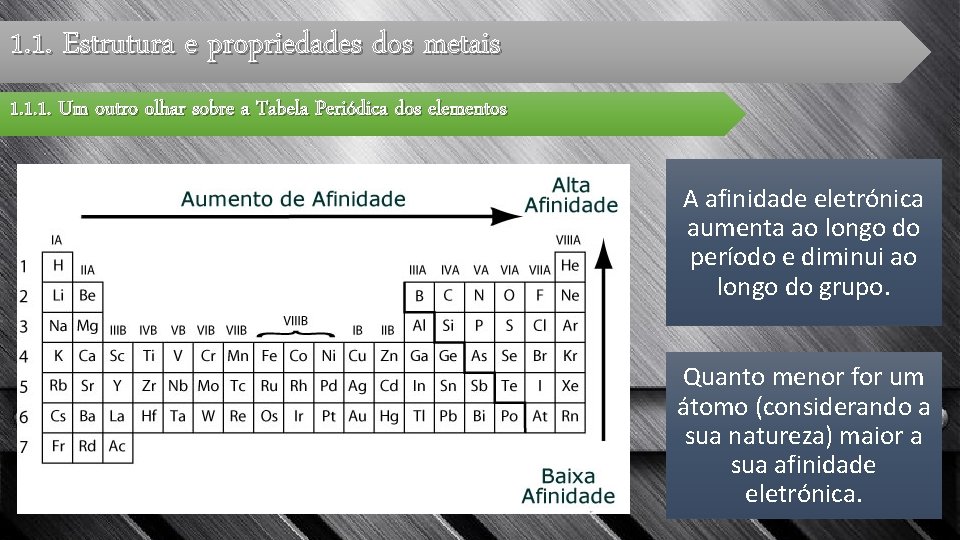
1. 1. Estrutura e propriedades dos metais 1. 1. 1. Um outro olhar sobre a Tabela Periódica dos elementos A afinidade eletrónica aumenta ao longo do período e diminui ao longo do grupo. Quanto menor for um átomo (considerando a sua natureza) maior a sua afinidade eletrónica.

1. 1. Estrutura e propriedades dos metais 1. 1. 1. Um outro olhar sobre a Tabela Periódica dos elementos

1. 1. Estrutura e propriedades dos metais 1. 1. 1. Um outro olhar sobre a Tabela Periódica dos elementos Energia de ionização é a energia mínima necessária para injetar uma mole de eletrões de uma mole de átomos neutros no estado gasoso e fundamental de forma a originar iões positivos. Os metais apresentam valores baixos de energia de ionização e os não metais apresentam valores mais elevados. Energia de Afinidade eletrónica é a energia libertada quando um eletrão se liga a um átomo ou molécula na fase gasosa. Os elementos metálicos apresentam baixas afinidades eletrónicas; não têm tendência a captar eletrões. Os elementos não metálicos pelo contrário são mais estáveis na forma de anião.

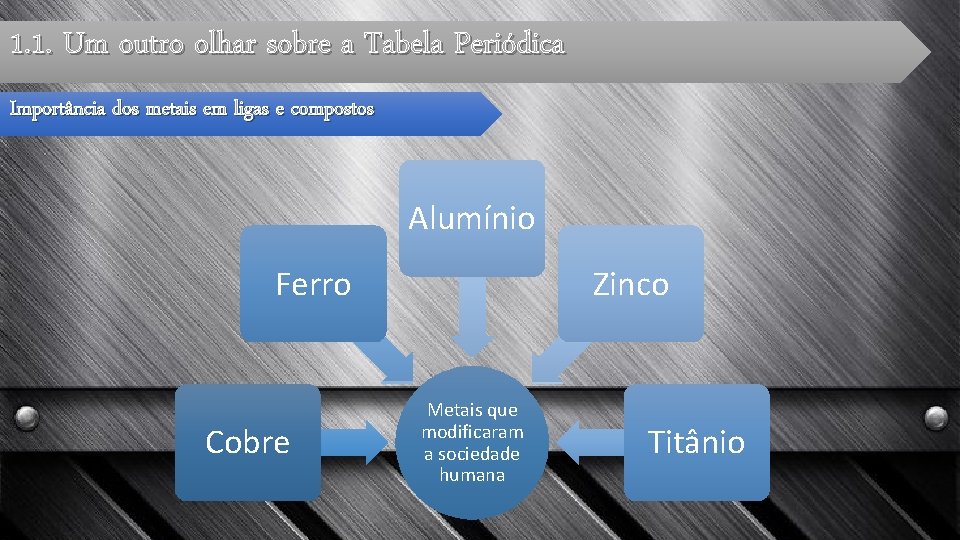
1. 1. Importância dos metais em ligas e compostos O ferro é utilizado na construção civil, na indústria automóvel e em ferramentas. É o segundo metal mais abundante na crusta terrestre e é o mais utilizado no mundo contemporâneo. M 1 O alumínio é usado em latas de bebidas, aviões, etc. Apesar de muito abundante na crusta terrestre, os processos de extração e purificação do A são mais dispendiosos do que os utilizados para obter outros metais. 1. Um outro olhar sobre a TP dos elementos

1. 1. Importância dos metais em ligas e compostos O cobre é utilizado na construção de destiladores (alambiques), fios elétricos, peças decorativas, tubos de canalização, etc. M 1 As baterias de lítio são utilizadas em telemóveis, computadores portáteis e até mesmo em alguns automóveis elétricos. 1. Um outro olhar sobre a TP dos elementos

1. 1. Importância dos metais em ligas e compostos O magnésio é utilizado em diversas ligas metálicas para lhes conferir dureza e menor densidade. O seu uso é diversificado, sobretudo na indústria automóvel e da aviação. M 1 O ouro é um dos metais mais utilizados na ourivesaria e joalharia. É também utilizado em componentes eletrónicos. 1. Um outro olhar sobre a TP dos elementos

M 7 7. Os metais no organismo humano

M 7 7. Os metais no organismo humano

1. 1. Importância dos metais em ligas e compostos Tipos de ligas metálicas M 1 1. Um outro olhar sobre a TP dos elementos

1. 1. Importância dos metais em ligas e compostos Outros materiais – Aplicações Liga de nitinol Semicondutores Kevlar • Utilizado em aeronáutica e na medicina, como, por exemplo, em aparelhos dentários. • É uma liga muito utilizada como biomaterial devido às suas excelentes propriedades de memória de forma e pseudoelasticidade. • Muito usados na indústria eletrónica, são sólidos cristalinos com uma condutividade térmica entre os condutores e os isoladores. • Utilizado, em coletes à prova de bala e aviões. • É um polímero cerca de sete vezes mais resistente do que o aço e muito leve. M 1 1. Um outro olhar sobre a TP dos elementos Nanomateriais • Têm aplicações na medicina, nos transportes e ambiente, tecnologias de informação e comunicação e indústria aerospacial. • São materiais desenhados à escala atómica e molecular.

1. 1. Um outro olhar sobre a Tabela Periódica Importância dos metais em ligas e compostos Idade da Pedra Idade do Bronze (90% Cu 10% Sn) Idade do Ferro “Era do Aço” (Fe e C) Era dos novos materiais

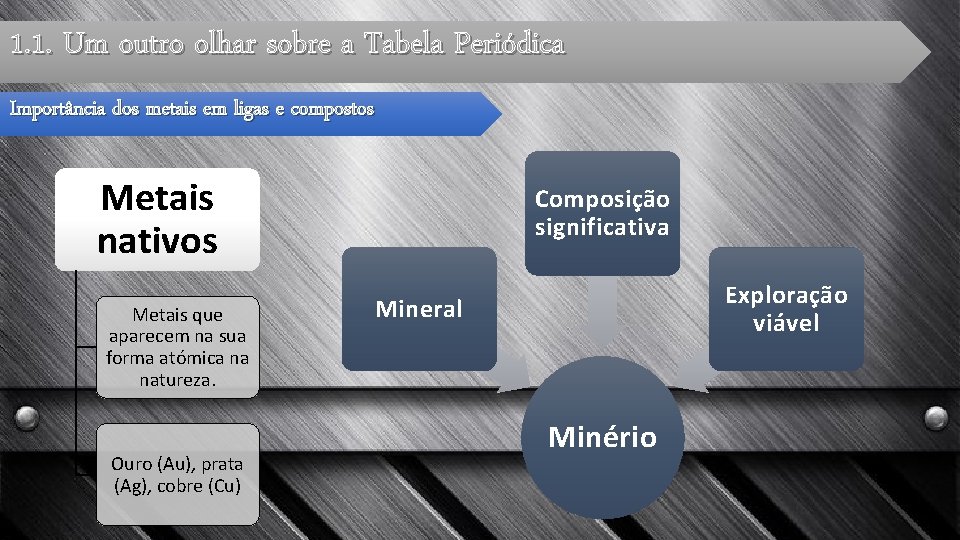
1. 1. Um outro olhar sobre a Tabela Periódica Importância dos metais em ligas e compostos Como os metais têm muita tendência em ceder eletrões a maioria dos metais não aparece na natureza na sua forma atómica. Os metais ionizam-se e ligam -se a outros elementos formando compostos iónicos (geralmente chamados de minerais).

1. 1. Um outro olhar sobre a Tabela Periódica Importância dos metais em ligas e compostos Povos Sumérios Metais e Ligas Ouro Cobre Egípcios Fenícios Têmpora de cada metal Bronze (cobre + estanho) Latão (cobre + zinco) Ferro (proveniente de meteoritos) Romanos Técnicas Aço (ferro + carbono) “Fornos” que atinjam temperaturas muito elevadas

1. 1. Um outro olhar sobre a Tabela Periódica Importância dos metais em ligas e compostos Metais nativos Metais que aparecem na sua forma atómica na natureza. Ouro (Au), prata (Ag), cobre (Cu) Composição significativa Exploração viável Mineral Minério

1. 1. Um outro olhar sobre a Tabela Periódica Importância dos metais em ligas e compostos Ligas metálicas Solução sólida composta por dois ou mais metais e um ou mais não metais Metalurgia Ciência e tecnologia de extração de metais dos seus minérios e da produção de ligas metálicas com as propriedades convenientes.

1. 1. Um outro olhar sobre a Tabela Periódica Importância dos metais em ligas e compostos Redução dos metais Diminuir o seu número de oxidação Ganhar eletrões Espécie reduzida e agente oxidante

1. 1. Um outro olhar sobre a Tabela Periódica Importância dos metais em ligas e compostos Os metais nativos são aqueles que ocorrem na natureza como substâncias elementares, por exemplo, Ag, Au, Cu. O facto de serem “menos reativos” e não apareceram ligados, por exemplo, a óxidos pode ter sido um dos motivos pelos quais foram usados pelo homem antes do Ferro. O trabalho com os metais sempre influenciou a vida das civilizações e o seu desenvolvimento. A exploração de um determinado metal dependia das solicitações da sociedade (caça, guerras, etc. ) fazendo com que o tratamento de cada um deles fosse aperfeiçoado; dependia também das condições “geológicas” de cada civilização, ou seja, dos recursos naturais de cada zona e da forma como o minério podia ser transportado. Com a evolução (aliada à necessidade) devem-se ter descoberto por acaso novos metais e novas ligas metálicas e o homem aprendeu a tirar partido das novas propriedades que adquiriam (exemplo da primeira liga metálica: o bronze que apresentava vantagens para determinados fins do que o cobre).

1. 1. Um outro olhar sobre a Tabela Periódica Importância dos metais em ligas e compostos A hematite, a magnetite e a pirite são os principais minérios de ferro (contêm, por exemplo, óxidos e sulfuretos de ferro). Dada as condições à superfície da Terra (presença de água e oxigénio, por exemplo) o ferro ocorre na natureza sobretudo na forma de ião positivo associado a O 2 -, S 22 - e CO 32 -.

1. 1. Um outro olhar sobre a Tabela Periódica Importância dos metais em ligas e compostos Alumínio Ferro Cobre Zinco Metais que modificaram a sociedade humana Titânio

1. 1. Um outro olhar sobre a Tabela Periódica Importância dos metais em ligas e compostos Novas exigências da sociedade levam à criação de novos materiais e ao “upgrade” dos existentes. Exemplo: necessidade de diminuir o peso das peças metálicas para reduzir o petróleo usado no transporte. Levou ao uso do alumínio, fibras de carbono ou à evolução das peças de aço que ficaram mais leves e mais finas.

1. 1. Um outro olhar sobre a Tabela Periódica Importância dos metais em ligas e compostos Exploração mineira excessiva Jazigos disponíveis são pobres e complexos O alumínio é muito difícil de extrair, sendo a sua reciclagem cada vez mais barata relativamente à sua extração. A reciclagem dos metais apresenta-se como a melhor solução para a sustentabilidade do uso dos metais pela humanidade. A extração e a reciclagem dos metais têm grandes impactos no ambiente.

1. 1. Um outro olhar sobre a Tabela Periódica Importância dos metais em ligas e compostos A reciclagem apresenta vantagens relativamente à extração: economiza o minério (dado que os metais são recursos não – renováveis), há o uso de menor energia e a poluição é menor. Os metais são muitas vezes usados como catalisadores (por exemplo o ferro nas enzimas).

1. 2. Elementos metálicos na TP (blocos s, p, d e f ) – Afinidade eletrónica (AE) é a energia posta em jogo (valor simétrico da variação de entalpia) na formação de uma mole de iões mononegativos a partir de uma mole de átomos no estado gasoso e fundamental, captando uma mole de eletrões. M 1 1. Um outro olhar sobre a TP dos elementos

1. 2. Elementos metálicos na TP (blocos s, p, d e f ) – Afinidade eletrónica Na maioria dos casos, a energia posta em jogo na formação de uma mole de iões mononegativos a partir de uma mole de átomos no estado gasoso e fundamental é um processo exotérmico (∆H < 0), logo energeticamente favorável. Noutros casos, este processo é endotérmico (∆H > 0) , sendo energeticamente desfavorável. M 1 1. Um outro olhar sobre a TP dos elementos

1. 2. Elementos metálicos na TP (blocos s, p, d e f ) – Afinidade eletrónica Os elementos metálicos apresentam baixa energia de ionização (são mais estáveis na forma de catiões) e os elementos não metálicos apresentam elevada afinidade eletrónica (são mais estáveis na forma de aniões). M 1 1. Um outro olhar sobre a TP dos elementos


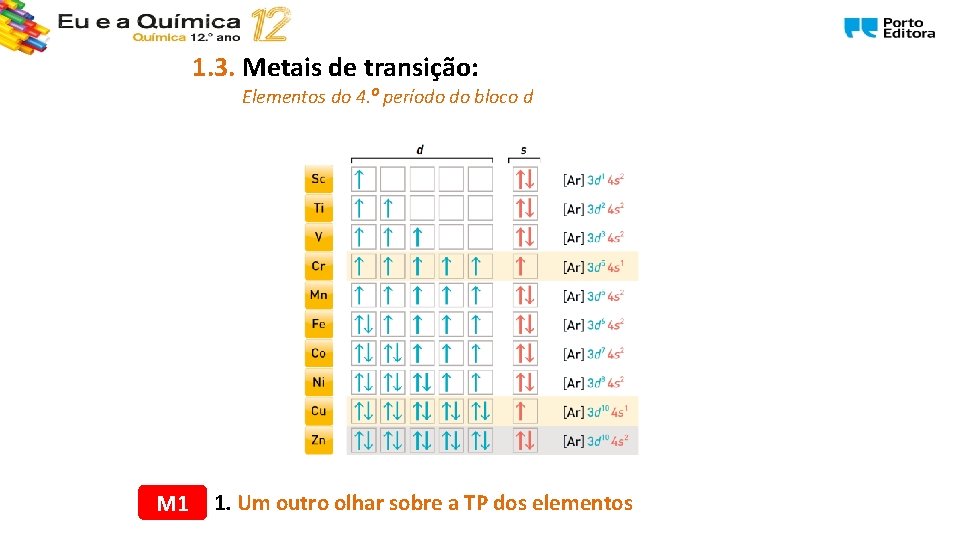
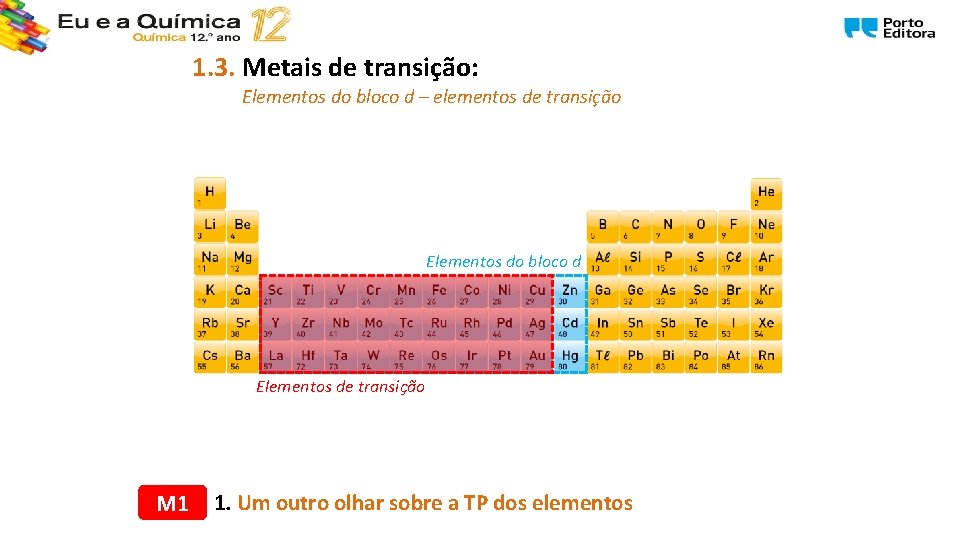
1. 3. Metais de transição: Elementos do bloco d M 1 1. Um outro olhar sobre a TP dos elementos

1. 3. Metais de transição: Elementos do bloco d Pertencem ao bloco d da TP todos os elementos que possuem eletrões em orbitais do tipo d em preenchimento ou acabadas de ser totalmente preenchidas. M 1 1. Um outro olhar sobre a TP dos elementos

1. 3. Metais de transição: Elementos do bloco d Elementos ou metais de transição são aqueles cujos átomos possuem uma orbital d incompleta ou que podem originar, pelo menos, um ião que possua uma orbital d incompleta. M 1 1. Um outro olhar sobre a TP dos elementos

1. 3. Metais de transição: Elementos do 4. º período do bloco d M 1 1. Um outro olhar sobre a TP dos elementos

1. 3. Metais de transição: Elementos de transição O zinco (Zn), apesar de pertencer ao bloco d, não é um elemento de transição dado que possui na sua configuração eletrónica o subnível d totalmente preenchido, d 10, passando a ter a configuração eletrónica [Ar] 3 d 10 ao formar o ião Zn 2+. Pela mesma razão, o cádmio e o mercúrio também não são metais de transição. O cobre (Cu), apesar de possuir uma configuração eletrónica [Ar] 3 d 10 4 s 1 , é de facto um elemento de transição, uma vez que pelo menos um dos iões que tem tendência a formar (Cu 2+) tem uma orbital no subnível d semipreenchida. M 1 1. Um outro olhar sobre a TP dos elementos

1. 3. Metais de transição: Elementos do bloco d – elementos de transição Elementos do bloco d Elementos de transição M 1 1. Um outro olhar sobre a TP dos elementos

Síntese de conteúdos • A Tabela Periódica consiste na disposição sistemática dos elementos químicos, na forma de uma tabela, em função das propriedades dos elementos e das substâncias elementares. • A Tabela Periódica atual é constituída por 118 elementos químicos que se encontram organizados em 18 grupos (que são as colunas verticais), 7 períodos (as linhas horizontais) e quatro blocos (blocos s, p, d e f). • Esta tabela inclui três tipos de elementos: os metais – que ocupam a maior parte da Tabela Periódica e que se encontra mais à esquerda; os não metais – que se situam mais à direita da Tabela Periódica e os semimetais, que se encontram entre os metais e os não metais. M 1 1. Um outro olhar sobre a TP dos elementos

Síntese de conteúdos • Muitas propriedades dos elementos e substâncias elementares variam de uma forma periódica com a sua posição na Tabela Periódica. • Genericamente, o raio atómico aumenta ao longo do grupo (de cima para baixo) e diminui ao longo do período (da esquerda para a direita). • A energia de ionização tende a aumentar ao longo do período (da esquerda para a direita) e a diminuir ao longo do grupo (de cima para baixo). • Os metais apresentam valores baixos de energia de ionização e os não metais valores mais elevados. • Pode assim afirma-se que o carácter metálico de um elemento está associado a uma baixa energia de ionização. M 1 1. Um outro olhar sobre a TP dos elementos

Síntese de conteúdos • Os metais são cada vez mais importantes no nosso dia a dia e são uma matéria-prima muito importante ao nível industrial e económico. • São poucos os metais que, no seu estado puro, servem para satisfazer as necessidades atuais da nossa sociedade, por isso recorre-se às ligas metálicas. • As ligas metálicas mais produzidas pela indústria são as de ferro, cobre, magnésio, alumínio, chumbo, titânio, lítio, níquel e ouro. • É expectável que o aço (liga de ferro e carbono) continue a ser, por razões económicas, a liga mais usada no futuro próximo. M 1 1. Um outro olhar sobre a TP dos elementos

Síntese de conteúdos • A afinidade eletrónica é a energia posta em jogo na formação de uma mole de iões mononegativos a partir de uma mole de átomos no estado gasoso e fundamental, captando uma mole de eletrões. • A afinidade eletrónica tende a aumentar ao longo do período e a diminuir ao longo do grupo. • Assim, os metais apresentam baixas afinidades eletrónicas e os não metais possuem elevadas afinidades eletrónicas. • Os elementos metálicos apresentam baixa energia de ionização (são mais estáveis na forma de catiões) e os elementos não metálicos apresentam elevada afinidade eletrónica (são mais estáveis na forma de aniões). M 1 1. Um outro olhar sobre a TP dos elementos

Síntese de conteúdos • Os elementos ou metais de transição são aqueles cujos átomos possuem uma orbital d incompleta ou que podem originar, pelo menos, um ião que possua uma orbital d incompleta. • O zinco apesar de pertencer ao bloco d, não é um elemento de transição dado possuir na sua configuração eletrónica o subnível d totalmente preenchido (com 10 eletrões) e 2 eletrões na orbital 4 s, passando a ter uma configuração eletrónica de valência 3 d 10 ao formar o catião dipositivo de zinco. M 1 1. Um outro olhar sobre a TP dos elementos

Diagrama de conteúdos

Diagrama de conteúdos

Diagrama de conteúdos

Diagrama de conteúdos























