METAIS ALCALINOS TERROSOS INTRODUO OS METAIS ALCALINOS TERROSOS



![METAIS ALCALINOS TERROSOS ELEMENTO Z. CONFIGURAÇÃO ELETRÔNICA CONDENSADA Be 4 [He] 2 s 2 METAIS ALCALINOS TERROSOS ELEMENTO Z. CONFIGURAÇÃO ELETRÔNICA CONDENSADA Be 4 [He] 2 s 2](https://slidetodoc.com/presentation_image_h/bf9b2080e4d31a89fa1b4114eb5ab0e8/image-4.jpg)
















































- Slides: 56

METAIS ALCALINOS TERROSOS INTRODUÇÃO OS METAIS ALCALINOS TERROSOS MOSTRAM AS MESMAS TENDÊNCIAS NAS PROPRIEDADES QUE FORAM OBSERVADAS NOS METAIS ALCALINOS. O Be (MUITO MAIS QUE O Li NO GRUPO 1) DIFERE DO RESTANTE DO GRUPO. O Be MOSTRA ALGUMAS SEMELHANÇAS COM O ALUMÍNIO NO GRUPO 3

METAIS ALCALINOS TERROSOS • SEMELHANÇAS DIAGONAIS NA TABELA PERIÓDICA • Li Be B C • Na Mg Al Si • OS MAT SÃO MENOS REATIVOS QUE OS METAIS DO GRUPO 1

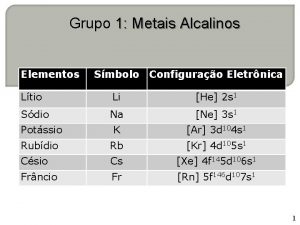
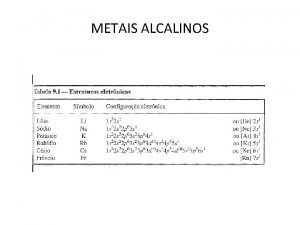
METAIS ALCALINOS TERROSOS • OS MAT GERALMENTE FORMAM COMPOSTOS IÔNICOS E INCOLORES E DIVALENTES. • ESTRUTURA ELETRÔNICA • TODOS OS MAT TEM 2 ELÉTRONS “s” NO NÍVEL ELETRÔNICO MAIS EXTERNO. • A CONFIGURAÇÃO ELETRÔNICA CONDENSADA É DO TIPO [GN] ns 2
![METAIS ALCALINOS TERROSOS ELEMENTO Z CONFIGURAÇÃO ELETRÔNICA CONDENSADA Be 4 He 2 s 2 METAIS ALCALINOS TERROSOS ELEMENTO Z. CONFIGURAÇÃO ELETRÔNICA CONDENSADA Be 4 [He] 2 s 2](https://slidetodoc.com/presentation_image_h/bf9b2080e4d31a89fa1b4114eb5ab0e8/image-4.jpg)
METAIS ALCALINOS TERROSOS ELEMENTO Z. CONFIGURAÇÃO ELETRÔNICA CONDENSADA Be 4 [He] 2 s 2 Mg 12 [Ne] 3 s 2 Ca 20 [Ar] 4 s 2 Sr 38 [Kr] 5 s 2 Ba 56 [Xe] 6 s 2 Ra 88 [Rn] 7 s 2

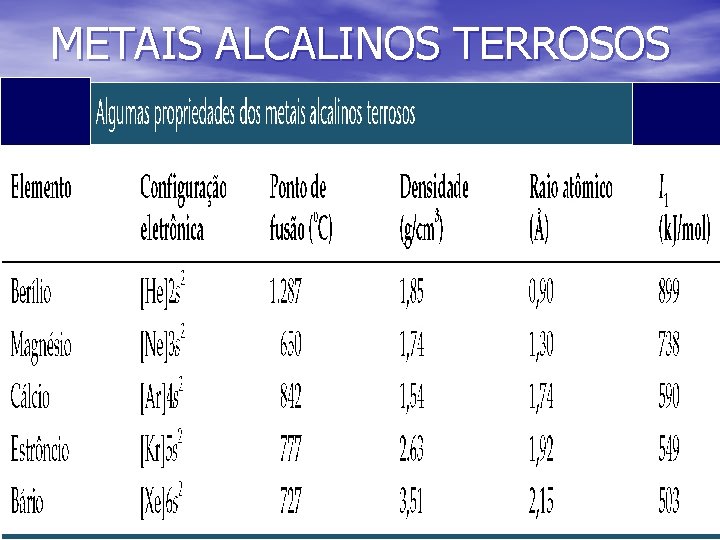
METAIS ALCALINOS TERROSOS • TAMANHO DOS ÁTOMOS E DOS ÍONS • OS ÁTOMOS DOS ELEMENTOS DO GRUPO 2 SÃO GRANDES, MAS MENORES QUE OS CORRESPONDENTES ELEMENTOS DO GRUPO 1, PORQUE A CARGA ADICIONAL DO NÚCLEO FAZ COM QUE A ATRAÇÃO SOBRE OS ELÉTRONS AUMENTE. • ANALOGAMENTE, OS ÍONS SÃO GRANDES, MAS SÃO MENORES QUE OS DOS CORRESPONDENTES ELEMENTOS DO GRUPO 1.

METAIS ALCALINOS TERROSOS →

OS METAIS ALCALINOS TERROSOS • DENSIDADE • OS METAIS ALCALINOS TERROSOS POSSUEM DENSIDADES MAIORES QUE OS METAIS ALCALINOS. • NÃO SE PODE FAZER UMA RACIONALIZAÇÃO SIMPLES DA DENSIDADE ENQUANTO PROPRIEDADE PERIÓDICA, SOBRETUDO PORQUE OS MAT POSSUEM ESTRUTURAS CRISTALINAS DIFERENTES.

METAIS ALCALINOS TERROSOS • ELETRONEGATIVIDADE • AS ELETRONEGATIVIDADES DOS MAT SÃO BAIXAS. ENTRETANTO SÃO MAIORES DO QUE DOS METAIS ALCALINOS CORRESPONDENTES. • QUANDO Mg, Ca, Sr e Ba REAGEM COM HALOGÊNIOS E OXIGÊNIO, A DIFERENÇA DE ELETRONEGATIVIDADE SERÁ GRANDE E OS COMPOSTOS FORMADOS SERÃO IÔNICOS. • QUANDO O Be REAGE COM OUTROS ÁTOMOS A DIFERENÇA DE ELETRONEGATIVIDADE É GERALMENTE PEQUENA → COMPOSTOS COVALENTES

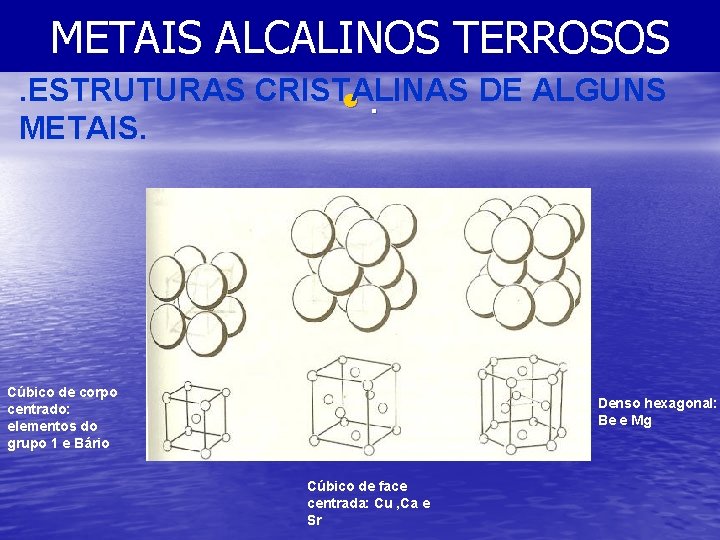
METAIS ALCALINOS TERROSOS • ESTRUTURA CRISTALINA , DUREZA , PONTOS DE FUSÃO E EBULIÇÃO • OS MAT TEM AS SEGUINTES ESTRUTURAS CRISTALINAS: • Be e Mg → HEXAGONAL DE EMPACOTAMENTO DENSO. • Ca e Sr → CÚBICO DE FACE CENTRADA. • Ba → CÚBICO DE CORPO CENTRADO.

METAIS ALCALINOS TERROSOS. ESTRUTURAS CRISTALINAS DE ALGUNS • . METAIS. Cúbico de corpo centrado: elementos do grupo 1 e Bário Denso hexagonal: Be e Mg Cúbico de face centrada: Cu , Ca e Sr

METAIS ALCALINOS TERROSOS • DUREZA, PF e PE • OS MAT POSSUEM 2 ELÉTRONS DE VALÊNCIA QUE PODEM PARTICIPAR DAS LIGAÇÕES METÁLICAS, ENQUANTO QUE OS MA POSSUEM UM ÚNICO ELÉTRON. • DEVIDO A ESTE FATO, OS MAT SÃO MAIS DUROS, SUAS ENERGIAS DE LIGAÇÃO SÃO MAIORES E SEUS PF E PE SÃO MUITO MAIS ELEVADOS QUE OS DOS METAIS ALCALINOS.

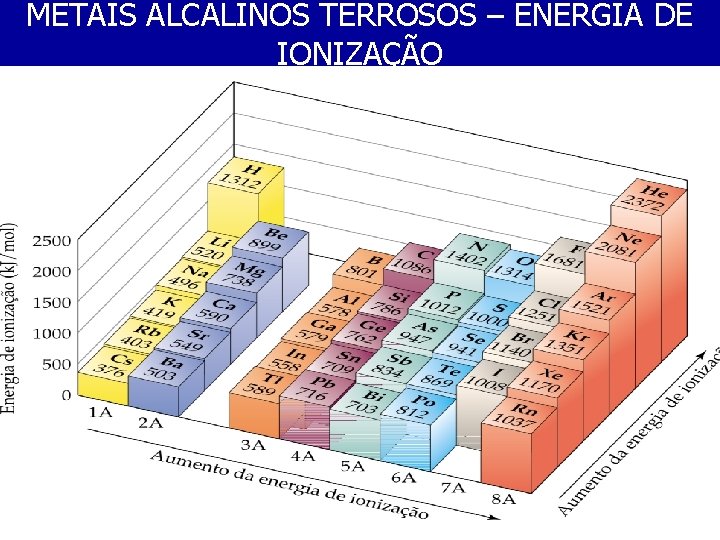
METAIS ALCALINOS TERROSOS • ENERGIA DE IONIZAÇÃO • A 3ª EI É TÃO ALTA QUE OS ÍONS M 3+ NUNCA SÃO FORMADOS. • A EI DO Be 2+ É ALTA, SENDO SEUS COMPOSTOS TIPICAMENTE COVALENTES. • OS COMPOSTOS FORMADOS PELO Mg, Ca, Sr e Ba SÃO PREDOMINANTEMENTE IÔNICOS E OS METAIS SÃO ENCONTRADOS COMO ÍONS DIVALENTES.

METAIS ALCALINOS TERROSOS – ENERGIA DE IONIZAÇÃO

METAIS ALCALINOS TERROSOS • OS ÁTOMOS DOS MAT SÃO MENORES QUE OS CORRESPONDENTES MA; OS ELÉTRONS ESTÃO MAIS FORTEMENTE LIGADOS E A 1ª EI DOS MAT É MAIOR QUE A DOS MA. • RETIRADO O 1º ELÉTRON Zef CRESCE E OS ELÉTRONS REMANESCENTES ESTÃO AINDA MAIS FORTEMENTE LIGADOS. • ASSIM A 2ª EI DOS MAT É QUASE O DOBRO DA 1ª. • O FATO DE SE FORMAREM COMPOSTOS IÔNICOS SUGERE QUE U 0 COMPENSA A ENERGIA NECESSÁRIA PARA PRODUZIR OS ÍONS.

METAIS ALCALINOS TERROSOS • ENERGIAS DE HIDRATAÇÃO • AS ENERGIAS DE HIDRATAÇÃO DOS ELEMENTOS DO GRUPO 2 SÃO DE 4 A 5 VEZES MAIORES QUE AS DOS CORRESPONDENTES ÍONS DO GRUPO 1. • ISSO SE DEVE PRINCIPALMENTE AO SEU MENOR TAMANHO E A SUA MAIOR CARGA, DE MODO QUE OS VALORES DE ∆H DE HIDRATAÇÃO DECRESCEM DE CIMA PARA BAIXO DENTRO DO GRUPO, À MEDIDA QUE O TAMANHO DOS ÍONS AUMENTA.

METAIS ALCALINOS TERROSOS • OS COMPOSTOS CRISTALINOS DO GRUPO 2 CONTÊM MAIS MOLÉCULAS DE ÁGUA DE CRISTALIZAÇÃO QUE OS CORRESPONDENTES COMPOSTOS DO GRUPO 1. • EXEMPLO Na. Cl e KCl SÃO ANIDROS. • Mg. Cl 2. 6 H 2 O e Ca. Cl 2. 6 H 2 O → HEXAIDRATADOS • O NÚMERO DE MOLÉCULAS DE ÁGUA DE CRISTALIZAÇÃO DIMINUI À MEDIDA QUE OS ÍONS SE TORNAM MAIORES.

METAIS ALCALINOS TERROSOS • COR DOS COMPOSTOS E PROPRIEDADES MAGNÉTICAS • DADO QUE OS ÍONS DIVALENTES POSSUEM UMA ESTRUTURA DE GÁS NOBRE, SEM ELÉTRONS DESEMPARELHADOS, TODOS OS SEUS COMPOSTOS SÃO DIAMAGNÉTICOS E INCOLORES, A NÃO SER QUE O NION SEJA COLORIDO.

METAIS ALCALINOS TERROSOS • SOLUBILIDADE E ENERGIA RETICULAR • A SOLUBILIDADE DA MAIORIA DOS SAIS DIMINUI COM O AUMENTO DE “Z”. • A SOLUBILIDADE DEPENDE DA ENERGIA RETICULAR DO SÓLIDO E DA ENERGIA DE HIDRATAÇÃO DOS ÍONS. • AS ENERGIAS RETICULARES SÃO MUITO MAIORES QUE A DOS CORRESPONDENTES COMPOSTOS DO GRUPO 1, DEVIDO AO AUMENTO DA CARGA.

METAIS ALCALINOS TERROSOS EQUAÇÃO DE BORN-LANDÉ

METAIS ALCALINOS TERROSOS • ALTAS ENERGIAS RETICULARES SÃO FAVORECIDAS POR PEQUENAS DIST NCIAS INTERIÔNICAS E ÍONS COM CARGAS ELEVADAS. • CONSIDERANDO-SE UM ÍON NEGATIVO QUALQUER, A ENERGIA RETICULAR DECRESCE À MEDIDA QUE AUMENTA O TAMANHO DO METAL. • A ENERGIA DE HIDRATAÇÃO TAMBÉM DIMINUI A MEDIDA QUE OS ÍONS METÁLICOS TORNAMSE MAIORES.

METAIS ALCALINOS TERROSOS • PARA QUE UMA SUBST NCIA SEJA SOLÚVEL, A ENERGIA DE HIDRATAÇÃO DEVE SER MAIOR QUE A ENERGIA RETICULAR. • CONSIDERE UM GRUPO DE COMPOSTOS CORRELATOS, POR EXEMPLO OS CLORETOS DE TODOS OS METAIS DO GRUPO 2. • DESCENDO NO GRUPO OS ÍONS METÁLICOS CRESCEM E A ENERGIA RETICULAR E A ENERGIA DE HIDRAÇÃO DIMINUEM.

METAIS ALCALINOS TERROSOS • UMA DIMINUIÇÃO DA ENERGIA RETICULAR FAVORECE O AUMENTO DA SOLUBILIDADE, MAS A DIMINUIÇÃO DA ENERGIA DE HIDRATAÇÃO FAVORECE UM DECRÉSCIMO DA SOLUBILIDADE. • NA MAIORIA DOS CASOS, A ENERGIA DE HIDRATAÇÃO DIMINUI MAIS RAPIDAMENTE QUE A ENERGIA RETICULAR, PORTANTO OS COMPOSTOS FICAM MENOS SOLÚVEIS À MEDIDA QUE O MAT AUMENTA DE TAMANHO.

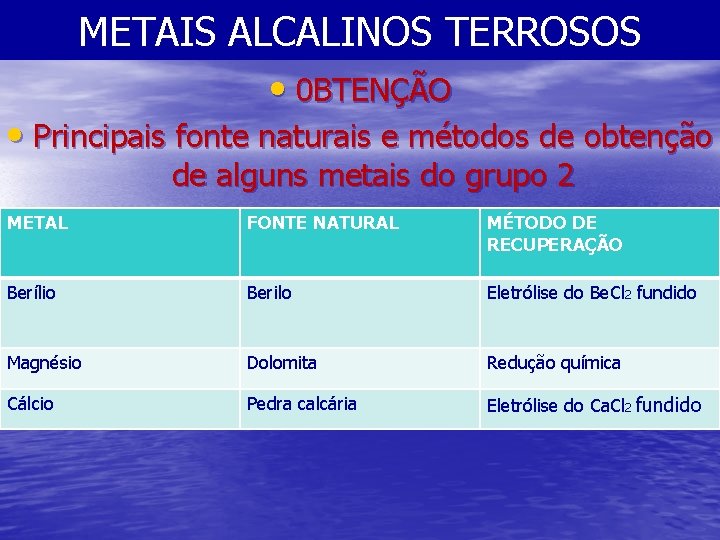
METAIS ALCALINOS TERROSOS • OBTENÇÃO • Metais são obtidos a partir de seus minérios com o uso de um agente redutor a altas temperaturas ou por eletrólise • Mg. O(s) + C(s) Mg(l) + CO(g) ∆ • Nesta reação o carbono é utilizado como agente redutor.

METAIS ALCALINOS TERROSOS • 0 BTENÇÃO • Principais fonte naturais e métodos de obtenção de alguns metais do grupo 2 METAL FONTE NATURAL MÉTODO DE RECUPERAÇÃO Berílio Berilo Eletrólise do Be. Cl 2 fundido Magnésio Dolomita Redução química Cálcio Pedra calcária Eletrólise do Ca. Cl 2 fundido

METAIS ALCALINOS TERROSOS • Berilo = Be 3 Al 2 Si 6 O 18 • Os átomos de sílicio e oxigênio alternados formam um anel de doze membros (ciclohexametasilicato) • Dolomita = Ca. Mg(CO 3)12 • Pedra calcárea = Ca. CO 3

METAIS ALCALINOS TERROSOS • Cálcio e estrôncio metálicos são obtidos industrialmente pela eletrólise de seus cloretos, aos quais se adiciona KCl para diminuir o ponto de fusão. • O bário também é produzido por eletrólise, mas é usualmente preparado pela redução a alta temperatura do óxido de bário pelo alumínio sob vácuo • 2 Al(s) + 3 Ba. O(s) → 3 Ba(l) + Al 2 O 3(s)

METAIS ALCALINOS TERROSOS • PROPRIEDADES QUÍMICAS • OS MAT QUASE SEMPRE REAGEM FORMANDO COMPOSTOS NOS QUAIS O METAL APRESENTA O ESTADO DE OXIDAÇÃO +2. • OS METAIS ALCALINOS TERROSOS SÃO AGENTES REDUTORES PODEROSOS, COMO SE PODE OBSERVAR PELOS SEUS POTENCIAIS DE REDUÇÃO. • DE FATO, COM EXCEÇÃO DO Be e DO Mg, ESSES ELEMENTOS SÃO AGENTES REDUTORES TÃO BONS QUANTO OS METAIS ALCALINOS.

METAIS ALCALINOS TERROSOS • . POTENCIAIS DE REDUÇÃO PARA OS METAIS ALCALINOS TERROSOS (εo volts) Be 2+ Mg 2+ Ca 2+ Sr 2+ Ba 2+ Ra 2+ + + + 2 e- → Be(s) 2 e- → Mg(s) 2 e- → Ca(s) 2 e- → Sr(s) 2 e- → Ba(s) 2 e- → Ra(s) -1, 69 v -2, 37 v -2, 89 v -2, 91 v -2, 92 v

METAIS ALCALINOS TERROSOS • A TABELA INDICA QUE O Be É MUITO MENOS ELETROPOSITIVO E NÃO REAGE COM A ÁGUA. • M(s) + 2 H 2 O(l) → M 2+(aq) + H 2(g) + 2 OH(aq) • Ca(s) + 2 H 2 O(l) → Ca(OH)2(aq) + H 2(g) • Ca, Sr e Ba têm potenciais de redução semelhantes aqueles dos correspondentes metais do grupo 1, e se situam em posições no topo da série eletroquímica.

METAIS ALCALINOS TERROSOS • Ca, Sr E Ba REAGEM FACILMENTE COM A ÁGUA FRIA, LIBERANDO HIDROGÊNIO E FORMANDO OS HIDRÓXIDOS. • Ca(s) + 2 H 2 O(l) → Ca(OH)2(aq) + H 2(g) • O Mg REAGE COM A ÁGUA QUENTE • Mg (s) + H 2 O(l) → Mg. O(aq) + H 2(g) ou • Mg(s) + 2 H 2 O(l) → Mg(OH)2(aq) + H 2(g)

METAIS ALCALINOS TERROSOS • O Mg FORMA UMA CAMADA PROTETORA DE ÓXIDO. ASSIM APESAR DE SEU POTENCIAL DE REDUÇÃO FAVORÁVEL, O Mg NÃO REAGE FACILMENTE A NÃO SER QUE A CAMADA DE ÓXIDO SEJA REMOVIDA POR AMALGAMAÇÃO COM MERCÚRIO.

METAIS ALCALINOS TERROSOS • ALGUMAS REAÇÕES DOS ELEMENTOS DO GRUPO 2 REAÇÃO M + 2 H 2 O → M(OH)2 M + 2 HCl → MCl 2 + H 2 Be + 2 Na. OH + 2 H 2 O → Na 2[Be(OH)4] + H 2 2 M + O 2 → 2 MO OBSERVAÇÃO Mg reage com água quente; Ca, Sr e Ba com água fria. Todos os metais reagem com ácidos liberando H 2 Be é anfótero Todos os membros do grupo formam óxidos normais

METAIS ALCALINOS TERROSOS • ALGUMAS REAÇÕES DOS ELEMENTOS DO GRUPO 2 REAÇÃO OBSERVAÇÃO Ba + O 2 → Ba. O 2 Com excesso de O 2 o Ba também forma peróxido. M + H 2→ MH 2 Ca, Sr e Ba formam a altas temperaturas hidretos iônicos 3 M + N 2 → M 3 N 2 Todos os elementos do grupo formam nitretos a temperaturas elevadas

METAIS ALCALINOS TERROSOS • ALGUMAS REAÇÕES DOS ELEMENTOS DO GRUPO 2 REAÇÃO OBSERVAÇÃO 3 M + 2 P → M 3 P 2 Todos os metais do grupo formam fosfetos a temperaturas elevadas M + S → MS Todos os metais formam sulfetos M Todos os metais formam selenetos. + Se → MSe M + Te → MTe Todos os metais formam teluretos

METAIS ALCALINOS TERROSOS • ALGUMAS REAÇÕES DOS ELEMENTOS DO GRUPO 2 REAÇÃO OBSERVAÇÃO M + X 2 → MX 2 Todos os metais formam haletos. X=F, Cl, Br e I M + 2 NH 3 → M(NH 2)2 + H 2 Todos os metais do grupo formam amidetos a altas temperaturas

METAIS ALCALINOS TERROSOS • DIFERENÇAS ENTRE O BERILIO E OS DEMAIS ELEMENTOS DO GRUPO • O Be apresenta propriedades diferentes daquelas dos demais metais do grupo 2 e se assemelha diagonalmente com o alumínio no grupo 13. • Citamos a seguir algumas diferenças entre o Be e os demais MAT. • 1 -Todos os haletos de Be são solúveis em solventes orgânicos

METAIS ALCALINOS TERROSOS • 2 -O Be é muito pequeno e tem uma densidade de carga elevada apresentando uma grande tendência a covalência. Como consequência os PF de seus compostos são mais baixos. Os demais haletos dos elementos do grupo 2 são iônicos. Be. F 2 – composto covalente – PF= 552 0 C Ca. F 2 – composto iônico – PF = 1418 0 C Sr. F 2 – composto iônico – PF= 1477 0 C

METAIS ALCALINOS TERROSOS • 3 - O hidreto de Be é deficiente em elétrons, polimérico e forma ligações multicentradas. • 4 -Os hidróxidos de metais alcalinos terrosos são bases fortes entretanto o hidróxido de berílio é anfótero. • 5 -O Be se torna “passivo” quando tratado com ácido nítrico. • 6 - O Be forma muitos complexos o que não é comum no caso dos elementos dos grupos 1 e 2.

METAIS ALCALINOS TERROSOS • SEMELHANÇAS DIAGONAIS ENTRE O BERÍLIO E O ALUMÍNIO • 1 -O Be forma um carbeto incomum Be 2 C que como o Al 4 C 3 , libera metano ao se hidrolisar. • 2 -O Be e o Al tornam-se passivos quando reagem com o HNO 3. • 3 -O Be. Cl 2 geralmente forma cadeias, mas pode formar o dímero. O Al. Cl 3 é um dímero.

METAIS ALCALINOS TERROSOS • 4 -O potencial padrão de eletrodo do Be se assemelha mais ao do Al. • ε 0 Al 3+/Al =-1, 66 v ε 0 Be 2+/Be =-1, 69 v • 5 -O Be(OH)2 como o Al(OH)3 é anfótero. • 6 -O hidreto de berílio é deficiente em elétrons e polimérico e forma ligações multicentradas, tal como o hidreto de alumínio.

METAIS ALCALINOS TERROSOS • CONDUTIVIDADE ELÉTRICA E TEMPERATURA A condutividade elétrica de um metal decresce com o aumento da temperatura. • Por outro lado a condutividade elétrica de um semicondutor cresce com o aumento da temperatura • DUREZA DA ÁGUA • A água dura contém carbonatos, bicarbonatos ou sulfatos de cálcio e magnésio dissolvidos.

METAIS ALCALINOS TERROSOS • A água dura dificulta a formação de espuma ao se utilizar sabões. • Os íons Ca 2+ e Mg 2+ reagem com o íon estearato do sabão gerando um precipitado de estearato de cálcio antes da formação de qualquer espuma. • 2 C 17 H 35 COO-Na+ + Ca. SO 4 → (C 17 H 35 COO-)2 Ca + Na 2 SO 4

METAIS ALCALINOS TERROSOS • Só após a remoção dos íons divalentes de Ca 2+ e Mg 2+ é que se pode obter uma espuma abundante. • Para a obtenção de espuma com uma água dura temos que usar uma grande quantidade de sabão. • Quanto mais dura for a água mais sabão será utilizado. • A dureza da água pode ser temporária ou permanente.

METAIS ALCALINOS TERROSOS • Dureza Temporária • A dureza temporária é decorrente da presença de Mg(HCO 3)2 e Ca(HCO 3)2. • A dureza temporária pode ser eliminada pela fervura. • A fervura expulsa o CO 2 e desloca o equilíbrio: • 2 HCO 3 - CO 3 2 - + CO 2 + H 2 O

METAIS ALCALINOS TERROSOS • Desta maneira os íons bicarbonatos decompõem-se em carbonatos e os íons metálicos precipitarão sobre a forma de carbonatos. • Removendo-se o Ca. CO 3 por filtração ou sedimentação a água estará livre da dureza. • A dureza temporária também pode ser eliminada adicionando-se cal hidratada para precipitar o carbonato de cálcio. • Este processo é denominado “depuração com cal”.

METAIS ALCALINOS TERROSOS • Elevando-se o p. H da água até 10, 5 a dureza temporária devida ao HCO 3 - pode ser quase que completamente eliminada. • Ca(HCO 3)2 + Ca(OH)2 2 Ca. CO 3 + 2 H 2 O • DUREZA PERMANENTE • A dureza permanente não pode ser eliminada pela fervura.

METAIS ALCALINOS TERROSOS • A dureza permanente decorre principalmente da presença de Mg. SO 4 ou Ca. SO 4 na solução. • Pequenas quantidades de água pura podem ser obtidas no laboratório por destilação ou passagem através de uma coluna de resina de troca iônica, onde os íons Ca 2+ e Mg 2+ são substituídos por Na+.

METAIS ALCALINOS TERROSOS • DUREZA PERMANENTE • Os íons Na+ não afetam a capacidade dos sabões de produzir espuma. • Os métodos de troca-iônica são largamente empregados na indústria. • {Resina. n. H}(s) + Ca 2+(aq) → • {Resina(n-2)H. Ca} (s) + 2 H+(aq)

METAIS ALCALINOS TERROSOS • Dureza Permanente • A remoção dos íons Ca 2+ e Mg 2+ da água dura é denominada abrandamento da água. • A dureza da água também pode ser eliminada, adicionando-se vários fosfatos, tais como o fosfato de sódio, o pirofosfato de sódio, o tripolifosfato de sódio ou o sal de Graham. • Esses fosfatos formam um complexo com os íons Ca 2+ Mg 2+.

METAIS ALCALINOS TERROSOS • USOS DOS METAIS ALCALINOS TERROSOS E SEUS COMPOSTOS • Berílio e Seus Compostos • O Be é raro, caro e tóxico, por isso ele e seus compostos apresentam uso limitado. • O Be puro é transparente aos raios X e assim é usado janelas de alguns tubos de raio X. • Ligas de Be e Cu são tão duras como alguns aços e são utilizadas na fabricação de ferramental que são úteis quando há perigo de explosão.

METAIS ALCALINOS TERROSOS • O óxido de Berílio é muito refratário (PF=2670) e é empregado na construção de isolantes elétricos para altas temperaturas. • Magnésio e Seus Compostos • O Magnésio é extensivamente usado na fabricação de ligas brilhantes e fortes que são particularmente utilizadas na indústria aeronáutica. • O Mg é um importante metal estrutural. • O Mg é usado na fabricação de ligas leves, para aviões, ferramentas e máquinas.

METAIS ALCALINOS TERROSOS • O Mg é empregado para fins militares (sinalizadores e bombas incendiárias) • O Mg é utilizado em sínteses industriais de muitos compostos orgânicos. • O hidróxido de magnésio é um dos componentes dos dentifrícios. • O sulfato de magnésio (sal de Epson) é um laxante.

METAIS ALCALINOS TERROSOS • Cálcio e Seus Compostos • A reatividade do cálcio com o oxigênio e água dificulta muito o uso do metal na forma livre. • O metal Ca é usado para a obtenção de ligas com o Al, utilizado na confecção de mancais. • O Ca é empregado como redutor na obtenção de outros metais como Zr, Cr, Th e U. • O Ca é usado na indústria do Fe e aço para controlar a quantidade de carbono no ferro fundido e na remoção de P, O e S.

METAIS ALCALINOS TERROSOS • O calcário é utilizado para a preparação do cal virgem , cimento e giz. • Estrôncio e Seus Compostos • Os compostos de estrôncio são utilizados em fogos de artifício e na sinalização das rodovias. • Bário e Seus Compostos • O Ba. SO 4 e tão insolúvel que embora o Ba 2+ seja tóxico, o Ba. SO 4 pode ser ingerido por via oral. Face ao exposto e considerando que íons Ba 2+ refletem fortemente os raios X o Ba. SO 4 é usado como contraste em radiografias.

METAIS ALCALINOS TERROSOS • As estruturas interiores do corpo podem ser caracterizadas porque o sulfato de bário é opaco aos raios X. • 0 Ba. SO 4 é utilizado como material de carga na manufatura de tintas e papel.

METAIS ALCALINOS TERROSOS • Rádio e Seus Compostos • O Ra é um emissor de partículas alfa. • O Ra já foi usado no tratamento radioterápico do câncer. Atualmente outras fontes de radiação são utilizadas para esta finalidade. • Ex: 60 Co