TABLA PERIODICA Y Propiedades peridicas de los elementos

TABLA PERIODICA Y Propiedades periódicas de los elementos

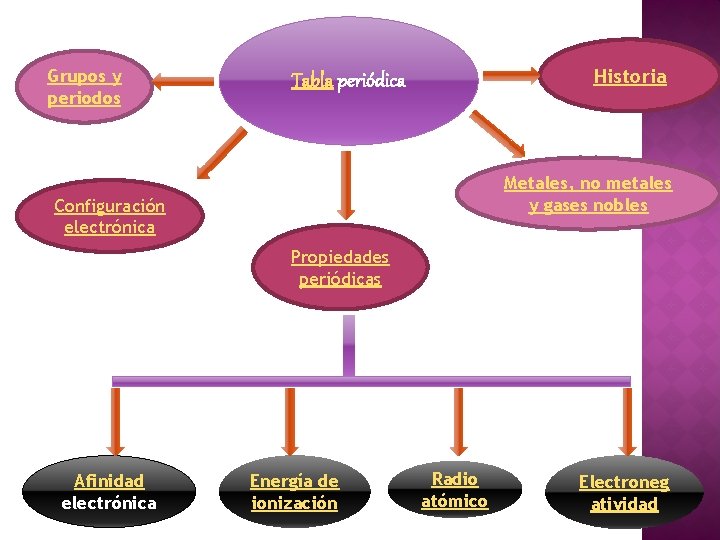
Grupos y periodos Historia Tabla periódica Metales, no metales y gases nobles Configuración electrónica Propiedades periódicas Afinidad electrónica Energía de ionización Radio atómico Electroneg atividad


Breve historia del Sistema Periódico • En 1817, Dobereiner Destaca la existencia de similitudes entre elementos agrupados en tríos que él denomina “tríadas”. • En 1864 Chancourtois y el inglés Newlands anuncian la Ley de las octavas En 1869, el alemán Meyer pone en evidencia una cierta periodicidad en el volumen atómico. . Simultáneamente con el ruso Mendeleïev, la primera tabla con 63 elementos. De esta manera los elementos son clasificados verticalmente. Las agrupaciones horizontales representan elementos de la misma “familia". Consiguió prever las propiedades químicas de tres de los elementos que faltaban a partir de las propiedades de los cuatro elementos vecinos. Cuando los elementos fueron descubiertos, ellos poseían las propiedades predichas. Sin embargo aunque la la clasificación de Mendeleïev marca un claro progreso, contiene ciertas anomalías debidas a errores de determinación de masa atómica A principios del siglo XX Henry Moseley propuso la ordenación por número atómico.

Ley de las octavas de Newlands 1 2 Li 6, 9 Be 9, 0 Na 23, 0 Mg 24, 3 K 39, 0 Ca 40, 0 3 4 5 6 B 10, 8 C 12, 0 N 14, 0 O 16, 0 Al 27, 0 Si 28, 1 P 31, 0 S 32, 1 7 F 19, 0 Cl 35, 5 : las propiedades se repiten cada ocho elementos. Pero esta ley no puede aplicarse a los elementos más allá del Calcio. .
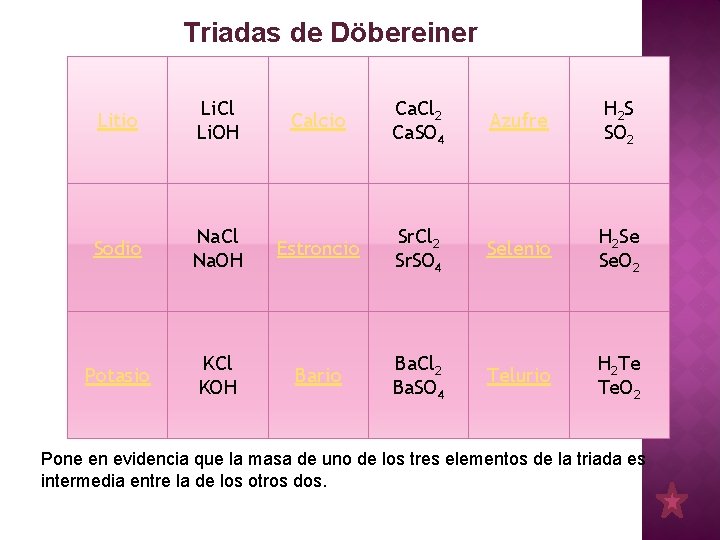
Triadas de Döbereiner Litio Li. Cl Li. OH Calcio Ca. Cl 2 Ca. SO 4 Azufre H 2 S SO 2 Sodio Na. Cl Na. OH Estroncio Sr. Cl 2 Sr. SO 4 Selenio H 2 Se Se. O 2 Potasio KCl KOH Bario Ba. Cl 2 Ba. SO 4 Telurio H 2 Te Te. O 2 Pone en evidencia que la masa de uno de los tres elementos de la triada es intermedia entre la de los otros dos.
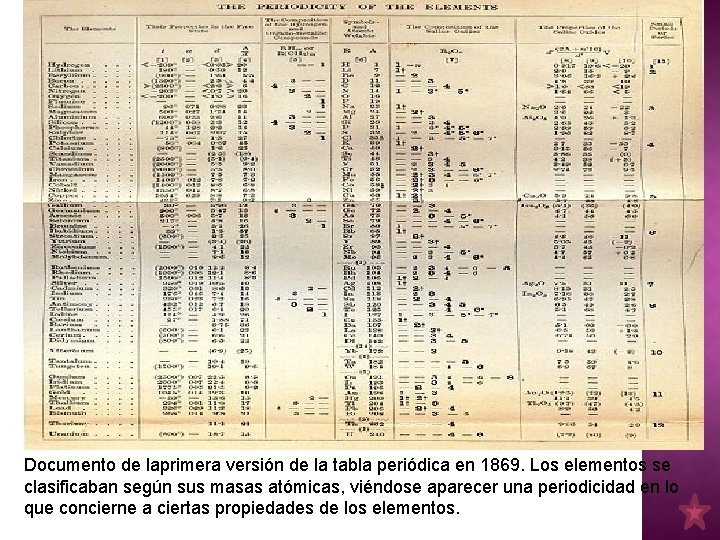
Documento de laprimera versión de la tabla periódica en 1869. Los elementos se clasificaban según sus masas atómicas, viéndose aparecer una periodicidad en lo que concierne a ciertas propiedades de los elementos.
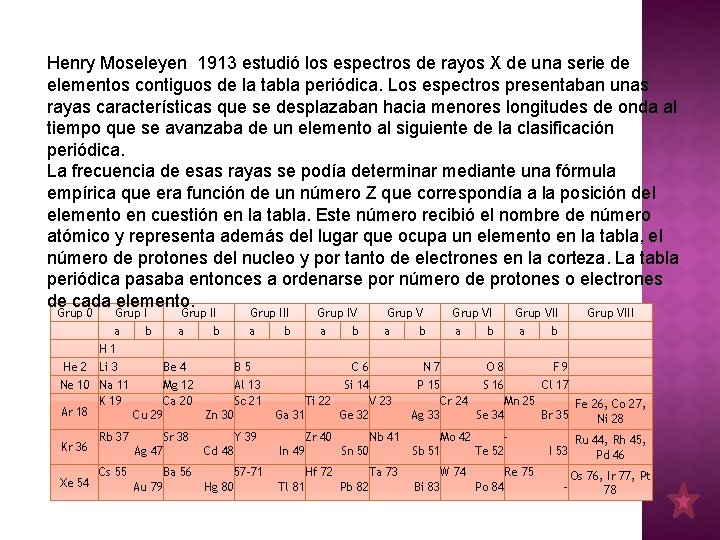
Henry Moseleyen 1913 estudió los espectros de rayos X de una serie de elementos contiguos de la tabla periódica. Los espectros presentaban unas rayas características que se desplazaban hacia menores longitudes de onda al tiempo que se avanzaba de un elemento al siguiente de la clasificación periódica. La frecuencia de esas rayas se podía determinar mediante una fórmula empírica que era función de un número Z que correspondía a la posición del elemento en cuestión en la tabla. Este número recibió el nombre de número atómico y representa además del lugar que ocupa un elemento en la tabla, el número de protones del nucleo y por tanto de electrones en la corteza. La tabla periódica pasaba entonces a ordenarse por número de protones o electrones de cada elemento. Grup 0 Grup III Grup IV Grup VIII a b a b H 1 He 2 Li 3 Be 4 B 5 C 6 N 7 O 8 F 9 Ne 10 Na 11 Mg 12 Al 13 Si 14 P 15 S 16 Cl 17 K 19 Ca 20 Sc 21 Ti 22 V 23 Cr 24 Mn 25 Fe 26, Co 27, Ar 18 Cu 29 Zn 30 Ga 31 Ge 32 Ag 33 Se 34 Br 35 Ni 28 Rb 37 Sr 38 Y 39 Zr 40 Nb 41 Mo 42 Ru 44, Rh 45, Kr 36 Ag 47 Cd 48 In 49 Sn 50 Sb 51 Te 52 I 53 Pd 46 Cs 55 Ba 56 57 -71 Hf 72 Ta 73 W 74 Re 75 Os 76, Ir 77, Pt Xe 54 Au 79 Hg 80 Tl 81 Pb 82 Bi 83 Po 84 78

Henry Moseleyen 1913 estudió los espectros de rayos X de una serie de elementos contiguos de la tabla periódica. Los espectros presentaban unas rayas características que se desplazaban hacia menores longitudes de onda al tiempo que se avanzaba de un elemento al siguiente de la clasificación periódica. La frecuencia de esas rayas se podía determinar mediante una fórmula empírica que era función de un número Z que correspondía a la posición del elemento en cuestión en la tabla. Este número recibió el nombre de número atómico y representa además del lugar que ocupa un elemento en la tabla, el número de protones del nucleo y por tanto de electrones en la corteza. La tabla periódica pasaba entonces a ordenarse por número de protones o electrones de cada elemento. Grup 0 Grup III Grup IV Grup VIII a b a b H 1 He 2 Li 3 Be 4 B 5 C 6 N 7 O 8 F 9 Ne 10 Na 11 Mg 12 Al 13 Si 14 P 15 S 16 Cl 17 K 19 Ca 20 Sc 21 Ti 22 V 23 Cr 24 Mn 25 Fe 26, Co 27, Ar 18 Cu 29 Zn 30 Ga 31 Ge 32 Ag 33 Se 34 Br 35 Ni 28 Rb 37 Sr 38 Y 39 Zr 40 Nb 41 Mo 42 Ru 44, Rh 45, Kr 36 Ag 47 Cd 48 In 49 Sn 50 Sb 51 Te 52 I 53 Pd 46 Cs 55 Ba 56 57 -71 Hf 72 Ta 73 W 74 Re 75 Os 76, Ir 77, Pt Xe 54 Au 79 Hg 80 Tl 81 Pb 82 Bi 83 Po 84 78
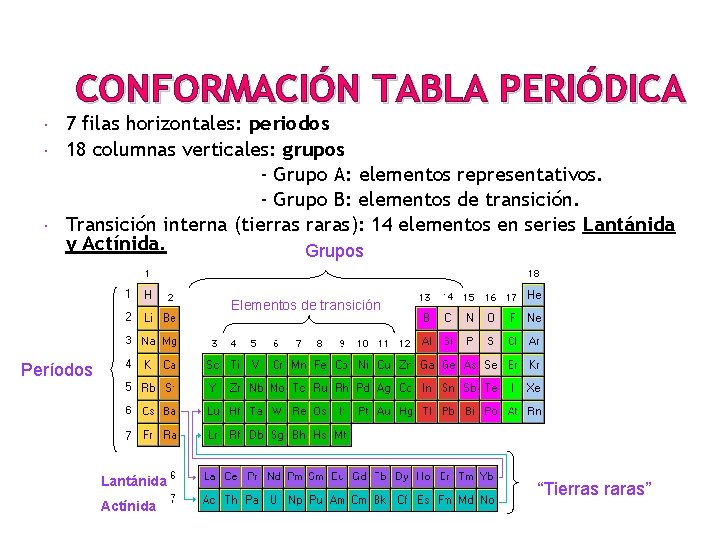
CONFORMACIÓN TABLA PERIÓDICA 7 filas horizontales: periodos 18 columnas verticales: grupos - Grupo A: elementos representativos. - Grupo B: elementos de transición. Transición interna (tierras raras): 14 elementos en series Lantánida y Actínida. Grupos Elementos de transición Períodos Lantánida Actínida “Tierras raras”
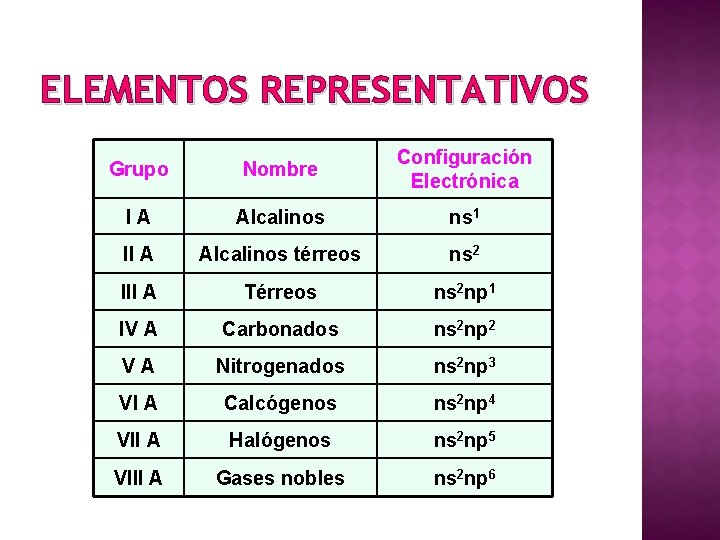
ELEMENTOS REPRESENTATIVOS Grupo Nombre Configuración Electrónica IA Alcalinos ns 1 II A Alcalinos térreos ns 2 III A Térreos ns 2 np 1 IV A Carbonados ns 2 np 2 VA Nitrogenados ns 2 np 3 VI A Calcógenos ns 2 np 4 VII A Halógenos ns 2 np 5 VIII A Gases nobles ns 2 np 6
ELEMENTOS REPRESENTATIVOS
ELEMENTOS TRANSICIÓN
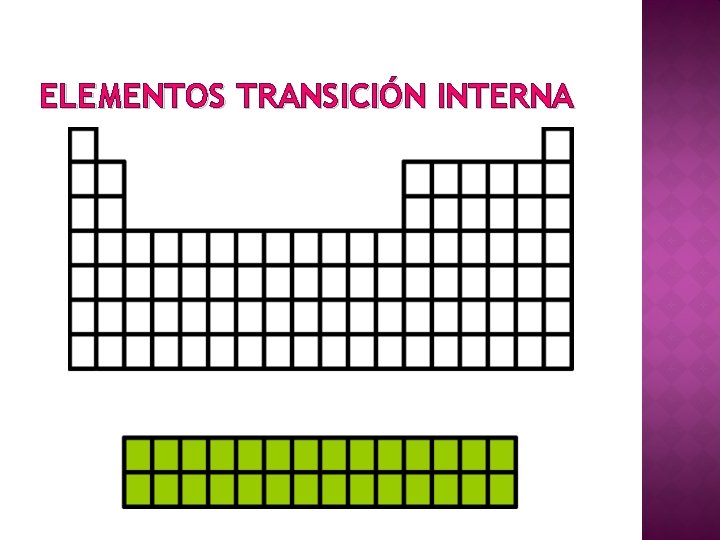
ELEMENTOS TRANSICIÓN INTERNA
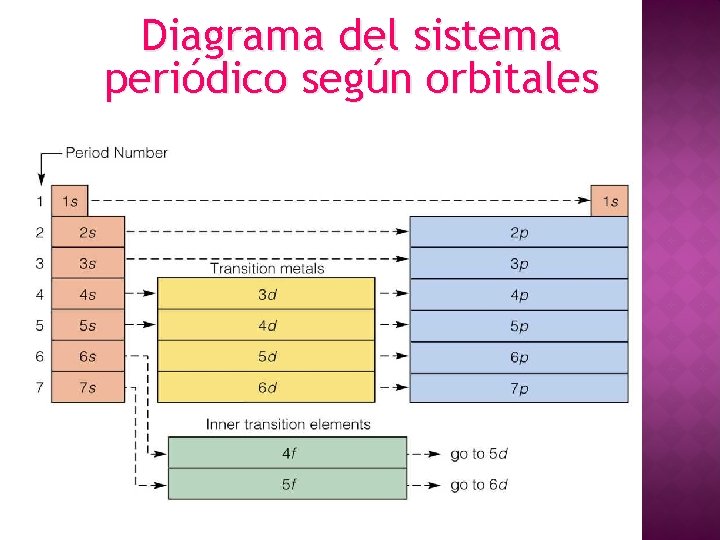
Diagrama del sistema periódico según orbitales
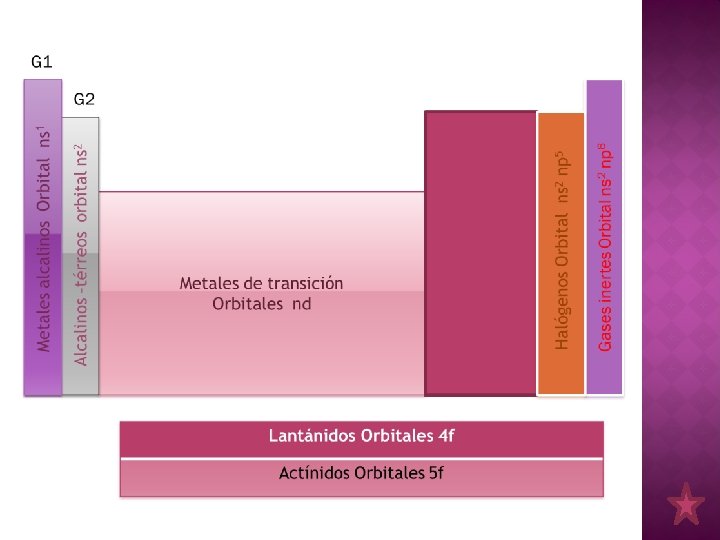

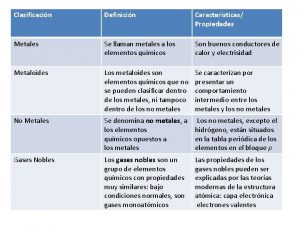
Tabla Periódica : Metales, No metales, Metaloides l Grupos o familias – – Grupo vertical de elementos situados en la tabla periódica Poseen propiedades químicas y físicas similares

l Período – Grupo horizontal de elementos situados en la tabla periódica – Transición de metales a no metales.

Propiedades químicas de los metales: metales Ø Por lo general poseen 1 a 3 electrones de valencia. Ø Forman cationes por pérdida de electrones. Ø Forman compuestos iónicos con no metales. Ø Los metales puros se caracterizan por el enlace metálico. Ø Los metales más químicamente reactivos están a la izquierda y abajo en la tabla.

Propiedades físicas de los metales: Ø Altos ptos. de fusión y ebullición. Ø Brillantes Ø Color plateado a gris Ø Alta densidad Ø Formas de sólidos cristalinos.

Propiedades químicas de los no metales: Ø Contienen cuatro o más electrones de valencia. Ø Forman aniones por ganancia de electrones cuando generan compuestos. Ø Forman compuestos iónicos con metales. Ø Forman compuestos covalentes con otros no metales.

Propiedades físicas de los no metales: Ø Son amorfos. Ø Poseen colores variados. Ø Son sólidos, líquidos o gases. Ø Poseen bajos puntos de fusión y ebullición. Ø Tienen baja densidad.
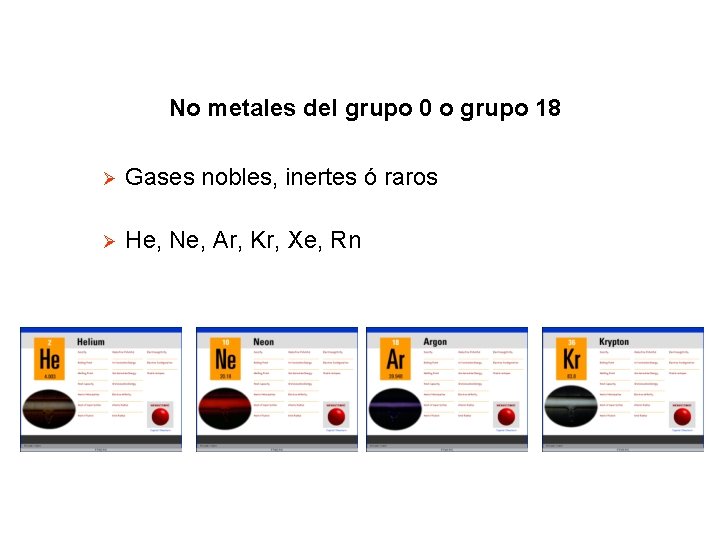
No metales del grupo 0 o grupo 18 Ø Gases nobles, inertes ó raros Ø He, Ne, Ar, Kr, Xe, Rn
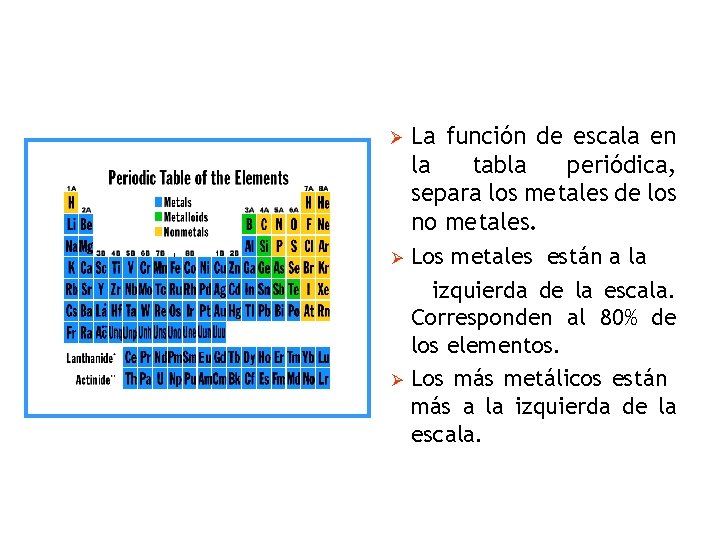
Ø Ø Ø La función de escala en la tabla periódica, separa los metales de los no metales. Los metales están a la izquierda de la escala. Corresponden al 80% de los elementos. Los más metálicos están más a la izquierda de la escala.
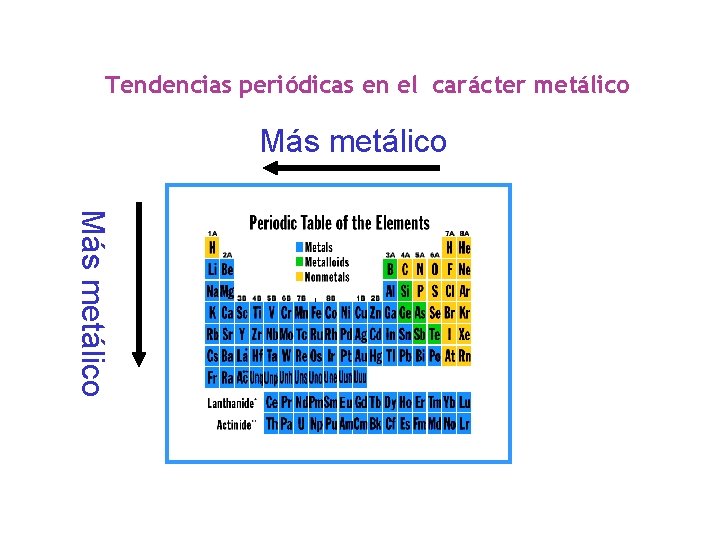
Tendencias periódicas en el carácter metálico Más metálico
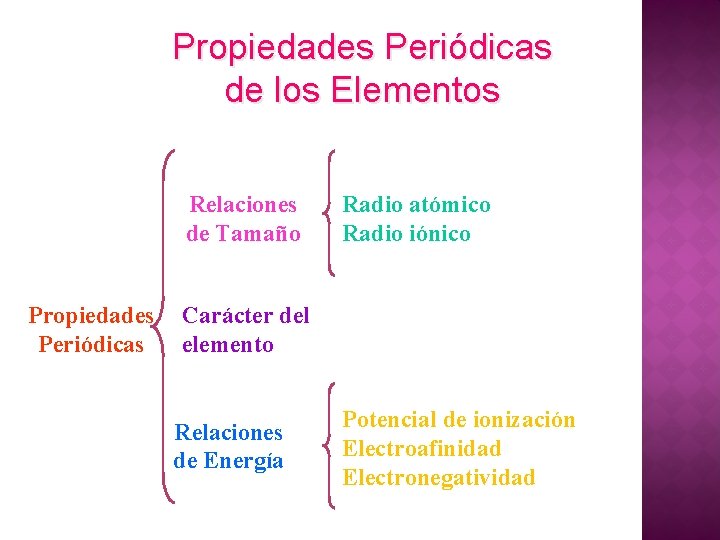
Propiedades Periódicas de los Elementos Relaciones de Tamaño Propiedades Periódicas Radio atómico Radio iónico Carácter del elemento Relaciones de Energía Potencial de ionización Electroafinidad Electronegatividad
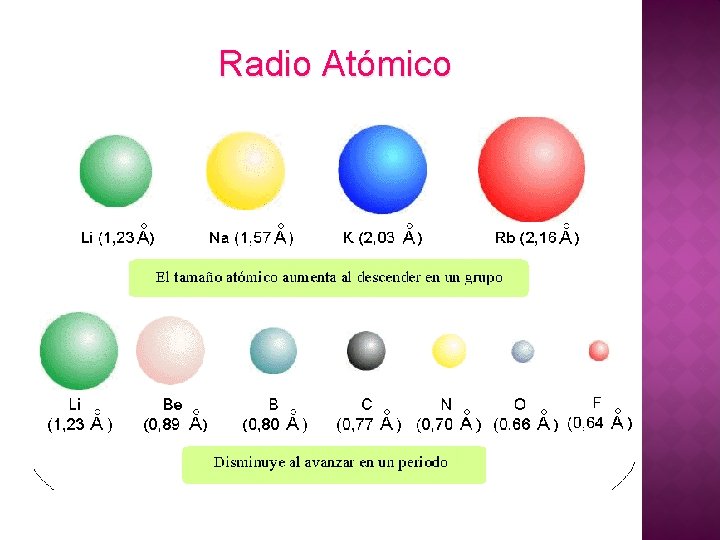
Radio Atómico

RADIO ATÓMICO
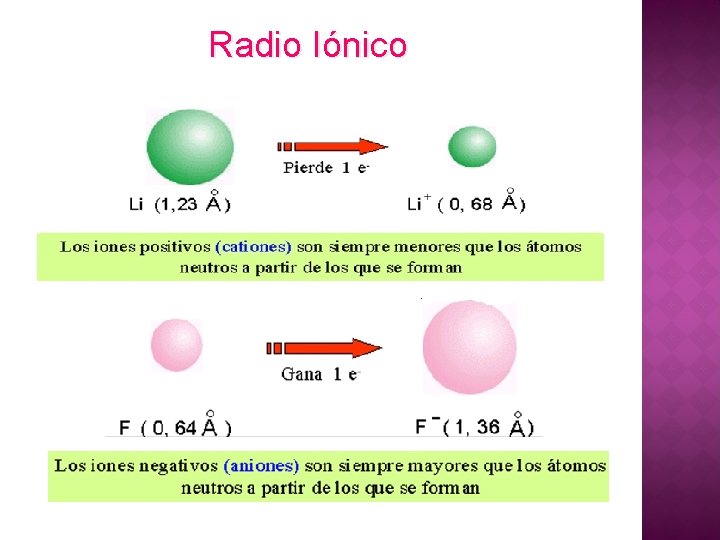
Radio Iónico
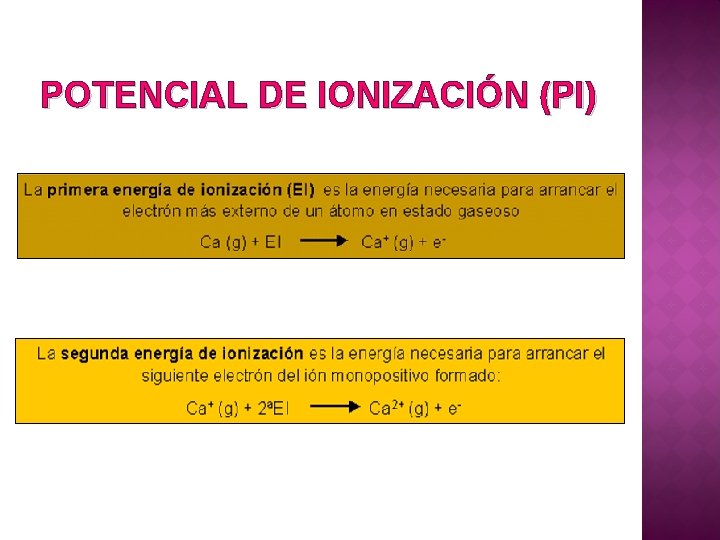
POTENCIAL DE IONIZACIÓN (PI)
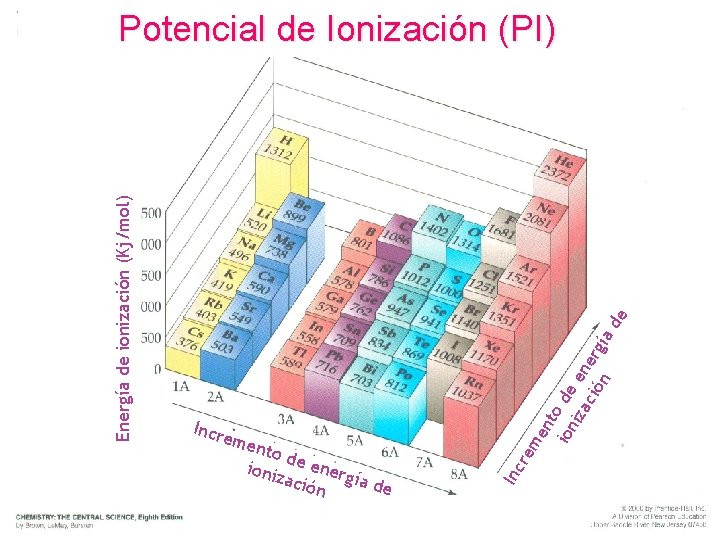
Potencial de Ionización (PI) de nt ion o de iza en ció erg n ía to d ioniz e energ ía d ació e n me eme n re Incr Inc Energía de ionización (Kj/mol) POTENCIAL DE IONIZACIÓN
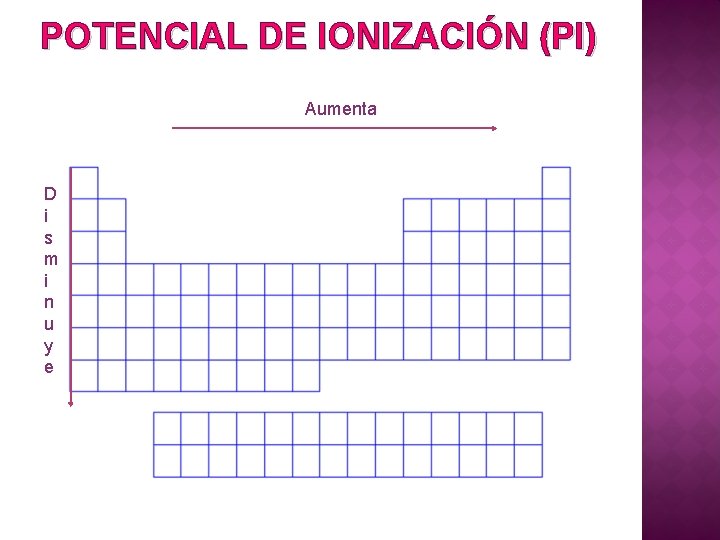
POTENCIAL DE IONIZACIÓN (PI) Aumenta D i s m i n u y e

ELECTROAFINIDAD (EA)
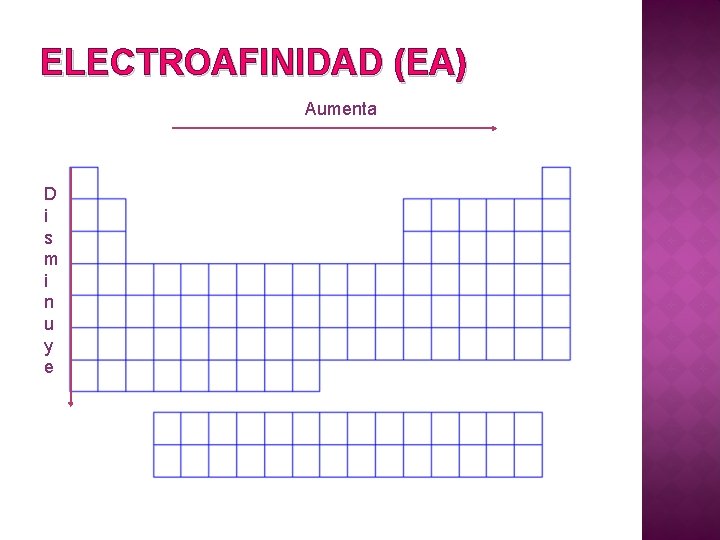
ELECTROAFINIDAD (EA) Aumenta D i s m i n u y e

ELECTRONEGATIVIDAD (EN) Propiedad que combina la energía de ionización y la electroafinidad. Nos informa sobre la tendencia que tienen los átomos de atraer los electrones del enlace. Esta propiedad se cuantifica en valores que van desde 0. 7 a 4. 0, siendo el flúor el elemento que posee un mayor valor de electronegatividad. Esta propiedad se relaciona en parte con la capacidad que poseen los elementos a formar cationes y aniones y al tipo enlace químico que forman entre sí.
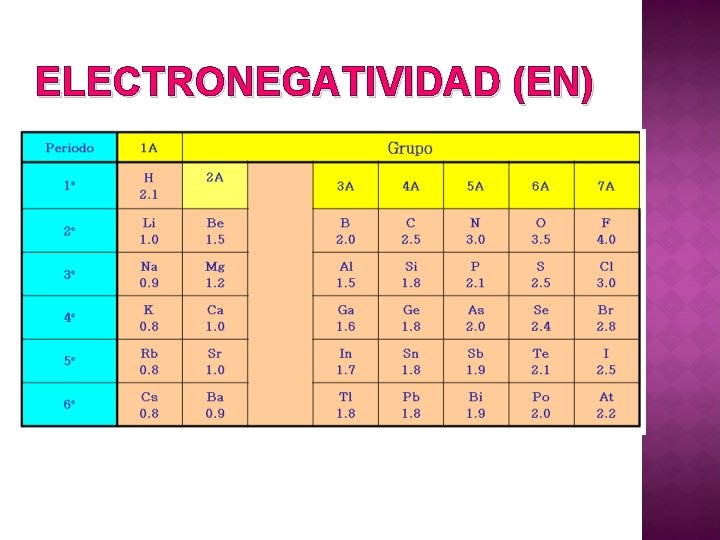
ELECTRONEGATIVIDAD (EN)

Fuerza que mantiene unido a los átomos. Los átomos cuando están reunidos adquieren mayor estabilidad y para que se forme un enlace químico debe existir la participación de electrones de la última capa de energía, estos se denominan electrones de valencia.

Gilbert Lewis ideo una notación para representar los electrones de valencia a través de puntos alrededor de cada átomo
- Slides: 39