Aula 3 xidos so formados por dois elementos















- Slides: 28

Aula 3

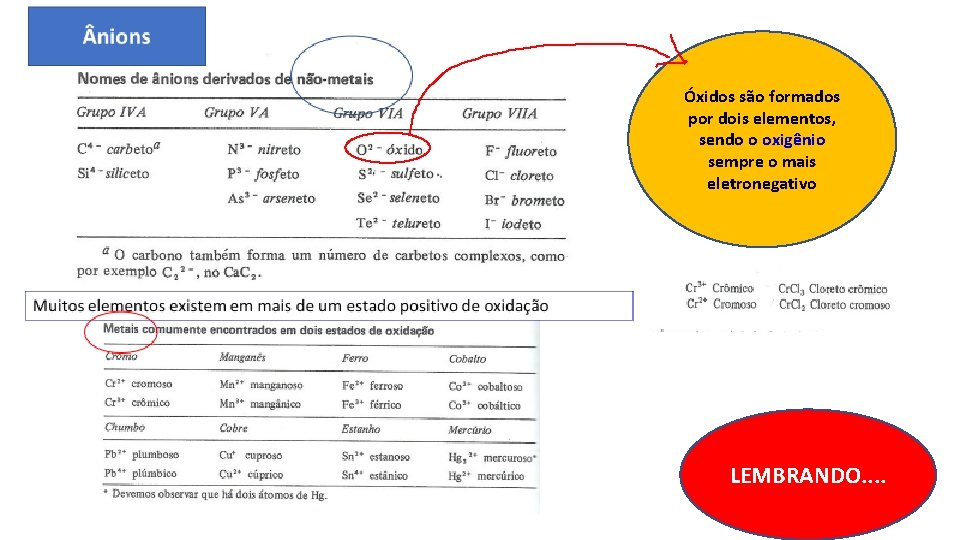
Óxidos são formados por dois elementos, sendo o oxigênio sempre o mais eletronegativo LEMBRANDO. .

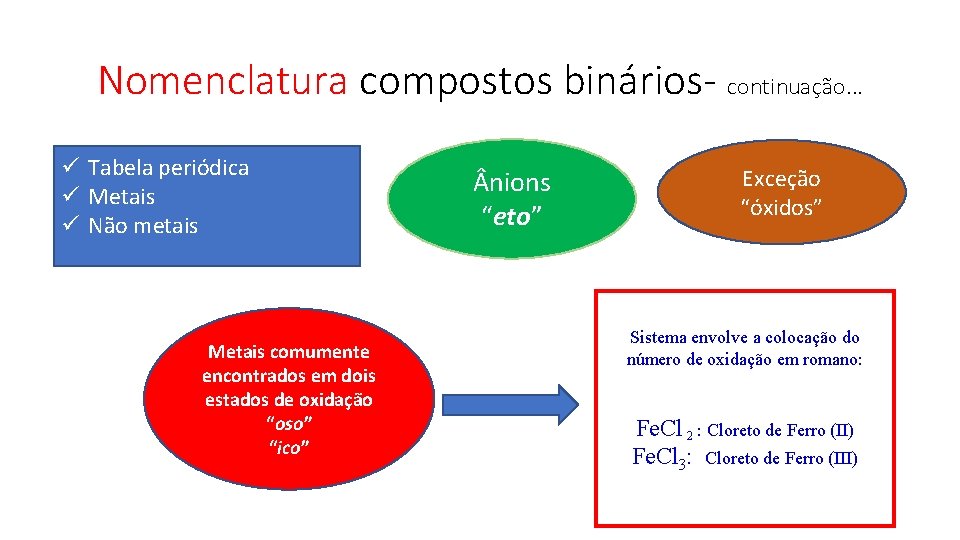
Nomenclatura compostos binários- continuação. . . ü Tabela periódica ü Metais ü Não metais Metais comumente encontrados em dois estados de oxidação “oso” “ico” nions “eto” Exceção “óxidos” Sistema envolve a colocação do número de oxidação em romano: Fe. Cl 2 : Cloreto de Ferro (II) Fe. Cl 3: Cloreto de Ferro (III)

üPara os compostos binários formados por DOIS não metais: o sistema de nomenclatura no qual os números de cada um dos átomos das moléculas são especificados por um prefixo grego: di (2), tri (3), tetra (4), penta (5), hexa (6). . . etc. O prefixo “mono” também é utilizado. PCl 3 NO 2 CO CO 2 ü ü Tricloreto de Fósforo Dióxido de nitrogênio Monóxido de carbono Dióxido de carbono

Ácidos binários: Hidrogênio + Não metal Nomenclatura : Ácido ----ídrico. HCl H 2 S ü Ácido clorídrico ü Ácido sulfídrico Dê a nomenclatura para as seguintes substâncias: Na. Br Ca. O Fe. Cl 3 O 2 F 2 Escreva as fórmulas para as seguintes substâncias: Pentafluoreto de iodo Óxido de Titânio (IV)

Geometria das ligações formas espaciais moleculares As estruturas de Lewis fornecem a conectividade atômica: elas nos mostram o número e os tipos de ligações entre os átomos. A forma espacial de uma molécula é determinada por seus ângulos de ligação. • Considere o CCl 4: no nosso modelo experimental, verificamos que todos os ângulos de ligação Cl-C-Cl são de 109, 5. • Conseqüentemente, a molécula não pode ser plana. • Todos os átomos de Cl estão localizados nos vértices de um tetraedro com o C no seu centro.

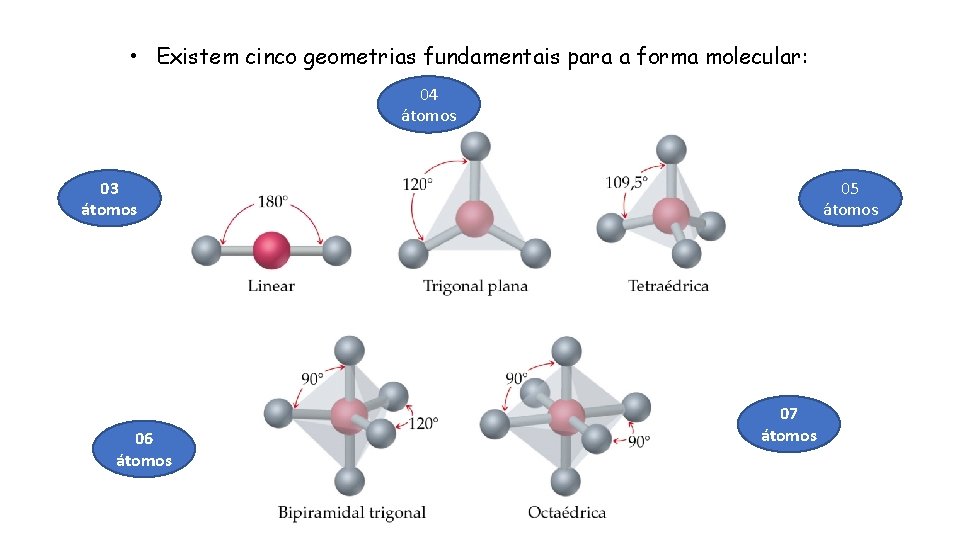
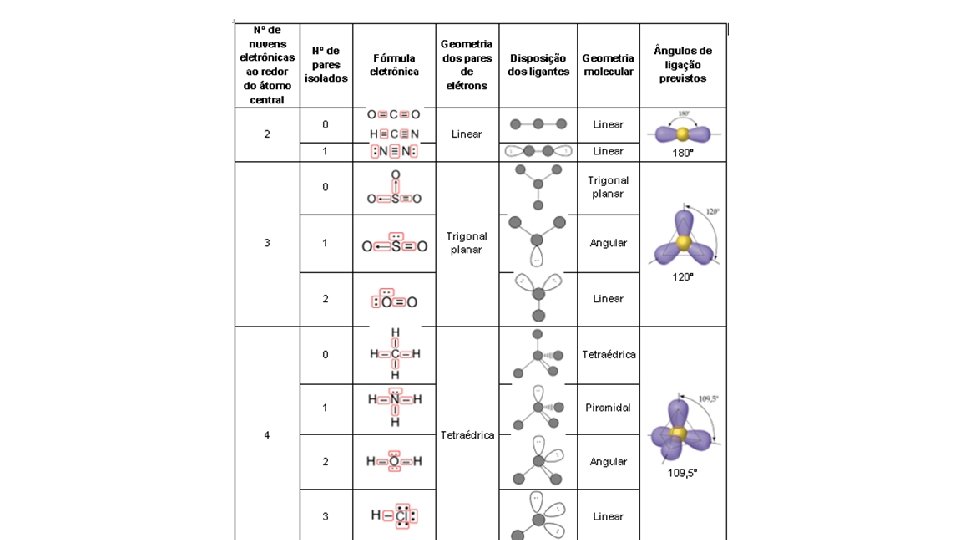
• Existem cinco geometrias fundamentais para a forma molecular: 04 átomos 03 átomos 06 átomos 05 átomos 07 átomos

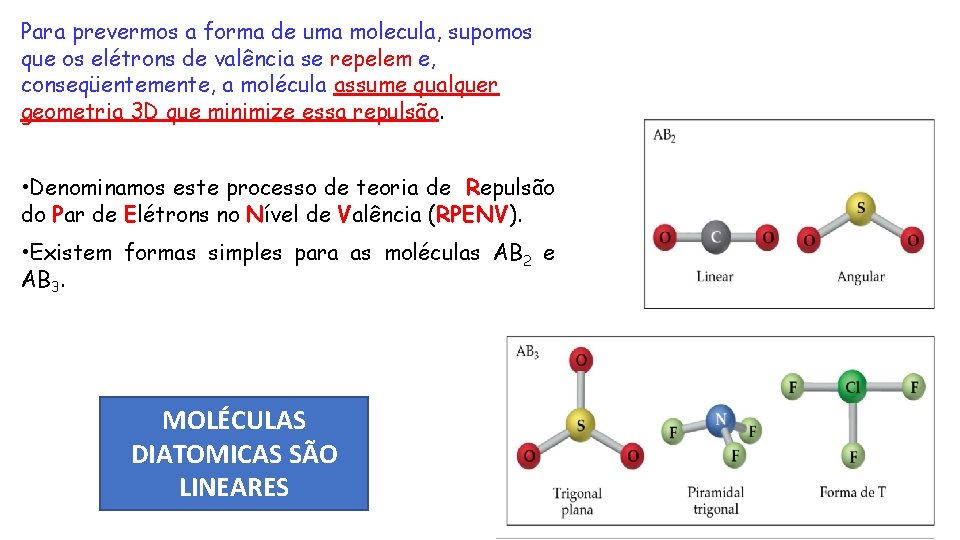
Para prevermos a forma de uma molecula, supomos que os elétrons de valência se repelem e, conseqüentemente, a molécula assume qualquer geometria 3 D que minimize essa repulsão. • Denominamos este processo de teoria de Repulsão do Par de Elétrons no Nível de Valência (RPENV). • Existem formas simples para as moléculas AB 2 e AB 3. MOLÉCULAS DIATOMICAS SÃO LINEARES

De acordo com a Teoria de repulsão dos pares eletrônicos da camada de valência, OS PARES DE ELÉTRONS EM TORNO DE UM ÁTOMO CENTRAL SE REPELEM E SE ORIENTAM PARA O MAIOR AFASTAMENTO ANGULAR POSSIVEL

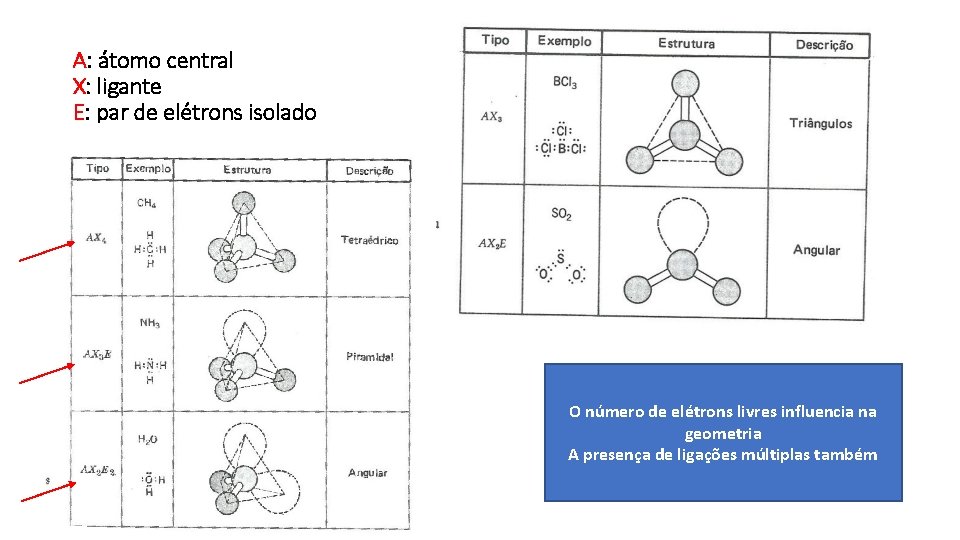
A: átomo central X: ligante E: par de elétrons isolado O número de elétrons livres influencia na geometria A presença de ligações múltiplas também



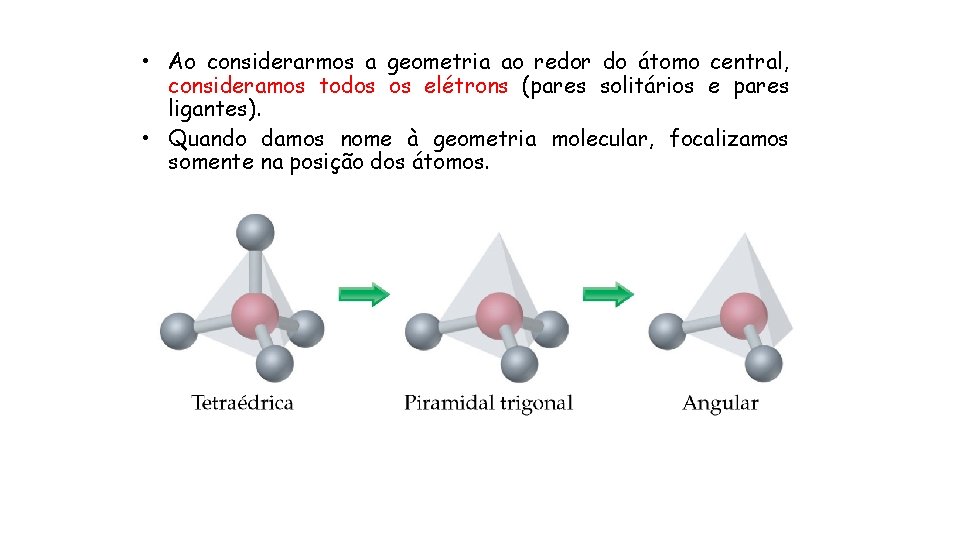
• Ao considerarmos a geometria ao redor do átomo central, consideramos todos os elétrons (pares solitários e pares ligantes). • Quando damos nome à geometria molecular, focalizamos somente na posição dos átomos.

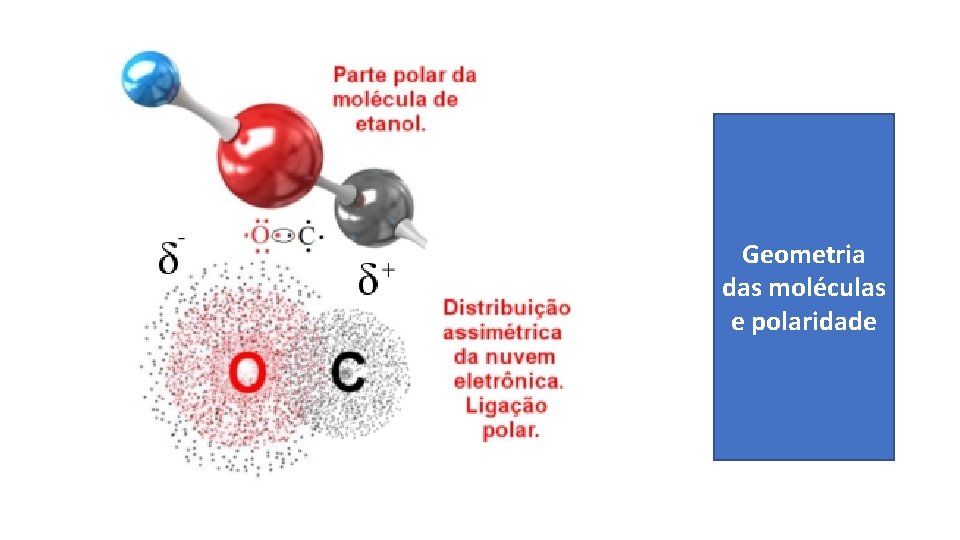
Geometria das moléculas e polaridade

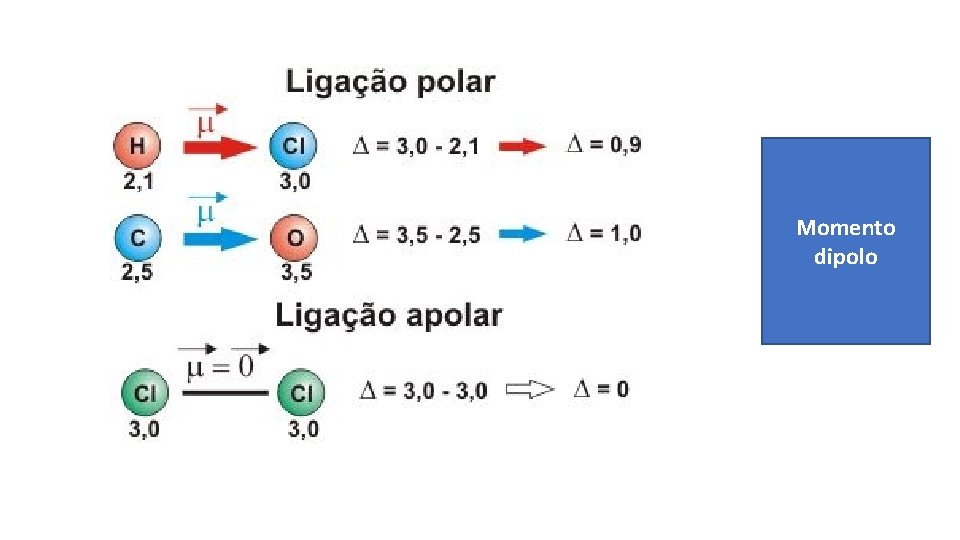
LIGAÇÕES COVALENTES APOLARES: ELÉTRONS COMPARTILHADOS IGUALMENTE ENTRE OS ÁTOMIS MOLECULAS POLARES E APOLARES: ELÉTRONS NÃO SÃO COMARTILHADOS IGUALMENTE (# ELETRONEGATIVIDADE) ELETRONEGATIVIDADE DOS ATOMOS GEOMETRIA VETORES

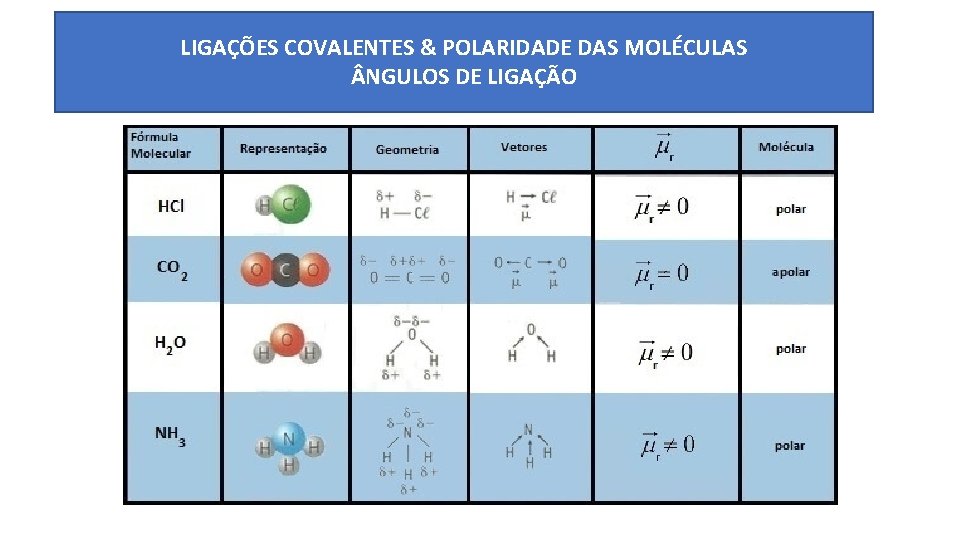
LIGAÇÕES COVALENTES & POLARIDADE DAS MOLÉCULAS NGULOS DE LIGAÇÃO

Momento dipolo

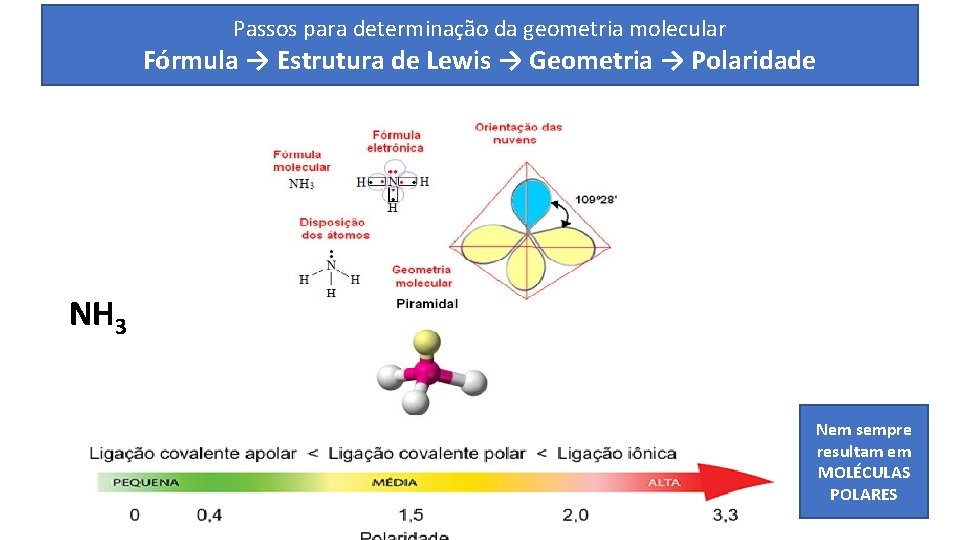
Passos para determinação da geometria molecular Fórmula → Estrutura de Lewis → Geometria → Polaridade NH 3 Nem sempre resultam em MOLÉCULAS POLARES


Praticar CH 3 Cl Estrutura de Lewis Tipo das ligações? Geometria A molécula é polar?


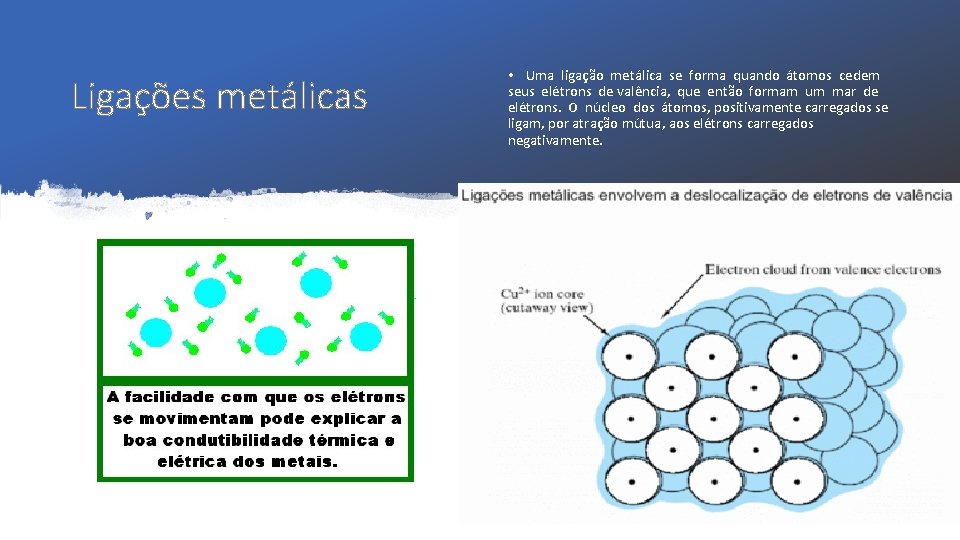
Ligações metálicas • Uma ligação metálica se forma quando átomos cedem seus elétrons de valência, que então formam um mar de elétrons. O núcleo dos átomos, positivamente carregados se ligam, por atração mútua, aos elétrons carregados negativamente.


Aço-> liga de ferro e carbono, no caso do aço inoxidável, adicionam-se ainda crômio e níquel Bronze->liga de cobre e estanho; Ouro 18 quilates ->liga de ouro e cobre;




AVALIAÇÃO MODULO 3 QUINTA FEIRA 22 DE OUTUBRO üRESUMO DO ARTIGO (MÁXIMO DUAS PÁGINAS) = 2, 0 P üLISTA DE EXERCICIOS (EMAIL : ASSUNTO AVALIAÇÃO LISTA) = 2, 0 P üAVALIAÇÃO SINCRONA (PROVA DISPONÍVEL A PARTIR DAS 19 H ENTREGA 22 H )= 6, 0 P
 9 seres vivos
9 seres vivos Germación
Germación Guanina citosina timina adenina
Guanina citosina timina adenina Los hidrocarburos son compuestos ternarios
Los hidrocarburos son compuestos ternarios Terpentanol
Terpentanol Los hidrocarburos son compuestos binarios formados solo por
Los hidrocarburos son compuestos binarios formados solo por 1 etil 2 5 dimetil 4 propilbenceno
1 etil 2 5 dimetil 4 propilbenceno Un enunciado puede ser un texto
Un enunciado puede ser un texto Hialoplasma
Hialoplasma Seres vivos formados por celulas procariotas
Seres vivos formados por celulas procariotas Los cromosomas están formados por
Los cromosomas están formados por Os atomos sao formados por protons neutrons e eletrons
Os atomos sao formados por protons neutrons e eletrons Cuales son los niveles troficos
Cuales son los niveles troficos Se
Se Cantigas de amor trovadorismo
Cantigas de amor trovadorismo Anion carbonato
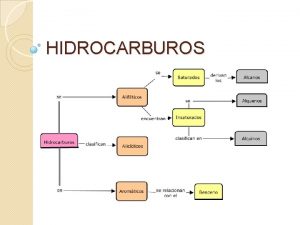
Anion carbonato Xidos
Xidos Ato eto ito
Ato eto ito Xidos
Xidos Xidos
Xidos Tabela de nomenclatura dos ácidos
Tabela de nomenclatura dos ácidos A cal viva é um material muito usado
A cal viva é um material muito usado X id os
X id os Fosfoacilglicerol
Fosfoacilglicerol Formados para servir a dios
Formados para servir a dios Atividades sobre paisagem natural e modificada
Atividades sobre paisagem natural e modificada Las personas valen por lo que son y no por lo que tienen
Las personas valen por lo que son y no por lo que tienen Conjuntos potencia
Conjuntos potencia Gracias dios por morir por mi
Gracias dios por morir por mi