Aula Metais alcalinos terrosos introduo Apresentam as mesmas











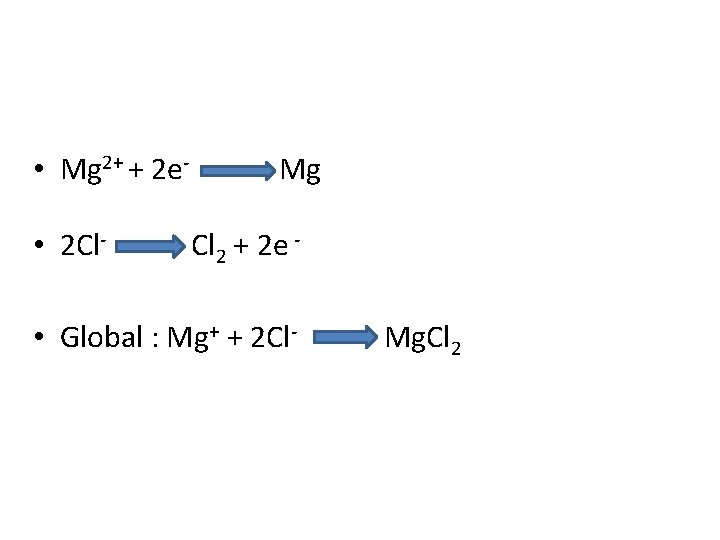








- Slides: 25

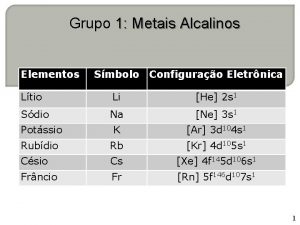
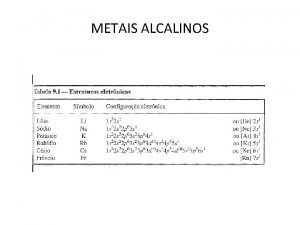
Aula Metais alcalinos terrosos

introdução • Apresentam as mesmas tendências em relação ao grupo I. • Berílio é exceção nesse grupo. Difere muito mais do que o lítio em seu grupo. A justificativa é que o átomo de berílio e o íon Be 2+ são muito pequenos em relação ao magnésio. • Cerca de quatro vezes maior do que do lítio em relação ao sódio ( relativo ). • Altamente reativos, mas menos reativos em relação aos metais alcalinos. • São bivalentes e formam compostos iônicos incolores. • Óxidos e hidróxidos são menos básicos que os correspondentes dos metais alcalinos. • Magnésio é um importante elemento desse grupo. Usado em grandes quantidades.

Compostos utilizados em grande quantidade Calcário ( Ca. CO 3 ), utilizado na preparação de cal, cimento e giz. Ca. SO 4, gesso Fluorita ( Ca. F 2 ) , utilizado na siderurgia, vidros, cerâmica, instrumentos ópticos. Magnesita ( Mg. CO 3 ), utilizado em tintas de impressão, vidros, indústria farmacêutica. Barita ( Ba. SO 4 ), 90% é utilizada em lamas de perfuração na industria petrolífera, tintas e papel

Ocorrência • Berílio: encontrado em minerais do grupo dos silicatos. Berilo ( Be 3 Al 2 Si 6 O 18 ) e fenacita (Be 2 Si. O 4). • Magnésio : sais de magnésio dissolvidos na água do mar, 0, 13%. Dolomita(Mg. CO 3. Ca. CO 3). • Magnesita (Mg. CO 3 ), talco (Mg 3(OH)2 Si 4 O 10). • Cálcio : calcário(mármore ) (Ca. CO 3), gesso(Ca. SO 4). • Estrôncio : celestista (Sr. SO 4 ), estroncianita (Sr. CO 3). • Bário : barita ( Ba. SO 4 )

obtenção • Não são obtidos facilmente por redução química. ( são fortes agentes redutores e em reação com carbono formam carbetos. Reagem com água, assim não pode ser usada • Eletrólise em meio aquoso forma a amalgama que é difícil separar o metal. • Podem ser obtidos por eletrólise ígnea (Na. Cl é usado para baixar o ponto de fusão do metal )

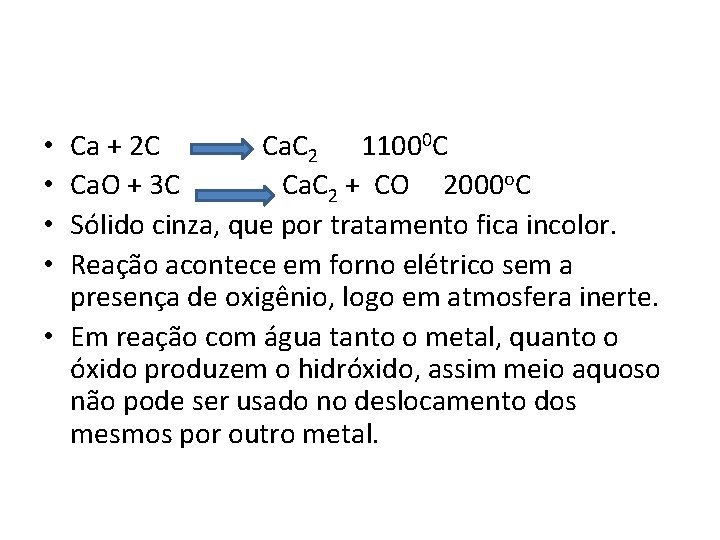
Ca + 2 C Ca. C 2 11000 C Ca. O + 3 C Ca. C 2 + CO 2000 o. C Sólido cinza, que por tratamento fica incolor. Reação acontece em forno elétrico sem a presença de oxigênio, logo em atmosfera inerte. • Em reação com água tanto o metal, quanto o óxido produzem o hidróxido, assim meio aquoso não pode ser usado no deslocamento dos mesmos por outro metal. • •


Obtenção do magnésio • Único elemento do grupo produzido na forma metálica em grande escala. • Metal leve, de baixa densidade (importância). • 1, 74 g/cm 3, o aço: 7, 8 g/cm 3, Al: 2, 7 g/cm 3. • Forma muitas ligas (estrutura e peças de aviões e motores de automóveis )

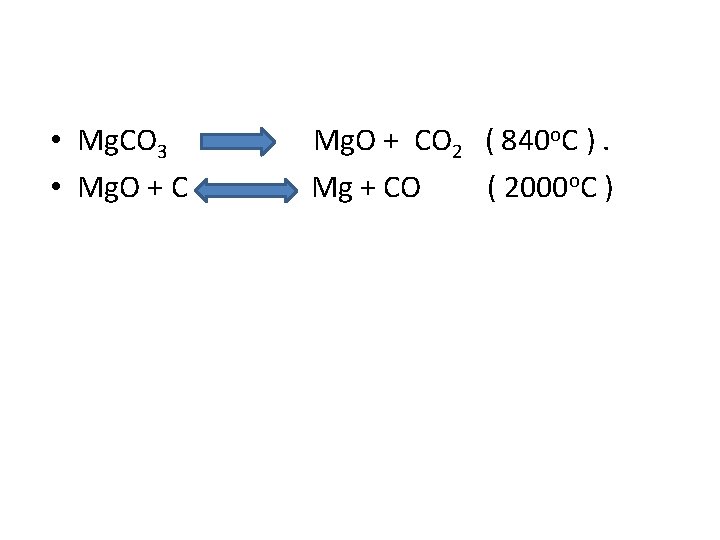
• O processo antigo utilizava Mg. O obtido pela decomposição térmica ( 840 o. C ) da magnesita (Mg. CO 3) A redução na faixa de 2000 o. C em forno rotativo. • O óxido de magnésio é reduzido pelo coque obtendose magnésio e CO no estado gasoso. • A mistura é resfriada rápidamente , de modo a se obter o metal no estado sólido e também evitar o deslocamento em sentido contrário à reação. Durante o processo toma-se o cuidado com ar e umidade devido a possibilidade de reações paralelas. Um dos meios de se evitar as reações paralelas é o uso de um gás inerte.

• Mg. CO 3 • Mg. O + CO 2 ( 840 o. C ). Mg + CO ( 2000 o. C )

Processo Pidgeon • Obtido pela redução de dolomita calcinada com liga de ferro/silício (ferrossilício) a 1150 o. C. • a pressão reduzida ( importante, pois consegue-se trabalhar a temperatura mais baixa, o que é conveniente ) • Temperatura de calcinação, entre 1400/1800 o. C

• Ou , • ( Ca, Mg )CO 3 Ca. O. Mg. O(s) + CO 2 , dolomita calcinada. (1400 -18000 C ) • ( Fe, Si )(s) +2 Mg. O(s) Fe(s) + Si. O 2 + 2 Mg(g) • 2 Ca. O + Si. O 2 Ca 2 Si. O 4 • O magnésio é recolhido por destilação à vácuo.

eletrólise • Obtido atualmente por eletrólise do cloreto de • magnésio com adição de cloreto de sódio com intuito de baixar o ponto de fusão da célula eletrolítica ( vantagens descritas na aula de metais alcalinos ). • Temperatura de processo 710 o. C • O Mg fundido que se forma no cátodo sobe para a superfície do eletrólito fundido. • O Cl se forma no ânodo e então coletado
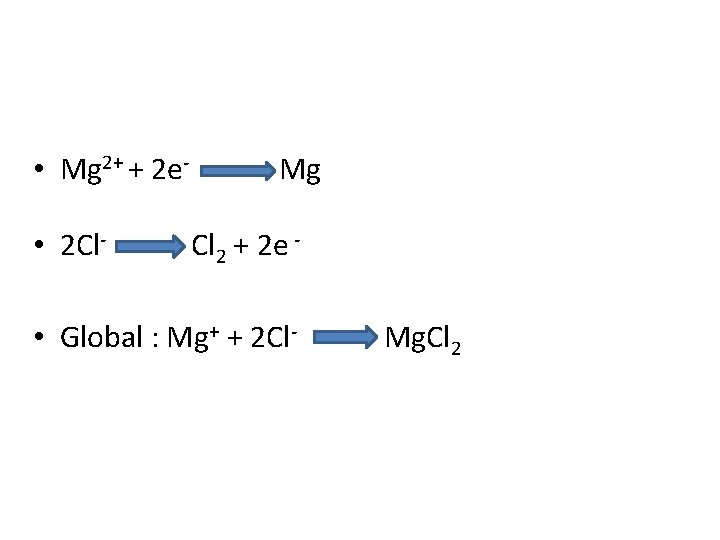
• Mg 2+ + 2 e • 2 Cl- Mg Cl 2 + 2 e - • Global : Mg+ + 2 Cl- Mg. Cl 2

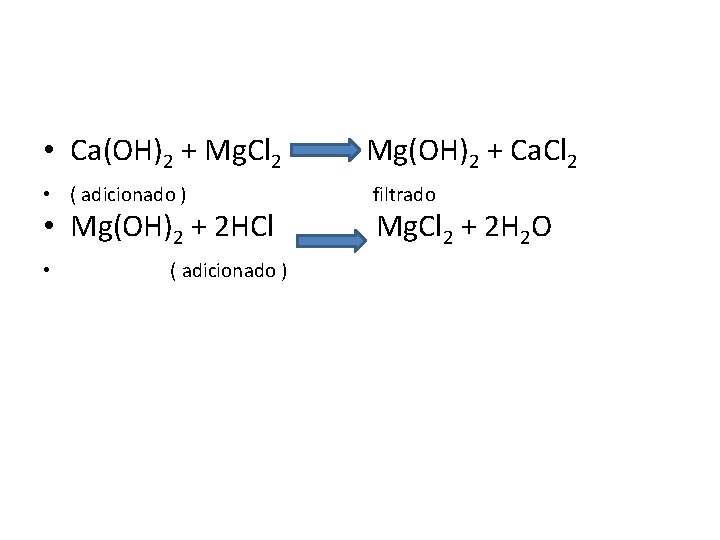
Produção do cloreto de magnésio para a eletrólise 1)Processo Dow de extração da água do mar Água do mar contém 0, 13% de íon Mg 2+ O Mg(OH)2 é menos solúvel que Ca(OH)2 Quando cal hidratada Ca(OH)2 é adicionada a água do mar (contém cloreto de magnésio em baixa concentração), os íons Ca 2+ vão para a fase aquosa na forma de cloreto de cálcio • Mg(OH)2 é precipitado. É filtrado, tratado com HCl formando o cloreto de magnésio • •

• Ca(OH)2 + Mg. Cl 2 • ( adicionado ) • Mg(OH)2 + 2 HCl • ( adicionado ) Mg(OH)2 + Ca. Cl 2 filtrado Mg. Cl 2 + 2 H 2 O

• 2) Processo Dow de extração da salmoura natural (alemanha e no Brasil, na Bahia) • dolomita calcinada ( Mg. O. Ca. O ) tratada com HCl forma o Ca. Cl 2 e Mg. Cl 2. • Trata-se o meio reacional com CO 2 de forma a tratar a dolomita calcinada remanescente obtendo carbonato de cálcio que vai precipitar ( íon Ca+ precipita na forma de Ca. CO 3 ). • Ca. Cl 2. Mg. Cl 2 + Ca. O. Mg. O + 2 CO 2 Mg. Cl 2 + 2 Ca. CO 3

• O Mg. Cl 2 também é obtido à partir da magnesita. • Por decomposição obtem-se o óxido de magnésio. • Fazendo a redução com CO e tratando com cloro chega-se ao cloreto de magnésio • Mg. O + Cl 2 Mg. Cl 2 + CO 2 • Obtenção por este método foi descartado. A redução já forma o Mg metálico, com posterior reação com cloro, o que torna uma reação de risco e necessidade de grande controle operacional.

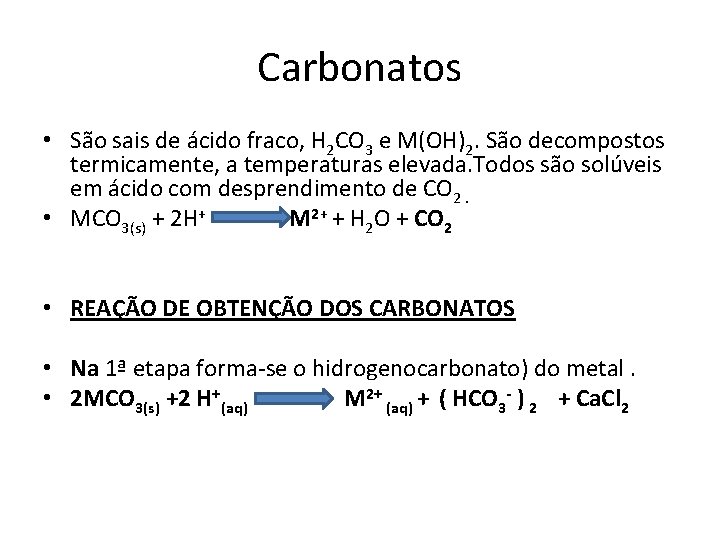
Carbonatos • São sais de ácido fraco, H 2 CO 3 e M(OH)2. São decompostos termicamente, a temperaturas elevada. Todos são solúveis em ácido com desprendimento de CO 2. • MCO 3(s) + 2 H+ M 2+ + H 2 O + CO 2 • REAÇÃO DE OBTENÇÃO DOS CARBONATOS • Na 1ª etapa forma-se o hidrogenocarbonato) do metal. • 2 MCO 3(s) +2 H+(aq) M 2+ (aq) + ( HCO 3 - ) 2 + Ca. Cl 2

• Os carbonatos insolúveis na natureza (granito) se dissolvem em uma solução fracamente ácida. Combinação de água com CO 2 • 2º ETAPA DA REAÇÃO • Quando a solução de um hidrogenocarbonato de um metal alcalino-terroso é aquecida, a solubilidade do CO 2 em água diminui, e os carbonatos insolúveis são precipitados. • M(HCO 3)2(aq) MCO 3(s) + CO 2 + H 2 O

• Nas cavernas observamos as estalactites crescendo no teto e as estalagmites crescendo no solo. ( reação acima )

Dureza da água • Água dura contém carbonatos, bicarbonatos, sulfatos de cálcio e magnésio. • Água dura dificulta a formação de espuma ao se utilizar sabão. • A água dura é formada pela dureza temporária e a dureza permanente. • A dureza temporária é formada pelo hidroge • nocarbonato de cálcio e do hidrogenocarbonato de magnésio que são solúveis e que por aquecimento da água perdem CO 2 e formam carbonatos insolúveis.

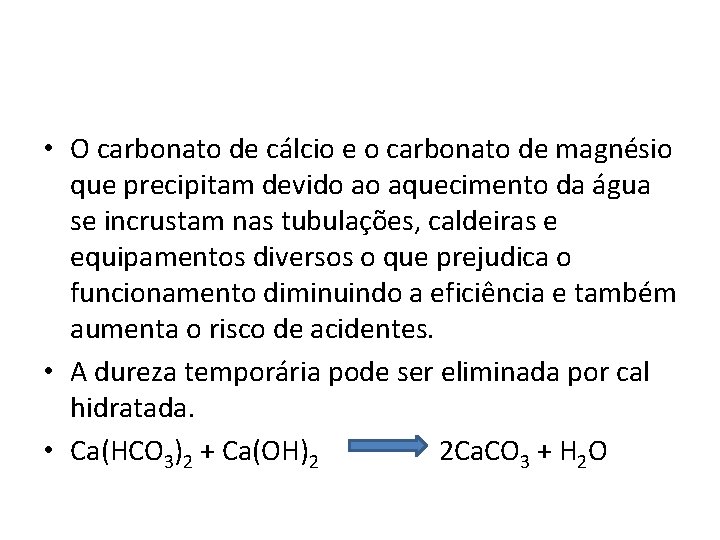
• O carbonato de cálcio e o carbonato de magnésio que precipitam devido ao aquecimento da água se incrustam nas tubulações, caldeiras e equipamentos diversos o que prejudica o funcionamento diminuindo a eficiência e também aumenta o risco de acidentes. • A dureza temporária pode ser eliminada por cal hidratada. • Ca(HCO 3)2 + Ca(OH)2 2 Ca. CO 3 + H 2 O

A dureza permanente é formada pelo Mg. SO 4 e o Ca. SO 4 A dureza permanente não é eliminada pela fervura da água. Antigamente a dureza permanente era eliminada pelo processo calcário – soda Ca. SO 4 + Na 2 CO 3 Ca. CO 3 + Na 2 SO 4 A destilação retira a dureza temporária. O carbonato fica retido no interior do destilador

• Atualmente a dureza total é eliminada na indústria, pelos abrandadores de dureza. • São equipamentos que possuem resinas catiônicas e aniônicas que trocam os íons cálcio e magnésio pelo íon sódio, deste modo diminuindo a incrustação em tubulações e caldeiras principalmente
 Metais alcalinos terrosos
Metais alcalinos terrosos Metais alcalinos e alcalinos terrosos
Metais alcalinos e alcalinos terrosos Tabela periodica metais alcalinos e alcalinos terrosos
Tabela periodica metais alcalinos e alcalinos terrosos Metais alcalinos
Metais alcalinos Elementos representativos de la tabla periódica
Elementos representativos de la tabla periódica Ligação metálica
Ligação metálica Metais
Metais Thierry metais
Thierry metais Idade dos metais
Idade dos metais Eletrons de valencia
Eletrons de valencia Intoxicação por metais pesados
Intoxicação por metais pesados Energia de fermi
Energia de fermi Raizes aprumada
Raizes aprumada Uel a força e a exuberância das cores douradas
Uel a força e a exuberância das cores douradas Segundo john rawls a noção de justiça comporta
Segundo john rawls a noção de justiça comporta Cmb aula virtual
Cmb aula virtual Plano de aula socioemocional
Plano de aula socioemocional Nico es responsable de la biblioteca de su aula
Nico es responsable de la biblioteca de su aula Aula de alongamento
Aula de alongamento Multiplicaciones abreviadas por 10 100 y 1000
Multiplicaciones abreviadas por 10 100 y 1000 Campus uhu
Campus uhu Aula docencia chuo
Aula docencia chuo Stata aula
Stata aula Tipos de clima emocional
Tipos de clima emocional Ejemplo de observación participante en el aula
Ejemplo de observación participante en el aula Uveg correo
Uveg correo