Predmet Moderne metode i tehnike karakterizacije neorganskih jedinjenja













![UV/VIS spektri metala d 2 elektronske konfiguracije Eksperimentalno dobijeni spektar jona [V(H 2 O)6]3+ UV/VIS spektri metala d 2 elektronske konfiguracije Eksperimentalno dobijeni spektar jona [V(H 2 O)6]3+](https://slidetodoc.com/presentation_image_h2/542719f6f347bb07994d72c3a809b29c/image-20.jpg)



![Slika 21. UV/VIS spektri akva kompleksa metala 3 d- serije [M(H 2 O)6]n+ Slika 21. UV/VIS spektri akva kompleksa metala 3 d- serije [M(H 2 O)6]n+](https://slidetodoc.com/presentation_image_h2/542719f6f347bb07994d72c3a809b29c/image-32.jpg)
![Zadaci za vežbanje 1. Maksimum apsorpcije vidljivog svetla jonom [Cu(NH 3)4]2+ odgovara talasnoj dužini Zadaci za vežbanje 1. Maksimum apsorpcije vidljivog svetla jonom [Cu(NH 3)4]2+ odgovara talasnoj dužini](https://slidetodoc.com/presentation_image_h2/542719f6f347bb07994d72c3a809b29c/image-34.jpg)


- Slides: 43

Predmet: Moderne metode i tehnike karakterizacije neorganskih jedinjenja Studijski program: Master akademske studije, Hemija 2014 Status predmeta: Obavezni Školska: 2016/2017 god. -teorijske vežbe[1] Predmetni Profesori: Prof. dr Dragan Đorđević Doc. dr Nenad S. Krstić Predmetni Asistent: Doc. dr Nenad S Krstić

Stereo-mikrokopija Ø Stereo mikroskop (Sl. 1) se od običnog, optičkog mikroskopa razlikuje po postojanju dva različita optička puta, (uz dva objektiva i dva okulara), koji stvaraju različite uglove posmatranja (razlika od 3 -10º) čime se stvara trodimenzionalna slika uzorka koji se posmatra. Ø Koristi se za posmatranje površina čvrstih uzoraka ili za fine poslove za koje je potrebna određena preciznost, kao i za ispitivanje neprovidnih uzoraka korišćenjem reflektovane svetlosti. Slika 1. Stereomikroskop

Ø Za razliku od klasičnih mikroskopa, kod stereo-mikroskopa češće se koristi reflektovano osvetljenje od transmitovanog, što omogućava posmatranje neprovidnih uzoraka. Karakteristike koje izdvajaju ovaj tip mikroskopa su velika radna razdaljina i dubina polja, koji stoje u inverznom odnosu sa rezolucijom. Ø Uvećanje ovog tipa mikroskopa je do 100×, pri čemu postoje dva sistema uvećanja. Jedan sistem je fiksirano uvećanje gde se primarno uvećanje postiže pomoću uparenih sočiva objektiva sa podešenim Slika 2. Stereomikroskopski snimak uzorka AK-120 ØDrugi sistem predstavlja zoom uvećanje koje se može menjati.

UV/VIS spektroskopija Ø UV/VIS spektroskopija se može koristiti za kvantitativno određivanje prelaznih metala i visoko konjugovanih organskih sistema. Rastvori jona prelaznih metala mogu biti obojeni zato što d-elektroni ovih metala mogu biti lako pobuđeni pri čemu prelaze iz jednog stanja u drugo. Ø Boja rastvora jona metala je se pod snažnim uticajem prisustva drugih vrsta koje se nalaze u tom rastvoru, kao što su neki anjoni ili ligandi. ØNa primer, boja razblaženog rastvora bakar(II)-sulfata je svetlo-plava, dodajući amonijak pojačava se boja rastvora i i dolazi do promene talasne dužine maksimalne apsorpcije (λmax).

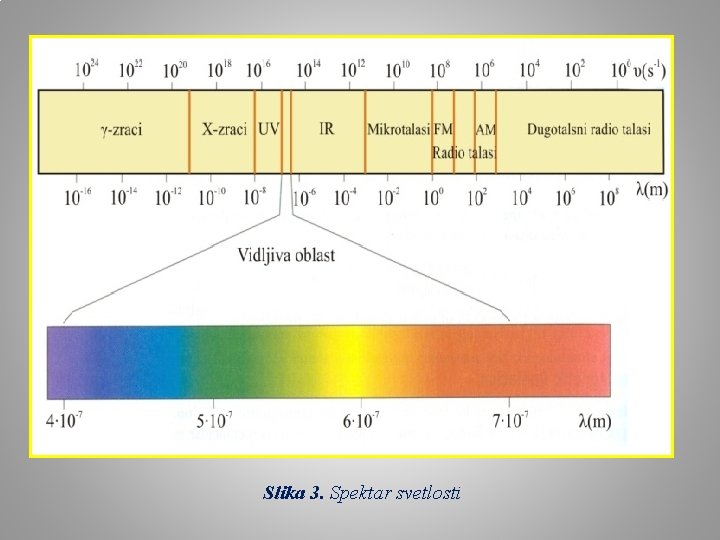
Slika 3. Spektar svetlosti

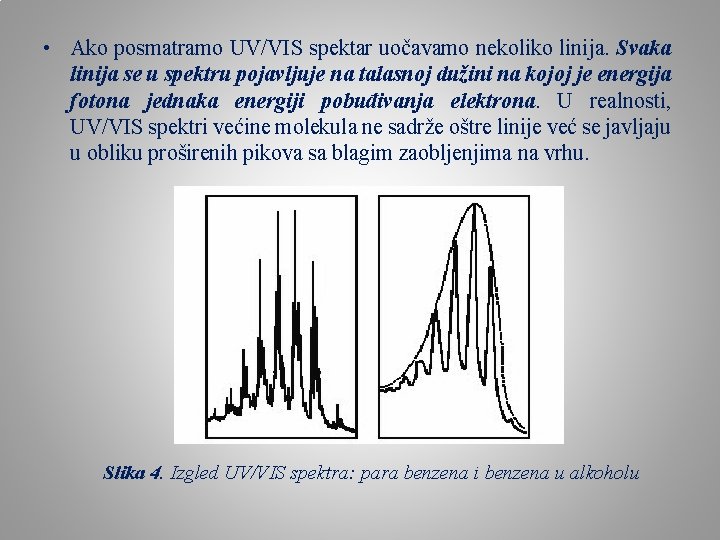
• Ako posmatramo UV/VIS spektar uočavamo nekoliko linija. Svaka linija se u spektru pojavljuje na talasnoj dužini na kojoj je energija fotona jednaka energiji pobuđivanja elektrona. U realnosti, UV/VIS spektri većine molekula ne sadrže oštre linije već se javljaju u obliku proširenih pikova sa blagim zaobljenjima na vrhu. Slika 4. Izgled UV/VIS spektra: para benzena i benzena u alkoholu

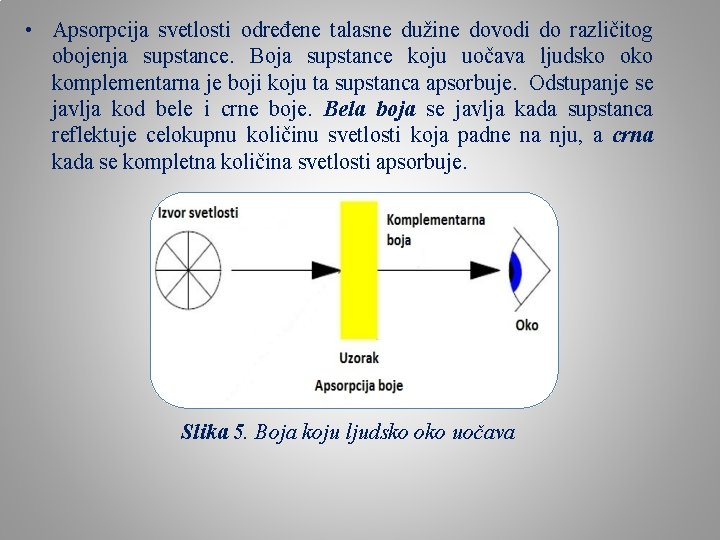
• Apsorpcija svetlosti određene talasne dužine dovodi do različitog obojenja supstance. Boja supstance koju uočava ljudsko oko komplementarna je boji koju ta supstanca apsorbuje. Odstupanje se javlja kod bele i crne boje. Bela boja se javlja kada supstanca reflektuje celokupnu količinu svetlosti koja padne na nju, a crna kada se kompletna količina svetlosti apsorbuje. Slika 5. Boja koju ljudsko oko uočava

Slika 6. Komplementarne boje

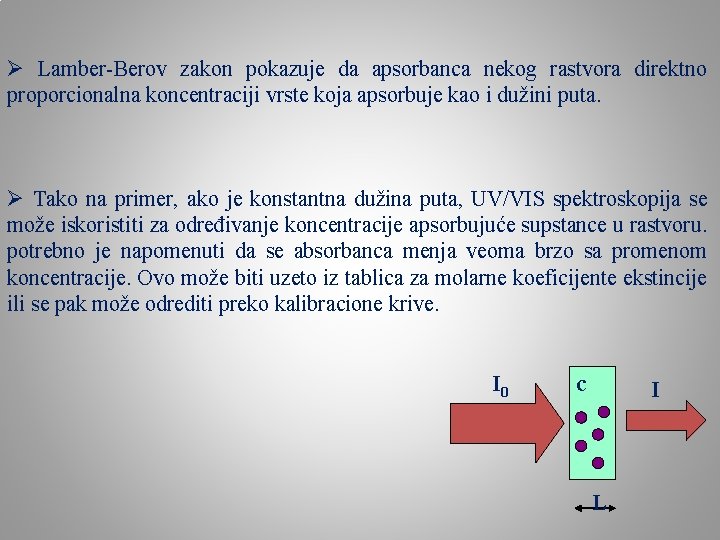
Ø Lamber-Berov zakon pokazuje da apsorbanca nekog rastvora direktno proporcionalna koncentraciji vrste koja apsorbuje kao i dužini puta. Ø Tako na primer, ako je konstantna dužina puta, UV/VIS spektroskopija se može iskoristiti za određivanje koncentracije apsorbujuće supstance u rastvoru. potrebno je napomenuti da se absorbanca menja veoma brzo sa promenom koncentracije. Ovo može biti uzeto iz tablica za molarne koeficijente ekstincije ili se pak može odrediti preko kalibracione krive. I 0 c I L

Ø Metoda koja se najčešće koristi za kvantitativno određivanje koncentracije apsorbujuće supstance u rastvoru, u osnovi sadrži Lamber-Berov zakon: A = log (I/I 0) = ε·c·L Øgde je: • A – merena apsorbanca, • I 0 – intenzitet upadnog zraka, • I – intenzitet propuštenog (transmitovanog) zraka, • L – dužina puta (debljina kivete u kojo se snima uzorak), • c – koncentracija supstance koja apsorbuje, • ε – konstanta (molarna absorptivnost, koeficijent molarne ekstinencije). • Molarna apsorptivnost predstavlja osnovnu osobinu molekulske vrste u datom rastvaraču, na određenom pritisku i temperaturi, i njena jedinica je 1/M·cm ili AU/M·cm.

UV/VIS spektrofotometar Ø Instrument koji se koristi u UV/VIS spektroskopiji zove se UV/VIS spektrofotometar. Pomoću njega se meri intenzitet svetlosti koji prolazi kroz uzorak (I), i upoređuje ga sa intenzitetom svetlosti pre nego sto ona prođe kroz uzorak (I 0). Odnos I/I 0 se naziva transmitancom, i obično se izražava u procentima (%T). Absorbanca A je povezana sa transmitancom T preko sledećeg izraza: A = - log(%T/100%). Ø UV/VIS spektrofotometar može biti podešen i da meri reflektancu (R). U tom slučaju, uređaj meri intenzitet svetlosti koja se reflektuje od uzorka (I), i upoređuje je sa intenzitetom svetlosti reflektovane od referentnog materijala (I 0). Odnos I/I 0 se naziva reflectanca, i izražava se u procentima (%R).

Ø Osnovni delovi sprektrofotometra su: 1) izvor svetlosti, 2) “držač” uzorka - kiveta, 3) difrakciona rešetka u monohromatoru ili prizmi, razdvaja svetlost različitih talasnih dužina, 4) detektor. Ø Izvor zračenja je obično volframova lampa (300 -2500 nm), deuterijumska lampa, koja prekriva i ultraljubičastu oblast (190 -400 nm), ksenonska lampa (160 -2000 nm), svetleće diode (LED-diode) za vidljivu oblast.

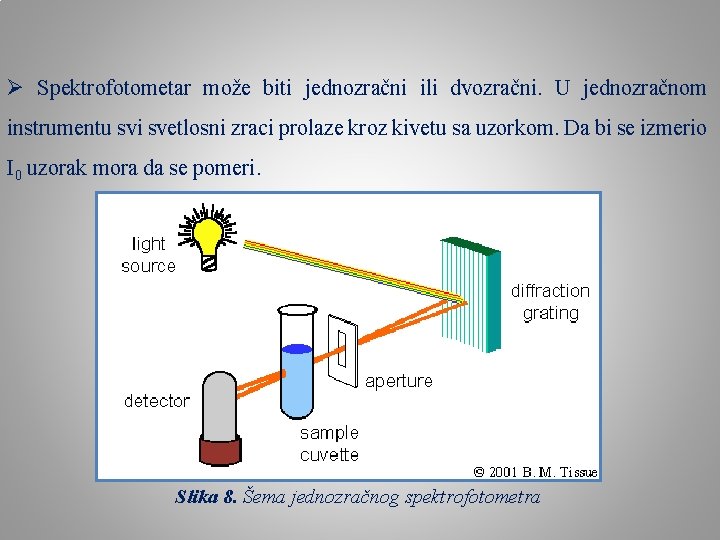
Ø Spektrofotometar može biti jednozračni ili dvozračni. U jednozračnom instrumentu svi svetlosni zraci prolaze kroz kivetu sa uzorkom. Da bi se izmerio I 0 uzorak mora da se pomeri. Slika 8. Šema jednozračnog spektrofotometra

ØNeki dvozračni instrumenti imaju dva detektora (fotodiode), i istovremeno se mere (snimaju) i snop (zrak) uzorka i referentnog rastvora. U drugim instrumentima, dva zraka (snopa) prolaze kroz zračni razdvajač „beam chopper“ koji blikira jedan zrak trenutno. Detektor naizmenično meri zrak koji prolazi kroz uzorak i referentni zrak sinhronizovano sa radom „beam chopper“a. ØU dvozračnom spektrofotometru svetlost se deli na dva snopa pre nego što stigne do uzorka. Jedan snop svetlosti se koristi kao referentni, dok drugi snop prolazi kroz uzorak. Za intenzitet referentnog snopa se uzima da je 100% Transmisija (ili 0 Apsorbanca), i merenjem se pokazuje odnos intenziteta dva svetlosna snopa.

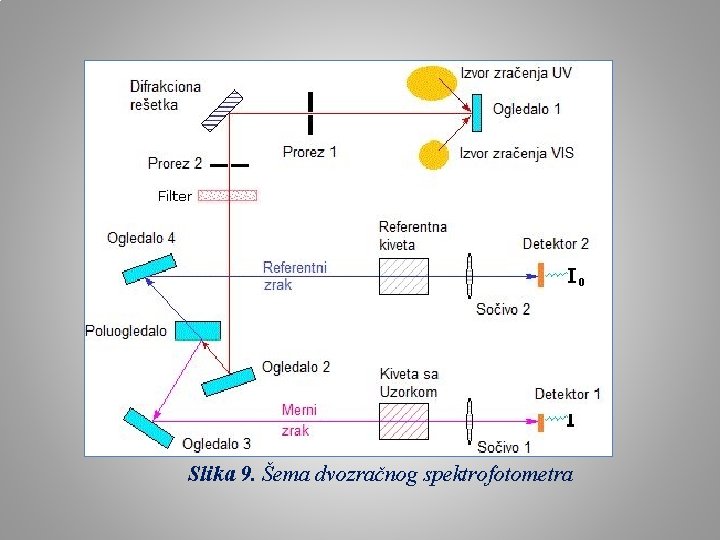
Slika 9. Šema dvozračnog spektrofotometra

ØUzorci za UV/VIS spektrofotometriju su uglavnom tečni, mada se može meriti absorbaca gasova i čvrstih uzoraka. Uzorci se stavljaju u transparentnu cev, kivetu. Kivete su obično pravougaonog oblika, najčešće unutrašnje širine 1 cm. (dužina puta L, Lambert-Beer-ov zakon). Epruvete se takođe mogu koristiti umesto kiveta u nekim instrumentima. Najčešće se primenjuju kivete izrađene od visoko kvalitetnih jedinjenja silicijuma ili kvarca, materijala koji su dobro transparentni za UV, VIS i blisku infrared oblast. Slika 10. Kivete za UV/VIS spektrofotometar

UV/VIS spektri prelaznih metala Kada kompleksnih jon apsorbuje svetlost može da dođe do prelaska elektrona sa nižeg energetskog podnivoa na viši. Ovaj prelaz određuje boju kompleksnog jedinjenja jer je energija apsorbovanog kvanta svetlosti (E) jednka energiji cepanja (Δ). Za jedan mol supstance koja apsorbuje svetlost važi odnos: gde je: E – energija cepanja, h – Plankova konstanta (h = 6, 6· 10 -34 Js), – frekvencija, c – brzina svetlosti (c = 3· 108 ms-1), λ – talasna dužina [m].


UV/VIS spektri prelaznih metala UV/VIS spektri metala d 1 elektronske konfiguracije Rastvor ovog kompleksnog jona apsorbuje svetlost u oblasti talasnih dužina od 450 -600 nm, a propušta sve fotone koji odgovaraju ljubičastoj (380 -450 nm) i crvenoj boji (600 -700 nm). Apsorpcioni maksimum odgovara veličini rascepa Δo=20 400 cm-1. Jon Ti 3+ ima jedan d elektron u t 2 g nivou koji apsorpcijom svetlosti prelazi na energetski viši eg nivo i ukida degeneraciju podnivoa (dz 2 i dx 2 -y 2) u ovom nivou (Jan-Telerov efekat u pobuđenom stanju jona d 1) i zato je ova apsorpciona traka nesimetrična i ima blago sedlo na 550 nm (slika 4). Slika 11. Dijagram energetskih nivoa za d 1 konfiguraciju u Oh ligandnom polju i UV/VIS apsorpcioni spektri [Ti(H O) ]3+
![UVVIS spektri metala d 2 elektronske konfiguracije Eksperimentalno dobijeni spektar jona VH 2 O63 UV/VIS spektri metala d 2 elektronske konfiguracije Eksperimentalno dobijeni spektar jona [V(H 2 O)6]3+](https://slidetodoc.com/presentation_image_h2/542719f6f347bb07994d72c3a809b29c/image-20.jpg)
UV/VIS spektri metala d 2 elektronske konfiguracije Eksperimentalno dobijeni spektar jona [V(H 2 O)6]3+ prikazan je na slici 12. U ovom spektru eksperimentalno su dobijene tri trake 17 000, 25 000 i 38 000 cm 1, što je u skladu sa teorijskim proračunavanjima. [V(H 2 O)6]3+ Slika 12. Dijagram energetskih nivoa za d 2 konfiguraciju u Oh ligandnom polju i UV/VIS apsorpcioni spektar [V(H 2 O)6]3+

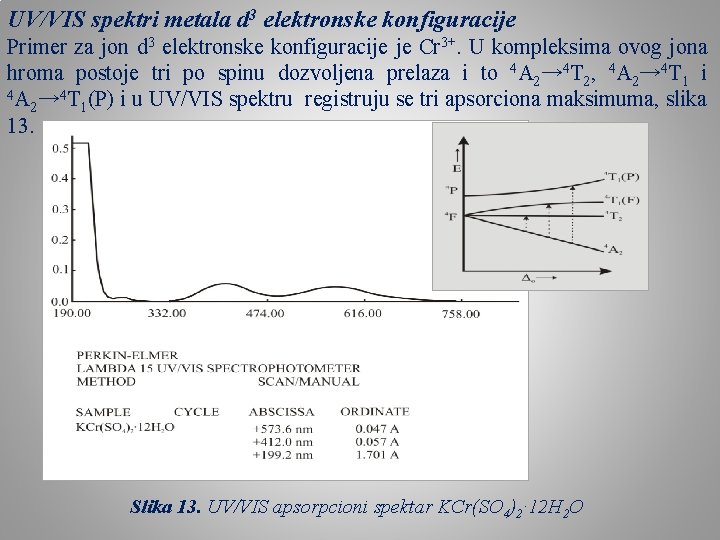
UV/VIS spektri metala d 3 elektronske konfiguracije Primer za jon d 3 elektronske konfiguracije je Cr 3+. U kompleksima ovog jona hroma postoje tri po spinu dozvoljena prelaza i to 4 A 2→ 4 T 2, 4 A 2→ 4 T 1 i 4 A → 4 T (P) i u UV/VIS spektru registruju se tri apsorciona maksimuma, slika 2 1 13. Slika 13. UV/VIS apsorpcioni spektar KCr(SO 4)2· 12 H 2 O

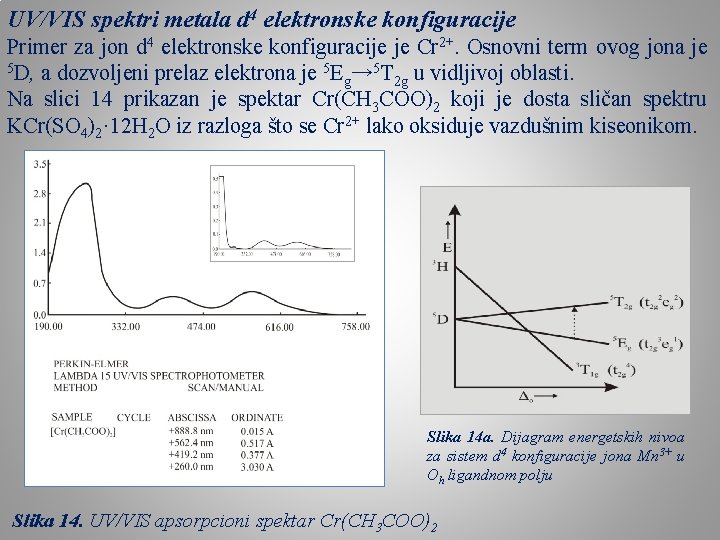
UV/VIS spektri metala d 4 elektronske konfiguracije Primer za jon d 4 elektronske konfiguracije je Cr 2+. Osnovni term ovog jona je 5 D, a dozvoljeni prelaz elektrona je 5 E → 5 T u vidljivoj oblasti. g 2 g Na slici 14 prikazan je spektar Cr(CH 3 COO)2 koji je dosta sličan spektru KCr(SO 4)2· 12 H 2 O iz razloga što se Cr 2+ lako oksiduje vazdušnim kiseonikom. Slika 14 a. Dijagram energetskih nivoa za sistem d 4 konfiguracije jona Mn 3+ u Oh ligandnom polju Slika 14. UV/VIS apsorpcioni spektar Cr(CH 3 COO)2

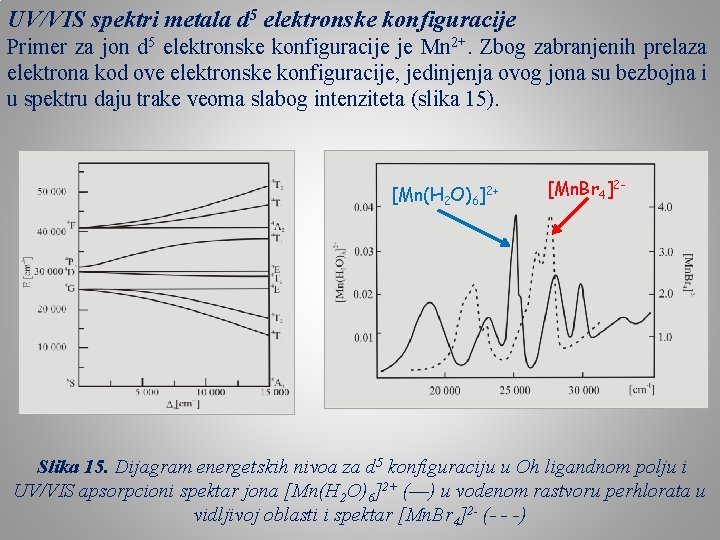
UV/VIS spektri metala d 5 elektronske konfiguracije Primer za jon d 5 elektronske konfiguracije je Mn 2+. Zbog zabranjenih prelaza elektrona kod ove elektronske konfiguracije, jedinjenja ovog jona su bezbojna i u spektru daju trake veoma slabog intenziteta (slika 15). [Mn(H 2 O)6]2+ [Mn. Br 4]2 - Slika 15. Dijagram energetskih nivoa za d 5 konfiguraciju u Oh ligandnom polju i UV/VIS apsorpcioni spektar jona [Mn(H 2 O)6]2+ (––) u vodenom rastvoru perhlorata u vidljivoj oblasti i spektar [Mn. Br 4]2 - (- - -)

Osnovne karakteristike ovog spektra su: • mali intezitet apsorpcionih traka, • veliki broj traka , • jedna traka je izrazito uska. Trake u spektru koje nastaju kao rezultat po spinu zabranjenih prelaza su, po pravilu, oko 100 puta slabijeg inteziteta od traka koje su nastale usled dozvoljenih prelaza.

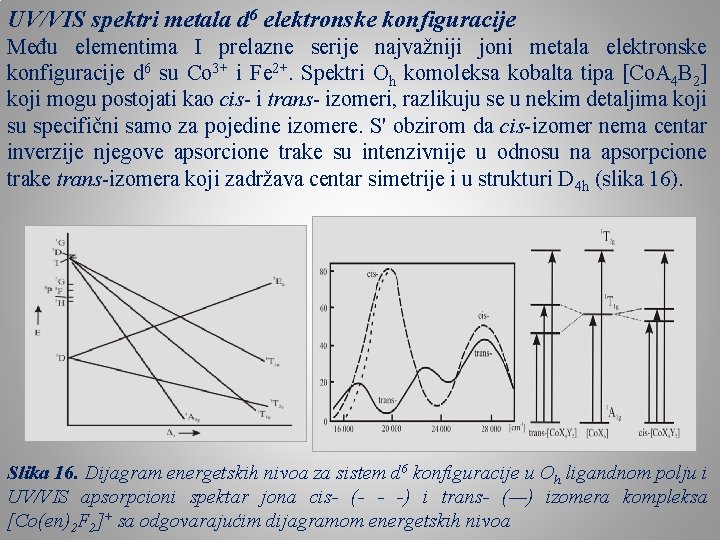
UV/VIS spektri metala d 6 elektronske konfiguracije Među elementima I prelazne serije najvažniji joni metala elektronske konfiguracije d 6 su Co 3+ i Fe 2+. Spektri Oh komoleksa kobalta tipa [Co. A 4 B 2] koji mogu postojati kao cis- i trans- izomeri, razlikuju se u nekim detaljima koji su specifični samo za pojedine izomere. S' obzirom da cis-izomer nema centar inverzije njegove apsorcione trake su intenzivnije u odnosu na apsorpcione trake trans-izomera koji zadržava centar simetrije i u strukturi D 4 h (slika 16). Slika 16. Dijagram energetskih nivoa za sistem d 6 konfiguracije u Oh ligandnom polju i UV/VIS apsorpcioni spektar jona cis- (- - -) i trans- (—) izomera kompleksa [Co(en)2 F 2]+ sa odgovarajućim dijagramom energetskih nivoa


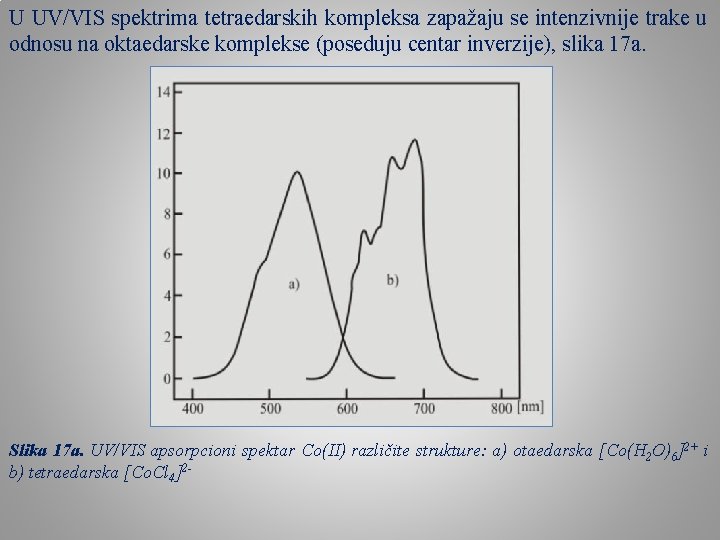
UV/VIS spektri metala d 7 elektronske konfiguracije Među 3 d-metalima najstabilniji jon d 7 konfiguracije gradi kobalt, Co(II)-jon. Položaji apsorpcionih maksimuma u spektrima i odgovarajući prelazi elektrona jona d 7 konfiguracije u Oh i Td ligandnom polju dati su u tabeli 1. Tabela 1. Položaji apsorpcionih maksimuma u spektrima jona d 7 konfiguracije u Oh i Td ligandnom polju U UV/VIS spektrima tetraedarskih kompleksa zapažaju se intenzivnije trake u odnosu na oktaedarske komplekse (poseduju centar inverzije), slika 11. Slika 17. Uprošćeni dijagram energetskih nivoa jona d 7 konfiguracije u Oh i Td ligandnom polju po Orgelu

U UV/VIS spektrima tetraedarskih kompleksa zapažaju se intenzivnije trake u odnosu na oktaedarske komplekse (poseduju centar inverzije), slika 17 a. Slika 17 a. UV/VIS apsorpcioni spektar Co(II) različite strukture: a) otaedarska [Co(H 2 O)6]2+ i b) tetraedarska [Co. Cl 4]2 -

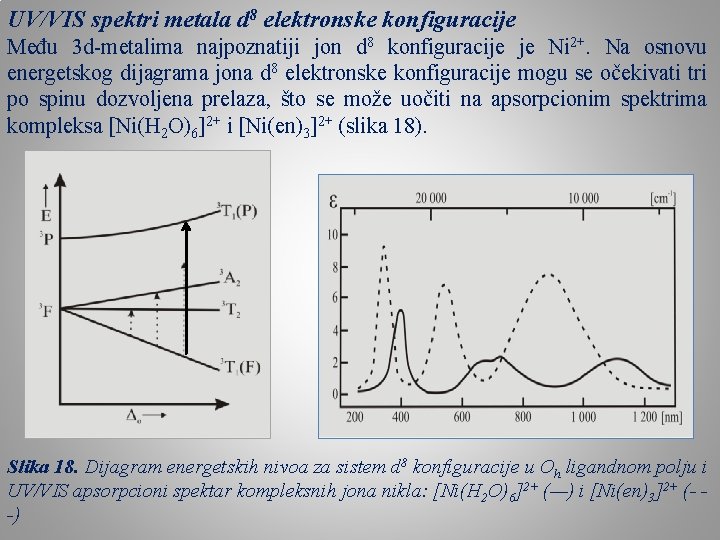
UV/VIS spektri metala d 8 elektronske konfiguracije Među 3 d-metalima najpoznatiji jon d 8 konfiguracije je Ni 2+. Na osnovu energetskog dijagrama jona d 8 elektronske konfiguracije mogu se očekivati tri po spinu dozvoljena prelaza, što se može uočiti na apsorpcionim spektrima kompleksa [Ni(H 2 O)6]2+ i [Ni(en)3]2+ (slika 18). Slika 18. Dijagram energetskih nivoa za sistem d 8 konfiguracije u Oh ligandnom polju i UV/VIS apsorpcioni spektar kompleksnih jona nikla: [Ni(H 2 O)6]2+ (—) i [Ni(en)3]2+ (- -)

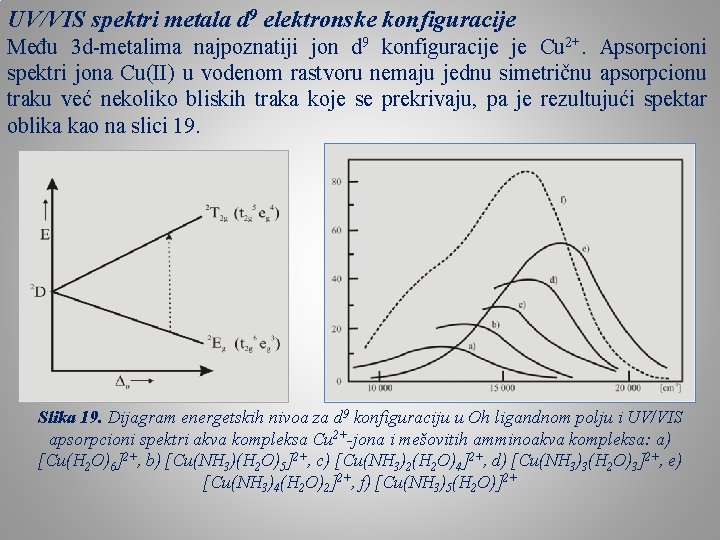
UV/VIS spektri metala d 9 elektronske konfiguracije Među 3 d-metalima najpoznatiji jon d 9 konfiguracije je Cu 2+. Apsorpcioni spektri jona Cu(II) u vodenom rastvoru nemaju jednu simetričnu apsorpcionu traku već nekoliko bliskih traka koje se prekrivaju, pa je rezultujući spektar oblika kao na slici 19. Slika 19. Dijagram energetskih nivoa za d 9 konfiguraciju u Oh ligandnom polju i UV/VIS apsorpcioni spektri akva kompleksa Cu 2+-jona i mešovitih amminoakva kompleksa: a) [Cu(H 2 O)6]2+, b) [Cu(NH 3)(H 2 O)5]2+, c) [Cu(NH 3)2(H 2 O)4]2+, d) [Cu(NH 3)3(H 2 O)3]2+, e) [Cu(NH 3)4(H 2 O)2]2+, f) [Cu(NH 3)5(H 2 O)]2+

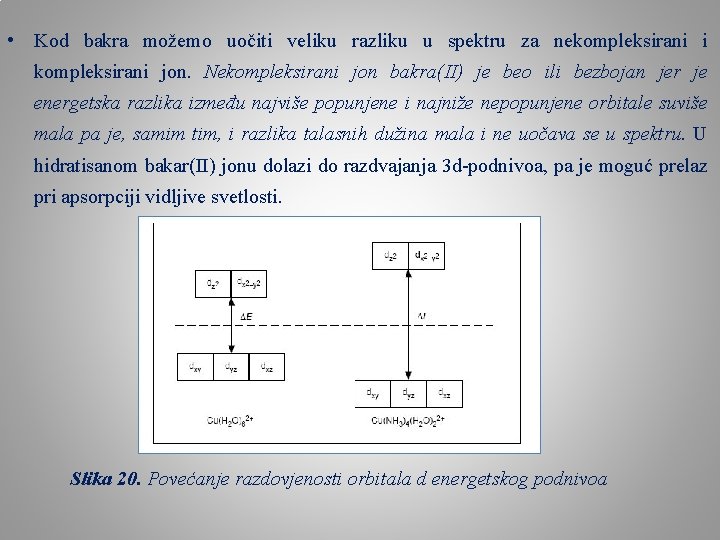
• Kod bakra možemo uočiti veliku razliku u spektru za nekompleksirani i kompleksirani jon. Nekompleksirani jon bakra(II) je beo ili bezbojan jer je energetska razlika između najviše popunjene i najniže nepopunjene orbitale suviše mala pa je, samim tim, i razlika talasnih dužina mala i ne uočava se u spektru. U hidratisanom bakar(II) jonu dolazi do razdvajanja 3 d-podnivoa, pa je moguć prelaz pri apsorpciji vidljive svetlosti. Slika 20. Povećanje razdovjenosti orbitala d energetskog podnivoa
![Slika 21 UVVIS spektri akva kompleksa metala 3 d serije MH 2 O6n Slika 21. UV/VIS spektri akva kompleksa metala 3 d- serije [M(H 2 O)6]n+](https://slidetodoc.com/presentation_image_h2/542719f6f347bb07994d72c3a809b29c/image-32.jpg)
Slika 21. UV/VIS spektri akva kompleksa metala 3 d- serije [M(H 2 O)6]n+

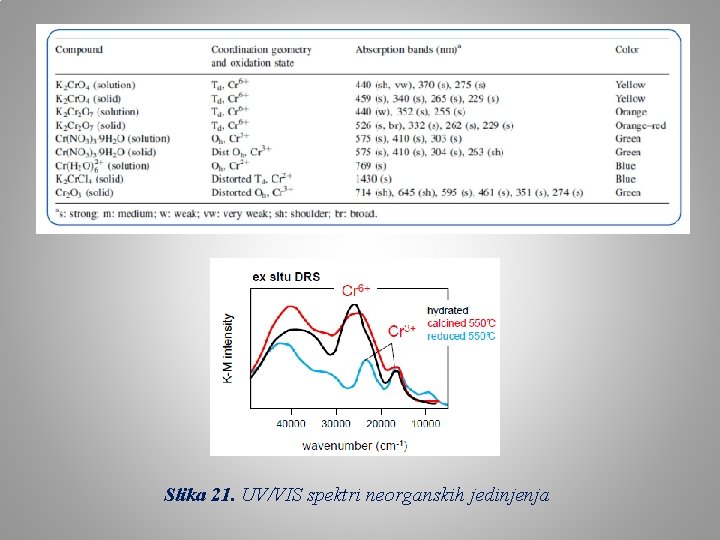
Slika 21. UV/VIS spektri neorganskih jedinjenja
![Zadaci za vežbanje 1 Maksimum apsorpcije vidljivog svetla jonom CuNH 342 odgovara talasnoj dužini Zadaci za vežbanje 1. Maksimum apsorpcije vidljivog svetla jonom [Cu(NH 3)4]2+ odgovara talasnoj dužini](https://slidetodoc.com/presentation_image_h2/542719f6f347bb07994d72c3a809b29c/image-34.jpg)
Zadaci za vežbanje 1. Maksimum apsorpcije vidljivog svetla jonom [Cu(NH 3)4]2+ odgovara talasnoj dužini od λ = 304 nm. Izračunat energiju cepanja d-podnivoa. 2. Energija cepanja za jon [Cr(H 2 O)6]3+ iznosi 167, 2 k. J/mol. Odrediti talasnu dužinu na kojoj apsorbuje. Koja je boja jedinjenja hroma(III) u rastvoru. 3. Maksimum apsorpcije vidljive svetlosti za kompleksni jon [Cu(NH 3)4]2+ odgovara talasnoj dužini od 304 nm, a za jon [Cu(H 2 O)6]2+ talasnoj dužini 365 nm. Izračunati energiju cepanja d-podnivoa u ovim kompleksnim jonovima. Kako se menja jačina ligandnog polja pri prelasku od NH 3 do H 2 O. 4. Kakva je boja jedinjenja mangana(III) u vodenim rastvorima ako je za [Mn(H 2 O)6]3+ jon Δ = 250, 5 k. J/mol? Kojoj talasnoj dužini odgovara maksimum apsorpcije vidljive svetlosti ovim jonom?

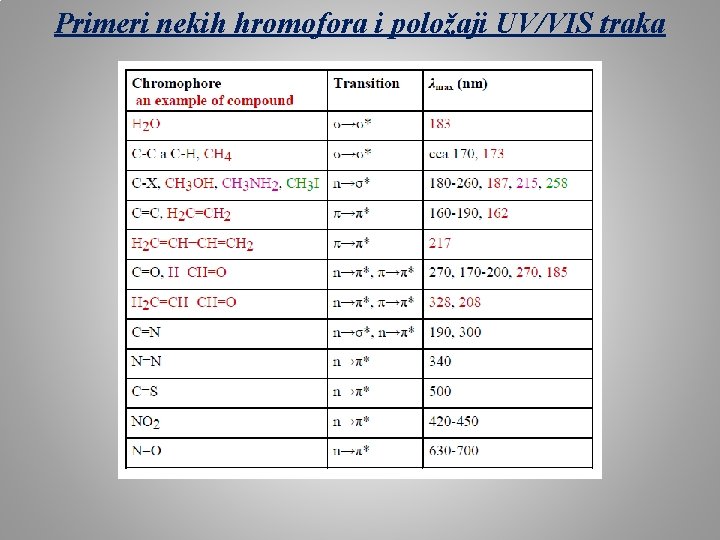
Primeri nekih hromofora i položaji UV/VIS traka

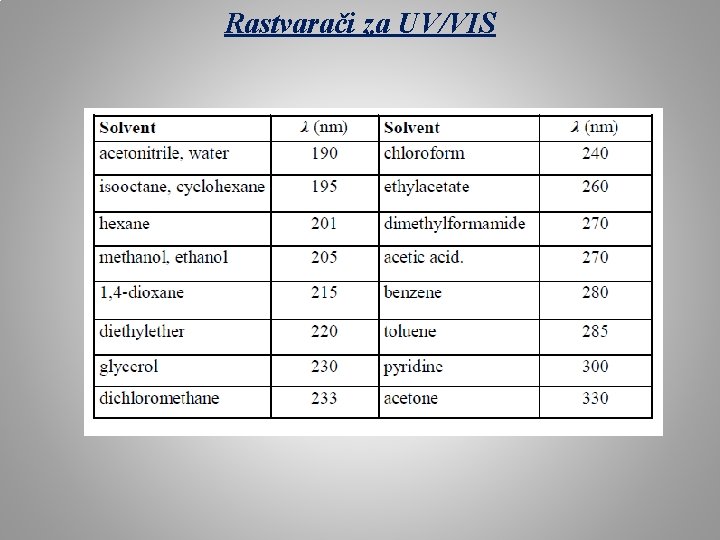
Rastvarači za UV/VIS

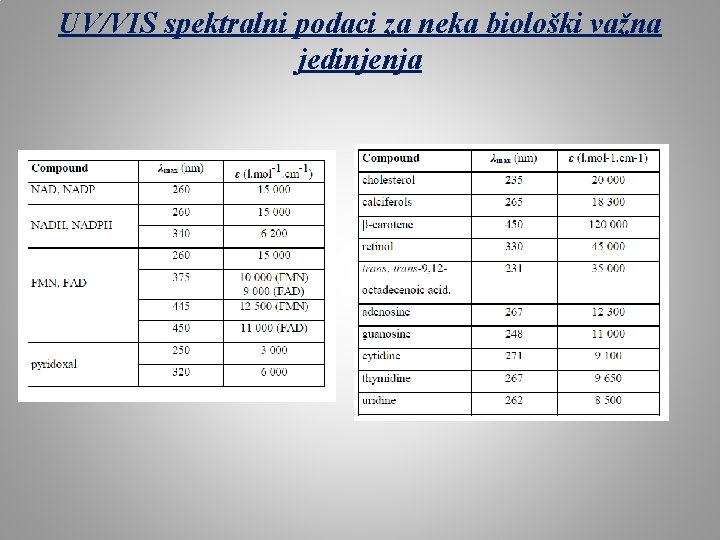
UV/VIS spektralni podaci za neka biološki važna jedinjenja

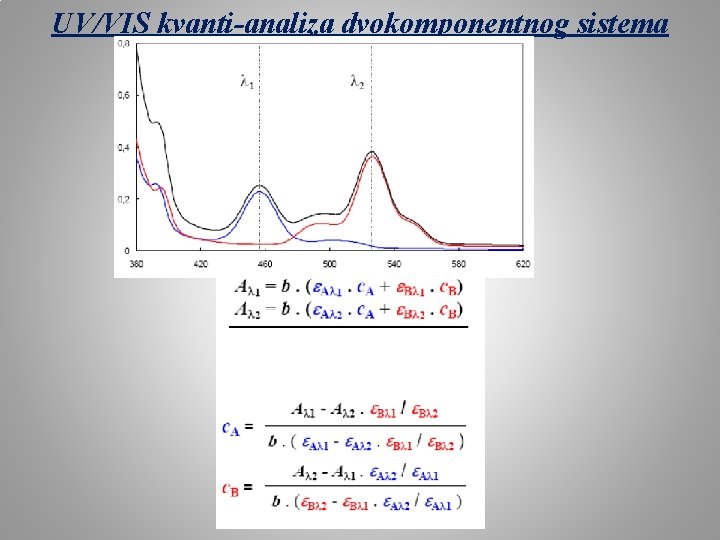
UV/VIS kvanti-analiza dvokomponentnog sistema

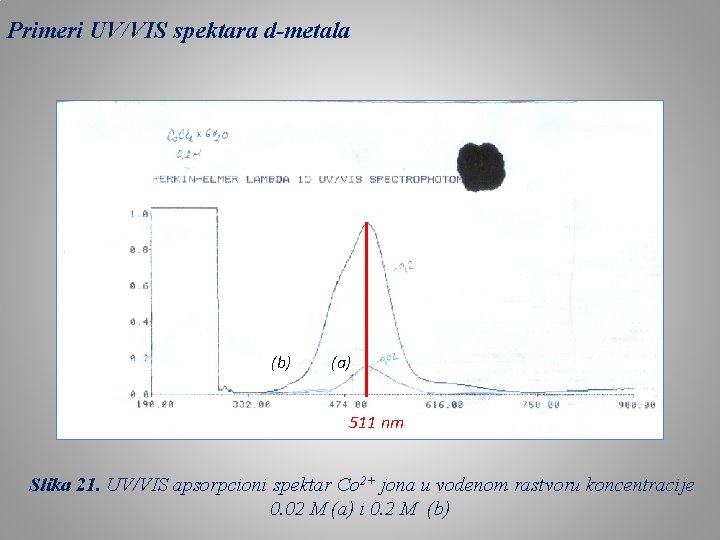
Primeri UV/VIS spektara d-metala (b) (a) 511 nm Slika 21. UV/VIS apsorpcioni spektar Co 2+ jona u vodenom rastvoru koncentracije 0. 02 M (a) i 0. 2 M (b)

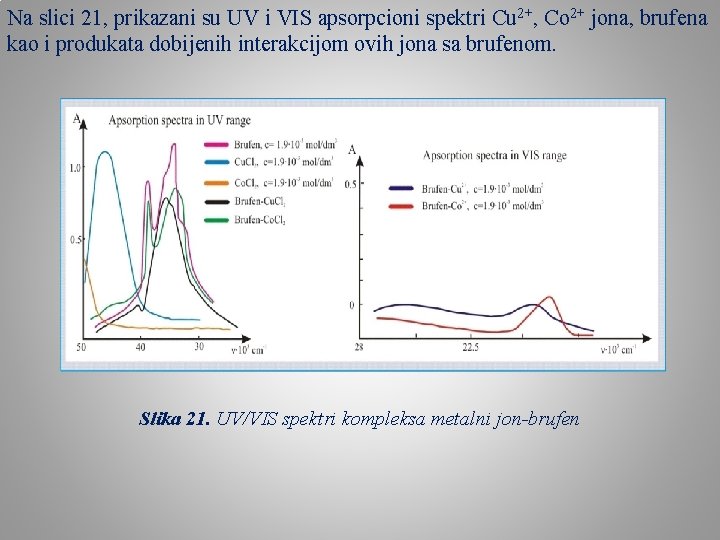
Na slici 21, prikazani su UV i VIS apsorpcioni spektri Cu 2+, Co 2+ jona, brufena kao i produkata dobijenih interakcijom ovih jona sa brufenom. Slika 21. UV/VIS spektri kompleksa metalni jon-brufen

UV/VIS spektroskopija u analizi neorganskih komponenti u vodi Analit Metoda Λ (nm) Tragovi metala Al Reaguje sa bojom Eriohrom cijanid R na p. H 6, kompleks crvene do pink boje 535 As Redukuje se cinkom do As. H 3 i sa srebro-dietiditiokarbamatom gradi crveni kompleks 535 Cd Ekstrakcija sa CHCl 3 koji sadrži ditiazon, iz uzorka koji je tretiran Na. OH, crveni do pink kompleks 518 Cr Oksiduje se do Cr(VI) i reaguje sa difenilkarbazidom, crveno-ljubičasti produkt 540 Cu Reaguje sa nekuprinom u slabokiselom rastvoru, a zatim se ekstrahuje sa CH 3 Cl/CH 3 OH; žuti kompleks 457 Fe Redukuje se do Fe(II) i reaguje sa o-fenantrolinom; narandžasto-crvni kompleks 510 Pb Extrakcija CH 3 Cl koji sadrži ditiazon iz uzorka , amonijačni pufer, višnja crveni kompleks 510 Mn Oksiduje se do Mn. O 4 - pomoću persulfata, ljubičasti rastvor 525 Hg Extrakcija CH 3 Cl koji sadrži ditiazon kompleks 492 Zn Reaguje sa zinkonom na p. H 9, plavi kompleks iz kiselog rastvora, narandžasti 620

UV/VIS spektroskopija u analizi neorganskih komponenti u vodi Analit Metoda Λ (nm) Anjonske vrste Amonijak Reakcija sa hipohloritom i fenolom uz Mn-so katalizator, plavi indofenol 630 Cijanidi U reakciji sa hloroaminom-T formiraju CNCl a zatim sa piridinbarbituratnom kiselinom crveno-plavu boju 578 Fluoridi Sa crvenim Zr-SPADNS nastaje Zr. F 6 -, boja ide do crvene 570 Sa leuko kristal ljubičastim nastaje plavi produkt 592 Nitrati Sa Cd do NO 2 -, a zatim sulfanilamidom i N-(1 -napthil)etilenediaminom gradi crvenu azo boju 543 Fosfati Reaguje sa amonijum molibdatom, zatim se redukuje sa Sn. Cl 2, molibdensko plavo 690 Residualni hloridi Organske vrste Fenol Reaguje sa 4 -aminoantpirinom i K 3[Fe(CN)6], žuta antipirinska boja 460 Anjonski surfaktanti Reaguju sa metilen plavom bojom i ekstrahuju se CH 3 Cl, plavo obojenje 652

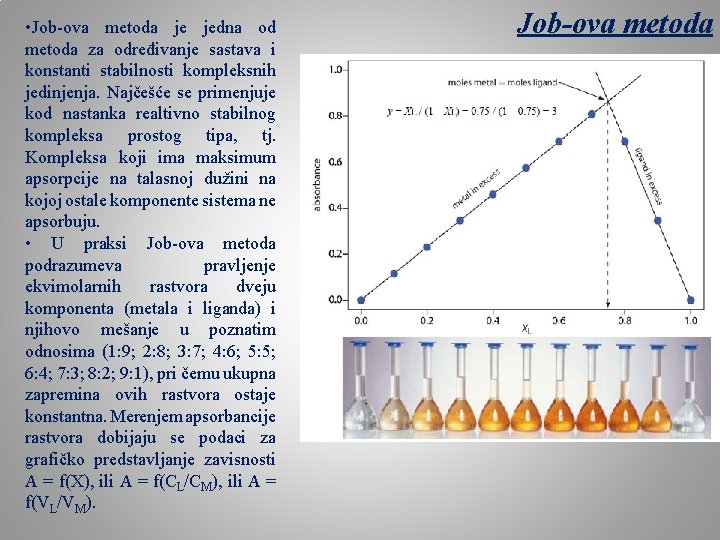
• Job-ova metoda je jedna od metoda za određivanje sastava i konstanti stabilnosti kompleksnih jedinjenja. Najčešće se primenjuje kod nastanka realtivno stabilnog kompleksa prostog tipa, tj. Kompleksa koji ima maksimum apsorpcije na talasnoj dužini na kojoj ostale komponente sistema ne apsorbuju. • U praksi Job-ova metoda podrazumeva pravljenje ekvimolarnih rastvora dveju komponenta (metala i liganda) i njihovo mešanje u poznatim odnosima (1: 9; 2: 8; 3: 7; 4: 6; 5: 5; 6: 4; 7: 3; 8: 2; 9: 1), pri čemu ukupna zapremina ovih rastvora ostaje konstantna. Merenjem apsorbancije rastvora dobijaju se podaci za grafičko predstavljanje zavisnosti A = f(X), ili A = f(CL/CM), ili A = f(VL/VM). Job-ova metoda
 Kalijum heksa cijano ferat
Kalijum heksa cijano ferat Hlorasta kiselina
Hlorasta kiselina Metoda rada
Metoda rada Evaluarea initiala avantaje si dezavantaje
Evaluarea initiala avantaje si dezavantaje Jurnalul cu dubla intrare metoda
Jurnalul cu dubla intrare metoda Metoda turul galeriei exemple
Metoda turul galeriei exemple Za sta se koristi spiritus
Za sta se koristi spiritus Skok u dalj
Skok u dalj Kompleksna jedinjenja primeri
Kompleksna jedinjenja primeri Tehnike rada u nastavi
Tehnike rada u nastavi Neproteinska azotna jedinjenja
Neproteinska azotna jedinjenja Tehnike uvijanja hto
Tehnike uvijanja hto Vodonik hemija
Vodonik hemija Hidridi metala
Hidridi metala Oprema informatičke tehnike
Oprema informatičke tehnike Kreativne tehnike u nastavi
Kreativne tehnike u nastavi Metode prikupljanja podataka
Metode prikupljanja podataka Amonoliza
Amonoliza Kompleksna jedinjenja hemija zadaci
Kompleksna jedinjenja hemija zadaci Osnovne grane tehnike
Osnovne grane tehnike Tehnike prikupljanja podataka
Tehnike prikupljanja podataka Koja je razlika između tehnike i tehnologije
Koja je razlika između tehnike i tehnologije Heterociklicna jedinjenja struktura
Heterociklicna jedinjenja struktura Tehnike prikupljanja podataka
Tehnike prikupljanja podataka Halogenovanje
Halogenovanje 13 grupa periodnog sistema elemenata
13 grupa periodnog sistema elemenata Podjela prapovijesti
Podjela prapovijesti Hlorovanje
Hlorovanje Epika drama
Epika drama Tehnike internet marketinga
Tehnike internet marketinga Oh grupa
Oh grupa Crtica književna vrsta
Crtica književna vrsta Dnevnik malog perice kviz
Dnevnik malog perice kviz Tehnike pisanja
Tehnike pisanja Organska hemija srednja skola
Organska hemija srednja skola Imaginarna osoba
Imaginarna osoba племенити гасови
племенити гасови Motivacija u nastavi
Motivacija u nastavi Solvejev postupak
Solvejev postupak Ag hemija
Ag hemija Karbonilna jedinjenja
Karbonilna jedinjenja Vanredni profesor znacenje
Vanredni profesor znacenje Plica pterygomandibularis
Plica pterygomandibularis Svojstva kiselina
Svojstva kiselina