VODONIK http www slideshare netMARKOCZVhemijanemetala OTKRIE VODONIKA Kevendi











- Slides: 14

VODONIK http: //www. slideshare. net/MARKOCZV/hemija-nemetala

OTKRIĆE VODONIKA Kevendiš 1699. godine Henri Kevendiš (Henry Cavendish, 1731 - 1810)

GRADITELJ VODE http: //www. slideshare. net/bibutor/vodonik-39048314

NALAŽENJE U TABLICI PSE Vodonik je jedini element u Tablici PSE koji ima dva mesta: Ia (1 grupa, po novoj podeli) - zbog jednog valentnog elektrona VIIa (17 grupa, po novoj podeli) - zbog svojstava nemetala. Nalazi e u 1. periodi. http: //stari. svethemije. com/node/138

NALAŽENJE U PRIRODI Najrasprostranjeniji element u svemiru: GRADI ZVEZDE. – SLOBODNO STANJE – JEDINJENJA: Oksidi Kiseline Baze (Hidroksidi) Soli Organska jedinjenja – BIOGENI ELEMENT (ulazi u sastav živih bića)

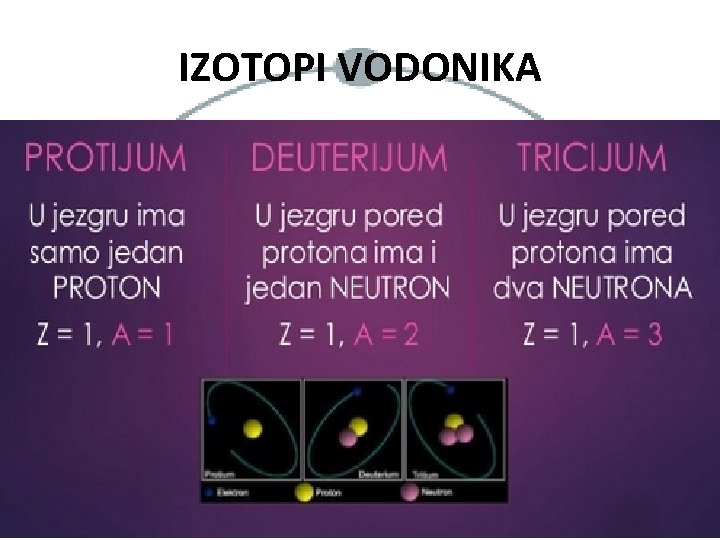
IZOTOPI VODONIKA

DEFINICIJA IZOTOPA - Atomi istog elementa koji imaju isti broj protona, a različit broj neutrona. - Atomi istog elementa koji imaju isti atomski, a različit maseni broj. VAŽNO: Gasovite supstance se u prirodi javljaju u obliku dvoatomskog molekula! (H 2, O 2, N 2, Cl 2, F 2). Kao dvoatomski molekuli javljaju se i Br 2 i I 2.

DOBIJANJE VODONIKA Laboratorijsko: - Metal i kiselina: Zn + 2 HCl → Zn. Cl 2 + H 2 Zn + H 2 SO 4 → Zn. SO 4 + H 2 - Metal i voda: Na + H 2 O → Na. OH + H 2 - Voda i kalcijum-hidrid: 2 H 2 O + Ca. H 2 → 2 H 2 + Ca(OH)2 Industrijsko: - Elektrolizom vode: 2 H 2 O → 2 N 2 + O 2 N 2 O + N 2 O → H 3 O+ + OH- Elektrolizom vodenog rastvora kuhinjske soli: 2 Na. Cl + 2 H 2 O → H 2 + Cl 2 + 2 Na. OH - Parcijalnom oksidacijom ugljovodonika i uglja (koks), tj. prevođenjem vodene pare kroz sloj užarenog koksa: H 2 O + C → H 2 + CO ("vodeni gas") - Razlaganjem ugljovodonika (metana)

FIZIČKA SVOJSTVA VODINIKA Najlakši gas u prirodi, bez boje, bez ukusa, bez mirisa. U slobodnom obliku javlja se u vidu dvoatomnih molekula H 2 (u molekulu se javlja nepolarna kovalentna veza). Nije otrovan, ali je zagušljiv i ako se udiše može izazvati nesvesticu. VALENCA: jedan (I)


HEMIJSKA SVOJSTVA VODONIKA Vodonik je lako zapaljiv gas. 2 H 2 + O 2 → 2 H 2 O Vodonik je jako redukciono sredstvo. Reaguje sa oksidima metala. DEFINICIJA HIDRIDA: Jedinjenje vodonika sa nekim drugim elementom.

DEFINICIJA „PRASKAVOG GASA” Smeša vodonika i kiseonika u zapreminskom odnosu 2: 1. Paljenjem „Praskavog gasa” nastaje voda. Koncentracija vodonikovih jona izražava se pomoću p. H vrednosti. p. H – mera kiselosti od nula do 7 – kisela sredina 7 – neutralna sredina od 7 do 14 – bazna sredina

JEDINJENJA VODONIKA Vodonik je reaktivan element, pa ulazi u sastav mnogih jedinjenja. Vodonik gradi: kiseline, baze, soli (Na. HCO 3 natrijum bikarbonat, soda bikarbona), hidride (Ca. H 2 -kalcijum hidrid) i ulazi u sastav mnogih bitnih organskih jedinjenja (vitamini, hormoni, ugljeni hidrati, lipidi, alkoholi…. ), zbog čega je on biogeni element. Svakako najrasprostranjenije jedinjenje vodonika (oksid vodonika) je voda (H 2 O).

UPOTREBA VODONIKA • • U procesima sagorevanja (raketno gorivo) Sečenje i zavarivanje metala U hemijskoj industriji U instrumentalnoj analitici U meteorologiji U elektronici U proizvodnji poluprovodnika U stvaranju redukcionih atmosfera u metalurgiji, rafinaciji metala, u termičkoj obradi metala
 Henri kevendis
Henri kevendis Laboratorijsko dobijanje vodonika
Laboratorijsko dobijanje vodonika Izobutil benzen
Izobutil benzen Slideshare slideshare
Slideshare slideshare Mail @ pt.slideshare.net
Mail @ pt.slideshare.net Https //www.slideshare.net
Https //www.slideshare.net Http slideshare
Http slideshare Siat.ung.ac.id krs
Siat.ung.ac.id krs Http //mbs.meb.gov.tr/ http //www.alantercihleri.com
Http //mbs.meb.gov.tr/ http //www.alantercihleri.com Scope of jurisprudence slideshare
Scope of jurisprudence slideshare Hypergonadism in males
Hypergonadism in males Hire purchase account
Hire purchase account Role of media in development ppt
Role of media in development ppt Nursing care plan for typhoid fever slideshare
Nursing care plan for typhoid fever slideshare Disadvantages of fractional distillation
Disadvantages of fractional distillation