Jedinjenja alkalnih metala Grade jedinjenja iskljuivo sa ox










- Slides: 12

Jedinjenja alkalnih metala Grade jedinjenja isključivo sa ox. br. +1 1

Alkalni metali grade jedinjenja sa kiseonikom: • Litijum gradi tipičan oksid: +1 -2 4 Li(s) + O 2(g) → 2 Li 2 O(s) • Natrijum pretežno gradi peroksid: +1 -1 2 Na(s) + O 2(g) → Na 2 O 2(s) • Ali u slučaju viška metala gradi oksid: +1 -2 4 Na(s) + O 2(g) → 2 Na 2 O(s) • Ostali grade superokside: K(s) + O 2(g) → KO 2(s) 2

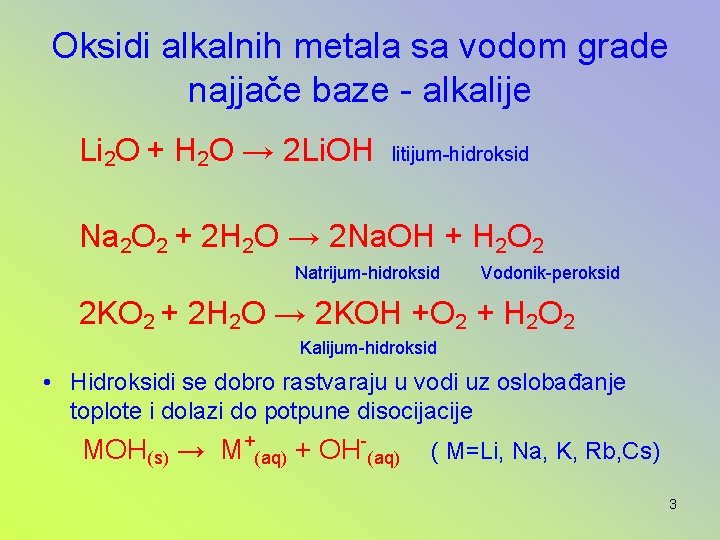
Oksidi alkalnih metala sa vodom grade najjače baze - alkalije Li 2 O + H 2 O → 2 Li. OH litijum-hidroksid Na 2 O 2 + 2 H 2 O → 2 Na. OH + H 2 O 2 Natrijum-hidroksid Vodonik-peroksid 2 KO 2 + 2 H 2 O → 2 KOH +O 2 + H 2 O 2 Kalijum-hidroksid • Hidroksidi se dobro rastvaraju u vodi uz oslobađanje toplote i dolazi do potpune disocijacije MOH(s) → M+(aq) + OH-(aq) ( M=Li, Na, K, Rb, Cs) 3

Alkalni metali se rastvaraju u vodi: 2 Na+2 H 2 O→ 2 Na. OH+H 2 2 Li+2 H 2 O → 2 Li. OH+H 2 Rastvaranje Li u vodi Rastvaranje Na u vodi. Idikator pokazuje baznu r-ju 4

2 M(s)+ 2 H 2 O → 2 M+(aq) + 2 OH-(aq) + H 2(g) Δr. H<0 • Reaktivnost raste sa porastom atomskog broja 1. 2. 3. 4. Li- reaguje sporo Na- burno K- uz paljenje vodonika Rb i Cs- uz eksploziju • Alkalni metali lako reaguju sa halogenim elementima gradeći soli – halogenide: 2 M(s) + X 2 → 2 MX(s) ( X=F, Cl, Br, I ) 5

Natrijum-hlorid, Na. Cl • Bela kristalna supstanca sa jonskom kristalnom rešetkom (pravilna kocka, koordinacioni br. je 6) • U prirodi se nalazi: 1. U zemljinoj kori kao kamena so 2. U morskoj vodi (2, 6% u proseku) i slanim jezerima • Primena: -Za dobijanje: H 2, Cl 2, HCl, Na. OH, Na 2 CO 3 … -sa ledom daje niske Na. Cl se može dobiti uparavanjem t, do -21°C 6 morske vode

Natrijum-hidroksid, Na. OH • Poznat je pod nazivima: masna, kaustična ili živa soda • To je bela, neprozirna, kristalna supstanca • U trgovini se javlja u obliku ljuspica, granula… • Rastvara se u vodi, nagriza staklo, porculan, Pt, Al (čuva se u plastičnoj ambalaži), • Fe i Ni su otporni Laboratorijsko dobijanje: 2 Na + 2 H 2 O → 2 Na. OH + H 2 7

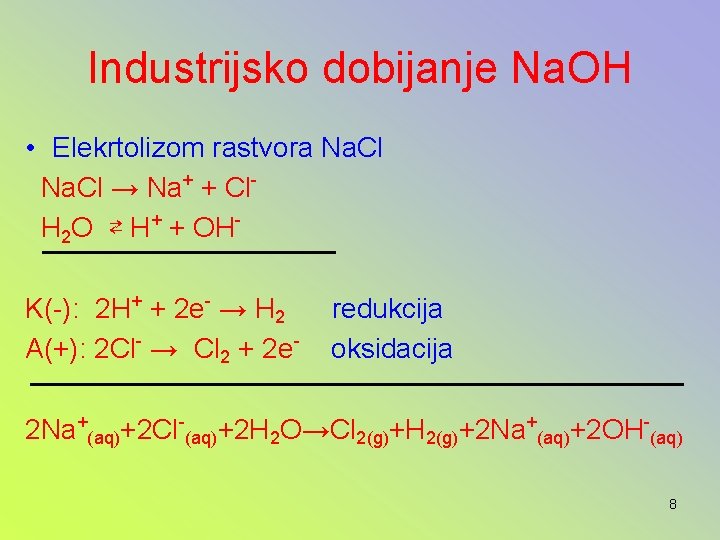
Industrijsko dobijanje Na. OH • Elekrtolizom rastvora Na. Cl → Na+ + Cl. H 2 O ⇄ H+ + OHK(-): 2 H+ + 2 e- → H 2 A(+): 2 Cl- → Cl 2 + 2 e- redukcija oksidacija 2 Na+(aq)+2 Cl-(aq)+2 H 2 O→Cl 2(g)+H 2(g)+2 Na+(aq)+2 OH-(aq) 8

Hemijske osobine Na. OH • Sa hlorom gradi hipohlorit 2 Na+(aq)+ 2 OH-(aq)+ Cl 2(g) → Na. Cl. O(s)+ H 2 O + Na+(aq)+ Cl-(aq) • Reaguje sa CO 2 iz vazduha (Na. OH je higroskopan) 2 Na. OH(s) + CO 2(g) → Na 2 CO 3(s) + H 2 O • Sa viškom vode, natrijum-karbonat gradi natrijumhidrogenkarbonat: Na 2 CO 3(s) + H 2 O + CO 2(g) ⇄ 2 Na. HCO 3(s) Primena: • Za industrijsko dobijanje Al, u tekstilnoj industriji, industriji sapuna , detergenata, celuloze, papira… 9

Natrijum-karbonat, Na 2 CO 3 • • Poznat je pod nazivom SODA Beli prah, rastvara se u vodi sa baznom reakcijom, zbog hidrolize: Na 2 CO 3 → 2 Na+ + CO 32 - + H 2 O ⇄ HCO 3 - + OH • Kristališe sa 10 molekula vode, Na 2 CO 3 · 10 H 2 O • Primena: -u industriji stakla, sapuna, hartije, boja, tekstilnoj industriji, za štavljenje kože, za omekšavanje vode • Dobija se industrijski Solvejevim postupkom 10

Solvejev postupak 1. U zasićeni rastvor Na. Cl se uvode CO 2 i NH 3 Na+ + Cl- + NH 3(g + CO 2(g) + H 2 O ⇄ NH 4+ + Na+ + HCO 3 - + Cl 2. Rastvor se ohladi na 15 - 27°C , kada kristališe Na. HCO 3 : 3. Vrši se zagrevanje Na. HCO 3 u rotacionoj peći: 2 Na. HCO 3 (s)⇄ Na 2 CO 3(s) + CO 2(g) + H 2 O 4. Preostali amonijum-hlorid se takođe zagreva i razlaže: NH 4 Cl(s) ⇄ NH 3(g) + HCl(g) • Proces je ekonomičan jer se najskuplja supstanca, amonijak, regeneriše i ponovo vraća u proces 11

Kalijum-nitrat, KNO 3 • Poznat je pod nazivom ŠALITRA • Idustrijski se dobija iz zasićenih rastvora KCl i Na. NO 3 Na+ + NO 3 - + K+ + Cl- ⇄ K+ + NO 3 - + ( Na+ + Cl-)(s) • Na 100°C najmanja je rastvorljivost Na. Cl • Na 20°C najmanja je rastvorljivost KNO 3 , pa će se on taložiti • Primena: Kao veštačko đubrivo, za konzerviranje namirnica, za izradu crnog baruta (meša se sa S) 12























