ZKLADN POZNATKY MOLEKULOV FYZIKY A TERMODYNAMIKY Ing Stanislav



![Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-5.jpg)










![Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-21.jpg)
















![Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-48.jpg)






![Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-60.jpg)









![Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-72.jpg)








![Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-82.jpg)









![Literatura l [1] ARENIUS, Olof. Wikipedia. cz [online]. [cit. 10. 9. 2012]. Dostupný na Literatura l [1] ARENIUS, Olof. Wikipedia. cz [online]. [cit. 10. 9. 2012]. Dostupný na](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-95.jpg)







![Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-104.jpg)











![Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-119.jpg)
![Literatura - pokračování l [4] MADAU, Mircea. Wikipedia. cz [online]. [cit. 29. 9. 2012]. Literatura - pokračování l [4] MADAU, Mircea. Wikipedia. cz [online]. [cit. 29. 9. 2012].](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-120.jpg)
- Slides: 120

ZÁKLADNÍ POZNATKY MOLEKULOVÉ FYZIKY A TERMODYNAMIKY Ing. Stanislav Jakoubek

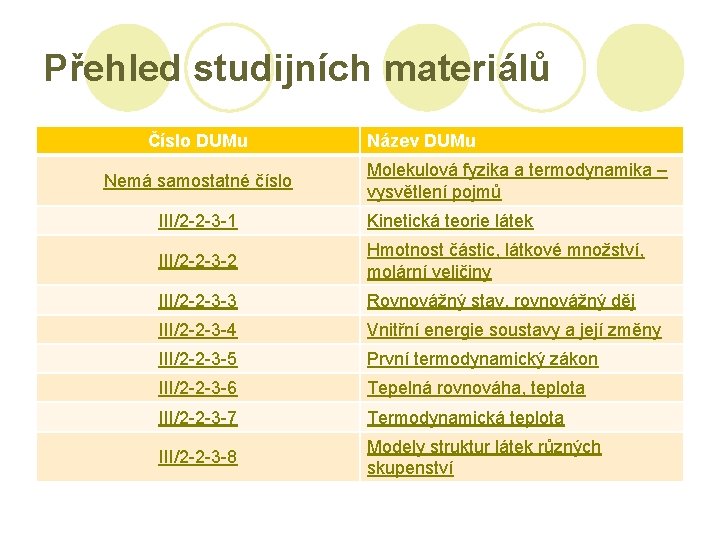
Přehled studijních materiálů Číslo DUMu Nemá samostatné číslo Název DUMu Molekulová fyzika a termodynamika – vysvětlení pojmů III/2 -2 -3 -1 Kinetická teorie látek III/2 -2 -3 -2 Hmotnost částic, látkové množství, molární veličiny III/2 -2 -3 -3 Rovnovážný stav, rovnovážný děj III/2 -2 -3 -4 Vnitřní energie soustavy a její změny III/2 -2 -3 -5 První termodynamický zákon III/2 -2 -3 -6 Tepelná rovnováha, teplota III/2 -2 -3 -7 Termodynamická teplota III/2 -2 -3 -8 Modely struktur látek různých skupenství

Úvod l Začneme vysvětlením pojmů molekulová fyzika a termodynamika l Existují různé metody poznání fyzikálních dějů l Probereme dvě z nich

Metody poznání l Vlastnosti látek na základě jejich složení z částic, neustálého pohybu a vzájemného působení; používá statistiku a pravděpodobnost molekulová fyzika l Neuvažuje částicové složení, ale používá měřitelné veličiny (T, p, V, …) termodynamika l Obě metody se vzájemně doplňují.
![Literatura l 1 BEDNAŘÍK Milan KUNZOVÁ Vlasta SVOBODA Emanuel Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-5.jpg)
Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory SOU. Praha: Státní pedagogické nakladatelství, n. p. , 1986, ISBN 14 -209 -86.

Kinetická teorie látek

Kinetická teorie látek l Jedna z velmi důležitých fyzikálních teorií l Je založena na třech základních experimentálních poznatcích

a) Látka každého skupenství se skládá z částic l Molekuly, atomy, ionty l Prostor není zcela zaplněn, mezi částicemi jsou mezery l Částice lze zobrazit (například elektronovým mikroskopem) l Rozměry:

Důkaz tohoto tvrzení : fotografie atomu l Fotografie hliníku na atomární úrovni

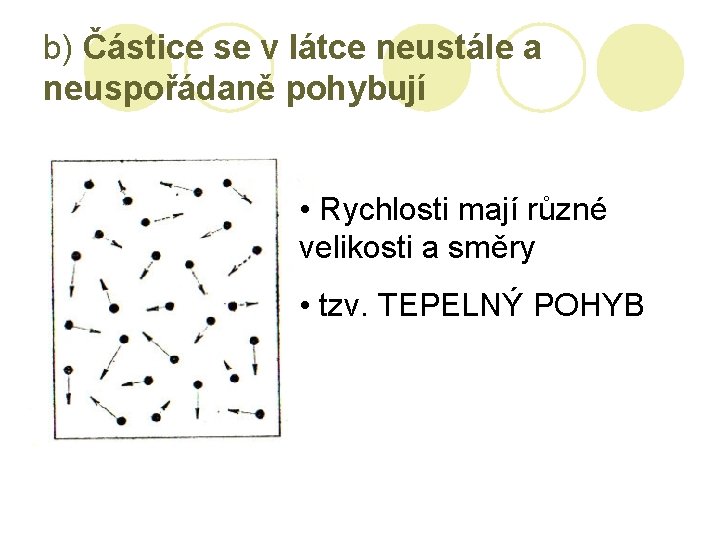
b) Částice se v látce neustále a neuspořádaně pohybují • Rychlosti mají různé velikosti a směry • tzv. TEPELNÝ POHYB

Některé experimentální důkazy l Difúze = samovolné pronikání částic jedné látky mezi částice druhé látky • Probíhá mezi látkami všech skupenství • Rychlost difúze závisí na teplotě (při vyšší teplotě rychleji)

Difúze (pokračování) l http: //www. youtube. com/watch? v=g. XJMB gy. T_hk&feature=related l http: //www. youtube. com/watch? v=o 6 nq. Ycr Iti. Q&NR=1&feature=endscreen l Molekuly jedné látky narážejí do molekul druhé látky l Existence mezimolekulových prostor

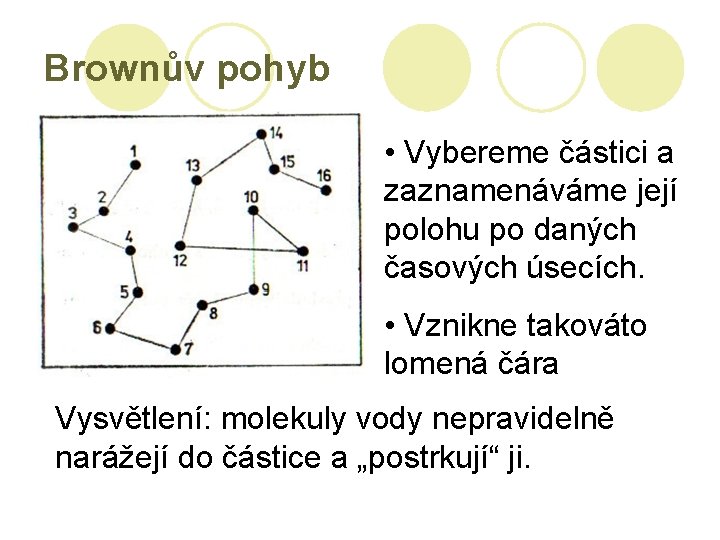
Brownův pohyb • Vybereme částici a zaznamenáváme její polohu po daných časových úsecích. • Vznikne takováto lomená čára Vysvětlení: molekuly vody nepravidelně narážejí do částice a „postrkují“ ji.

Brownův pohyb (pokračování) l Rychlost částice závisí na teplotě (s rostoucí teplotou roste) l 1827 – skotský biolog Robert Brown – objevil na pylových zrnkách ve vodě l Myslel si, že jde o vlastní pohyb pylových zrnek l Správně objasnil až Albert Einstein

Robert Brown (1773 -1858)

Rozpouštění cukru l Rychlost závisí na teplotě

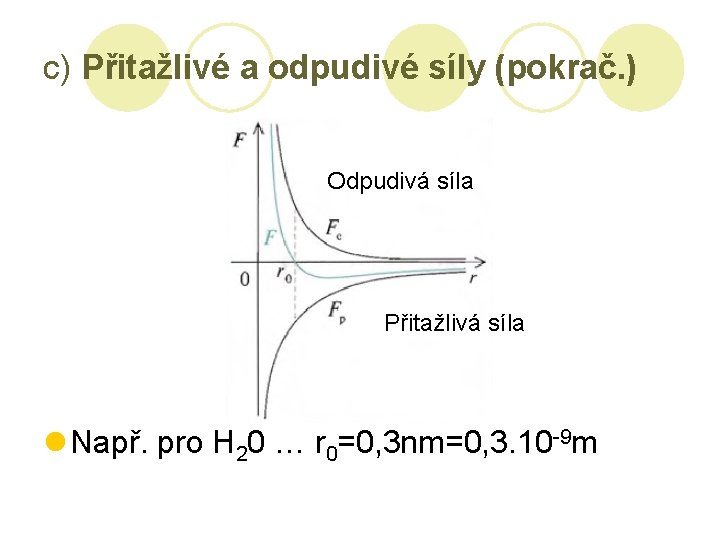
c) Částice na sebe navzájem působí přitažlivými i odpudivými silami l Síly působí současně l V určité vzdálenosti se síly vyrovnají částice jsou v rovnovážné poloze

c) Přitažlivé a odpudivé síly (pokrač. ) Odpudivá síla Přitažlivá síla l Např. pro H 20 … r 0=0, 3 nm=0, 3. 10 -9 m

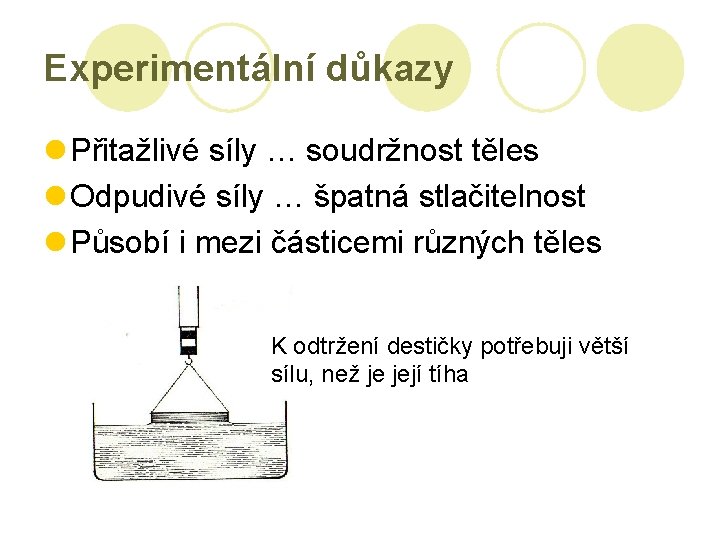
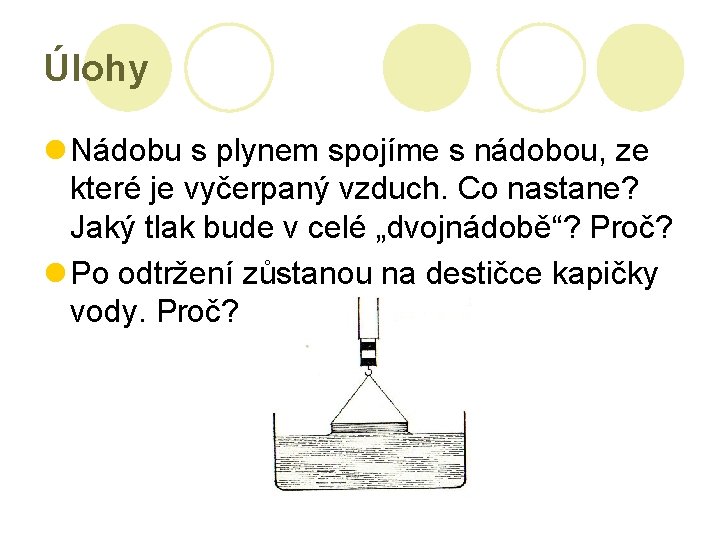
Experimentální důkazy l Přitažlivé síly … soudržnost těles l Odpudivé síly … špatná stlačitelnost l Působí i mezi částicemi různých těles K odtržení destičky potřebuji větší sílu, než je její tíha

Úlohy l Nádobu s plynem spojíme s nádobou, ze které je vyčerpaný vzduch. Co nastane? Jaký tlak bude v celé „dvojnádobě“? Proč? l Po odtržení zůstanou na destičce kapičky vody. Proč?
![Literatura l 1 BEDNAŘÍK Milan KUNZOVÁ Vlasta SVOBODA Emanuel Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-21.jpg)
Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory SOU. Praha: Státní pedagogické nakladatelství, n. p. , 1986, ISBN 14 -209 -86. l [2] TARÁBEK, Pavol; ČERVINKOVÁ, Petra a kol. Odmaturuj z fyziky. Brno: Didaktis, 2006, ISBN 80 -7358058 -6. l [3] MAULL; POLYBLANK. Wikipedia. cz [online]. [cit. 1. 9. 2012]. Dostupný na WWW: <http: //cs. wikipedia. org/wiki/Soubor: Robert_Brown_(bota nist). jpg>.

Hmotnost částic, látkové množství, molární veličiny

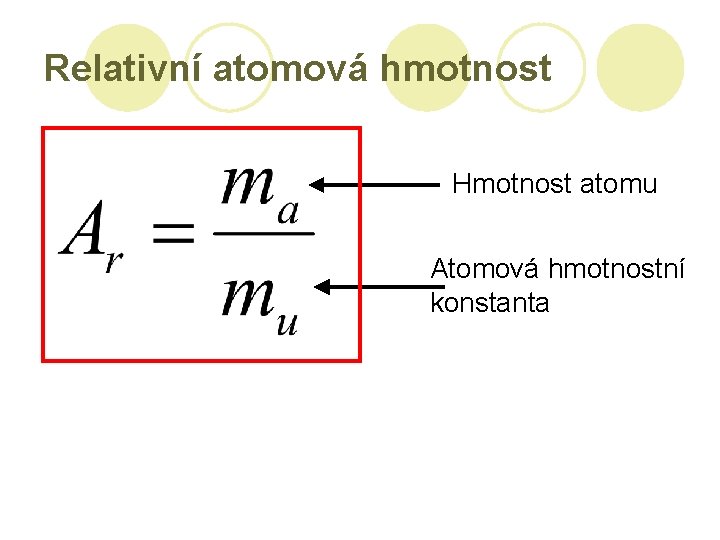
Hmotnost částic l Hmotnost částic je velmi malá l Např. : l špatně se s tím počítá, proto se zavádí tzv. relativní atomová hmotnost

Relativní atomová hmotnost Hmotnost atomu Atomová hmotnostní konstanta

Atomová hmotnostní konstanta l Představuje jakýsi „atomární“ kilogram (tedy hmotnost, se kterou porovnáváme hmotnosti atomů a molekul) l Je definována jako atomové hmotnosti l Přesná hodnota: mu=1, 6605655. 10 -27 kg l Pro výpočty zaokrouhlíme:

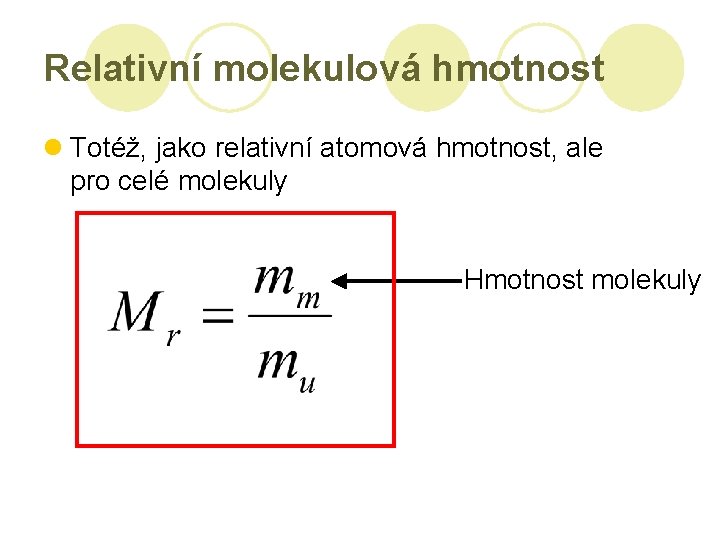
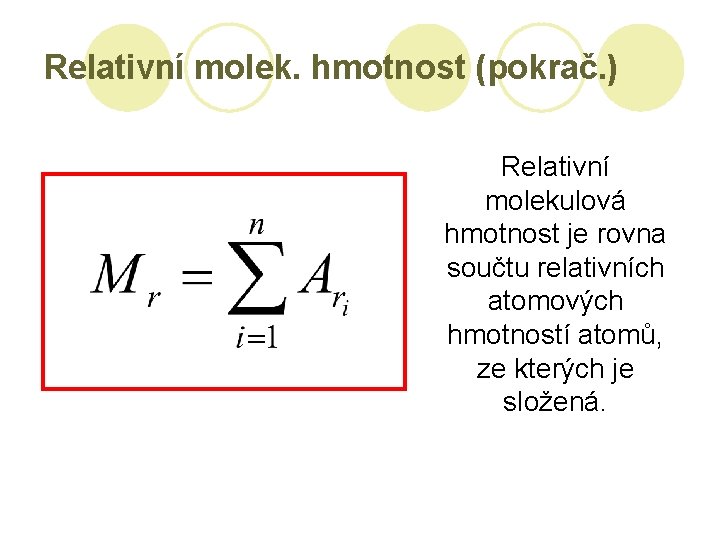
Relativní molekulová hmotnost l Totéž, jako relativní atomová hmotnost, ale pro celé molekuly Hmotnost molekuly

Relativní molek. hmotnost (pokrač. ) Relativní molekulová hmotnost je rovna součtu relativních atomových hmotností atomů, ze kterých je složená.

Jednotka Ar a Mr Jsou bezrozměrné (tedy bez jednotky)

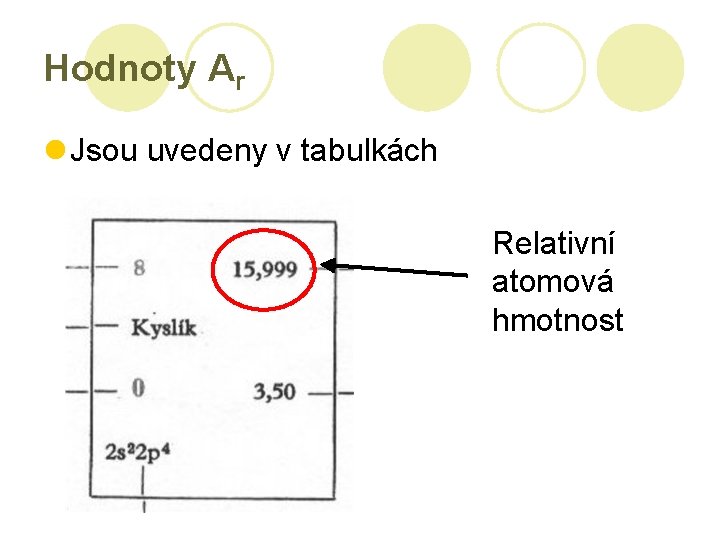
Hodnoty Ar l Jsou uvedeny v tabulkách Relativní atomová hmotnost

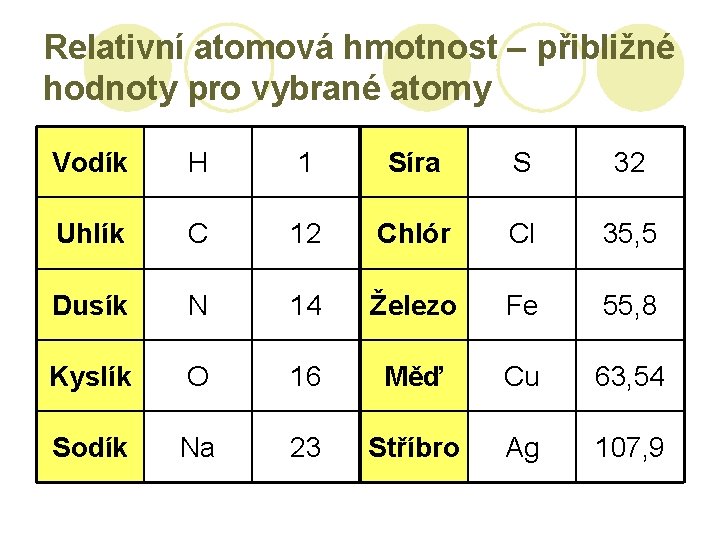
Relativní atomová hmotnost – přibližné hodnoty pro vybrané atomy Vodík H 1 Síra S 32 Uhlík C 12 Chlór Cl 35, 5 Dusík N 14 Železo Fe 55, 8 Kyslík O 16 Měď Cu 63, 54 Sodík Na 23 Stříbro Ag 107, 9

Příklad l Určete hmotnost atomu mědi. Z tabulek: Ar(Cu)=63, 54; ma(Cu)=?

Příklad l Určete relativní molekulovou hmotnost molekuly kyseliny sírové H 2 SO 4. Z tabulek: Ar(H)=1, Ar(S)=32, Ar(O)=16

Příklad l Z definice atomové hmotnostní konstanty určete Víme: mu je definována jako hmotnosti l jeho atomové A tedy: A r=12

Příklad (důležitý!!) l Kolik atomů obsahuje 12 gramů ? Hmotnost vzorku Hmotnost jednoho atomu

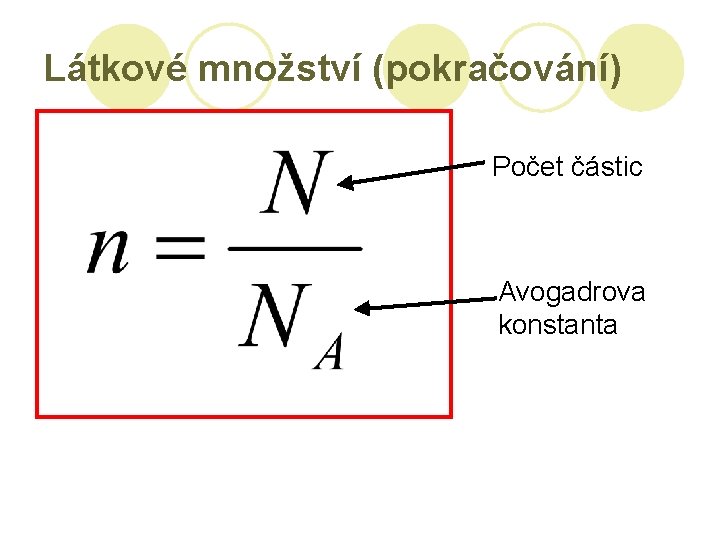
Látkové množství l Soustava, která obsahuje právě tolik částic (např. atomů, molekul, …), kolik obsahuje 12 gramů uhlíku , má látkové množství 1 mol. Avogadrova konstanta Odpovídá počtu částic obsažených v tělese o látkovém množství 1 mol.

Amedeo Avogadro (1776 -1856) l Italský fyzik

Látkové množství (pokračování) Počet částic Avogadrova konstanta

Molární veličiny l Jsou vztažené k látkovému množství 1 mol l Příklady: ¡Molární hmotnost ¡Molární objem ¡Molární tepelná kapacita ¡Molární entropie ¡…

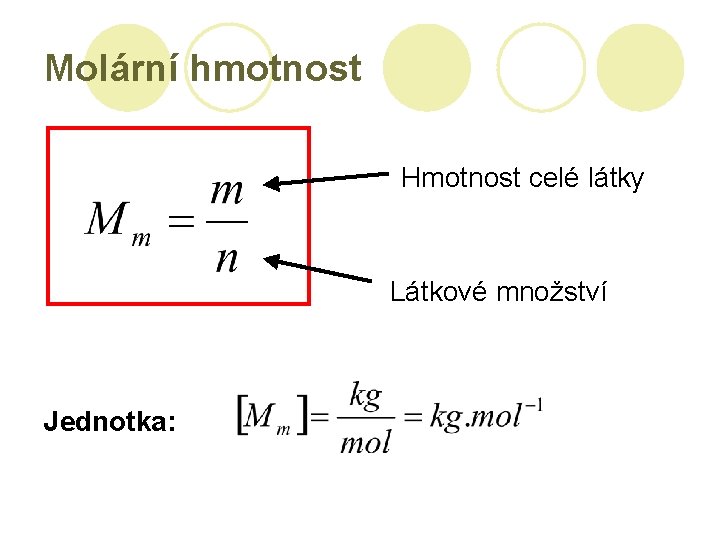
Molární hmotnost Hmotnost celé látky Látkové množství Jednotka:

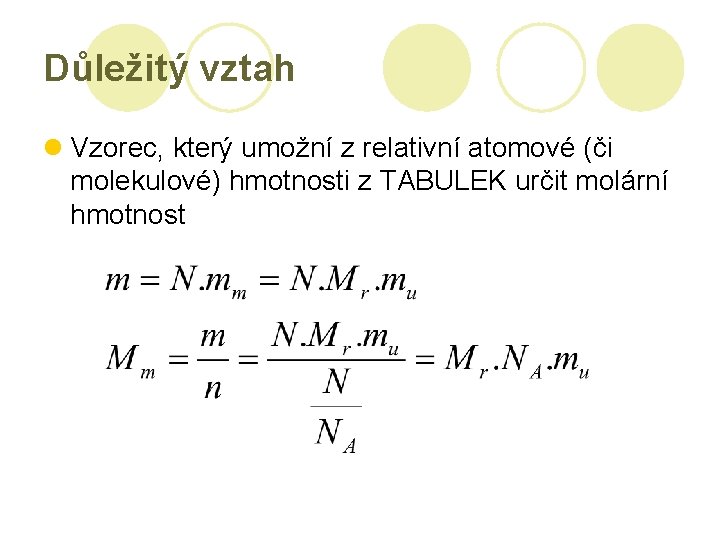
Důležitý vztah l Vzorec, který umožní z relativní atomové (či molekulové) hmotnosti z TABULEK určit molární hmotnost

Důležitý vztah (pokračování) l Dosadíme hodnoty Avogadrovy konstanty a atomové hmotnostní konstanty

Příklad l Určete látkové množství a počet molekul ve vodě o hmotnosti 1 kg.

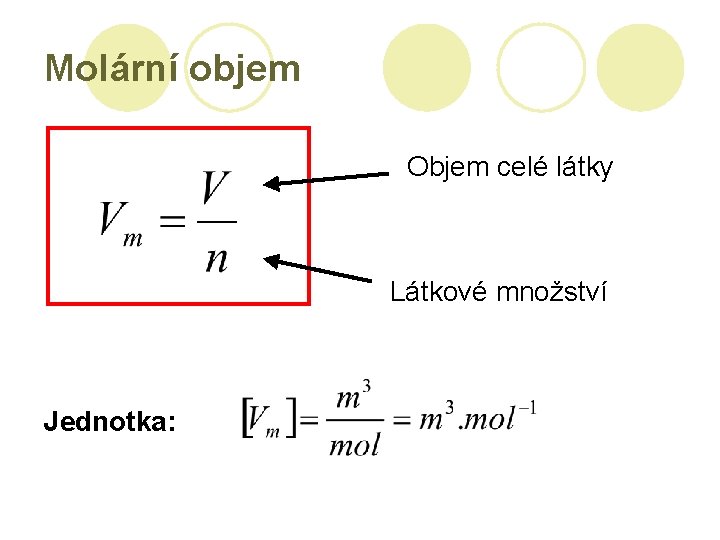
Molární objem Objem celé látky Látkové množství Jednotka:

Příklad l Vzorek vodíku obsahuje 36. 1023 molekul H 2. Jaké je jeho látkové množství?

Příklad l V nádobě je 200 molů chlóru Cl 2. Určete jeho hmotnost.

Příklad l Kolik atomů obsahuje destička ze stříbra Ag o hmotnosti 100 gramů?

Příklad l V nádobě o objemu 3, 54 m 3 je 5 kg kyslíku O 2. Jaký je jeho molární objem?
![Literatura l 1 BEDNAŘÍK Milan KUNZOVÁ Vlasta SVOBODA Emanuel Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-48.jpg)
Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory SOU. Praha: Státní pedagogické nakladatelství, n. p. , 1986, ISBN 14 -209 -86. l [2] MIKULČÁK, Jiří a kol. Matematické, fyzikální a chemické tabulky pro střední školy. Praha: Státní pedagogické nakladatelství, n. p. , 1988, ISBN 15 084/87210. l [3] SENTIER, C. . Wikipedia. cz [online]. [cit. 1. 9. 2012]. Dostupný na WWW: <http: //cs. wikipedia. org/wiki/Soubor: Avogadro_Amedeo. j pg>.

Rovnovážný stav, rovnovážný děj

Stavové veličiny l Tělesa mají: různou teplotu, různý tlak, různý objem, různé chemické složení, různé skupenství, … l Říkáme, že mají různé STAVY l STAVOVÉ VELIČINY – určují stav soustavy (p, V, T, …)

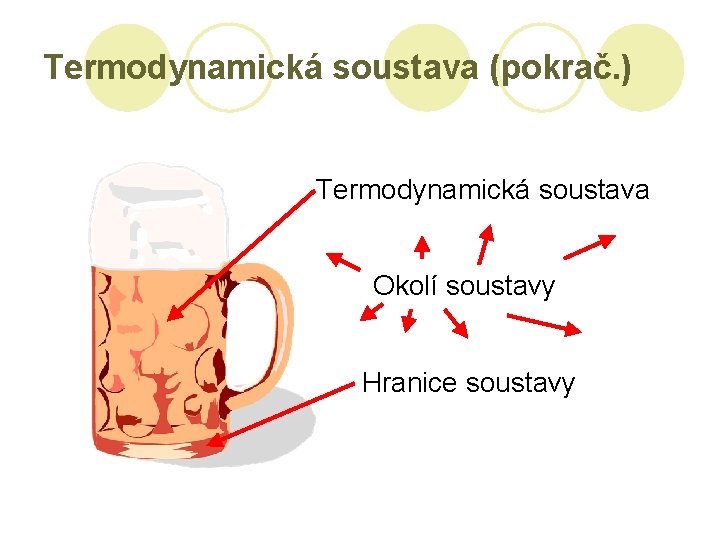
Termodynamická soustava l Termodynamická soustava: skupina těles, jejichž stav zkoumáme; část prostoru a její látková náplň l Okolí soustavy: oblasti, které jsou vně soustavy l Hranice soustavy: oddělují soustavu od okolí

Termodynamická soustava (pokrač. ) Termodynamická soustava Okolí soustavy Hranice soustavy

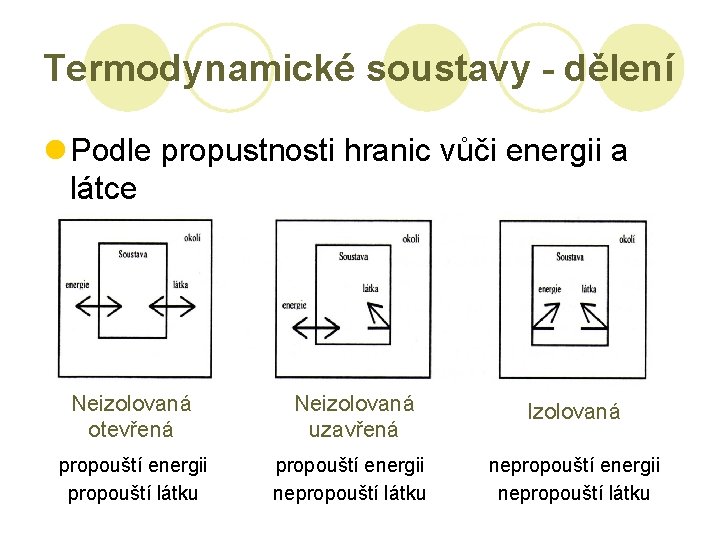
Termodynamické soustavy - dělení l Podle propustnosti hranic vůči energii a látce Neizolovaná otevřená Neizolovaná uzavřená Izolovaná propouští energii propouští látku propouští energii nepropouští látku nepropouští energii nepropouští látku

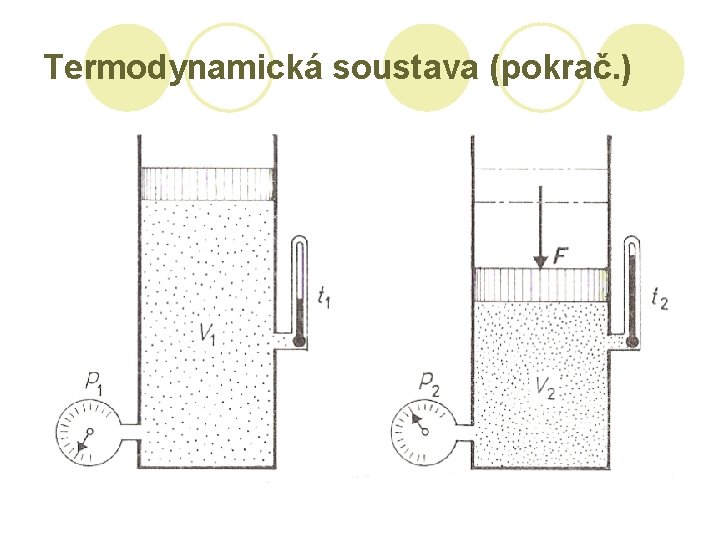
Termodynamická soustava (pokrač. ) l Při vzájemném působení soustavy a jejího okolí se mění stav soustavy l Například: chladne čaj v hrnku

Termodynamická soustava (pokrač. )

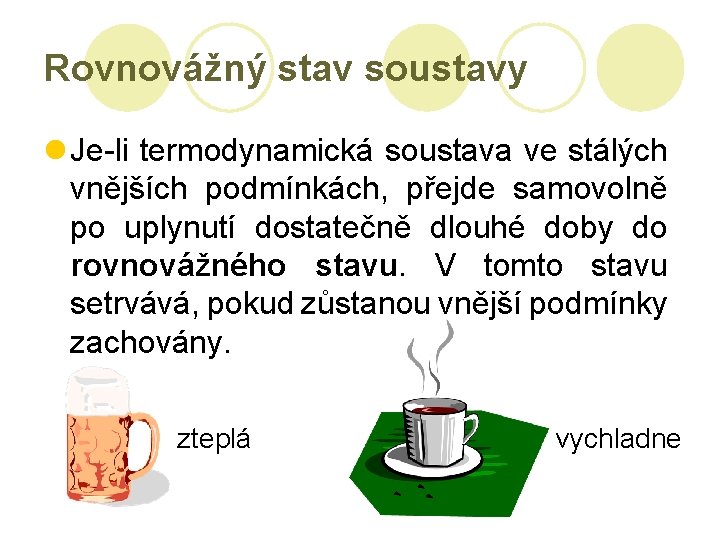
Rovnovážný stav soustavy l Je-li termodynamická soustava ve stálých vnějších podmínkách, přejde samovolně po uplynutí dostatečně dlouhé doby do rovnovážného stavu. V tomto stavu setrvává, pokud zůstanou vnější podmínky zachovány. zteplá vychladne

Rovnovážný děj l Soustava prochází řadou na sebe navazujících rovnovážných stavů. l Je to model; reálné děje se více či méně blíží l Přibližně: pokud jde o děje, které probíhají velmi pomalu. l Například: chlazení skloviny, chlazení oceli při výrobě, …, teplající půllitr, …

Vratný a nevratný děj l Vratný děj: při zpětném ději projde všemi rovnovážnými stavy, jako při přímém ději, ale v opačném pořadí l Příklad: pomalé stlačování plynu a jeho pomalé rozpínání l Nevratný děj: opak vratného děje l Příklad: rozpouštění kostky cukru (žádným rozumným způsobem se znovu neutvoří.

Úloha l Mějme náš teplající půllitr. Jde o děj rovnovážný? Je vratný nebo nevratný? Pokud teplá pomalu, lze to považovat za děj rovnovážný. Pokud ho opětovně ochladíme, z hlediska teploty to je děj vratný. Striktně z hlediska chemie a mikrobiologie ne. Střídání teplot obecně potravinám nesvědčí.
![Literatura l 1 BEDNAŘÍK Milan KUNZOVÁ Vlasta SVOBODA Emanuel Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-60.jpg)
Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory SOU. Praha: Státní pedagogické nakladatelství, n. p. , 1986, ISBN 14 -209 -86. l [2] Kliparty od firmy Zoner Software, a. s. l [3] EVA, Münsterová; EVA, Molliková. Základy termodynamiky, kinetiky a difuze [online]. [cit. 28. 9. 2012]. Dostupný na WWW: <ime. fme. vutbr. cz/files/vyuka/BUM/04 -BUM. ppt>.

Vnitřní energie soustavy a její změny

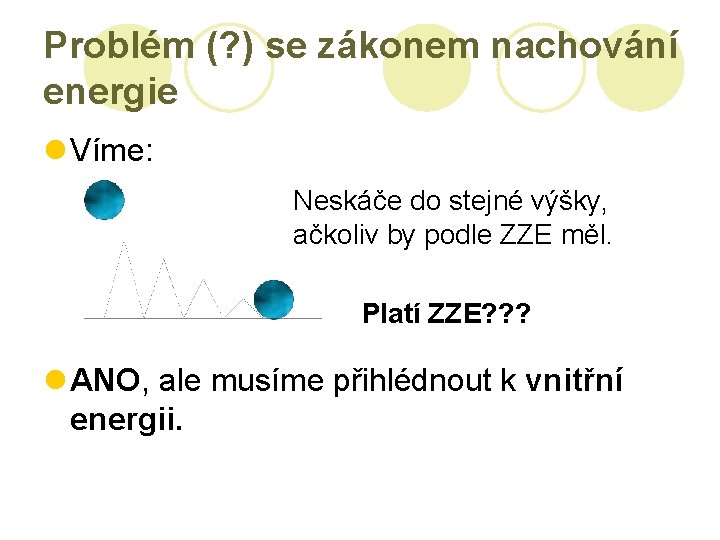
Problém (? ) se zákonem nachování energie l Víme: Neskáče do stejné výšky, ačkoliv by podle ZZE měl. Platí ZZE? ? ? l ANO, ale musíme přihlédnout k vnitřní energii.

Složky vnitřní energie l Celková kinetická energie pohybujících se částic l Celková potenciální energie částic (je dána vzájemným silovým působením) l Kinetická a potenciální energie kmitajících atomů uvnitř molekul l Energie elektronů a jaderná energie l Poznámka: pro nás důležité první dvě

Definice vnitřní energie soustavy l Vnitřní energií soustavy nazveme součet celkové kinetické energie neuspořádaně se pohybujících částic (atomů, molekul, iontů) a celkové potenciální energie vzájemné polohy těchto částic. l Označení vnitřní energie: U

Změny vnitřní energie l Konáním práce – například při tření, mletí, ohýbání drátu, stlačení plynu v izolované nádobě, … l Pokus: třete o sebe ruce. Co cítíte? l Vysvětlení: částice na styčných plochách se více rozkmitají a předají část energie dalším částicím

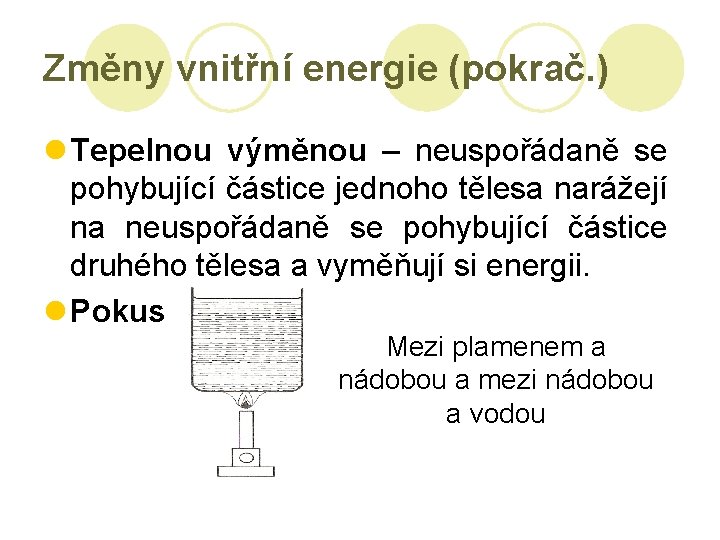
Změny vnitřní energie (pokrač. ) l Tepelnou výměnou – neuspořádaně se pohybující částice jednoho tělesa narážejí na neuspořádaně se pohybující částice druhého tělesa a vyměňují si energii. l Pokus: Mezi plamenem a nádobou a mezi nádobou a vodou

Zobecněný zákon zachování energie l Při dějích probíhajících v izolované soustavě zůstává součet kinetické, potenciální a vnitřní energie konstantní.

Změna vnitřní energie jako veličina l U 1 – vnitřní energie na počátku děje l U 2 – vnitřní energie na konci děje Změna vnitřní energie

Veličina teplo l Teplo: l Jednotka: Joule … J l Například: Q=10 J l Při nárůstu vnitřní energie těleso přijímá teplo. l Při poklesu vnitřní energie těleso odevzdává teplo.

ZZE při tepelné výměně l Při tepelné výměně platí ZZE l Příklad: Studené těleso vložíme do teplé vody. Mezi vodou a tělesem dojde k tepelné výměně. l ΔU 1 – změna energie pro vodu; je záporná l ΔU 2 – změna energie pro těleso; kladná ΔU 1=-ΔU 2=Q l Celková energie soustavy zůstává stejná

Příklad l Těleso o hmotnosti 5 kg padá ve vzduchu z výšky 10 m do písku. Vypočtěte změnu vnitřní energie tělesa a písku po dopadu. l Těleso po dopadu „neskáče“ díky měkkému písku a veškerá jeho původní energie se změní na vnitřní energii.
![Literatura l 1 BEDNAŘÍK Milan KUNZOVÁ Vlasta SVOBODA Emanuel Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-72.jpg)
Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory SOU. Praha: Státní pedagogické nakladatelství, n. p. , 1986, ISBN 14 -209 -86. l [2] Obrázek míčku Archiv autora

První termodynamický zákon

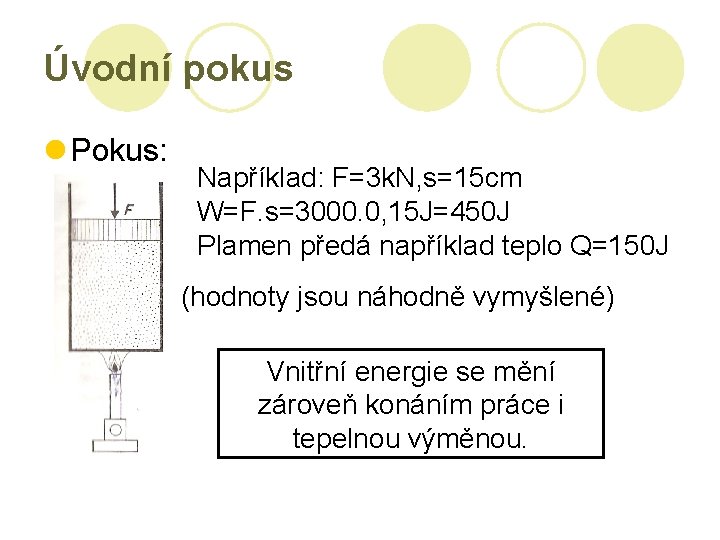
Úvodní pokus l Pokus: Například: F=3 k. N, s=15 cm W=F. s=3000. 0, 15 J=450 J Plamen předá například teplo Q=150 J (hodnoty jsou náhodně vymyšlené) Vnitřní energie se mění zároveň konáním práce i tepelnou výměnou.

1. termodynamický. zákon (pokrač. ) Přírůstek vnitřní energie soustavy je roven součtu práce vykonané vnějšími silami a tepla, které okolí odevzdá soustavě. • W – práce, kterou vykonají okolní tělesa • Q – teplo, které okolí dodá do soustavy

Pozor na znaménka!!! l Soustava konáním práce vnějšími silami přijímá energii … W>0 l Soustava sama vykonává práci (k čemu jinému by nám byl motor? ), tedy odevzdává energii … W<0 l Soustava tepelnou výměnou přijímá energii … Q>0 l Soustava dodává energii do okolí … Q<0

Jiné znění 1. termodynam. zákona l Úpravou získáme: l Provedeme přeznačení: -W=W‘ l Význam W‘: práce vykonaná soustavou na okolí l A tedy: l Teplo Q dodané soustavě se rovná součtu přírůstku její vnitřní energie a práce, kterou soustava vykoná.

… jinými slovy l Teplo (tedy energie) dodané soustavě se částečně spotřebuje na přírůstek její vnitřní energie (tedy na její zahřátí) a částečně na práci, kterou soustava vykoná. l Motor – dodáme energii z paliva; motor se ohřeje a vykoná práci.

Jiné znění 1. termodynamického z. l Není možné sestrojit zařízení, které by vykonávalo práci bez změny své vnitřní energie nebo energie okolí. l Perpetuum mobile 1. druhu.

Příklad l Plyn uzavřený v nádobě s pohyblivým pístem vykonal práci 4 k. J. Jak se změnila jeho vnitřní energie, neproběhla-li tepelná výměna? Jak se projeví tato změna vnitřní energie u plynu? l Poklesne o 4 k. J. Poklesne teplota a tlak.

Příklad l Plyn uzavřený v nádobě s neměnným objemem přijal teplo 10 MJ. Jak se změní jeho vnitřní energie? Jak se projeví tato změna u plynu? Stálý objem, tedy nic se nikam nepohybuje, tedy nulová práce!!!
![Literatura l 1 BEDNAŘÍK Milan KUNZOVÁ Vlasta SVOBODA Emanuel Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-82.jpg)
Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory SOU. Praha: Státní pedagogické nakladatelství, n. p. , 1986, ISBN 14 -209 -86.

Tepelná rovnováha, teplota

Úvodní úvaha l Dvě tělesa dáme do vzájemného styku. l Mohou nastat dvě možnosti: 1. Nedojde k tepelné výměně tělesa jsou ve vzájemné tepelné rovnováze; mají stejnou teplotu 2. Dojde k tepelné výměně; trvá do tepelné rovnováhy; na počátku různé teploty těles

Tepelná výměna (pokračování) l Tělesu s počáteční vyšší teplotou poklesla vnitřní energie U l Tělesu s počáteční nižší teplotou se vnitřní energie zvýšila.

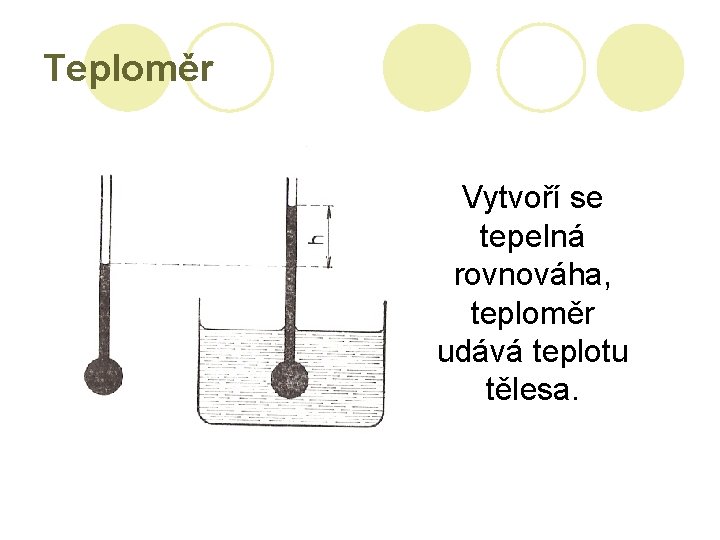
Teploměr Vytvoří se tepelná rovnováha, teploměr udává teplotu tělesa.

Stupnice obecně l Chci měřit – potřebuji stupnici l Stupnice – stanovím nulu a velikost dílku l Toto platí obecně, nejen pro stupnice pro měření teploty.

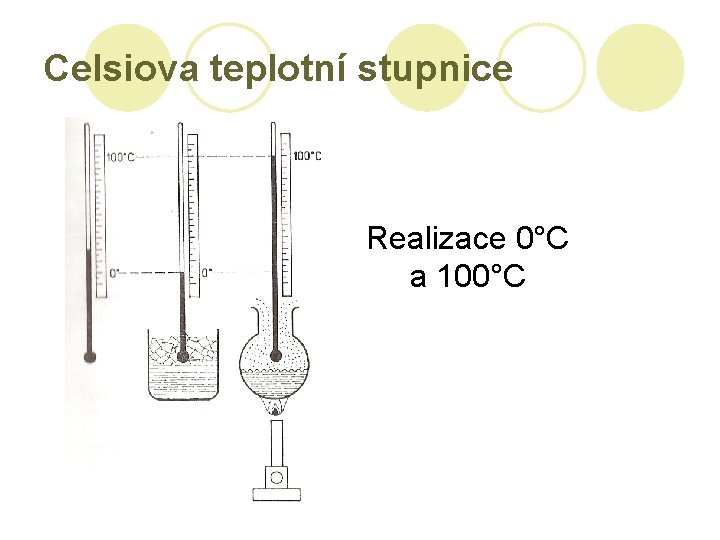
Celsiova teplotní stupnice (1742) l 0°C – rovnovážný stav mezi vodou a ledem za normálního tlaku (což je 1, 01325. 105 Pa) l 100°C – rovnovážný stav vody a její syté páry za normálního tlaku l Vydělíme 100 a máme velikost jednoho stupně Celsia

Celsiova teplotní stupnice Realizace 0°C a 100°C

Anders Celsius (1701 -1744) l Švédský astronom a fyzik

Zajímavosti l Původní Celsiova stupnice byla navržena obráceně (tedy 100°C pro tání ledu a 0°C pro var vody) l Do dnešní podoby: Carl Linné (1745) l Existovala i starší teplotní stupnice – Réaumurova stupnice (1730); již se nepoužívá

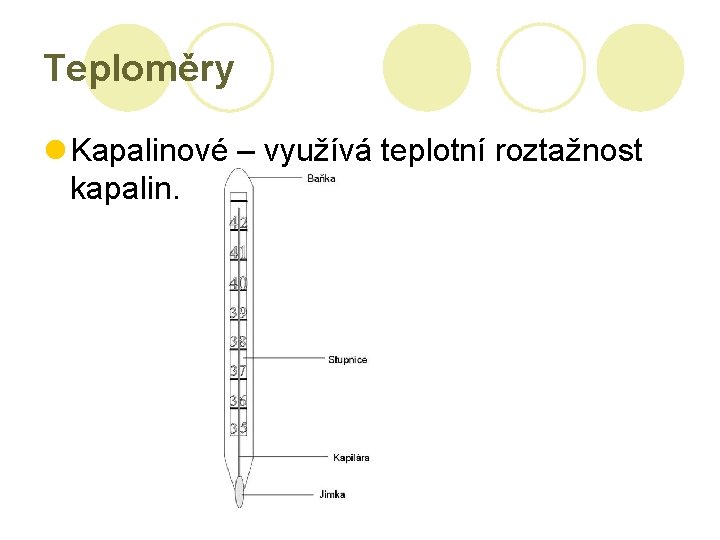
Teploměry l Kapalinové – využívá teplotní roztažnost kapalin.

Kapalinové teploměry (pokračování) l Rtuťový: -39°C až 357°C l Lihový: -114°C až 78°C l Další kapaliny pro měření vyšších i nižších teplot

Teploměry (pokračování) l Odporové teploměry – elektrický odpor se mění s teplotou l Pyrometr – dvě tělesa zahřátá na stejnou teplotu vydávají záření téže barvy l Bimetalový teploměr – využívá rozdílné teplotní roztažnosti různých kovů l Termočlánky l…
![Literatura l 1 ARENIUS Olof Wikipedia cz online cit 10 9 2012 Dostupný na Literatura l [1] ARENIUS, Olof. Wikipedia. cz [online]. [cit. 10. 9. 2012]. Dostupný na](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-95.jpg)
Literatura l [1] ARENIUS, Olof. Wikipedia. cz [online]. [cit. 10. 9. 2012]. Dostupný na WWW: <http: //cs. wikipedia. org/wiki/Soubor: Anders-Celsius. Head. jpg>. l [2] MIČUDA, Pavel. Wikipedia. cz [online]. [cit. 10. 9. 2012]. Dostupný na WWW: <http: //cs. wikipedia. org/wiki/Soubor: Teplomer. jpg>. l [3] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory SOU. Praha: Státní pedagogické nakladatelství, n. p. , 1986, ISBN 14 -209 -86.

Termodynamická teplota

Zavedení termodynamické teploty l Má jen jednu základní teplotu l Tr – rovnovážný stav soustavy led + voda + sytá vodní pára (tzv. trojný bod vody) l Tr=273, 16 K l Kelvin – jedna ze základních jednotek SI l Je definována jako 273, 16 díl termodynamické teploty trojného bodu vody

Porovnání Celsiovy a Kelvinovy teplotní stupnice Je posunutá 0, ale velikost dílku je stejná.

Příklad l Vyjádřete teploty 200 K a 855, 5 K ve °C a teploty -5°C a 30°C v kelvinech.

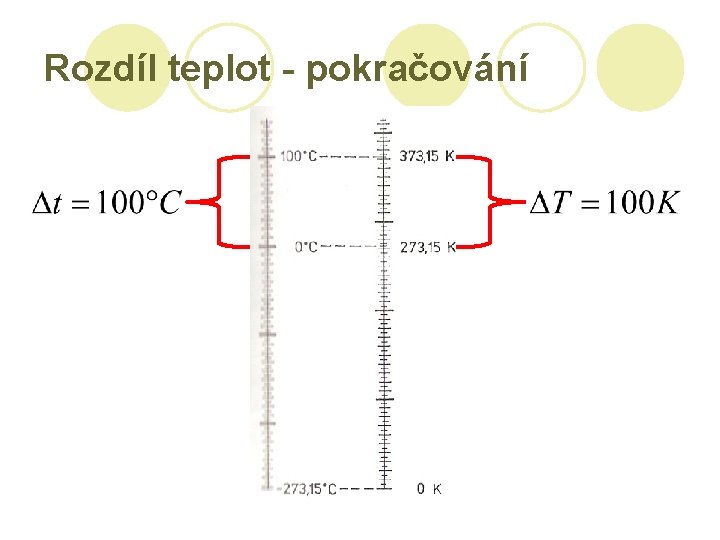
Vyjádření rozdílu teplot l Víme: velikost dílku je na obou stupnicích stejná.

Rozdíl teplot - pokračování

Absolutní nula l Lze se přiblížit jisté minimální teplotě l T=0 K (t=-273, 15°C), ale ne ji dosáhnout (zjednodušeně řečený 3. termodynamický zákon) l Nejnižší dosažená teplota (zatím): T=450 p. K=450. 10 -12 K l Kolem absolutní nuly získávají látky zajímavé vlastnosti – supravodivost, supratekutost, …

Příklad l Čím se liší zápisy T=100 K a T=100 K? Vyjádřete oba zápisy také ve °C. l T=100 K … konkrétní teplota l T=100 K … rozdíl teplot, ne konkrétní teplota l 100 K=(100 -273, 15)°C=-173, 15°C l t=100°C
![Literatura l 1 BEDNAŘÍK Milan KUNZOVÁ Vlasta SVOBODA Emanuel Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-104.jpg)
Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory SOU. Praha: Státní pedagogické nakladatelství, n. p. , 1986, ISBN 14 -209 -86.

Modely struktur látek různých skupenství

Úvodní poznámky l V této kapitole uvedeme jen základní poznatky o skupenstvích látek. l Podrobně budou probírány v samostatných tematických celcích. l Skupenství: ¡Plynné látky ¡Pevné látky ¡Kapalné látky ¡Plazma

Plynné látky l Střední vzdálenost mezi částicemi je výrazně větší, než jejich velikost. l V takové vzdálenosti je přitažlivá síla mezi nimi minimální a lze ji zanedbat. l Ke změně rychlosti (velikosti a směru) dochází díky vzájemným srážkám. l Mezi srážkami rovnoměrný přímočarý pohyb.

Plynné látky - pokračování l Víceatomové molekuly konají posuvný a rotační pohyb. l Atomy uvnitř molekul kmitají. l Díky malým přitažlivým silám je celková potenciální energie molekul daleko menší, než jejich pohybová energie.

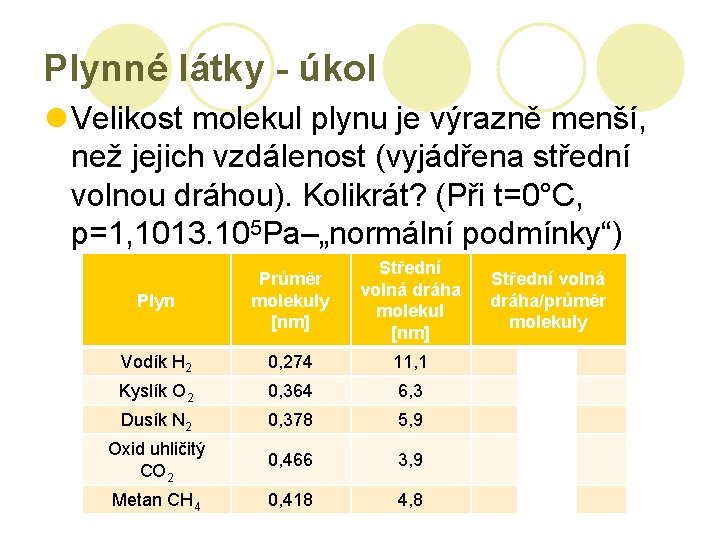
Plynné látky - úkol l Velikost molekul plynu je výrazně menší, než jejich vzdálenost (vyjádřena střední volnou dráhou). Kolikrát? (Při t=0°C, p=1, 1013. 105 Pa–„normální podmínky“) Plyn Průměr molekuly [nm] Střední volná dráha molekul [nm] Střední volná dráha/průměr molekuly Vodík H 2 0, 274 11, 1 40, 5 Kyslík O 2 0, 364 6, 3 17, 3 Dusík N 2 0, 378 5, 9 15, 6 Oxid uhličitý CO 2 0, 466 3, 9 8, 4 Metan CH 4 0, 418 4, 8 11, 5

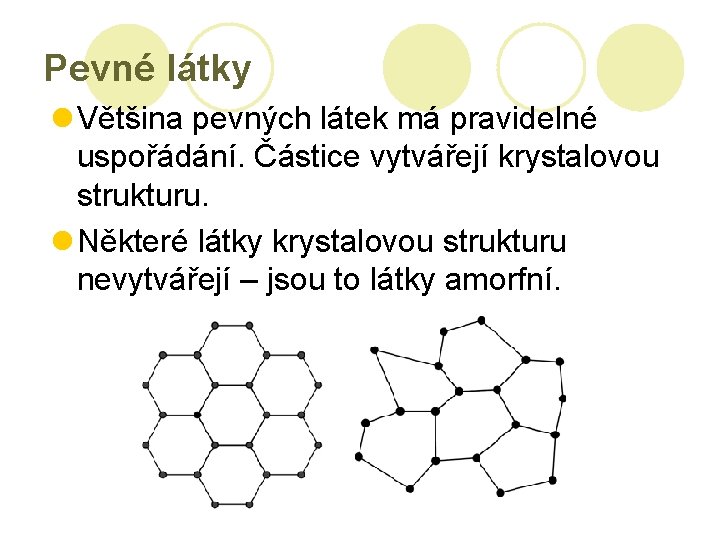
Pevné látky l Většina pevných látek má pravidelné uspořádání. Částice vytvářejí krystalovou strukturu. l Některé látky krystalovou strukturu nevytvářejí – jsou to látky amorfní.

Pevné látky - pokračování l Střední vzdálenost částic: 0, 2 nm až 0, 3 nm. l Kolem svých rovnovážných poloh konají kmitavé neuspořádané pohyby. l Celková potenciální energie daná vzájemným silovým působením je větší, než celková kinetická energie, která je dána nepravidelným kmitavým pohybem.

Kapalné látky l Molekuly kapalin jsou méně pohyblivé, než molekuly v plynu. l Jsou poutány přitažlivými silami. l Střední vzdálenost mezi molekulami je asi 0, 2 nm. l Přitažlivé síly jsou ale slabší, než u pevných látek. l Každá molekula kmitá kolem své rovnovážné polohy.

Kapalné látky - pokračování l Rovnovážná poloha molekul se v čase mění. l Rychlost změny rovnovážné polohy závisí na teplotě. Při vyšší teplotě je rychlejší. l Celková potenciální energie molekul je srovnatelná s jejich celkovou kinetickou energií.

Plazma l Někdy se bere jako čtvrté skupenství látky. l Je to soustava elektricky nabitých částic (elektronů, iontů) a neutrálních částic. l V podstatě jde o ionizovaný plyn. l Soubor částic je navenek celkově neutrální. l Při vysokých teplotách (např. 108 K) je plazma složeno jen z volných jader a elektronů.

Plazma - pokračování l Srážky částic nejsou náhlé, jako v plynu, ale plynulé (díky elektrickým silám). l Přírodní plazma: plamen, blesk, polární záře. l Umělé plazma: například při elektrických výbojích v plynech.

Plazma - obrázky Polární záře Blesk

Úkol l Vysvětlete rozdíl v hustotě mezi pevnými látkami a kapalinami na jedné straně a plyny na druhé straně z hlediska molekulové fyziky. l V kapalinách a v pevných látkách jsou molekuly daleko blíž u sebe, takže se jich do daného objemu vejde podstatně víc.

Úkol l Proč se kapalina při přelévání nerozpadne na jednotlivé molekuly, kdežto plyn ano? l Mezi molekulami plynu lze zanedbat přitažlivé síly. Molekuly plynu téměř nic nedrží pohromadě. V kapalinách jsou přitažlivé síly mezi molekulami významné a kapalinu pohromadě udrží.
![Literatura l 1 BEDNAŘÍK Milan KUNZOVÁ Vlasta SVOBODA Emanuel Fyzika II pro studijní obory Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-119.jpg)
Literatura l [1] BEDNAŘÍK, Milan; KUNZOVÁ, Vlasta; SVOBODA, Emanuel. Fyzika II pro studijní obory SOU. Praha: Státní pedagogické nakladatelství, n. p. , 1986, ISBN 14 -209 -86. l [2] MIKULČÁK, Jiří a kol. Matematické, fyzikální a chemické tabulky pro střední školy. Praha: Státní pedagogické nakladatelství, n. p. , 1988, ISBN 15 084/87210. l [3] AUTOR NEUVEDEN. Techmania. cz [online]. [cit. 29. 9. 2012]. Dostupný na WWW: <http: //www. techmania. cz/edutorium/art_exponaty. php? x kat=fyzika&xser=537472756 b 74757261206 ce 174656 bh &key=592>.
![Literatura pokračování l 4 MADAU Mircea Wikipedia cz online cit 29 9 2012 Literatura - pokračování l [4] MADAU, Mircea. Wikipedia. cz [online]. [cit. 29. 9. 2012].](https://slidetodoc.com/presentation_image_h/d6c2f543c776cfe6a4b976e8be002ccd/image-120.jpg)
Literatura - pokračování l [4] MADAU, Mircea. Wikipedia. cz [online]. [cit. 29. 9. 2012]. Dostupný na WWW: <http: //cs. wikipedia. org/wiki/Soubor: Lightning_over_Orad ea_Romania_cropped. jpg>. l [5] AUTOR NEUVEDEN. Wikipedia. cz [online]. [cit. 29. 9. 2012]. Dostupný na WWW: <http: //cs. wikipedia. org/wiki/Soubor: Polarlicht_2. jpg>.
 Didaktika fyziky
Didaktika fyziky Katedra fyziky chemie a odborného vzdělávání
Katedra fyziky chemie a odborného vzdělávání Obory fyziky
Obory fyziky Historie fyziky
Historie fyziky Sgp kim
Sgp kim Doc. phdr. stanislav matulay, phd
Doc. phdr. stanislav matulay, phd Stanislav szabo
Stanislav szabo Stanislav szabo
Stanislav szabo Stanislav kokoška
Stanislav kokoška Basic perinatal matrices
Basic perinatal matrices Cirrocus
Cirrocus Stanislav michek
Stanislav michek Petra kurajica
Petra kurajica Stanislav hofman
Stanislav hofman Hidrojenin özellikleri
Hidrojenin özellikleri Que son los crackers
Que son los crackers Past continuous slides
Past continuous slides Google scholar
Google scholar Causative make
Causative make Bear to or ing
Bear to or ing Ing pääte
Ing pääte Verbs of emotion + gerund form (-ing)
Verbs of emotion + gerund form (-ing) Do gerunds always end in ing
Do gerunds always end in ing Ing words
Ing words Colegio ing armando i santacruz
Colegio ing armando i santacruz Ing
Ing Past simple חוקים
Past simple חוקים Verb + object + gerund
Verb + object + gerund Swat strategic planning
Swat strategic planning Novell
Novell Ing openers
Ing openers Change present progressive
Change present progressive Skratky titulov
Skratky titulov Pupuh gambuh ing serat wulangreh kedadeyan saka pada
Pupuh gambuh ing serat wulangreh kedadeyan saka pada Finance ing
Finance ing Ing preguntas frecuentes
Ing preguntas frecuentes Nikola škarić
Nikola škarić B ing
B ing Emma ing ofsted
Emma ing ofsted Present progressive חוקים
Present progressive חוקים Diplom ing
Diplom ing Opener words for sentences
Opener words for sentences Present perfect
Present perfect Ing curs
Ing curs Ing. marek pavlík
Ing. marek pavlík Sue
Sue Regret gerund infinitive
Regret gerund infinitive Verb + infinitive or ing
Verb + infinitive or ing Toma liliana
Toma liliana Xxx discounts
Xxx discounts Interested in gerund or infinitive
Interested in gerund or infinitive Infinitive of purpose
Infinitive of purpose Mildrex
Mildrex Ing maroc
Ing maroc Ing. marcela pavlová
Ing. marcela pavlová Ing direct toledo
Ing direct toledo Past simple van go
Past simple van go Fronted adverbials ispace
Fronted adverbials ispace Eur ing vs ceng
Eur ing vs ceng Procesador de consultas base de datos
Procesador de consultas base de datos Complete the sentences below use ing verb forms
Complete the sentences below use ing verb forms Ketewajuhan
Ketewajuhan Ing pt
Ing pt Ing
Ing Verkleinwoord van kas
Verkleinwoord van kas Remember to or ing
Remember to or ing Verbs followed by ing
Verbs followed by ing Inglog
Inglog Was were verb ing
Was were verb ing Skočdopole petr ing
Skočdopole petr ing Mag.ing.agr
Mag.ing.agr Om-ing
Om-ing Ing
Ing 1 complete the sentences
1 complete the sentences Palmovke
Palmovke Ngoko lugu gadhah
Ngoko lugu gadhah Identifying gerunds and gerund phrases
Identifying gerunds and gerund phrases Tembang
Tembang The infinitive verb
The infinitive verb Ing direct avila
Ing direct avila Bacc ing opt
Bacc ing opt Perfect participle phrase
Perfect participle phrase Njaluk kawigaten
Njaluk kawigaten Mag ing mech
Mag ing mech Hlavní části soustruhu
Hlavní části soustruhu Ing edith hernandez
Ing edith hernandez Present simple
Present simple Apa bae wujude pawarta cetak
Apa bae wujude pawarta cetak Iso 18065
Iso 18065 Kestopreesens englanti
Kestopreesens englanti Plk. ing. jan krejčí, mba
Plk. ing. jan krejčí, mba Haring ibon
Haring ibon Presente continuo de happen
Presente continuo de happen Gerund ing form
Gerund ing form Has been ing tense
Has been ing tense Formulario portabilidad ing
Formulario portabilidad ing Henrik van bruggen ing
Henrik van bruggen ing Ing marek pavlik phd
Ing marek pavlik phd Simon andrews ing
Simon andrews ing Geotecnia 2 ing unlp
Geotecnia 2 ing unlp Ilc ing
Ilc ing Instituto juan de padilla torrijos
Instituto juan de padilla torrijos Ing direct guy
Ing direct guy Mag.ing.agr
Mag.ing.agr Sat nav discounts
Sat nav discounts Cra ing
Cra ing Adjectives and infinitives
Adjectives and infinitives Stop present progressive
Stop present progressive Verbs followed by ing or infinitive
Verbs followed by ing or infinitive Ing marek pavlik
Ing marek pavlik Spotpa
Spotpa Mag sanit ing
Mag sanit ing Jinising wayang kang digawe saka kayu yaiku
Jinising wayang kang digawe saka kayu yaiku Add -s or -es to the verbs
Add -s or -es to the verbs Testinging
Testinging Kang ora kalebu dasanamane tembung pranatacara yaiku …
Kang ora kalebu dasanamane tembung pranatacara yaiku … Be + ing present
Be + ing present Hot ing
Hot ing Go con ing
Go con ing Wanneer gerund of infinitive
Wanneer gerund of infinitive Infinitive forms
Infinitive forms