Valitutti Tifi Gentile La chimica della Natura Zanichelli




































































- Slides: 74

Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 1

7. La chimica dell’acqua

7. 1 La molecola dell’acqua è polare

L’acqua e la Terra • 1 • L’acqua è la sostanza che più caratterizza il nostro Pianeta tra tutti quelli del Sistema Solare. • Dalle sue proprietà fisiche e chimiche dipendono moltissimi fenomeni naturali. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 4

L’acqua e la Terra • 2 • Ad esempio, i fenomeni meteorologici, l’erosione delle rocce, tutti i fenomeni che interessano gli esseri viventi… • Per comprendere le sue incredibili proprietà analizziamo anzitutto le caratteristiche della sua molecola. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 5

Molecole polari e apolari • 1 I legami O-H sono covalenti polari. Infatti, l’ossigeno attira fortemente gli elettroni di legame, spostando la loro carica negativa su di sé, mentre sugli atomi di idrogeno si accumula una parziale carica positiva. La distribuzione asimmetrica della carica elettrica rende la molecola polare. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 6

Molecole polari e apolari • 2 La polarità di una molecola dipende sia dalla presenza di legami covalenti polari sia dalla geometria della molecola. Ad esempio CO 2 è apolare perché i due dipoli, nella struttura lineare, si annullano a vicenda. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 7

Molecole polari e apolari • 3 Il CHCl 3 (cloroformio) risulta polare per la diversa polarità dei legami C-H e C-Cl. Nella struttura tetraedrica di CCl 4 invece i dipoli si annullano. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 8

7. 2 Tra molecole d’acqua si forma il legame a idrogeno

Il legame a idrogeno • 1 • L’acqua allo stato di vapore è costituita da molecole tutte uguali. • Immaginiamo di avvicinare sempre di più fra loro queste molecole. Come si orienteranno una rispetto all’altra? Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 10

Il legame a idrogeno • 2 • La presenza di cariche parziali positive sugli atomi H e negative sugli atomi O fa orientare le molecole in modo che siano più efficaci le attrazioni elettrostatiche. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 11

Il legame a idrogeno • 3 • Quando le molecole di acqua sono sufficientemente vicine tra esse si forma un legame a idrogeno, un particolare esempio di legame intermolecolare. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 12

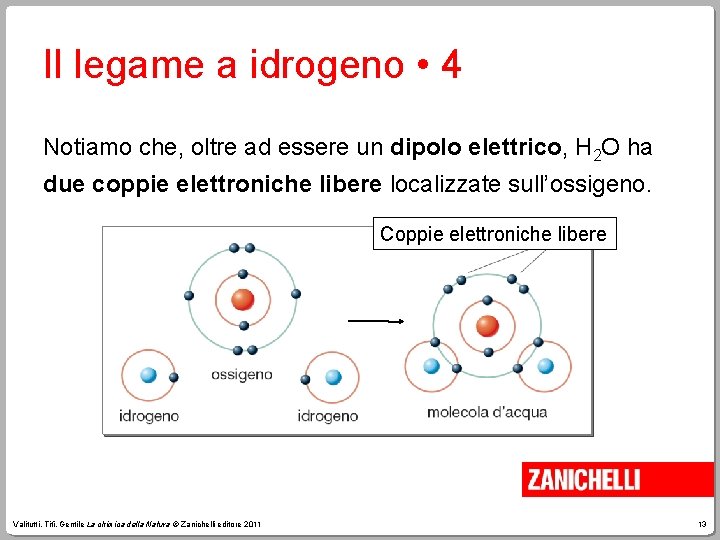
Il legame a idrogeno • 4 Notiamo che, oltre ad essere un dipolo elettrico, H 2 O ha due coppie elettroniche libere localizzate sull’ossigeno. Coppie elettroniche libere Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 13

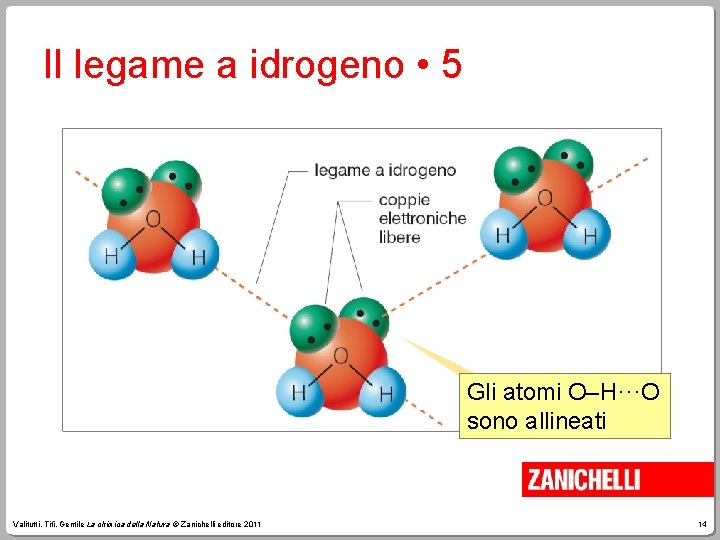
Il legame a idrogeno • 5 Gli atomi O–H···O sono allineati Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 14

Il legame a idrogeno • 6 • Nel legame a idrogeno gli atomi O–H···O devono essere allineati. • Le molecole legate da legami a idrogeno sono costrette a orientarsi e distanziarsi per rispettare la geometria del legame. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 15

Il legame a idrogeno • 7 • La stragrande maggioranza delle proprietà dell’acqua deriva dalla sua polarità e dalla presenza del legame a idrogeno. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 16

Il legame a idrogeno • 8 • Il legame a idrogeno esiste anche per altre molecole, in cui H è legato ad un non metallo di dimensioni piccole che attrae fortemente gli elettroni di legame e con una coppia elettronica libera (N, O, F). Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 17

7. 3 L’acqua ha un comportamento peculiare: proprietà fisiche

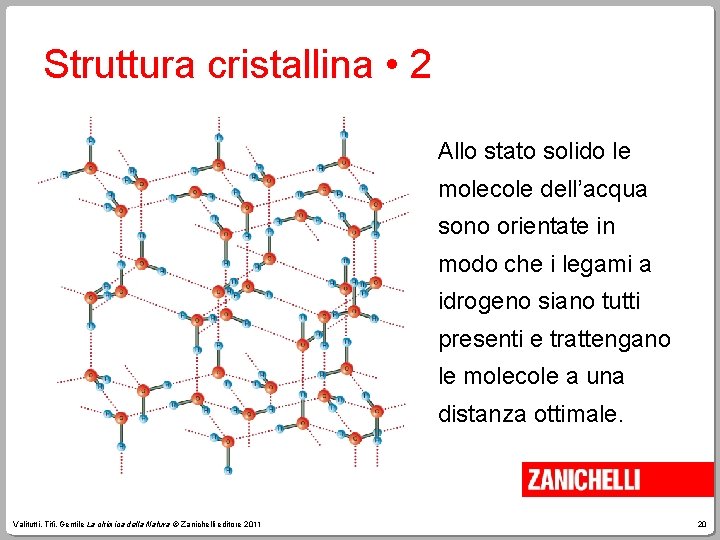
Struttura cristallina • 1 • Allo stato solido le molecole occupano posizioni geometriche molto precise, in un’impalcatura tridimensionale stabile chiamata reticolo cristallino. Autore, Autore. Titolo © Zanichelli editore 2009 19

Struttura cristallina • 2 Allo stato solido le molecole dell’acqua sono orientate in modo che i legami a idrogeno siano tutti presenti e trattengano le molecole a una distanza ottimale. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 20

Stato liquido • 1 • Nello stato liquido la disposizione delle molecole è disordinata, quasi come nel vapore, le molecole hanno elevata mobilità e si scambiano di posto frequentemente. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 21

Stato liquido • 2 • Nel liquido, come nel solido, il numero di molecole per unità di volume è molto elevato (liquidi e solidi sono considerati pressoché incomprimibili). • Il numero di legami idrogeno è però molto minore che nel solido. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 22

Acqua liquida e ghiaccio • 1 • La formazione di legami a idrogeno comporta un allontanamento delle molecole d’acqua passando allo stato solido. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 23

Acqua liquida e ghiaccio • 2 • A differenza di quanto avviene per la maggior parte dei materiali, la densità dell’acqua solida (ghiaccio) è quindi minore di quella dell’acqua liquida. • La massima densità dell’acqua è a 4°C. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 24

Acqua liquida e ghiaccio • 3 Questo fenomeno è di incredibile importanza per la vita. È possibile vivere negli oceani sotto la calotta polare, e negli abissi oceanici la temperatura rimane sempre superiore a 0°C. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 25

Acqua liquida e vapore • Per passare allo stato aeriforme si devono spezzare tutti i legami a idrogeno. Questo avviene a una temperatura molto elevata (100°C), quando le molecole hanno sufficiente energia cinetica. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 26

Calore specifico • 1 L’acqua è liquida tra 0° e 100°C, un intervallo di temperatura molto grande. Infatti la superficie del globo terrestre è occupata per più di due terzi da oceani, e la maggior parte dei fenomeni chimici naturali avviene in ambiente acquoso. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 27

Calore specifico • 2 • Per raggiungere la temperatura di 100 °C l’acqua deve assorbire un’elevata quantità di calore. • 1 kg d’acqua per aumentare di un grado la sua temperatura deve assorbire 1 kilocaloria (4, 184 J). Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 28

Calore specifico • 3 Il calore specifico è la quantità di energia che deve assorbire (o cedere) 1 kg di materiale per aumentare (o diminuire) di 1 K la sua temperatura. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 29

Calore specifico • 4 • Mettiamo un pentolino d’acqua sul fuoco. Dopo alcuni secondi: – Se tocchiamo il metallo ci bruciamo: il metallo ha un basso calore specifico (conduce il calore); – L’acqua, è ancora fredda: l’acqua ha un elevato calore specifico (è un isolante termico). Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 30

Calore specifico • 5 • Dall’elevato calore specifico dell’acqua deriva l’azione mitigatrice dei climi delle località costiere o lacustri, e parte della stabilità termica degli organismi viventi. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 31

Tensione di vapore • 1 • I liquidi passano allo stato di vapore attraverso l’evaporazione e l’ebollizione. • L’evaporazione può avvenire a qualsiasi temperatura e interessa solo la superficie del liquido. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 32

Tensione di vapore • 2 • Le particelle del liquido non hanno tutte la stessa energia e velocità. Quelle con energia cinetica superiore alla media, se si trovano vicine alla superficie, possono sfuggire dal liquido. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 33

Tensione di vapore • 3 La tensione di vapore è la grandezza che esprime la tendenza delle molecole di un liquido a passare allo stato aeriforme. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 34

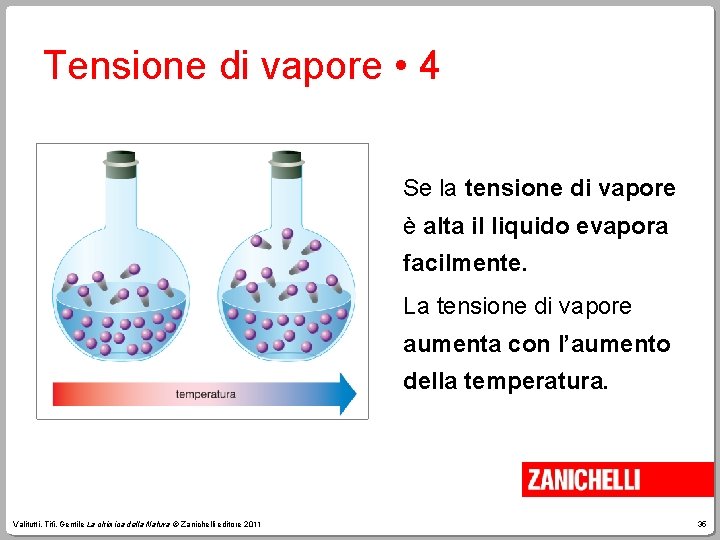
Tensione di vapore • 4 Se la tensione di vapore è alta il liquido evapora facilmente. La tensione di vapore aumenta con l’aumento della temperatura. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 35

Tensione di vapore • 5 I liquidi caratterizzati da forze intermolecolari più deboli (come l’etere) hanno un’elevata tensione di vapore e sono detti volatili. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 36

Tensione di vapore • 6 • Nell’acqua i legami a idrogeno determinano una tensione di vapore particolarmente bassa, cioè una scarsa volatilità. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 37

Tensione di vapore • 7 Quando la tensione di vapore uguaglia la pressione esterna, il liquido giunge all’ebollizione. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 38

Tensione di vapore • 8 • L’acqua bolle a 100 °C a 1 atm, ma può bollire a temperature più basse (come in alta montagna) o più alte (come in una pentola a pressione). Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 39

Tensione superficiale • 1 La tensione superficiale fa sì che l’acqua si comporti come una pellicola, e che le gocce d’acqua siano sferiche. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 40

Tensione superficiale • 2 Le forze attrattive che agiscono sulle molecole di superficie non sono bilanciate: ciascuna molecola di superficie risente di una forza che la attira verso l’interno e, per questo motivo, la superficie tende a contrarsi. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 41

Tensione superficiale • 3 La tensione superficiale è la tendenza delle molecole della superficie a lasciarsi attrarre verso l’interno. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 42

Tensione superficiale • 4 • A causa della tensione superficiale il liquido tende ad assumere la forma che gli permette di avere la minore area superficiale (la forma sferica). Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 43

Tensione superficiale • 5 • La superficie del liquido si comporta come una specie di pellicola che cerca di contenere il volume interno opponendosi al suo aumento. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 44

Tensione superficiale • 6 • La tensione superficiale diminuisce all’aumentare della temperatura. • I tensioattivi contenuti nei detersivi riducono moltissimo la tensione superficiale dell’acqua. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 45

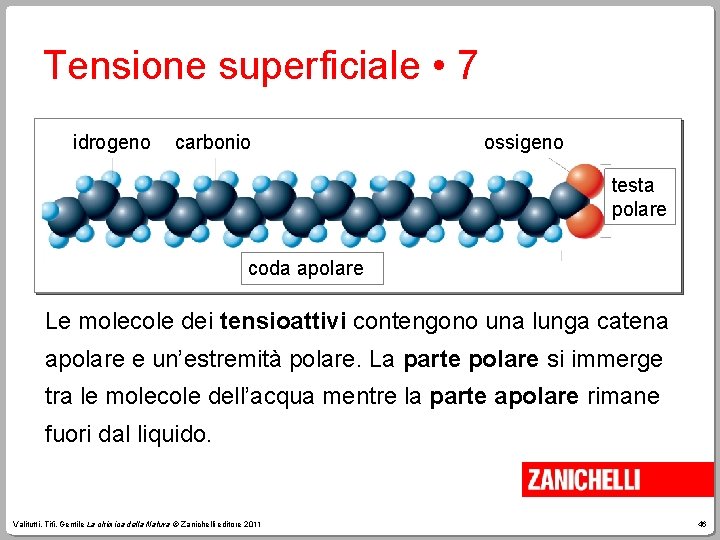
Tensione superficiale • 7 idrogeno carbonio ossigeno testa polare coda apolare Le molecole dei tensioattivi contengono una lunga catena apolare e un’estremità polare. La parte polare si immerge tra le molecole dell’acqua mentre la parte apolare rimane fuori dal liquido. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 46

Tensione superficiale • 8 • I tensioattivi riducono la tensione superficiale tanto che l’aria può essere incorporata nel liquido e formare una schiuma. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 47

Tensione superficiale • 9 • Inoltre, minuscole goccioline oleose possono essere disperse nell’acqua e formare un’emulsione, permettendo il lavaggio. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 48

Capillarità • 1 • Se immergiamo un tubicino di vetro (capillare) in acqua, essa penetra nel tubicino e raggiunge un’altezza tanto più alta quanto più è stretto il tubicino. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 49

Capillarità • 2 • Questo fenomeno, chiamato capillarità, sembra un paradosso perché contravviene al principio di Archimede dei vasi comunicanti. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 50

Capillarità • 3 • La capillarità è dovuta alle proprietà chimiche e fisiche dell’acqua: – coesione, cioè attrazione reciproca tra le molecole d’acqua attraverso il legame a idrogeno; – adesione, cioè affinità chimica delle molecole d’acqua per il vetro, dovuta alla loro polarità. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 51

Capillarità • 4 • Le molecole di acqua a contatto con il vetro vi aderiscono e tendono a salire lungo il capillare bagnandolo. • Le molecole all’interno sono coese tra loro e tendono a resistere alla risalita. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 52

Capillarità • 5 • La contrapposizione di queste forze fa sì che la superficie del liquido prenda una forma emisferica, detta menisco. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 53

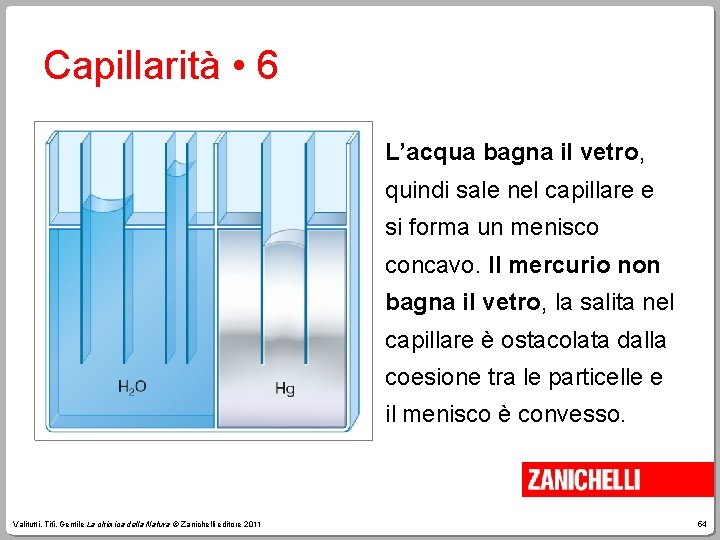
Capillarità • 6 L’acqua bagna il vetro, quindi sale nel capillare e si forma un menisco concavo. Il mercurio non bagna il vetro, la salita nel capillare è ostacolata dalla coesione tra le particelle e il menisco è convesso. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 54

7. 4 L’acqua ha un comportamento peculiare: proprietà chimiche

Soluzioni acquose • 1 Molte sostanze tendono spontaneamente a miscelarsi con l’acqua. La teina e la catechina sono sostanze che si liberano dalle foglie di tè messe in infusione in acqua calda, formando una soluzione acquosa. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 56

Soluzioni acquose • 2 • Perché si formi una soluzione (cioè un miscuglio omogeneo), si devono rompere i legami tra le particelle di soluto e molti dei legami tra le particelle di solvente. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 57

Soluzioni acquose • 3 • Al loro posto si formano legami tra le particelle del soluto e del solvente. • L’acqua è in grado di solubilizzare sostanze ioniche (come Na. Cl) e sostanze polari (come HCl e gli zuccheri). Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 58

Soluzioni acquose • 4 Tramite gli atomi O H 2 O solvata Na+ L’azione delle molecole di acqua sui composti ionici indebolisce i legami ionici. Nella maggioranza dei casi gli ioni del composto vengono liberati, in un processo detto dissociazione. Tramite gli atomi H H 2 O solvata Cl- Autore, Autore. Titolo © Zanichelli editore 2009 59

Soluzioni acquose • 5 Autore, Autore. Titolo © Zanichelli editore 2009 60

Soluzioni acquose • 6 • Analogamente, quando le molecole di H 2 O interagiscono con sostanze polari come HCl riescono a rompere i legami covalenti polari formando ioni idrati, in un processo detto ionizzazione. Autore, Autore. Titolo © Zanichelli editore 2009 61

Soluzioni acquose • 7 • Gli ioni idrati che si formano dalla ionizzazione o dalla dissociazione sono circondati da molecole di acqua orientate in modo da massimizzare le interazioni elettrostatiche attrattive. Autore, Autore. Titolo © Zanichelli editore 2009 62

Soluzioni acquose • 8 • Le soluzioni in cui sono presenti ioni come soluti conducono la corrente elettrica e sono dette soluzioni elettrolitiche. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 63

Soluzioni acquose • 9 Le sostanze in grado di liberare ioni in soluzione vengono dette elettroliti. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 64

Soluzioni acquose • 10 • Il saccarosio si solubilizza perché le molecole di H 2 O instaurano legami a idrogeno con i gruppi OH delle molecole di saccarosio. Il reticolo cristallino del saccarosio si sfalda ma non si formano ioni. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 65

Soluzioni acquose • 11 • L’olio non viene solubilizzato dall’acqua. Le molecole apolari dell’olio non possono attirare le molecole di H 2 O che continuano ad attirarsi tra di loro. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 66

Il simile scioglie il simile • I solventi polari (acqua, alcol, acetone) solubilizzano molecole polari (saccarosio o glicerina). • I solventi apolari (benzina, CCl 4, cherosene) solubilizzano molecole apolari (naftalina, olio). Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 67

Solventi Sostanze chimiche utilizzate come solventi Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 68

Acidi e basi • 1 • Gli elettroliti che in acqua liberano ioni H+ sono detti acidi, quelli che liberano ioni OH- sono detti basi. • Gli ioni H+ in acqua si trovano in realtà come H 3 O+. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 69

Acidi e basi • 2 • OH- è detto ione idrossido. • H 3 O+ è detto ione idronio. • Nell’acqua pura c’è una uguale quantità di ioni H 3 O+ e di ioni OH-. • Una soluzione con uguali quantità di H 3 O+ e di OH- è detta neutra. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 70

Acidi e basi • 3 • Sciogliendo in acqua un acido si ottiene una soluzione acida, in cui la concentrazione di H 3 O+ è maggiore di quella di OH-. Esempi sono il succo di limone e l’aceto. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 71

Acidi e basi • 4 • Sciogliendo in acqua una base si ottiene una soluzione basica, in cui la concentrazione di OH- è maggiore di quella di H 3 O+. Esempi sono l’ammoniaca, il bicarbonato e molti detersivi. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 72

Acidi e basi • 5 L’indicatore universale diventa rosso nelle soluzioni acide, blu in quelle basiche, giallo-verde in quelle neutre. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 73

Acidi e basi • 6 • Il grado di acidità di una soluzione si indica con la scala del p. H, che va da 0 a 14: – se p. H=7 la soluzione è neutra, – se p. H<7 la soluzione è acida, – se p. H>7 la soluzione è basica. Valitutti, Tifi, Gentile La chimica della Natura © Zanichelli editore 2011 74
 La doppia natura della luce zanichelli
La doppia natura della luce zanichelli Valitutti zanichelli
Valitutti zanichelli Soluzioni il racconto della chimica
Soluzioni il racconto della chimica Tifi
Tifi Qorin tifi va paratif
Qorin tifi va paratif Serie di bowen
Serie di bowen Soluzioni il racconto della chimica e della terra
Soluzioni il racconto della chimica e della terra Soluzioni il racconto della chimica
Soluzioni il racconto della chimica Simonetta klein il racconto della chimica
Simonetta klein il racconto della chimica Il racconto della chimica e della terra soluzioni
Il racconto della chimica e della terra soluzioni Moti millenari della terra zanichelli
Moti millenari della terra zanichelli Il racconto della chimica e della terra 2 esercizi svolti
Il racconto della chimica e della terra 2 esercizi svolti Prove della sfericità della terra zanichelli
Prove della sfericità della terra zanichelli Viviamo porfirio mio
Viviamo porfirio mio Atomo di bohr
Atomo di bohr I 5 regni degli esseri viventi
I 5 regni degli esseri viventi Capitolo 14 chimica zanichelli soluzioni
Capitolo 14 chimica zanichelli soluzioni Soluzioni capitolo 14 zanichelli chimica
Soluzioni capitolo 14 zanichelli chimica Chimica piu capitolo 10 soluzioni
Chimica piu capitolo 10 soluzioni Resa effettiva chimica
Resa effettiva chimica Chimica più soluzioni capitolo 17
Chimica più soluzioni capitolo 17 Barriere postzigotiche
Barriere postzigotiche Chimica zanichelli soluzioni capitolo 16
Chimica zanichelli soluzioni capitolo 16 Soluzioni chimica piu capitolo 22
Soluzioni chimica piu capitolo 22 Capitolo 11 chimica zanichelli
Capitolo 11 chimica zanichelli Soluzioni lineamenti di chimica
Soluzioni lineamenti di chimica Zanichelli chimica soluzioni capitolo 6
Zanichelli chimica soluzioni capitolo 6 Soluzioni capitolo 19
Soluzioni capitolo 19 Soluzioni chimica zanichelli capitolo 6
Soluzioni chimica zanichelli capitolo 6 Le soluzioni zanichelli
Le soluzioni zanichelli Soluzioni chimica capitolo 12
Soluzioni chimica capitolo 12 Soluzioni chimica più zanichelli capitolo 8
Soluzioni chimica più zanichelli capitolo 8 Pila daniell zanichelli
Pila daniell zanichelli Dalle soluzioni all'elettrochimica soluzioni capitolo 16
Dalle soluzioni all'elettrochimica soluzioni capitolo 16 Soluzioni chimica zanichelli capitolo 10
Soluzioni chimica zanichelli capitolo 10 Valitutti soluzioni capitolo 18
Valitutti soluzioni capitolo 18 Scopriamo la biologia zanichelli
Scopriamo la biologia zanichelli Soluzioni capitolo 11 zanichelli chimica
Soluzioni capitolo 11 zanichelli chimica Valitutti esploriamo soluzioni
Valitutti esploriamo soluzioni Posca chimica più soluzioni
Posca chimica più soluzioni Il sistema endocrino zanichelli
Il sistema endocrino zanichelli Capitolo 10 chimica zanichelli
Capitolo 10 chimica zanichelli Laura gentile
Laura gentile Breughl
Breughl Dina gentile
Dina gentile Andorre gentilé
Andorre gentilé Riforma gentile schema
Riforma gentile schema Gentile da fabriano adorazione dei magi analisi
Gentile da fabriano adorazione dei magi analisi Gentile ettore serra
Gentile ettore serra Chi è questa che ven ch ogn om la mira
Chi è questa che ven ch ogn om la mira Tim gentile
Tim gentile Krysten gentile sap
Krysten gentile sap Riforma gentile 1923
Riforma gentile 1923 Simonetta gentile
Simonetta gentile Thomas c gentile
Thomas c gentile Gianfranco gentile
Gianfranco gentile Riforma gentile schema
Riforma gentile schema Kemahiran tertutup dan terbuka
Kemahiran tertutup dan terbuka Giuseppe valitutti
Giuseppe valitutti Acidi e basi si scambiano protoni
Acidi e basi si scambiano protoni Valitutti soluzioni capitolo 11
Valitutti soluzioni capitolo 11 La nuova chimica di rippa
La nuova chimica di rippa Giuseppe valitutti
Giuseppe valitutti Giuseppe valitutti
Giuseppe valitutti Valitutti soluzioni capitolo 18
Valitutti soluzioni capitolo 18 Marco falasca
Marco falasca Giuseppe valitutti
Giuseppe valitutti Giuseppe valitutti
Giuseppe valitutti Potenziali standard di riduzione
Potenziali standard di riduzione Legge proust
Legge proust Leggi ponderali mappa concettuale
Leggi ponderali mappa concettuale Zonazione chimica
Zonazione chimica Coefficiente di van't hoff
Coefficiente di van't hoff Cv voltammetry
Cv voltammetry Reazioni chimiche esempi
Reazioni chimiche esempi





























































































