Valitutti Tifi Gentile Esploriamo la chimica Zanichelli editore























- Slides: 26

Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 1

Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento

Capitolo 5 La quantità chimica: la mole 1. La massa atomica e la massa molecolare 2. Contare per moli 3. Formule chimiche e composizione percentuale Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 3

1. La massa atomica e la massa molecolare Dalton compilò la prima tabella delle masse atomiche degli elementi conosciuti, prendendo come riferimento l’atomo di idrogeno: la massa così espressa è detta massa atomica relativa. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 4

1. La massa atomica e la massa molecolare Le masse atomiche proposte da Dalton risultarono errate nella maggior parte dei casi perché Dalton partiva dal presupposto che la molecola d’acqua avesse formula HO, cioè che l’ossigeno fosse otto volte più pesante dell’idrogeno. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 5

1. La massa atomica e la massa molecolare Fu grazie alla distinzione fra atomi e molecole proposta da Stanislao Canizzaro (in base agli studi già compiuti nel 1811 da Amedeo Avogadro) che si arrivò alla corretta determinazione della massa degli atomi. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 6

1. La massa atomica e la massa molecolare Canizzaro utilizzò il principio di Avogadro per correggere le masse atomiche relative conosciute e propose un metodo per misurarle che aveva origine dalla densità dei gas. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 7

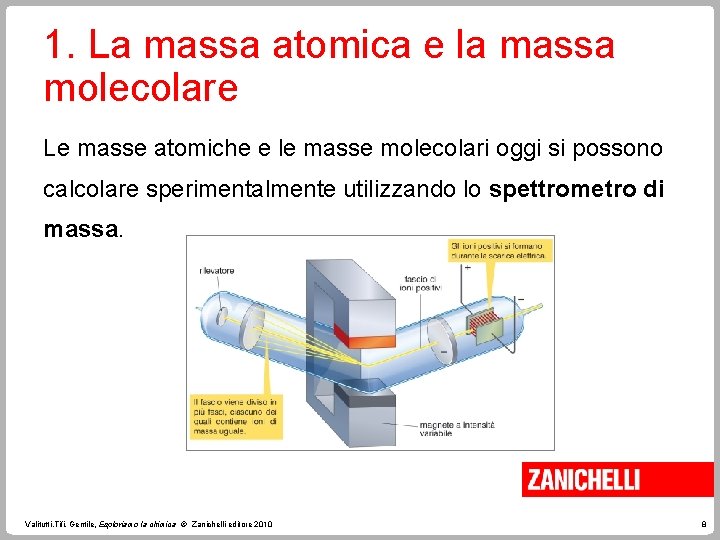
1. La massa atomica e la massa molecolare Le masse atomiche e le masse molecolari oggi si possono calcolare sperimentalmente utilizzando lo spettrometro di massa. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 8

1. La massa atomica e la massa molecolare La massa atomica di un elemento è la massa relativa rispetto all’ atomo di 12 C. L’unità di massa atomica (u o dalton) è uguale a 1/12 della massa dell’atomo 12 C. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 9

1. La massa atomica e la massa molecolare La massa atomica relativa, MA, di un elemento è la sua massa espressa in unità u, quindi relativamente alla massa dell’atomo di carbonio. La tavola periodica riporta per ogni elemento il valore della massa atomica, chiamata anche peso atomico. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 10

1. La massa atomica e la massa molecolare La massa molecolare relativa, MM o peso molecolare, è la somma delle masse atomiche compaiono nella molecola. Per i composti ionici la massa molecolare relativa si calcola allo stesso modo ma prende il nome di peso formula. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 11

2. Contare per moli Il valore dell’unità di massa atomica, 1 u = 1, 661 10 -24 g, è estremamente piccolo per essere misurato con gli strumenti a noi conosciuti. È stato perciò necessario trovare una grandezza che mettesse in relazione gli atomi e le molecole con le grandezze misurabili con le bilance. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 12

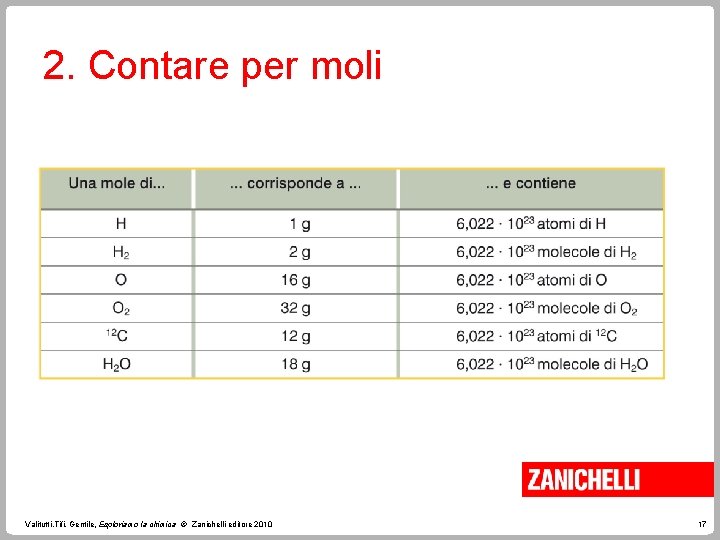
2. Contare per moli Questa grandezza è la mole (mol). Una mole è la quantità di sostanza che contiene un numero di particelle elementari uguali al numero di atomi contenuti in 12 g di 12 C. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 13

2. Contare per moli La massa di una mole di un elemento (o di una molecola) è uguale alla sua massa atomica (o molecolare) espressa in grammi/mole. La massa molare M che si misura in g/mol, è la massa di una mole. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 14

2. Contare per moli Avogadro si pose il problema di quante particelle elementari fossero contenute in una mole e lo risolse tramite il rapporto: massa molare/massa atomica = = 6, 022 1023 particelle/mol Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 15

2. Contare per moli Il risultato del rapporto massa molare/massa atomica = = 6, 022 1023 particelle/mol è noto come numero o costante di Avogadro. Una mole di sostanza contiene sempre 6, 022 1023 particelle (atomi, molecole o ioni). Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 16

2. Contare per moli Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 17

2. Contare per moli In pratica, per calcolare il numero di moli di una sostanza si usa la formula Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 18

3. Formule chimiche e composizione percentuale Attraverso le formule chimiche esprimono i rapporti di combinazione fra gli atomi componenti è possibile calcolare la percentuale in massa o composizione percentuale di ciascun elemento presente nel composto. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 19

3. Formule chimiche e composizione percentuale La composizione percentuale è utile per determinare la massa effettiva di un elemento presente in una data massa di composto. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 20

3. Formule chimiche e composizione percentuale Con l’analisi qualitativa e quantitativa si calcolano sperimentalmente le percentuali in massa degli elementi, da cui si ricava la formula minima del composto. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 21

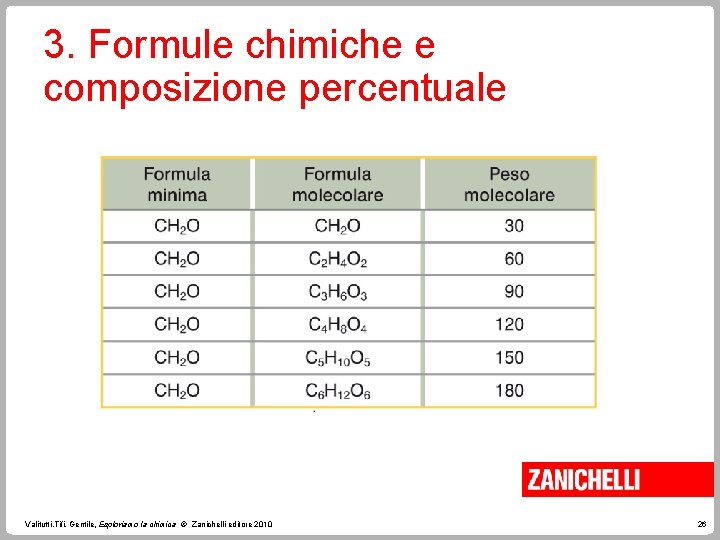
3. Formule chimiche e composizione percentuale La formula minima indica il rapporto di combinazione minimo con cui gli atomi si legano per formare la molecola. La composizione percentuale è utile per determinare la massa effettiva di un elemento presente in una data massa di composto. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 22

3. Formule chimiche e composizione percentuale I passaggi per determinare la formula minima sono i seguenti: • si scrive la massa m in grammi di ciascun elemento presente in 100 g di composto, cioè la sua percentuale in massa; • si calcola il numero di moli n di ciascun elemento; Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 23

3. Formule chimiche e composizione percentuale • si divide il numero di moli di ciascun elemento per il più piccolo numero di moli calcolato: i numeri interi che si ottengono sono gli indici numerici della formula; • si scrivono gli elementi e in basso a destra di ciascuno il rispettivo indice. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 24

3. Formule chimiche e composizione percentuale Per ricavare la formula molecolare di un composto è necessario misurare sperimentalmente anche la sua massa molecolare. La formula molecolare è un multiplo della formula minima. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 25

3. Formule chimiche e composizione percentuale Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 26
 Geometria triangolare planare
Geometria triangolare planare Acidi e basi si scambiano protoni
Acidi e basi si scambiano protoni Zanichelli chimica molecole in movimento soluzioni
Zanichelli chimica molecole in movimento soluzioni Franco lucisano editore
Franco lucisano editore Principio di le chatelier
Principio di le chatelier Toshmali tif
Toshmali tif Tifi
Tifi Soluzioni chimica capitolo 13
Soluzioni chimica capitolo 13 Soluzioni cap 11 chimica
Soluzioni cap 11 chimica Soluzioni capitolo 19 zanichelli chimica
Soluzioni capitolo 19 zanichelli chimica Soluzioni chimica zanichelli capitolo 6
Soluzioni chimica zanichelli capitolo 6 Scopriamo la biologia zanichelli
Scopriamo la biologia zanichelli Il sistema endocrino zanichelli
Il sistema endocrino zanichelli Peso atomico
Peso atomico Elettrolisi acqua
Elettrolisi acqua Legge azione reazione
Legge azione reazione Soluzioni capitolo 10
Soluzioni capitolo 10 Barriere prezigotiche
Barriere prezigotiche Soluzioni chimica capitolo 18
Soluzioni chimica capitolo 18 Dissociazione chimica
Dissociazione chimica Zanichelli soluzioni chimica capitolo 16
Zanichelli soluzioni chimica capitolo 16 Posca chimica soluzioni
Posca chimica soluzioni Soluzioni capitolo 6 zanichelli chimica più
Soluzioni capitolo 6 zanichelli chimica più Stati condensati della materia
Stati condensati della materia Proprietà colligative zanichelli
Proprietà colligative zanichelli Soluzioni capitolo 14 zanichelli chimica
Soluzioni capitolo 14 zanichelli chimica Osmolarità
Osmolarità














































