Valitutti Tifi Gentile Esploriamo la chimica Zanichelli editore


































- Slides: 39

Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 1

Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento

Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3. La legge di Boyle 4. La legge di Charles 5. La legge di Gay-Lussac 6. Le reazioni tra i gas e il principio di Avogadro Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 3

Capitolo 6 Le leggi dei gas 7. Quanto pesano un atomo e una molecola? 8. Il volume molare dei gas 9. L’equazione di stato dei gas ideali 10. Le miscele gassose Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 4

1. I gas ideali e la teoria cineticomolecolare Nel 1630 fu usato per la prima volta il termine gas: Van Helmont che lo inventò, pensava però che non fosse possibile contenere un gas in un recipiente, perché aveva una natura e una composizione diversa dai liquidi e dai solidi. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 5

1. I gas ideali e la teoria cineticomolecolare Il primo scienziato a raccogliere una sostanza aeriforme fu Robert Boyle. Egli teorizzò che l’aria fosse costituita da microscopici corpuscoli in movimento capaci di legarsi tra loro per formare aggregati macroscopici. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 6

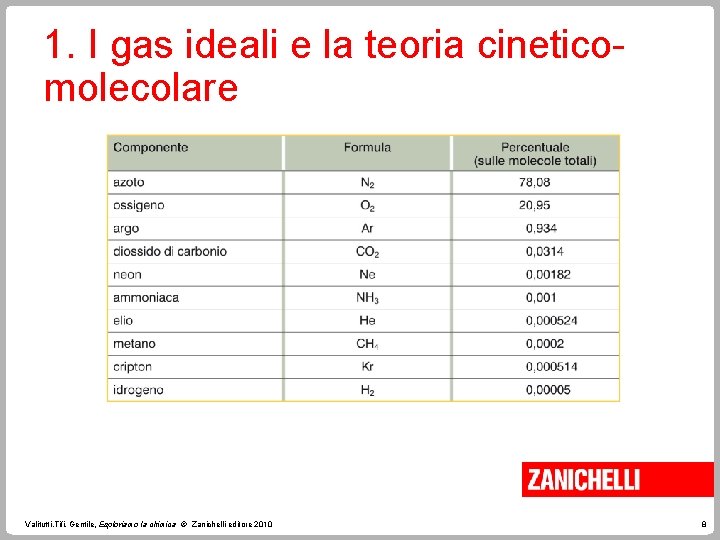
1. I gas ideali e la teoria cineticomolecolare Nonostante per molti secoli si sia creduto che l’aria fosse una sostanza elementare, essa è in realtà una miscela di gas composta prevalentemente da ossigeno e azoto e da altri numerosi componenti. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 7

1. I gas ideali e la teoria cineticomolecolare Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 8

1. I gas ideali e la teoria cineticomolecolare I gas dal punto di vista macroscopico hanno tutti lo stesso comportamento, che tuttavia risulta sensibile alle variazioni di temperatura e pressione. La teoria cinetico-molecolare ne spiega la natura sulla base del modello dei gas ideali o perfetti. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 9

1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l’energia cinetica media delle particelle è proporzionale alla temperatura assoluta; 2. non si attraggono reciprocamente; 3. sono puntiformi e il loro volume è trascurabile; 4. si muovono a grande velocità in tutte le direzioni con un movimento disordinato. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 10

1. I gas ideali e la teoria cineticomolecolare Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 11

2. La pressione del gas I gas non hanno forma propria, ma occupano quella del recipiente che li contiene: le particelle, quando sono lontane le une dalle altre, non risentono delle forze attrattive. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 12

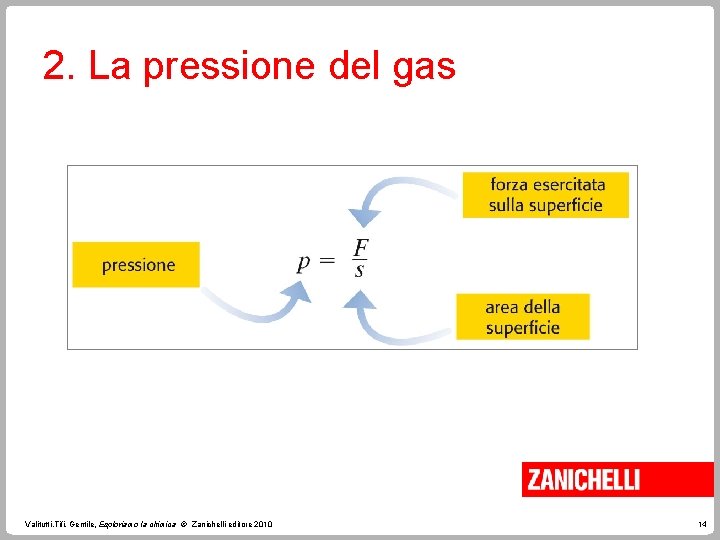
2. La pressione del gas In generale, la pressione p è data dal rapporto tra la forza F, che agisce perpendicolarmente a una superficie, e l’area s della superficie stessa. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 13

2. La pressione del gas Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 14

2. La pressione del gas La pressione è una grandezza intensiva. L'unità di misura della pressione nel Sistema Internazionale è il pascal (Pa), pari a un newton (N) per metro quadrato (m 2). 1 Pa = 1 N / m 2 Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 15

2. La pressione del gas Nel 1644 Torricelli costruì un dispositivo per misurare la pressione atmosferica: il primo barometro a mercurio. Prese un lungo tubo di vetro, chiuso ad una estremità, lo riempì di mercurio e lo capovolse. A livello del mare, il livello del mercurio nel tubo si abbassava ad un’altezza di 760 mm. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 16

2. La pressione del gas Il livello raggiunto dal mercurio fornisce la misura della pressione atmosferica esercitata sulla superficie del mercurio nella bacinella, espressa in millimetri di mercurio (mm. Hg). Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 17

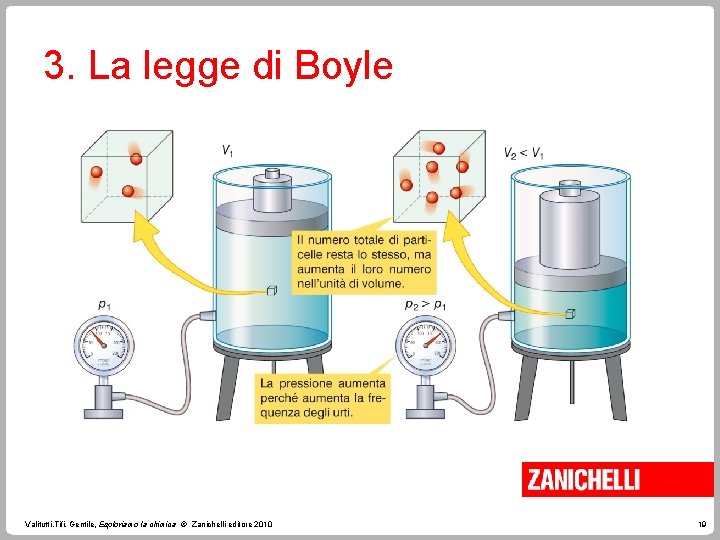
3. La legge di Boyle Sperimentalmente, Boyle ha dimostrato che, a temperatura costante, la pressione di una data quantità di gas è inversamente proporzionale al suo volume. p V = k con T costante. Questa è la legge di Boyle. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 18

3. La legge di Boyle Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 19

4. La legge di Charles dimostrò sperimentalmente che, a pressione costante, il volume di una data quantità di gas è direttamente proporzionale alla sua temperatura assoluta. V/T = k con T temperatura assoluta e p costante Questa è la legge di Charles. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 20

4. La legge di Charles Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 21

4. La legge di Charles – 273, 15 °C è lo zero assoluto (0 K), ovvero la temperatura alla quale il volume dei gas si annulla. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 22

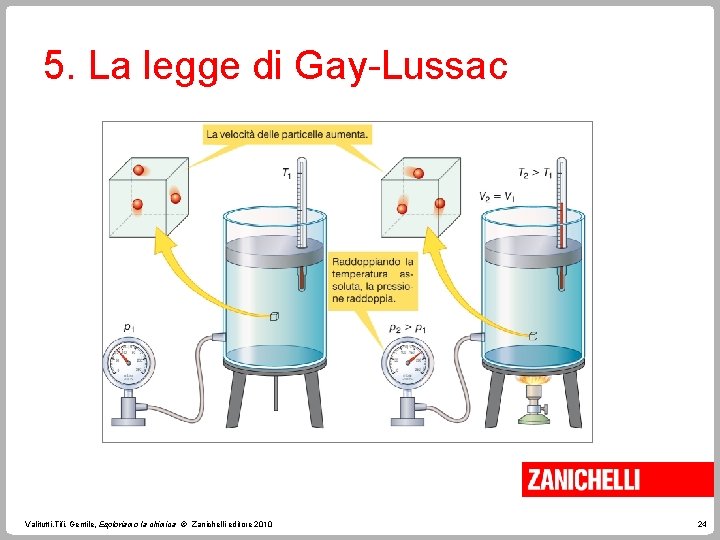
5. La legge di Gay-Lussac Sperimentalmente Gay-Lussac ha dimostrato che, a volume costante, la pressione di una data quantità di gas è direttamente proporzionale alla sua temperatura assoluta. p/T = k con V costante. Questa è la legge di Gay-Lussac. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 23

5. La legge di Gay-Lussac Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 24

6. Le reazioni dei gas e il principio di Avogadro Le ricerche condotte da Gay. Lussac sui gas confermarono l’esistenza di rapporti di combinazione ben precisi tra i loro volumi. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 25

6. Le reazioni dei gas e il principio di Avogadro Gay-Lussac arrivò quindi a formulare la legge di combinazione dei volumi. Il rapporto tra i volumi di gas che reagiscono tra loro è espresso da numeri interi e piccoli. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 26

6. Le reazioni dei gas e il principio di Avogadro La legge di combinazione dei volumi di Gay-Lussac e la teoria atomica di Dalton furono messe in relazione dal principio di Avogadro. Volumi uguali di gas diversi, alla stessa pressione e temperatura, contengono lo stesso numero di molecole. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 27

6. Le reazioni dei gas e il principio di Avogadro Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 28

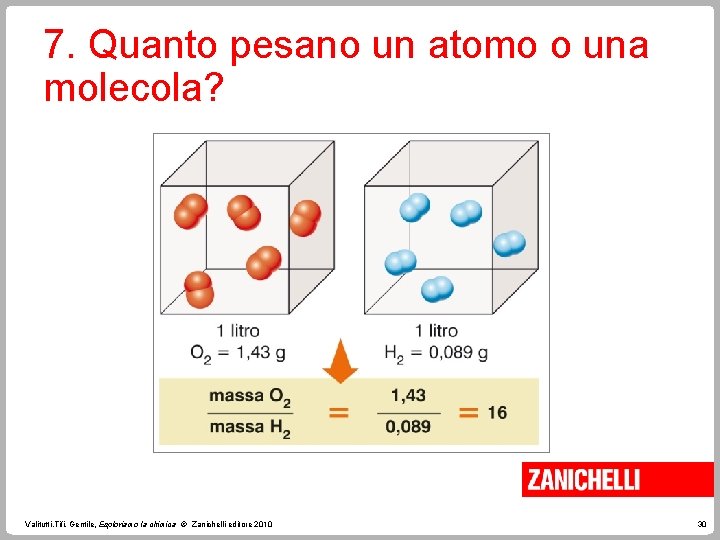
7. Quanto pesano un atomo o una molecola? Sappiamo che, a parità di pressione e temperatura, in un litro di gas ossigeno (O 2) e in un litro di gas idrogeno (H 2) vi è lo stesso numero di molecole. Il rapporto tra la massa dell'ossigeno e la massa dell'idrogeno è pari a 16. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 29

7. Quanto pesano un atomo o una molecola? Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 30

7. Quanto pesano un atomo o una molecola? Da questa relazione possiamo allora dedurre che • le molecole di ossigeno hanno massa maggiore di quelle dell’ idrogeno; • la massa di un atomo di ossigeno è sedici volte la massa di un atomo di idrogeno. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 31

7. Quanto pesano un atomo o una molecola? Il principio di Avogadro può essere formulato matematicamente. A pressione e temperatura costanti, il volume di un gas è direttamente proporzionale al suo numero di molecole. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 32

8. Il volume molare dei gas A STP (0 °C e 1 atm) il volume molare dei gas è 22, 4 L, ovvero una mole di qualsiasi gas occupa 22, 4 L di volume. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 33

9. L’equazione di stato dei gas ideali Le tre leggi dei gas che abbiamo enunciato mettono in evidenza come il comportamento allo stato gassoso dipenda da tre parametri fondamentali • pressione, • temperatura; • volume. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 34

9. L’equazione di stato dei gas ideali Dalla combinazione delle tre leggi si ottiene la legge generale dei gas (p V)/ T = k Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 35

9. L’equazione di stato dei gas ideali Equazione di stato dei gas ideali p V=n R T p = pressione (in atm) V = volume (in L) n = numero di moli T = temperatura assoluta (in K) R = costante universale dei gas = 0, 082 (in L atm mol-1 K-1) Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 36

10. Le miscele gassose La pressione parziale è la pressione esercitata da ciascun gas costituente una miscela, in assenza degli altri. Questa legge è definita legge delle pressioni parziali di Dalton. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 37

10. Le miscele gassose Data una miscela di gas in un recipiente, le particelle di ciascun gas urtano le pareti e producono una pressione identica a quella che generano quando si trovano da sole nel medesimo recipiente. Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 38

10. Le miscele gassose La pressione totale esercitata da una miscela di gas è uguale alla somma delle pressioni parziali dei singoli componenti la miscela (legge di Dalton). Ptotale = p 1 + p 2 + p 3 + … Valitutti, Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010 39
 Geometria triangolare planare
Geometria triangolare planare Acidi e basi si scambiano protoni zanichelli
Acidi e basi si scambiano protoni zanichelli Valitutti esploriamo soluzioni
Valitutti esploriamo soluzioni Franco lucisano editore
Franco lucisano editore Principio di le chatelier
Principio di le chatelier Etiotrop davolash
Etiotrop davolash N
N Soluzioni chimica zanichelli capitolo 6
Soluzioni chimica zanichelli capitolo 6 Osmolarità
Osmolarità Solu zanichelli
Solu zanichelli Chimica più soluzioni capitolo 12
Chimica più soluzioni capitolo 12 Chimica più verde soluzioni
Chimica più verde soluzioni Capitolo 8 chimica piu soluzioni
Capitolo 8 chimica piu soluzioni Soluzioni capitolo 16 le reazioni chimiche
Soluzioni capitolo 16 le reazioni chimiche Chimica più posca fiorani soluzioni
Chimica più posca fiorani soluzioni Soluzioni capitolo 18 zanichelli chimica
Soluzioni capitolo 18 zanichelli chimica Soluzioni capitolo 11 chimica più
Soluzioni capitolo 11 chimica più Soluzioni chimica capitolo 19
Soluzioni chimica capitolo 19 Chimica più verde soluzioni
Chimica più verde soluzioni Scopriamo la biologia zanichelli
Scopriamo la biologia zanichelli Capitolo 21 chimica zanichelli
Capitolo 21 chimica zanichelli Chimica più soluzioni capitolo 8
Chimica più soluzioni capitolo 8 Chimica soluzioni capitolo 14
Chimica soluzioni capitolo 14 Soluzioni chimica più capitolo 10
Soluzioni chimica più capitolo 10 Chimica piu capitolo 10 soluzioni
Chimica piu capitolo 10 soluzioni Leggi ponderali della chimica
Leggi ponderali della chimica Soluzioni chimica più capitolo 17
Soluzioni chimica più capitolo 17 Coefficienti stechiometrici
Coefficienti stechiometrici Barriere prezigotiche
Barriere prezigotiche Chimica zanichelli soluzioni capitolo 16
Chimica zanichelli soluzioni capitolo 16 Scala di mohs zanichelli
Scala di mohs zanichelli Chimica zanichelli soluzioni capitolo 6
Chimica zanichelli soluzioni capitolo 6 Stati condensati della materia
Stati condensati della materia Ic ronco scrivia
Ic ronco scrivia Un'intera nottata buttato vicino a un compagno massacrato
Un'intera nottata buttato vicino a un compagno massacrato Tim gentile
Tim gentile Krysten gentile sap
Krysten gentile sap Thomas c gentile
Thomas c gentile Riforma gentile 1923
Riforma gentile 1923 Simonetta gentile
Simonetta gentile