Le Leggi ponderali Classi prime Biennio Tecnico Tecnologico

Le Leggi ponderali Classi prime Biennio Tecnico Tecnologico Anno Scolastico 2012/2013

Obiettivi Verificare la legge di Lavoisier raccogliendo e confrontando dati sperimentali ottenuti in laboratorio Verificare la legge di Proust raccogliendo e confrontando dati sperimentali ottenuti in laboratorio Acquisire esperienza diretta sulle reazioni chimiche per riconoscere quando queste avvengono Comprendere come l’impostazione del metodo di lavoro possa influenzare l’esito di un esperimento
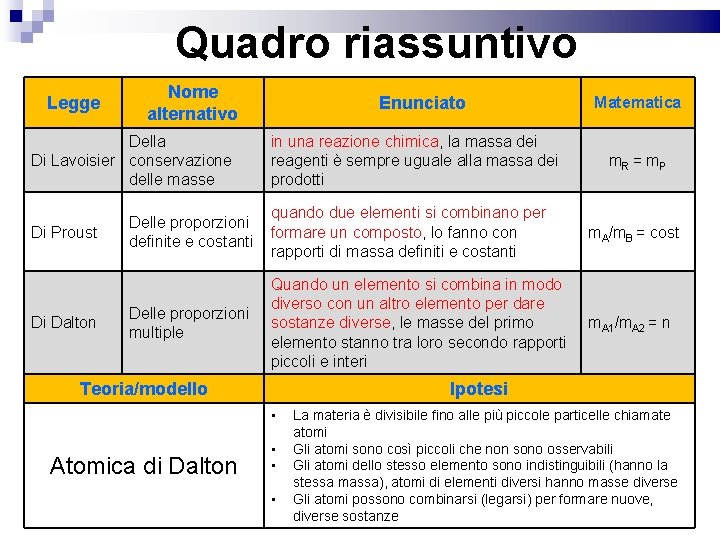
Quadro riassuntivo Legge Nome alternativo Della Di Lavoisier conservazione delle masse Di Proust Di Dalton Enunciato in una reazione chimica, la massa dei reagenti è sempre uguale alla massa dei prodotti Matematica m. R = m P Delle proporzioni definite e costanti quando due elementi si combinano per formare un composto, lo fanno con rapporti di massa definiti e costanti m. A/m. B = cost Delle proporzioni multiple Quando un elemento si combina in modo diverso con un altro elemento per dare sostanze diverse, le masse del primo elemento stanno tra loro secondo rapporti piccoli e interi m. A 1/m. A 2 = n Teoria/modello Ipotesi • Atomica di Dalton • • • La materia è divisibile fino alle più piccole particelle chiamate atomi Gli atomi sono così piccoli che non sono osservabili Gli atomi dello stesso elemento sono indistinguibili (hanno la stessa massa), atomi di elementi diversi hanno masse diverse Gli atomi possono combinarsi (legarsi) per formare nuove, diverse sostanze
Video sulle leggi ponderali Esperienza sulla prima legge https: //www. youtube. com/watch? v=3 z. Nwtq. SDBl 0 Esperienza sulla seconda legge https: //www. youtube. com/watch? v=Y 3 al 1 Om. Ij 2 U Spiegazione ed esempi sulla prima e seconda legge https: //www. youtube. com/watch? v=6 BFHC 5 U 3 WVA Leggi di Lavoisier e Proust https: //www. youtube. com/watch? v=_Zl. WXw. X 68 X 8

Legge di Lavoisier Quando una reazione chimica avviene in un ambiente chiuso: La somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti Un sistema di reazione si definisce chiuso quando: Non scambia materia con l’ambiente circostante (può scambiare energia) Viene chiamata anche: Legge della conservazione della massa Articolo su Chimicamo http: //www. chimicamo. org/chimica-generale/legge-dilavoisier. html

Legge di Lavoisier • In una reazione chimica in un sistema chiuso – La somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti • Legge della conservazione della massa • Deriva dal principio di conservazione – Niente si crea e niente si distrugge

Significato di legge e di ponderale • La legge descrive un fenomeno, anche matematicamente, ma non lo spiega • Invece la teoria offre anche una spiegazione al fenomeno • • Le 3 leggi ponderali e la teoria atomica Le 3 leggi di Keplero e la Teoria gravitazionale di Newton • Sono leggi che studiano le masse delle sostanze coinvolte nelle reazioni (ponderale = relativo al peso)

La I legge matematicamente • La prima legge può quindi essere rappresentata da una relazione matematica • • • m. R = m P m. R = m. P Per esempio • A+B C+D • m. A + m B = m C + m D • Reazione di doppio scambio • AB + CD AD + CB

Esercizi svolti e non Legge di Lavoisier su Chimica online http: //www. chimica-online. it/test/esercizi-leggelavoisier. htm Bilanciamento delle equazioni chimiche su Chimica online http: //www. chimica-online. it/test/esercizi-bilanciamento -reazioni-chimiche. htm
Esercizi svolti e non Legge di Proust su Chimica online http: //www. chimica-online. it/test/esercizi-leggeproust. htm

Laboratorio 1 • Ioduro di potassio – KI – tossico a lungo termine; irritante • Nitrato di piombo – Pb(NO 3)2 – tossico a lungo termine; irritante; comburente; ecotossico; corrosivo • 2 KI(aq) + Pb(NO 3)2(aq) Pb. I 2↓ + 2 KNO 3(aq) – si forma un precipitato solido di ioduro di piombo • Bilanciamento di una equazione chimica • si aggiungono dei coefficienti numerici (in verde)

Laboratorio 2 • Carbonato di calcio - Ca. CO 3(s) – nessun pericolo • Acido cloridrico – HCl – corrosivo – Ca. CO 3(s)+2 HCl(aq) CO 2↑+Ca. Cl 2(aq) + H 2 O(l) – 159, 82 g = 0, 20 g + 159, 62 g

Applicazione della Legge di Lavoisier 4: 32 2: 16 1: 8 2 H 2(g) + __O 2(g) → 2 H 2 O(l) 4 g + 32 g = 36 g Conoscendo le masse dei reagenti si può prevedere la massa dei prodotti ottenibili 2 g + 16 g = 18 g Il bilanciamento delle equazioni chimiche è una applicazione della legge Nessun atomo si crea né si distrugge

Ancora una reazione • __N 2 + 3 H 2 2 NH 3 (ammoniaca) • 28 g 6 g 34 g • È una reazione di sintesi di un composto partendo dai suoi elementi –A+B C • Quanti grammi di NH 3 (ammoniaca) si ottengono facendo reagire 45 g di N 2 (azoto) sapendo che 28 g ne producono 34 g? – 28 g: 45 g=34 g: xg –x = (34 gx 45 g)/28 g=54, 6 g N 2 28 g 45 g 3 H 2 6 g - 2 NH 3 34 g xg

Altro esercizio • Sapendo che se si brucia del glucosio (C 6 H 12 O 6) si ottiene anidride carbonica (CO 2) e acqua (H 2 O) calcolare quanta anidride carbonica si ottiene da 13 g di glucosio (45 g. Gluc: 66 g. CO 2) • __C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O • 45 g 66 g • 13 g xg • 45 g: 66 g=13 g: xg • xg=(66 gx 13 g)/45 g=19, 1 g

Legge di Proust (seconda) Quando due o più elementi si combinano (reagiscono) per dare un composto… Le masse dei reagenti stanno fra loro secondo rapporti definiti e costanti è chiamata anche Legge delle proporzioni definite e costanti

La II legge in matematica • Anche la legge di Proust può essere espressa in forma matematica semplice • Per una reazione tipo • • A + B AB m. A/m. B = cost. • • • 2 g di H reagiscono sempre con 16 g di O 1 mg di H reagisce con 8 mg di O 32 t di O reagiscono con 4 t di H 0, 35 g di H reagiscono con 2, 8 (=0, 35*8) g di O Il rapporto delle masse è sempre di 1: 8 • Quindi, per la formazione di acqua (H 2 O)

Esercizio n° 14 di pg 85 • 28 g di S (zolfo) si combinano completamente con il Fe (ferro), e si ottengono 77 g di solfuro di ferro. Se avessimo una miscela costituita da 28 g di S e da 65 g di Fe, quale massa di solfuro di ferro otterremo? • S + Fe Fe. S • 28 g 49 g 77 g • 28 g 65 g 77 g + 16 g. Fe • Quanto zolfo in più devo fornire alla reazione?

Soluzione

Applicazioni della Legge di Proust 2 H 2(g) + O 2(g) → 2 H 2 O(l) 4 g + 32 g = 36 g Il rapporto di combinazione tra le masse di idrogeno e ossigeno, per formare l'acqua, è sempre di 1: 8 H 2(g) + O 2(g) → H 2 O 2(l) 2 g + 32 g = 34 g

Esercizio Determinare quanta acqua si forma facendo reagire idrogeno e ossigeno con i seguenti rapporti di massa 2 H 2(g) + O 2(g) → 2 H 2 O(l) 56 g + 34 g = xg Determinare anche il reagente in eccesso e di quanto è in eccesso 1 g: 8 g=xg: 34 g xg = (1 gx 34 g)/8 g = 4, 25 g di idrogeno Avanzano 51, 75 g di idrogeno Si ottengono 38, 25 g di acqua
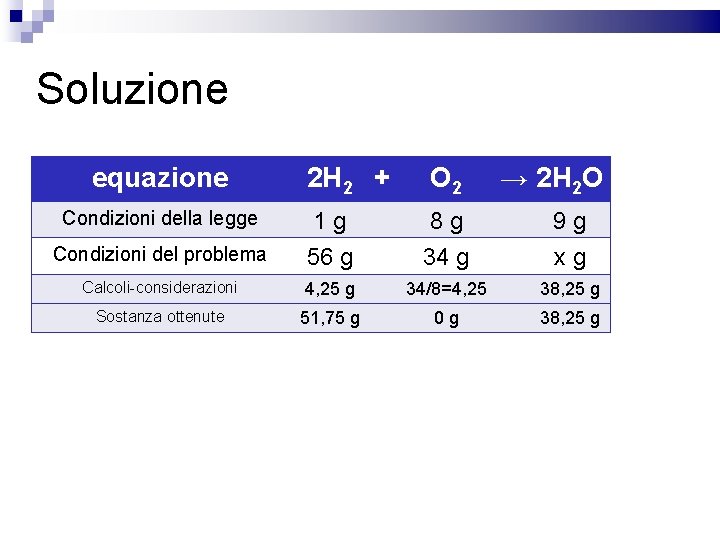
Soluzione equazione 2 H 2 + O 2 → 2 H 2 O Condizioni della legge 1 g 8 g 9 g Condizioni del problema 56 g 34 g xg Calcoli-considerazioni 4, 25 g 34/8=4, 25 38, 25 g Sostanza ottenute 51, 75 g 0 g 38, 25 g

Verifica della legge di Lavoisier Esperienza 1 Verificare se la somma della massa dei reagenti è uguale alla somma della massa dei prodotti Si opera in ambiente chiuso (senza scambio di materia) Deve essere chiaro che sta avvenendo una reazione chimica Avviene un cambiamento di colore che denota una reazione chimica Si forma anche un precipitato, cioè una sostanza solida (sale) insolubile che si deposita sul fondo del recipiente di reazione

La reazione di precipitazione Pb(NO 3)2 + 2 KI Pb. I 2↓ + 2 KNO 3 Nitrato di piombo + ioduro di potassio ioduro di piombo (precipita giallo) + nitrato di potassio (solubile in acqua) Come avete operato? Si effettuano due prove Una con ambiente di reazione aperto Una con ambiente di reazione chiuso Si misura la massa del sistema con le due soluzioni separate Si fanno reagire mischiando le due soluzioni (avviene una reazione perché si forma un precipitato giallo) Si misura la massa del sistema dopo la reazione Composizione del sistema di reazione Beuta Provetta Tappo

La reazione di formazioni di CO 2 Na 2 CO 3 + 2 HCl CO 2↑ + H 2 O + 2 Na. Cl Carbonato di sodio + acido cloridrico anidride carbonica (si disperde in aria) + cloruro di sodio (sale solubile in acqua) + acqua Come si opera? Si effettuano due prove Una con ambiente di reazione aperto Una con ambiente di reazione chiuso Si misura la massa del sistema con l’acido e il sale separati Si fanno reagire mischiando le due soluzioni (avviene una reazione perché si forma un’effervescenza di CO 2) Si misura la massa del sistema dopo la reazione Composizione del sistema di reazione Beuta Provetta Tappo o palloncino (solo per il sistema chiuso)

Verifica della legge di Proust Principio teorico Si studia una reazione che avviene in modo completo: 2 HCl + Zn Zn. Cl 2 + H 2↑ 72, 9 g + 65, 4 g=136, 3+2, 0 g Si utilizza HCl in eccesso: 50 m. L concentrazione 1: 1 Si misura la massa dello Zn. Cl 2 da cui si sottrae la massa dello Zn per ottenere la massa del Cl (applicando la legge di Lavoisier) Si calcola il rapporto di massa tra il Cl e lo Zn per ottenere tanti valori sperimentali quante sono le determinazioni (gruppi di lavoro) Si calcola il rapporto teorico ottenibile dalla formula dello Zn. Cl 2 e si effettua il calcolo dell’errore relativo percentuale Dal confronto dei dati ottenuti con il rapporto teorico si può verificare se la legge di Proust è stata dimostrata Cioè quando due o più elementi si combinano per dare un composto lo fanno secondo rapporti di massa definiti e costanti

Aspetti relativi alla sicurezza • Evaporazione delle soluzioni sotto cappa aspirante – Evapora l’acido cloridrico (corrosivo) • Acido cloridrico – corrosivo • Cloruro di zinco – corrosivo, dannoso per l’ambiente, nocivo • Idrogeno – infiammabile • Piastra riscaldante - Possibili ustioni sulla pelle

Analisi dei dati Il calcolo dello scarto per ogni gruppo risulta positivo, questo fa pensare che ● ● Ipotesi: ● ● Sia stato commesso un errore sistematico Poiché tutti i sali sono igroscopici è possibile che il cloruro di zinco, dopo l'essicazione a caldo, abbia assorbito umidità atmosferica prima della pesata Correzione del metodo: ● ● Effettuare il raffreddamento in un essicatore (gel di silice) Effettuare le operazioni di pesata velocemente

Conclusioni E' stata dimostrata la legge di Proust? È stata dimostrata poiché l'errore relativo percentuale è accettabile per tutti i gruppi • Poiché deve essere minore del 4%

Domanda n° 2 22 g di prodotto 6 g di un reagente Quanti g dell’altro reagente servono? Basta fare una sottrazione 22 g – 6 g = 16 g Per risolvere si applica la legge di Lavoisier

Domanda n° 3 108 g di reagente Si ottengono 100 g di prodotto Quanti g dell’altro prodotto otteniamo? Basta fare una sottrazione 108 g – 100 g = 8 g Per risolvere si applica la legge di Lavoisier

Domanda n° 4 Il rapporto di massa m. Ca/m. O = 1, 5 Si risolve con una proporzione Si risolve anche con la formula inversa

Esercizio Calcolare quanta anidride carbonica si produce bruciando un sacchetto di carbone da 10 kg per arrostire i muggini Si deve conoscere la reazione di combustione del carbonio C + O 2 CO 2 12 g + 32 g x (g. CO 2) 12 g. C: 10 kg. C=32 g. O: xkg. O x(kg. O)=(10 x 32)/12=26, 7 kg. O 10 kg + 26, 7 kg =36, 7 kg CO 2

Esercizio 2 Calcolare quanto azoto è necessario per produrre 45 g di ammoniaca se ho la possibilità di avere a disposizione tutto l’idrogeno necessario È necessario conoscere il rapporto di combinazione N 2 + 3 H 2 2 NH 3 equazione bilanciata 14 g + 3 g x g 14(g. N 2): 17(g. NH 3)=x(g. N 2): 45(g. NH 3) x = (14 x 45)/17 = 37, 0 g N 2 45 – 37 = 8 g H 2

Esercizio 3 22 grammi di sodio (Na) reagiscono con 13 grammi di ossigeno (O 2) secondo la reazione seguente: 4 Na + O 2 2 Na 2 O 46 g. Na + 16 g. O 2 ? (g. Na 2 O) Determinare quale dei due reagenti è in eccesso e di quanto Il reagente in eccesso è il Na L’ossigeno si consuma tutto, per sapere quanto Na si consuma si deve calcolare il rapporto 16/13=1, 23 Si moltiplica la quantità di Na per 1, 23: 22*1, 23=27, 06 g Rimangono 46 -27, 06=18, 94 g di Na non reagito Calcolare quanto ossido di sodio (Na 2 O) si ottiene 27, 06+16=43, 06 g di ossido di sodio

La legge di Dalton Legge delle proporzioni multiple Quando un elemento si combina con una quantità fissa di un altro elemento, per formare composti diversi, . . . lo fa secondo rapporti di massa, dello stesso elemento, semplici e interi 2 C + O 2 → 2 CO 24 g+32 g=56 g C + O 2 → CO 2 12 g+32 g=44 g

Viceversa m. R 1/m. R 2 = n • È possibile applicare lo stesso ragionamento anche all’ossigeno nella stessa reazione A. 2 C + O 2 → 2 CO 12 g+16 g = 28 g B. C + O 2 → CO 2 12 g+32 g=44 g m. OB/m. OA = 32 g/16 g = 2

Altri esempi 2 H 2 + O 2 → 2 H 2 O 4 g+32 g=36 g H 2 + O 2 → H 2 O 2 2 g+32 g=34 g 4 Fe + 3 O 2 → 2 Fe 2 O 3 224 g+96 g=320 g di ossido ferrico 2 Fe + O 2 → 2 Fe. O 112 g+32 g=144 g di ossido ferroso

Come creare un riferimento fisso A. 4 Fe + 3 O 2 → 2 Fe 2 O 3 224 g+96 g=320 g di ossido ferrico B. 2 Fe + O 2 → 2 Fe. O 112 g+32 g=144 g di ossido ferroso Si moltiplicano per 2 le masse relative alla reazione B. 2 x 112 g+2 x 32 g=2 x 144 g 224 g+64 g=288 g Il rapporto delle masse dell’ossigeno nei due composti si ottiene dal rapporto m. OA/m. OB= 96/64=6/4=3/2

In generale interpretando • A 2 + B 3 A 2 B 3 • 3 A + B 3 3 AB • m. A 1/m. A 2 = n

Teoria atomica di Dalton La materia è formata da particelle chiamate atomi Gli atomi sono invisibili (troppo piccoli) e indivisibili Nelle reazioni chimiche gli atomi si combinano in numeri interi Gli atomi di elementi diversi sono diversi e in particolare hanno masse diverse Gli atomi dello stesso elemento sono identici Gli atomi possono legarsi tra loro per formare sostanze diverse

Commenti sulla teoria • Non tutte le affermazioni di Dalton si sono dimostrate corrette • Gli atomi si possono combinare tra loro per formare molecole • • • Molecole: sono raggruppamenti di atomi con proprietà tipiche e ben definite Atomi tutti uguali: sostanze elementari Atomi diversi: composti • In genere le sostanze sono formate da un numero enorme di molecole tutte uguali fra loro
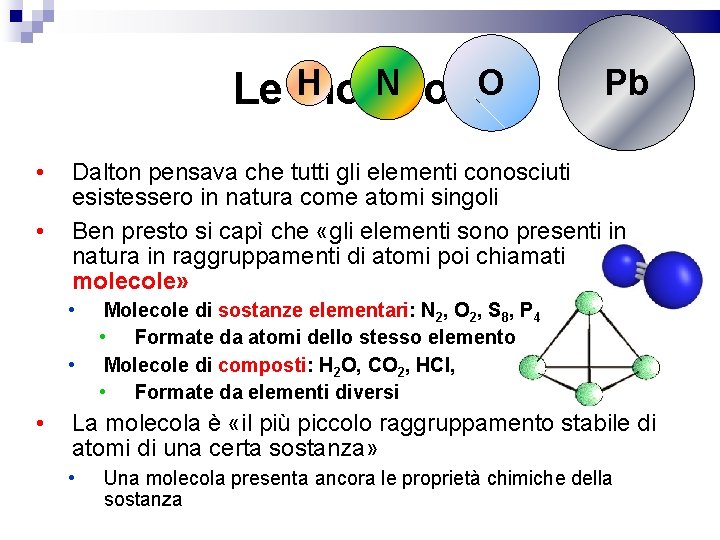
N O Le H molecole • • Dalton pensava che tutti gli elementi conosciuti esistessero in natura come atomi singoli Ben presto si capì che «gli elementi sono presenti in natura in raggruppamenti di atomi poi chiamati molecole» • • • Pb Molecole di sostanze elementari: N 2, O 2, S 8, P 4 • Formate da atomi dello stesso elemento Molecole di composti: H 2 O, CO 2, HCl, • Formate da elementi diversi La molecola è «il più piccolo raggruppamento stabile di atomi di una certa sostanza» • Una molecola presenta ancora le proprietà chimiche della sostanza

Differenze tra elementi • La differenza tra elementi per Dalton si traduce in differenza tra le masse • • Ci sono elementi più leggeri ed altri più pesanti Ci sono elementi più voluminosi ed altri meno voluminosi • Si può avere una misura precisa delle masse degli atomi? • È possibile e si può esprimere in kg o in g o qualunque multiplo o sottomultiplo • È rappresentata da un numero estremamente piccolo • • Per esempio: 0, 0000000000001 grammi In notazione scientifica: 1, 0 x 10 -23 g

Unità di massa atomica (uma o u) • Era inizialmente la massa dell’atomo di H • • m. H = 1 uma Cioè la massa di un atomo di idrogeno (H) è posta uguale a 1 uma • Cosa significa questo? • Gli scienziati dicono che l’atomo di ossigeno (O) ha massa di 16 uma • Questo significa che l’ossigeno ha una massa 16 volte maggiore dell’idrogeno • Le masse atomiche si trovano nella tavola periodica

Σm. R=Σm. P Esercizio sulla prima legge Da una reazione chimica abbiamo ottenuto 45 g di una sostanza C e 21 g di una sostanza D. Calcolare la massa del reagente B sapendo che la massa del reagente A che abbiamo consumato è di 15 g. Scrivi l'equazione chimica. A+B→C+D 15 g+xg. B=45 g+21 g (45+21)-15=xg 66 -15=51 g di B

Esercizio sulla seconda legge L'idrogeno (H 2) reagisce con l'azoto (N 2) per dare ammoniaca (NH 3) Scrivi l'equazione chimica bilanciata Calcola quanto azoto devo consumare se faccio reagire 67 g di idrogeno sapendo che 6 g di idrogeno reagiscono sempre con 28 g di azoto per dare ammoniaca Calcolare anche quanta ammoniaca si forma 3 H 2 + N 2 → 2 NH 3
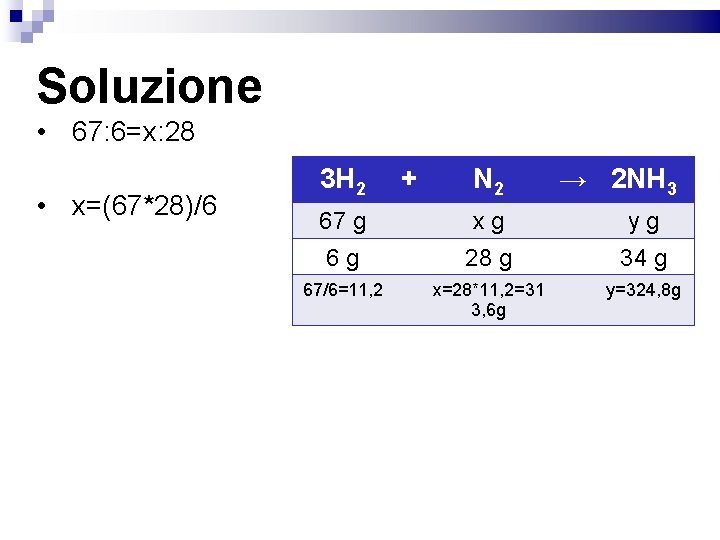
Soluzione • 67: 6=x: 28 • x=(67*28)/6 3 H 2 + N 2 → 2 NH 3 67 g xg yg 6 g 28 g 34 g 67/6=11, 2 x=28*11, 2=31 3, 6 g y=324, 8 g

Un problema industriale Un'industria vuole produrre 75 tonnellate di ammoniaca (NH 3) sintetizzandola dall'idrogeno (H 2) e dall'azoto (N 2) Sapendo che l'azoto si può ricavare gratis dall'aria calcola la quantità di idrogeno che l'ufficio commerciale deve comprare Scrivi la reazione ed effettua i calcoli 3 H 2 + N 2 → 2 NH 3 6 g + 28 g = 34 g

Approfondimento - bilanciamento 2 N 2 + 5 O 2 → 2 N 2 O 5 Sintesi Na 2 SO 4 + Pb(NO 3)2 → Pb. SO 4 + 2 Na. NO 3 Doppio 2 KOH + H 2 SO 4 → K 2 SO 4 + 2 H 2 O Doppio scambio (acido-base) Al 2(SO 4)3 + 3 Ca(OH)2 → 2 Al(OH)3 + 3 Ca. SO 4 Doppio scambio

Approfondimento - Proust Pirite – Fe. S 2 In Spagna si estrae un minerale con x% ferro (Fe) e y% di zolfo (S) Negli Stati Uniti d'America si estrae lo stesso tipo di minerale con le stesse percentuali in massa di Fe e S. Perchè a Camedda sembra normale? Calcola le due percentuali x e y!

Soluzione MAFe = 56 MAS = 32 → 2 x 32 = 64 MMFe. S 2 = 56 + (32 x 2) = 120 %Fe = 100*(56/120) = 47% %S = 100*(64/120) = 53% Abbiamo dimostrato che conoscendo la formula di un composto possiamo risalire alla sua composizione elementare In realtà si realizza il processo inverso

Approfondimento - Dalton Pb O 207, 0 g 16, 0 g Pb O 310, 5 g 48, 0 g Qual è il rapporto di combinazione del piombo nei due composti rispetto ad 1 g di O? È un rapporto piccolo e intero?
- Slides: 53