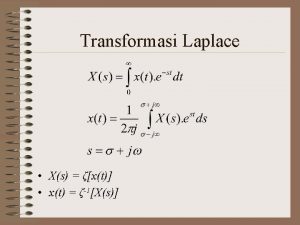Pengertian materi sifat materi Perubahan materi Klasifikasi materi

Pengertian materi sifat materi, Perubahan materi, Klasifikasi materi, serta hukum-hukum yang berhubungan dengan materi.

ILMU KIMIA • Kimia Ilmu pengetahuan alam yang mempelajari tentang MATERIyang meliputi: – – – Struktur materi Susunan materi Sifat materi Perubahan materi Energi yang menyertai dari suatu materi • Materi segala sesuatu yang mempunyai masa dan menempati ruang
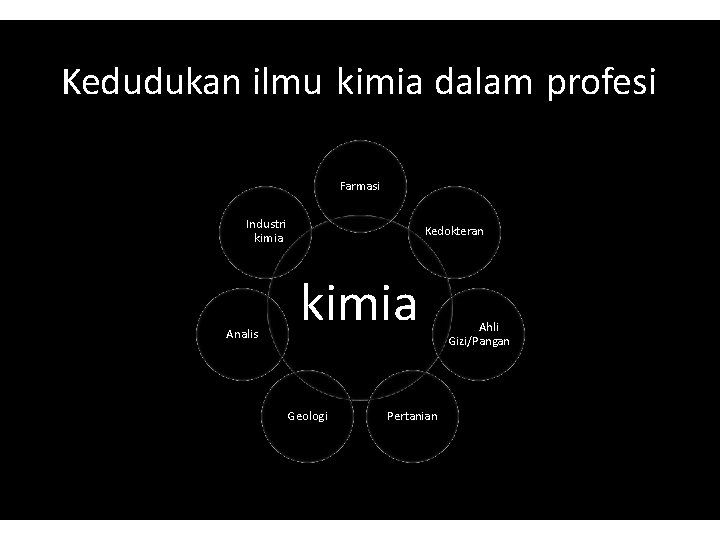
Kedudukan ilmu kimia dalam profesi Farmasi Industri kimia Analis Kedokteran kimia Geologi Pertanian Ahli Gizi/Pangan
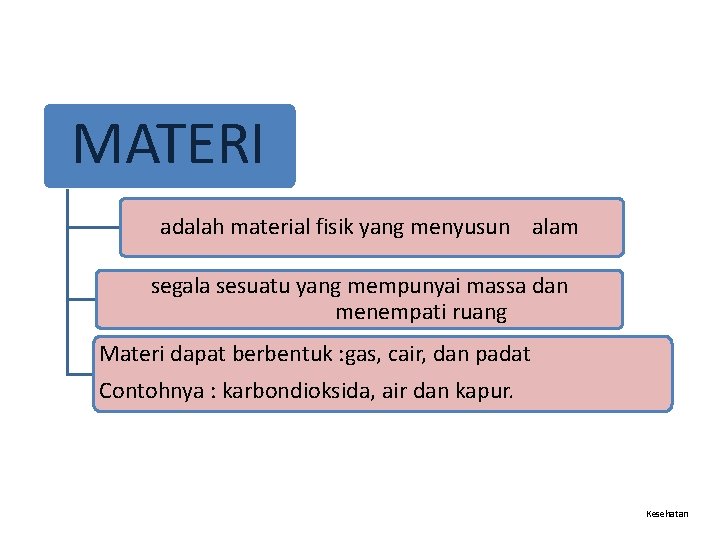
MATERI adalah material fisik yang menyusun alam segala sesuatu yang mempunyai massa dan menempati ruang Materi dapat berbentuk : gas, cair, dan padat Contohnya : karbondioksida, air dan kapur. Kesehatan
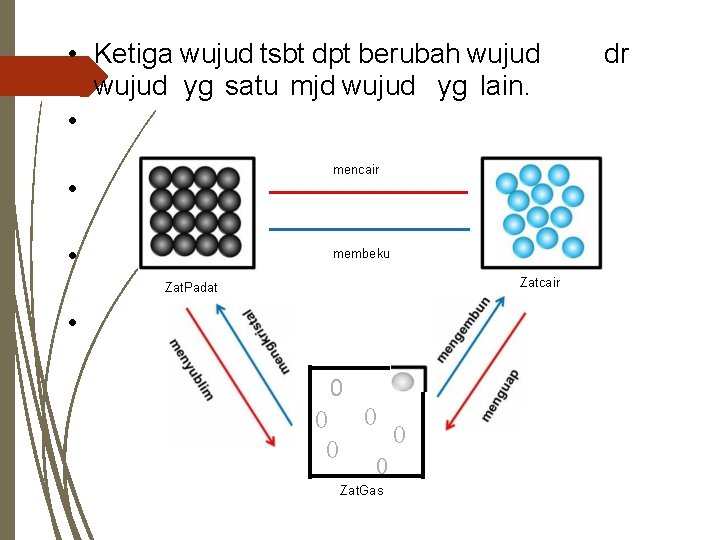
• Ketiga wujud tsbt dpt berubah wujud yg satu mjd wujud yg lain. • mencair • • membeku Zatcair Zat. Padat • 0 0 0 Zat. Gas dr
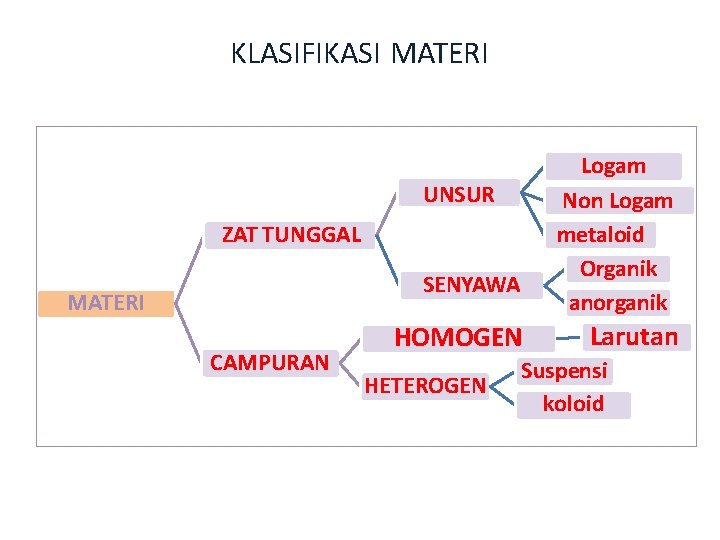
KLASIFIKASI MATERI Logam Non Logam metaloid Organik anorganik UNSUR ZAT TUNGGAL SENYAWA MATERI CAMPURAN HOMOGEN HETEROGEN Larutan Suspensi koloid

Pengertian campuran Materi yang tersusun dari beberapa zat tunggal, sehingga mempunyai sifat dan komposisi yang bervariasi Ciri-ciri campuran : terdiri atas 2 jenis zat tunggal atau lebih dengan komposisi tidak t masih mempunyai sifat zat asalnya dapat dipisahkan menjadi komponennya air laut adalah campuran air, Na. Cl, lainnya. Udara bersih N 2, O 2, CO 2, dan gas Sirop air dan gula. Kesehatan

Campuran: Heterogen & Homogen • Contoh larutan homogen: Larutan gula setelah diaduk. • Susunan dr campurannya diseluruh bagian larutan akan sama. • Campuran heterogen: pasir & serbuk besi. • Susunannya tdk seragam. • Minyak & air jg tidak memiliki susunan yg konstan. • Setiap campuran apakah heterogen maupun homogen dapat dipisahkan secara fisika menjadi komponen murninya tanpa megubah identitas setiap dr setiap komponen.

Perbedaan antara Campuran I omogen dengan Campuran Heterogen Tujuan: . Ieng tahui p r campuran h t r a n c mpur n homo en engan n. A. lat dan bahan: Cua uah g la , sen ok makan air gula p ir, an tan h. Pro edur kerja: . . Tuangkan air ke alam gelas p rtama an ke ua ng n · mlah y ng 2. Ma ukkan uama. sen ok mak n gula pa ir ke alam gela pert ma. 3. . f ukkan a n · ok makan tan h ke alam gel k u. . erh ti n gam ar i rnpin. 4. A uk eti p gela ampai gul pa ir an tanah rcampur en an rata. t, am ti 5. Biark n n - n in kan gela ua. ri perco aan iata ? ~: , : : u c: "-------

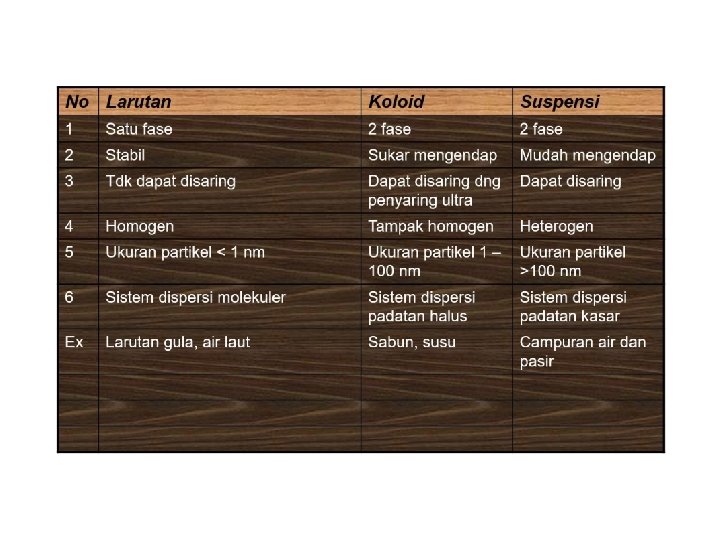
1. Campuran Homogen Adalah campuran antara 2 zat atau lebih yang partikel-partikel penyusunnya tidak dapat dibedakan lagi. Disebut juga dengan larutan. Ukuran partikel larutan berdiameter sekitar 0, 00001 m (tdk bisa diamati)

Contoh : - larutan gula - larutan garam - stainless steel - emas - campuran gas

2. Campuran Heterogen Campuran antara 2 macam zat atau lebih yang partikel 2 penyusunnya masih dapat dibedakan satu dengan lainnya. Contoh : - tanah - air sungai - makanan - minuman - air laut - adonan kue - air minyak, dll

Campuran heterogen di bagi 2, yaitu : a. Koloid Partikel 2 nya hanya dapat dilihat dengan mikroskop ultra. Ukuran partikel 0, 5 sd 1 mm Contoh : susu, asap, kabut, agar-agar. b. Suspensi Partikel 2 nya bisa dilihat dgn mikroskop biasa. Ukuran partikel lebih besar dari 3 mm Contoh : minyak air, air keruh, air kapur

Pengayakan Penyaringan berdasarkan Sifat Fisika Sentrifugasi Kristalisasi Distilasi Pemisahan Campuran Kromatografi berdasarkan Sifat Kimia Ekstraksi Penjernihan air

Merupakan pemisahan campuran berdasarkan perbedaan ukuran partikel Contoh : Tukang bangunan menyaring pasir

Digunakan untuk memisahkan padatan dengan cairan atau untuk menjernihkan air secara sederhana Contoh : a. Penyaringan santan b. Pemisahan air dari teh c. Penyaringan jus jambu dengan bijinya
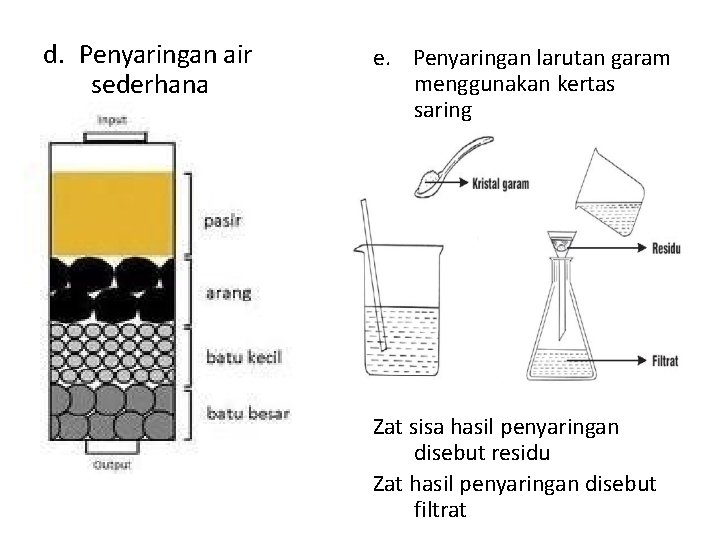
d. Penyaringan air sederhana e. Penyaringan larutan garam menggunakan kertas saring Larutan gar Zat sisa hasil penyaringan disebut residu Zat hasil penyaringan disebut filtrat

Digunakan untuk memisahkan zat padat dari zat cair dengan cara penguapan Contoh : Pembuatan garam (air laut + garam) Pembuatan gula pasir dari tebu (air + gula tebu)
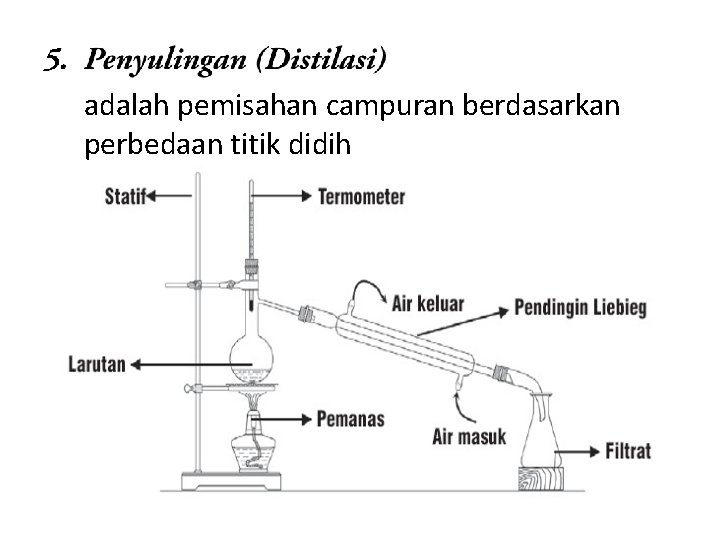
adalah pemisahan campuran berdasarkan perbedaan titik didih

Distilasi dapat digunakan dalam pengolahan minyak mentah dan disebut Distilasi Bertingkat Contoh distilasi : Pemisahan air + garam pada air laut menjadi air murni Pembuatan minyak kayu putih

adalah pemisahan campuran antara zat yang mudah menyublim dengan zat yang tidak dapat menyublim Contoh zat yang mudah menyublim : Kapur barus, iodine, dan kafein Sublimasi iodin

adalah pemisahan campuran berdasarkan perbedaan daya serap zat penyerap (absorben) dengan zat penyusunnya Contoh : - pada tinta - kapur warna - spidol warna

Pemisahan Campuran Berdasarkan Sifat Kimia • Contoh : - Membersihkan air dari garam-garam kalsium dan magnesium - Penambahan tawas pada penjernihan air Tawas digunakan untuk menggumpalkan kotoran yang berupa lumpur halus
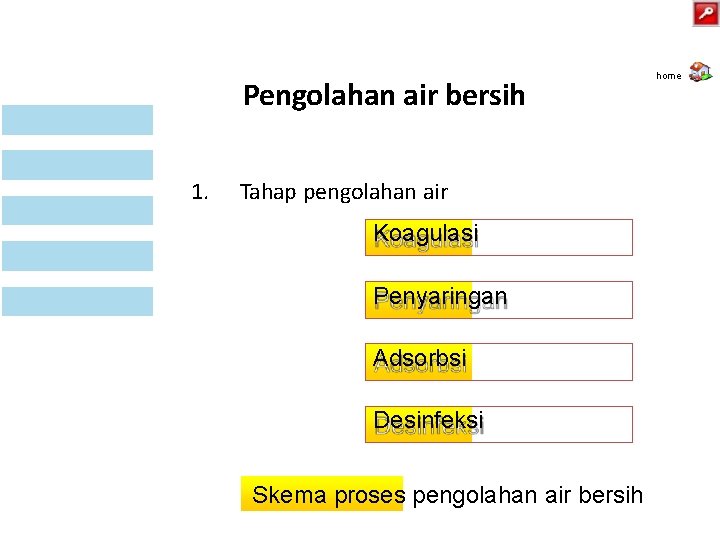
Pengolahan air bersih 1. Tahap pengolahan air Koagulasi Penyaringan Adsorbsi Desinfeksi Skema proses pengolahan air bersih home

PENGOLAHAN AIR BERSIH home Koagulasi • • • Air sungai di endapkan lumpurnya lalu tambahkan tawas / Al 2(SO 4)3 dan gas klorin / kaporit. Fungsi tawas : menggumpalkan lumpur koloid shg mudah disaring Membentuk koloid Al(OH)3 yang dapat mengadsorbsi zat pencemar dan mengendapkannya fungsi kaporit : pembasmi kuman Apakah koagulasi ? ? Koagulasi Penyaringan Adsorbsi Desinfeksi
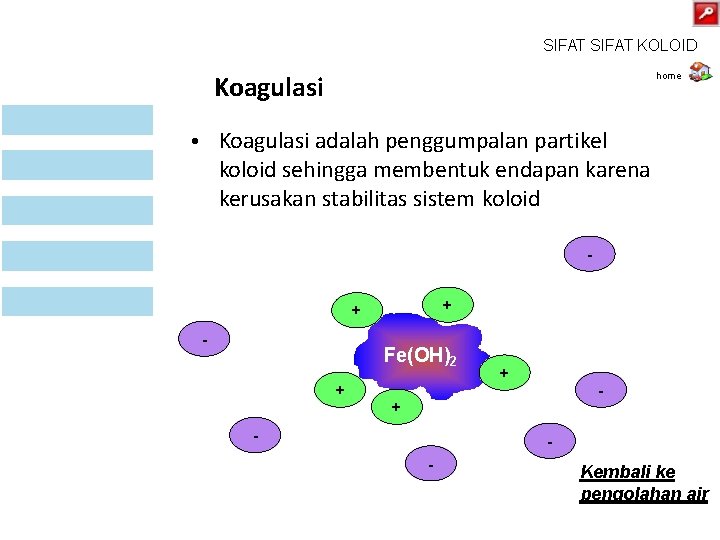
SIFAT KOLOID Koagulasi home • Koagulasi adalah penggumpalan partikel koloid sehingga membentuk endapan karena kerusakan stabilitas sistem koloid + + - Fe(OH)2 + + - - Kembali ke pengolahan air

PENGOLAHAN AIR BERSIH home Penyaringan • Air disaring dengan saringan yang terdiri dari lapisan kerikil dan pasir sorpsi desinad feksi Koagulasi Penyaringan Adsorbsi Desinfeksi
PENGOLAHAN AIR BERSIH home Proses Adsorbsi • • Penyerapan dilakukan oleh Al(OH)3 dan karbon aktif Fungsi karbon aktif yaitu menghilangkan bau, warna, rasa, dan zat-zat kimia. Apakah absorbsi Koagulasi Penyaringan Adsorbsi Desinfeksi
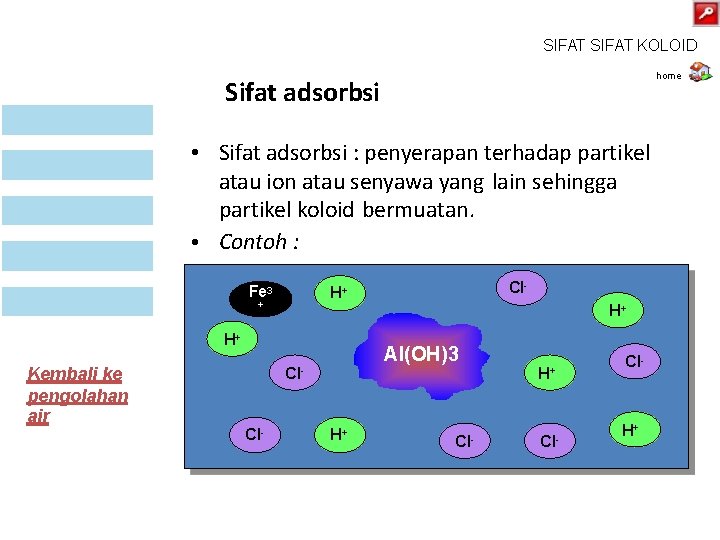
SIFAT KOLOID home Sifat adsorbsi • Sifat adsorbsi : penyerapan terhadap partikel atau ion atau senyawa yang lain sehingga partikel koloid bermuatan. • Contoh : Fe 3 + H+ H+ Kembali ke pengolahan air Cl- H+ Al(OH)3 Cl • (i) Koloid Fe(OH)3 bermuatan positif karena + Cl H permukaannya menyerap ion H+. Cl- H+

PENGOLAHAN AIR BERSIH home Proses Disenfeksi • Air yang sudah cukup bersih ditambahkan kapur untuk menaikkan Ph dan gas Klorin guna mematikan hama Koagulasi Penyaringan Adsorbsi Desinfeksi
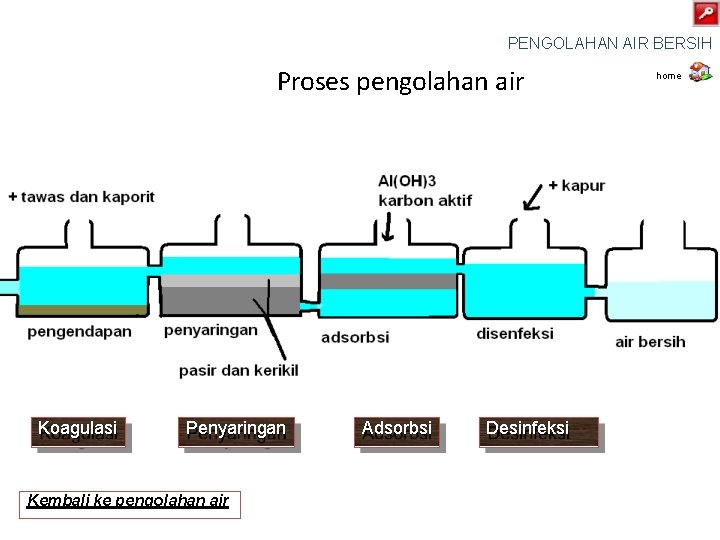
PENGOLAHAN AIR BERSIH Proses pengolahan air Koagulasi Penyaringan Kembali ke pengolahan air Adsorbsi Desinfeksi home

Zat tunggal • Zat tunggal = materi yang memiliki susunan partikel yang tidak mudah dirubah dan memiliki • komposisi yang tetap. Zat tunggal dapat diklasifikasikan sebagai unsur • dan senyawa. • •
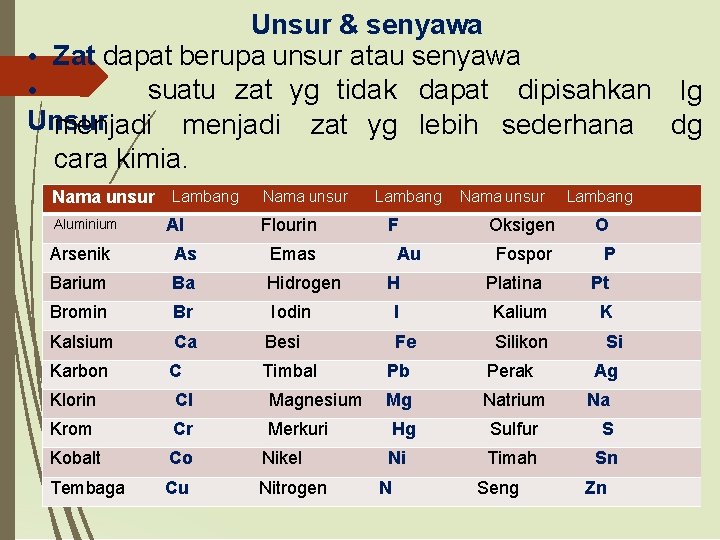
Unsur & senyawa • Zat dapat berupa unsur atau senyawa suatu zat yg tidak dapat dipisahkan lg • Unsur: menjadi zat yg lebih sederhana dg cara kimia. Nama unsur Lambang Aluminium Al Nama unsur Flourin Arsenik As Emas Barium Ba Hidrogen Bromin Br Iodin Kalsium Ca Besi Karbon C Timbal Klorin Cl Magnesium Krom Cr Merkuri Kobalt Co Nikel Tembaga Cu Nitrogen Lambang F Au H Nama unsur Oksigen Fospor Platina I Kalium Fe Silikon Lambang O P Pt K Si Pb Perak Mg Natrium Hg Sulfur S Ni Timah Sn N Seng Ag Na Zn

35 UNSUR • • Contoh Unsur dalam kehidupan sehari-hari : Arang yang berwarna hitam, yang terdapat dalam sisa pembakaran, dalam pensil dan digunakan sebagai elektroda dalam batere, adalah unsur karbon. Unsur Logam juga dapat kita jumpai dalam bentuk perhiasan emas, perak dan platina. Contoh unsur logam cadmium, air raksa dan timah hitam disajikan pada Gambar 2. 1.
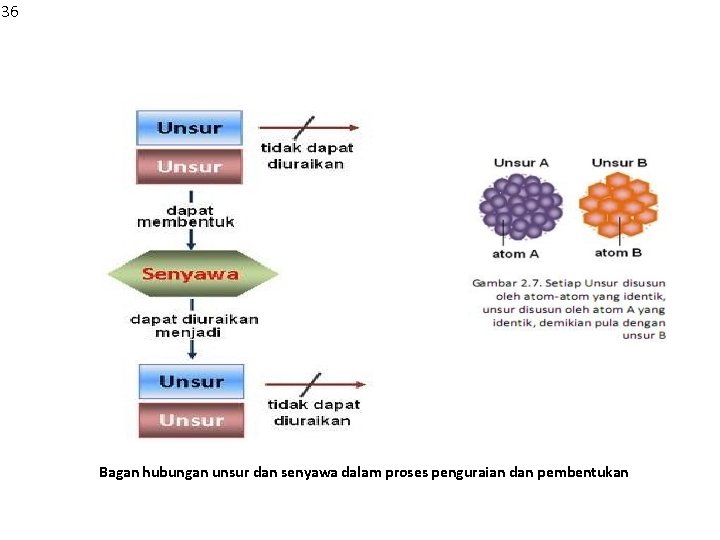
36 Bagan hubungan unsur dan senyawa dalam proses penguraian dan pembentukan

Unsur dikelompokan menjadi 3, yaitu : 1. Unsur Logam putih mengkilap titik lebur rendah dapat menghantar arus listrik dapat ditempa dapat menhantarkan kalor/panas pada umumnya berupa zat padat

a. b. c. d. e. f. g. Kh r o m (Cr) Digunakan untuk bumper mobil, dan campuran dengan baja menjadi stainless steel. Besi (Fe) Merupakan logam yang paling murah, sebagai campuran dengan karbon menghasilkan baja untuk konstruksi bangunan, mobil dan rel kereta api. Nikel ( Ni ) Nikel padat sangat tahan terhadap udara dan air pada suhu biasa, oleh pelindung cara itu nikel digunakan sebagai lapisan dengan karena disepuh. Tembaga (Cu) Tembaga banyak digunakan pada kabel listrik, perhiasan, dan uang tembaga dengan logam. Campuran timah menghasilkan perunggu seng menghasilkan kuningan. sedangkan campuran tembaga dengan Seng (Zn) digunakan sebagai atap rumah, perkakas rumah tangga, Seng dapat mencegah karat. besi untuk dan pelapis Platina (Pt) Platina digunakan pada knalpot mobil, kontak listrik, clan dalam bidang kedokteran sebagai pengaman tulang yang patah. Emas (Au) merupakan Emas logam sangat tidak reaktif, dan ditemukan dalam bentuk murni. Emas digunakan sebagai perhiasan dan komponen listrik berkualitas emas dengan perak banyak tinggi. Campuran bahan koin. digunakan sebagai

2. Unsur Non Logam tidak mengkilap penghantar arus listrik yang buruk tidak dapat ditempa

3. Unsur Semi Logam (Metaloid) memiliki sifat dianata logam dan bukan logam
ta Cl h
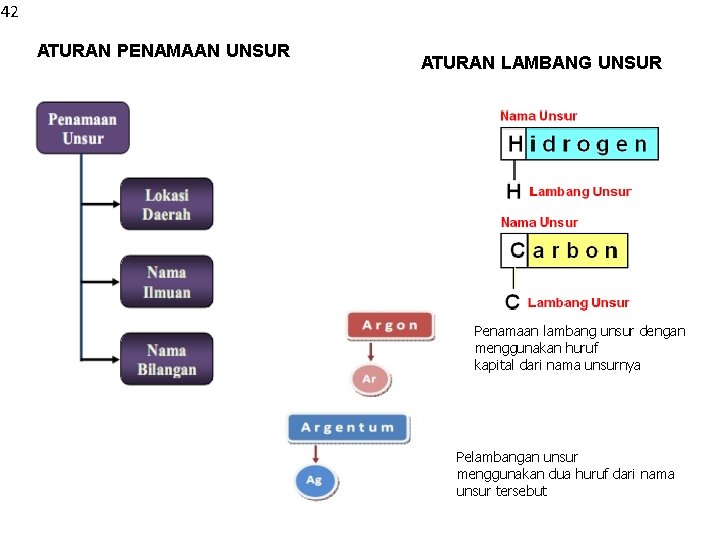
42 ATURAN PENAMAAN UNSUR ATURAN LAMBANG UNSUR Penamaan lambang unsur dengan menggunakan huruf kapital dari nama unsurnya Pelambangan unsur menggunakan dua huruf dari nama unsur tersebut

Nama unsur yang kita kenal dalam bahasa Indonesia belum tentu sama dengan nama unsur baku yang ditetapkan oleh International Union of Pure and applied Chemistry yang kita kenal, misal tembaga nama kimia yang menurut(IUPAC) IUPAC adalah Cuprum, demikian juga emas adalah aurum. Nama unsur diambil dari nama satu daerah seperti germanium (Jerman), polonium (Polandia), Fransium (Perancis), europium (Eropa), amerisium (Amerika), kalifornium (Kalifornia), stronsium (Strontia, Scotlandia) Ilmuan yang berjasa didalam bidang kimia juga digunakan seperti: einstenium (Einstein), curium (Marie dan P Curie), fermium (Enrico Fermi), nobelium (Alfred Nobel). Nama planet juga diabadikan sebagai nama unsur seperti: uraniumnama (Uranus), plutonium (Pluto), dan neptunium (Neptunus). Untuk beberapa unsur yang baru ditemukan, khususnya untuk unsur dengan nomor 104 keatas mempergunakan akar kata dari bilangan. nil = 0, un = 1, bi = 2, tri = 3 quad =4, pent = 5, hex = 6, sept = 7, okt = 8 dan enn = 9. contoh untuk unsur dengan nomor 107 yaitu unilseptium, yang berasal dari bilangan 1 : un, bilangan 0 : nil, dan tujuh : sept serta tium, sehingga nama unsur tersebut adalah unilseptium (Uns).

SENYAWA Pengertian Senyawa Zat yang terdiri atas dua atau lebih unsur yang secara kimia bergabung dengan perbandingan tertentu. Menghasilkan materi baru yang sifatnya berbeda dengan unsur-unsur penyusunnya Contoh: air (H 2 O), sukrosa (C 12 H 22 O 11), kalsium karbonat (Ca. CO 3) Kesehatan
IHsaild. : e 4 n 5 gan Judul Halaman Terkait KLASIFIKASI SENYAWA BERDASAR SUMBERNYA SENYAWA ORGANIK SENYAWA ANORGANIK
46 • Senyawa organik dibangun oleh atom utamanya karbon, sehingga senyawa ini juga dikenal dengan istilah • hidrokarbon. Senyawa hidrokarbon banyak terdapat di alam dan juga pada makhluk hidup, dimulai dari bahan bakar sampai dengan molekul yang berasal atau • ditemukan dalam makhluk hidup Contohnya seperti karbohidrat, protein, lemak, asam amino dan ureum atau urea terdapat pada air seni (urin). Gula pasir atau sakarosa yang banyak terdapat didalam tebu dan alkohol merupakan hasil fermentasi dari lautan gula, dll.
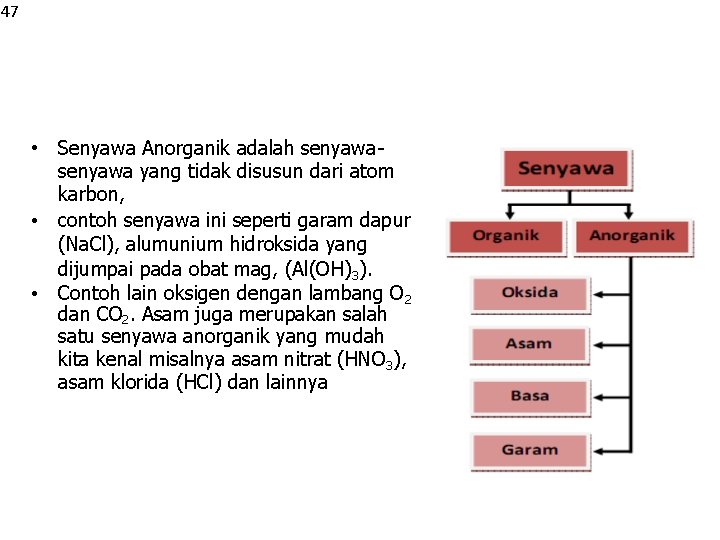
47 • Senyawa Anorganik adalah senyawa yang tidak disusun dari atom karbon, • contoh senyawa ini seperti garam dapur (Na. Cl), alumunium hidroksida yang dijumpai pada obat mag, (Al(OH)3). • Contoh lain oksigen dengan lambang O 2 dan CO 2. Asam juga merupakan salah satu senyawa anorganik yang mudah kita kenal misalnya asam nitrat (HNO 3), asam klorida (HCl) dan lainnya
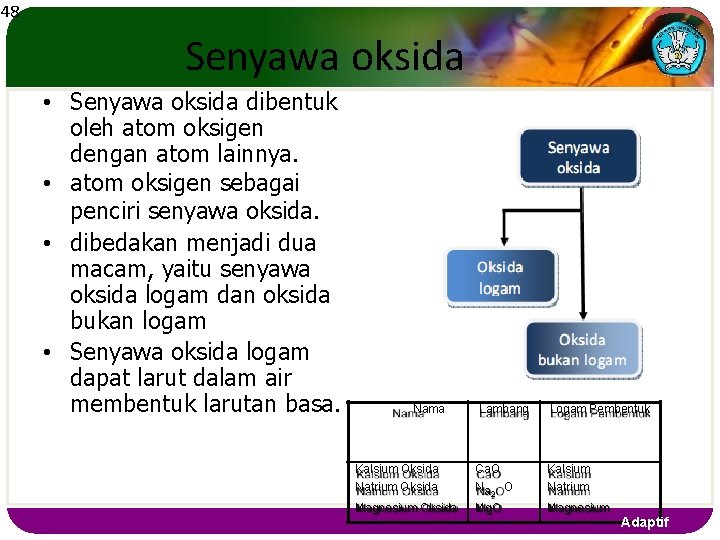
48 Senyawa oksida • Senyawa oksida dibentuk oleh atom oksigen dengan atom lainnya. • atom oksigen sebagai penciri senyawa oksida. • dibedakan menjadi dua macam, yaitu senyawa oksida logam dan oksida bukan logam • Senyawa oksida logam dapat larut dalam air membentuk larutan basa. Nama Lambang Logam Pembentuk Kalsium Oksida Natrium Oksida Ca. O Na O Kalsium Natrium Magnesium Oksida Mg. O Magnesium 2 Adaptif

49 Senyawa oksida bukan logam • Senyawa oksida bukan logam dibentuk dari unsur bukan logam dengan oksigen, misalnya antara unsur nitrogen dengan oksigen. • Senyawa oksida bukan logam dapat larut dalam air membentuk larutan asam. • senyawa oksida bukan logam biasanya berbentuk gas Nama Karbon monoksida Karbon dioksida Difosfor penta oksida Lambang CO CO 2 P 2 O Keterangan 1 Oksigen 5 2 Oksigen 2 fosfor 5 oksigen Adaptif
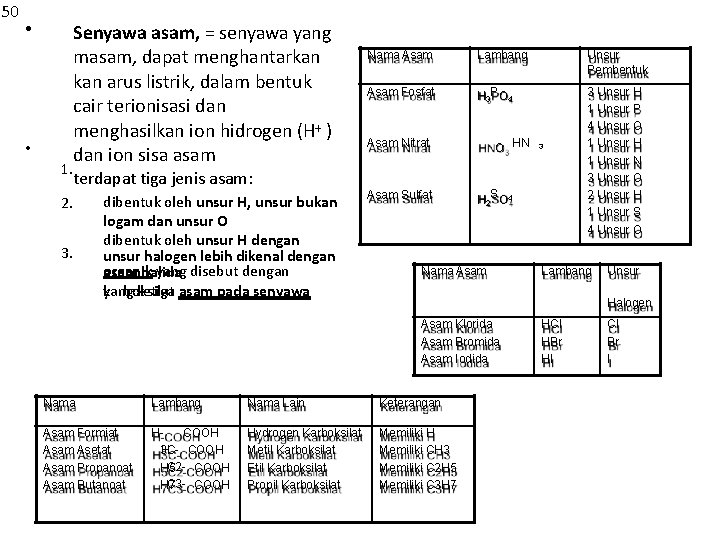
50 • • 1. Senyawa asam, = senyawa yang masam, dapat menghantarkan arus listrik, dalam bentuk cair terionisasi dan menghasilkan ion hidrogen (H+ ) dan ion sisa asam terdapat tiga jenis asam: 2. 3. dibentuk oleh unsur H, unsur bukan logam dan unsur O dibentuk oleh unsur H dengan unsur halogen lebih dikenal dengan organik yang disebut dengan asam halida karboksilat yang ketiga asam pada senyawa Nama Asam Lambang Unsur Pembentuk Asam Fosfat H 3 PO 4 3 Unsur H 1 Unsur P 4 Unsur O 1 Unsur H 1 Unsur N 3 Unsur O 2 Unsur H 1 Unsur S 4 Unsur O O HN Asam Nitrat Asam Sulfat 3 H 2 SO 4 Nama Asam Lambang Unsur Halogen Asam Klorida Asam Bromida Asam Iodida Nama Lambang Nama Lain Keterangan Asam Formiat Asam Asetat Asam Propanoat Asam Butanoat HCOOH 3 CH COOH C 2 - COOH H 5 C 3 - COOH H 7 Hydrogen Karboksilat Metil Karboksilat Etil Karboksilat Propil Karboksilat Memiliki H Memiliki CH 3 Memiliki C 2 H 5 Memiliki C 3 H 7 HCl HBr HI Cl Br I

51 Senyawa basa, dibentuk oleh unsur logam dan dengan gugus hidroksida (OH). • Senyawa basa terasa pahit atau getir jika dirasakan, menimbulkan rasa gatal panas. • Larutan basa dapat menghantarkan arus listrik, karena mengalami ionisasi. Hasil ionisasi berupa ion logam dan gugus OH • Logam Lambang Senyawa Mg Na K Al Mg(OH) 2 Na. OH KOH Al(OH) 3 Nama Senyawa Magnesium Hidroksida Natrium Hidroksida Kalium Hidroksida Alumunium Hidroksida Adaptif

52 • Senyawa garam = dibentuk oleh unsur logam dan sisa asam. memiliki rasa asin, larutan senyawa ini dapat menghantarkan arus listrik kerena terjadi ionisasi. Senyawa garam Na. Cl, terionisasi menjadi ion Na+ dan ion sisa asam Cl Nama Garam lambang Kalium Iodida Kalsium Karbonat KI Ca. CO 3 i 2 O Ion Penyususun K+ dan I 32 Ca 2+ dan CO i+ O 42 Adaptif
GAS CAIR PADAT Kesehatan

• Susunan molekul berjauhan • kerapatan rendah • Tidak selalu bergerak dengan kecepatan tinggi Kesehatan

• Campuran gas selalu uniform (serba sama) • Gaya tarik-menarik antar partikel dapat diabaikan • Laju suatu partikel selalu berubah-ubah tapi laju rata-rata partikel-partikel memiliki volume dan bentuk tetap Kesehatan

• Gas dapat dimampatkan • Gas dapat dalam bentuk atom tunggal seperti golongan gas mulia (He, Ar, Xe), diatomic (H 2, O 2, F 2), dan dalam bentuk senyawa (NO, CO 2, H 2 S) Kesehatan

• Mempunyai kerapatan yang lebih tinggi bila dibanding dengan gas, namun lebih rendah bila dibandingkan dengan padatan • Jarak antar partikel lebih dekat • Merupakan fase yang terkondensasi Kesehatan

IHsaild. : e 5 n 8 gan Judul Halaman Terkait CIRI-CIRI ZAT CAIR • Merupakan fase yang bisa dikatakan tidak terkompresi • Bentuk cairan akan menyesuaikan dengan wadahnya

1. Kerapatannya sangat tinggi, jauh lebih tinggi daripada gas dan cairan 2. Jarak antar partikel sangat dekat 3. Merupakan fase yang terkondensasi 4. Merupakan fase yang bisa dikatakan tidak terkompresi 5. Mampu mempertahankan bentuknya Kesehatan
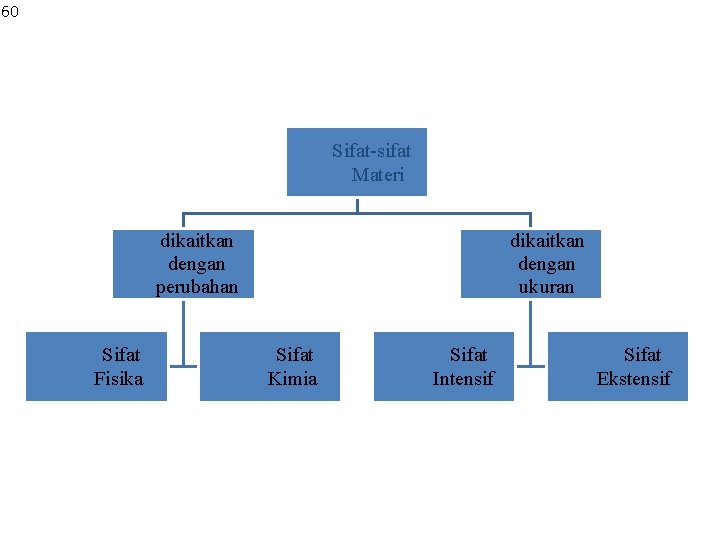
60 Sifat-sifat Materi dikaitkan dengan perubahan Sifat Fisika dikaitkan dengan ukuran Sifat Kimia Sifat Intensif Sifat Ekstensif
SIFAT MATERI Sifat materi Sifat Fisika Sifat Kimia Kesehatan

SIFAT FISIKA Sifat yang dapat diamati karena ada perubahan fisika atau perubahan yang tidak kekal Sifat Fisika Contoh Suhu Massa Warna Bau Air untuk mandi 40°C 5 gram Nikel Belerang kuning H 2 S busuk Titik didih Kelarutan Berat jenis Kekerasan Kelistrikan Air pada 100°C Na. Cl larut dalam air Air 1 gram/mili. Liter Intan sangat keras Besi menghantar listrik Kesehatan Adaptif

SIFAT KIMIA Adalah sifat-sifat yang dapat diamati muncul pada saat terjadi perubahan kimia Substansi Besi (Fe) Karbon (C) Natrium (Na) TNT Sifat kimia Korosi → Fe 2 O 3 Terbakar → CO 2 Dengan air → Na. OH + H 2 Meledak (terurai) → gas Kesehatan Adaptif
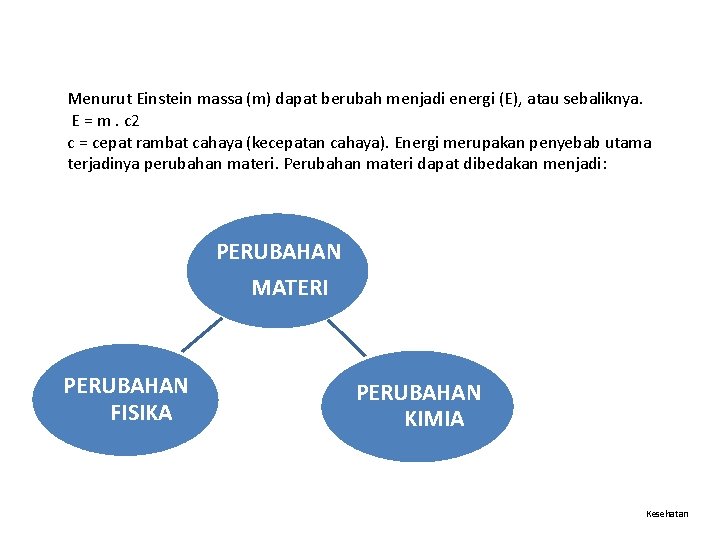
Menurut Einstein massa (m) dapat berubah menjadi energi (E), atau sebaliknya. E = m. c 2 c = cepat rambat cahaya (kecepatan cahaya). Energi merupakan penyebab utama terjadinya perubahan materi. Perubahan materi dapat dibedakan menjadi: PERUBAHAN MATERI PERUBAHAN FISIKA PERUBAHAN KIMIA Kesehatan
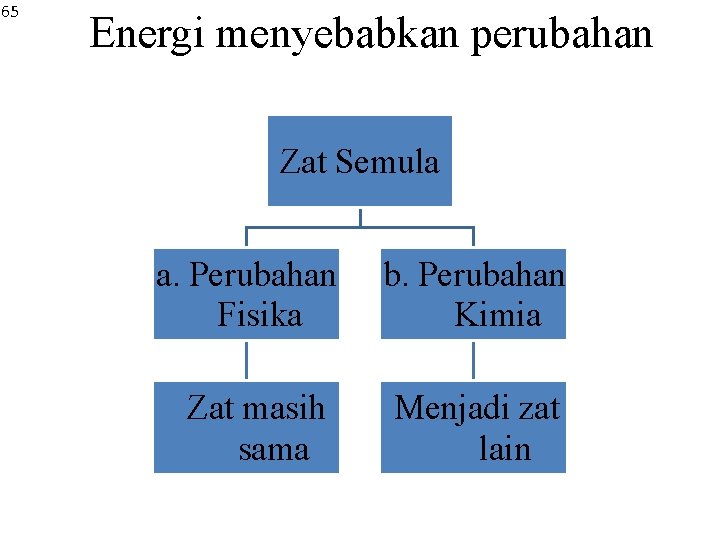
65 Energi menyebabkan perubahan Zat Semula a. Perubahan Fisika b. Perubahan Kimia Zat masih sama Menjadi zat lain

bersifat dapat balik(reversible) dan tidak menghasilkan zat baru Contoh: lilin meleleh, air membeku, dan besi memuai Kesehatan

bersifat tidak balik (irreversible) dan kekal. menghasilkan zat baru yang berbeda dengan zat semula. Perubahan kimia selanjutnya disebut reaksi kimia Contoh: besi berkarat, kertas/ kayu terbakar, dan fotosintesis, pemanasan batu kapur. Kesehatan

Ciri reaksi kimia 1. 2. 3. 4. 5. 6. Perubahan bau Perubahan warna Pembentukan gas Timbulnya cahaya Pembentukan endapan baru Perubahan p. H Kesehatan

1. Terjadi perubahan warna contoh: apel yang dipotong kemudian dibiarkan 2. Terjadi perubahan suhu contoh: reaksi kapur tohor dengan air Ca. O + H 2 O Ca(OH)2 3. Terjadi pembentukan endapan contoh: reaksi larutan kapur dengan CO 2 Ca(OH)2 + CO 2 Ca. CO 3 (s) + H 2 O 4. Terjadi pembentukan gas contoh: reaksi asam cuka dengan soda kue CH 3 COOH + Na. HCO 3 CH 3 COONa + H 2 O + CO 2

Sifat fisika & kimia materi • Zat diidentifikasi dari sifat-sifat & susunannya. • Warna, titik leleh, titik didih, & kerapatan : sifat fisika. • Sifat fisika: dapat diukur & diamati tanpa mengubah susunan/identitas suatu zat. Contoh: • mengukur titik leleh es dg memanaskan es balok & mencatat suhunya ketika es berubah menjadi cair. • Air berbeda dg es hnya dr penampilan & tdk dr susunannya. ---perubahan fisika.
Sifat kimia • Gas hydrogen terbakar dlm gas oksigen menghasilkan air. • Ada melakukan perubahan kimia, pembakaran. H & O 2 hilang, berganti H 2 O. Secara kimia berbeda air dg O & H. tdk diperoleh kembali O & H dr air. • Perebusan telur. • Pencernaan tubuh.

Semua sifat materi dapat diukur dibagi dalam golongan: 2 • Sifat ekstensif & intensif. • Nilai sifat ekstensif yg terukur bergantung pd seberapa banyak materi yg diukur. • massa, panjang, volume. • Semakin banyak materi semakin besar massa. • Nilai dari ekstensif yg sama dpt dijumlahkan. • Contoh: 2 keping logam mempunyai massa gabungan yg merupakan jlh dr masing 2 keping uang tsbt.

• Nilai terukur dr sifat intensif tdk bergantung pd jlh materi yg diukur. • Contoh: suhu. Jk 2 gelas air dg suhu yg sama, mk jk dicampur suhu air tetap sama spt pd keadaan terpisah.

7 4 HUKUM DASAR KIMIA X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa HUKUM PROUST (hukum perbandingan tetap) PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Perbandingan massa unsur-unsur yang membentuk suatu senyawa selalu tetap Perbandingan massa C dan O dalam CO 2 selalu 3 : 8 Perbandingan massa H dan O dalam H 2 O selalu 1 : 8 Perbandingan massa C , H dan O dalam asam cuka selalu 6 : 1 : 8 Dan lain sebagainya
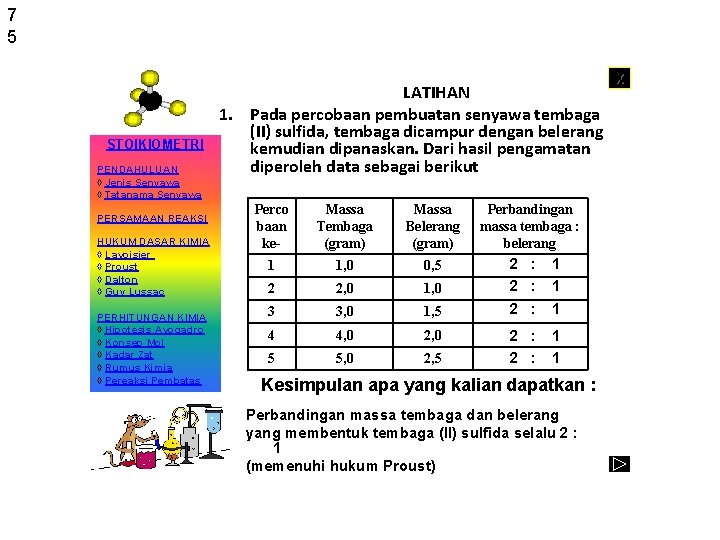
7 5 STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas LATIHAN 1. Pada percobaan pembuatan senyawa tembaga (II) sulfida, tembaga dicampur dengan belerang kemudian dipanaskan. Dari hasil pengamatan diperoleh data sebagai berikut Perco baan ke- Massa Tembaga (gram) Massa Belerang (gram) 1 1, 0 0, 5 2 2, 0 1, 0 3 3, 0 1, 5 4 4, 0 2, 0 5 5, 0 2, 5 Perbandingan massa tembaga : belerang 2 : 2 : 1 1 1 2 : 1 1 Kesimpulan apa yang kalian dapatkan : Perbandingan massa tembaga dan belerang yang membentuk tembaga (II) sulfida selalu 2 : 1 (memenuhi hukum Proust) X

7 6 X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa 2. Air terbentuk dari unsur hidrogen dan oksigen dengan perbandingan massa 1 : 8. Apabila tersedia 4, 0 gram hidrogen, berapa gram oksigen yang diperlukan agar seluruh hidrogen habis bereaksi membentuk air? PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Jawab : Perbandingan massa hidrogen : oksigen =1 : 8 4 gram Massa hidrogen = 8/1 x 4 = 32 gram Massa oksigen = Jadi massa oksigen yang dibutuhkan adalah 32 gram.

7 7 STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI 3. Belerang sebanyak 3, 2 gram tepat bereaksi dengan sejumlah gas oksigen membentuk 8 gram senyawa belerang trioksida. Tentukan perbandingan massa belerang dan oksigen yang terdapat dalam belerang trioksida tersebut. Jawab : HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac Massa belerang = 3, 2 gram PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Massa oksigen =(8 – 3, 2) = 4, 8 gram Massa belerang trioksida = 8 gram Jadi perbandingan massa belerang : oksigen = 3, 2 : 4, 8 = 2 : 3 X

7 8 X LATIHAN 1. Unsur Nitrogen dan Oksigen dapat membentuk dua macam senyawa dengan data sebagai berikut STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas Senyawa I Massa Nitrogen Massa Oksigen 28 gram 32 gram II 28 gram 64 gram Gunakan data tersebut untuk menguji berlakunya hukum Dalton Jawab : Senyawa I II Perbandingan Massa Nitrogen : Massa Oksigen 28 : 32 = 7 : 8 28 : 64 = 7 : 16 Jadi perbandingan massa oksigen yang mengikat sejumlah unsur nitrogen yang sama = 8 : 16 = 1 : 2 Perbandingan massa oksigen antara senyawa I dan senyawa II merupakan bilangan bulat dan sederhana sehingga memenuhi hukum dalton

7 9 2. STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas X Unsur Karbon dan Oksigen dapat membentuk dua macam senyawa dengan data sebagai berikut Senyawa Massa Karbon Massa Oksigen CO 0, 12 gram 0, 16 gram CO 2 0, 24 gram 0, 64 gram Gunakan data tersebut untuk menguji berlakunya hukum Dalton Jawab : Senyawa CO CO 2 Perbandingan Massa Karbon : Massa Oksigen 0, 12 : 0, 16 = 3 : 4 0, 24 : 0, 64 = 3 : 8 Jadi perbandingan massa oksigen yang mengikat sejumlah 4: 8=1: 2 unsur karbon yang sama = Kesimpulan : Hukum dalton berlaku, karena perbandingan massa oksigen antara senyawa I dan senyawa II merupakan bilangan bulat dan sederhana

8 0 STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa 3. Unsur A dan B membentuk dua senyawa. Senyawa I mengandung 15 gram A dan 80 gram B. Senyawa II mengandung 30 gram A dan 240 gram B. Gunakan data tersebut untuk menguji berlakunya hukum Dalton Jawab : ` PERSAMAAN REAKSI Senyawa Massa A Massa B HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac I 15 gram 30 gram 80 gram 240 gram PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas X II Senyawa I II Perbandingan Massa A : Massa B 15 : 80 = 3 : 16 30 : 240 = 3 : 24 Jadi perbandingan massa B yang mengikat sejumlah massa A yang sama = 16 : 24 = 2 : 3 Kesimpulan : Sesuai dengan hukum dalton, karena perbandingan massa B antara senyawa I dan senyawa II merupakan bilangan bulat dan sederhana

8 1 HUKUM DASAR KIMIA X STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas LUSSAC HUKUM GAY (hukum perbandingan volume) Apabila diukur pada suhu dan tekanan yang sama, maka perbandingan volume gas yang bereaksi dan hasil reaksi merupakan bilangan bulat dan sederhana Dalam reaksi kimia perbandingan volume gas = perbandingan koefisien

8 2 X LATIHAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 1. Pada reaksi antara gas hidrogen dan gas oksigen menghasilkan uap air. Berapa liter gas oksigen yang diperlukan dan berapa liter uap air yang dihasilkan apabila gas hidrogen yang direaksikan sebanyak 12 liter. Jawab : Persamaan reaksi : Perbandingan volume: Volume : 2 H 2(g) + O 2(g) → 2 H 2 O(g) 2 12 L 1 6 L 2 12 L 6 L sedangkan uap air yang dihasilkan 12 L Jadi volume gas oksigen yang diperlukan

8 3 X LATIHAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 2. Pada temperatur dan tekanan yang sama direaksikan 30 m. L gas hidrogen dengan 10 m. L gas nitrogen menghasilkan gas amoniak. Tentukan jumlah volume gas amoniak yang terbentuk! Jawab : Persamaan reaksi : Perbandingan volume: Volume : 3 H 2(g) + N 2(g) 2 NH 3(g) 3 30 m. L 1 10 m. L Jadi volume gas amoniak yang terbentuk 20 2 20 m. L

8 4 X LATIHAN STOIKIOMETRI PENDAHULUAN ◊ Jenis Senyawa ◊ Tatanama Senyawa PERSAMAAN REAKSI HUKUM DASAR KIMIA ◊ Lavoisier ◊ Proust ◊ Dalton ◊ Guy Lussac PERHITUNGAN KIMIA ◊ Hipotesis Avogadro ◊ Konsep Mol ◊ Kadar Zat ◊ Rumus Kimia ◊ Pereaksi Pembatas 3. Berapa volume gas belerang trioksida yang terbentuk apabila 2 Liter gas belerang dioksida bereaksi sempurna dengan gas oksigen? Jawab : Persamaan reaksi : 2 SO 2(g) + O 2(g) 2 SO 3(g) Perbandingan volume : Volume : 2 1 2 2 L 1 L 2 L Jadi volume gas belerang trioksida yang terbentuk 2 L
- Slides: 84