Il legame chimico II la geometria molecolare e














- Slides: 76

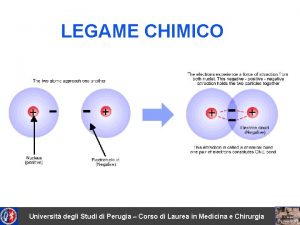
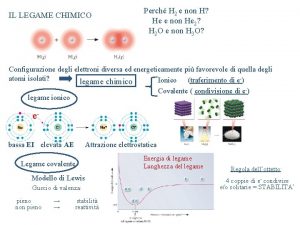
Il legame chimico II: la geometria molecolare e l’ibridizzazione degli orbitali atomici Capitolo 7 Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

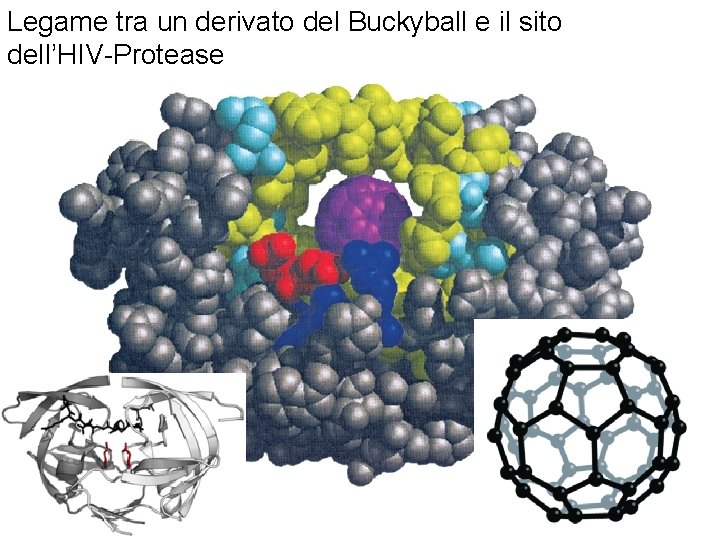
Legame tra un derivato del Buckyball e il sito dell’HIV-Protease Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

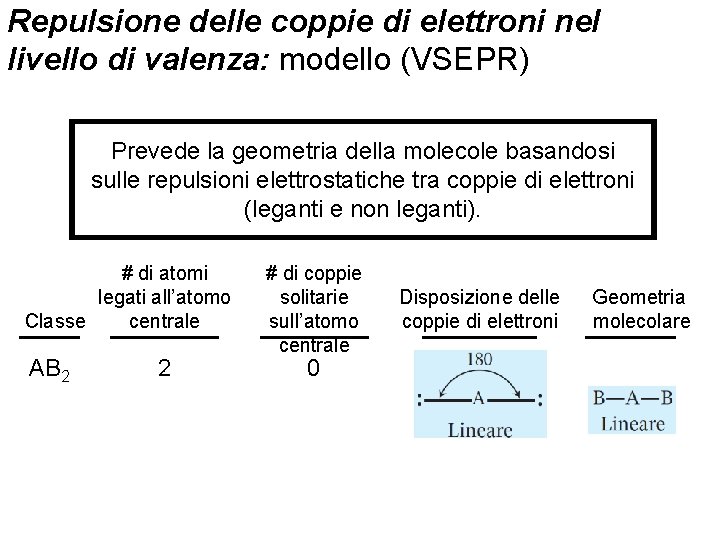
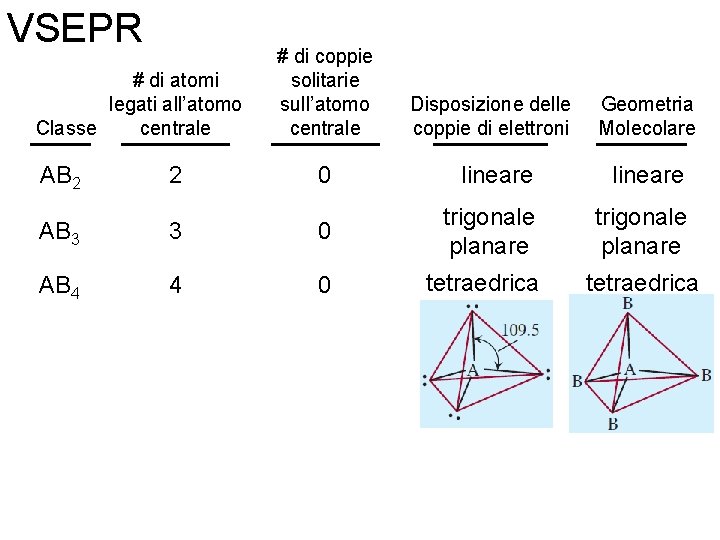
Repulsione delle coppie di elettroni nel livello di valenza: modello (VSEPR) Prevede la geometria della molecole basandosi sulle repulsioni elettrostatiche tra coppie di elettroni (leganti e non leganti). # di atomi legati all’atomo centrale Classe AB 2 2 Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby # di coppie solitarie sull’atomo centrale Disposizione delle coppie di elettroni Geometria molecolare 0 Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

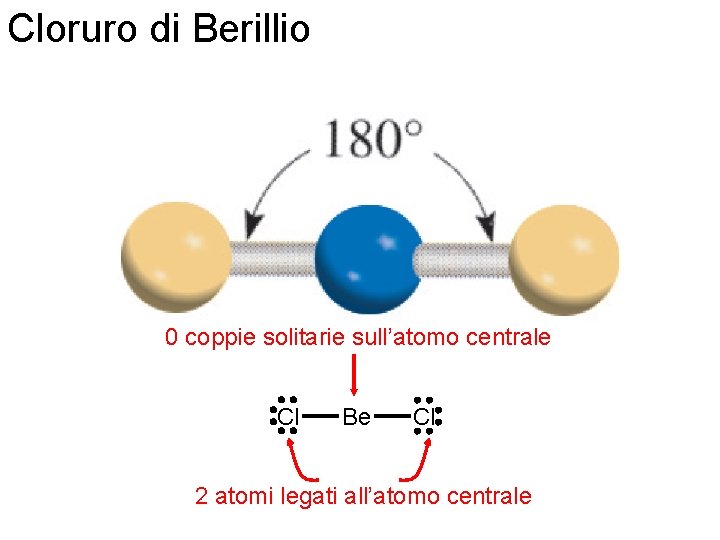
Cloruro di Berillio 0 coppie solitarie sull’atomo centrale Cl Be Cl 2 atomi legati all’atomo centrale Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

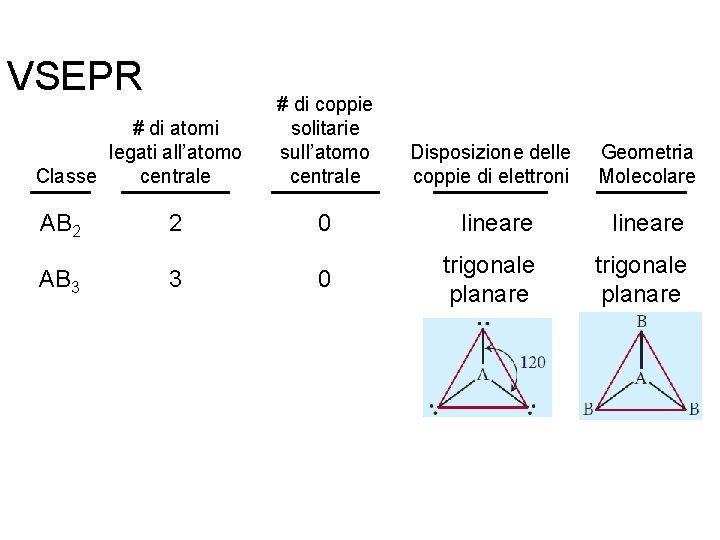
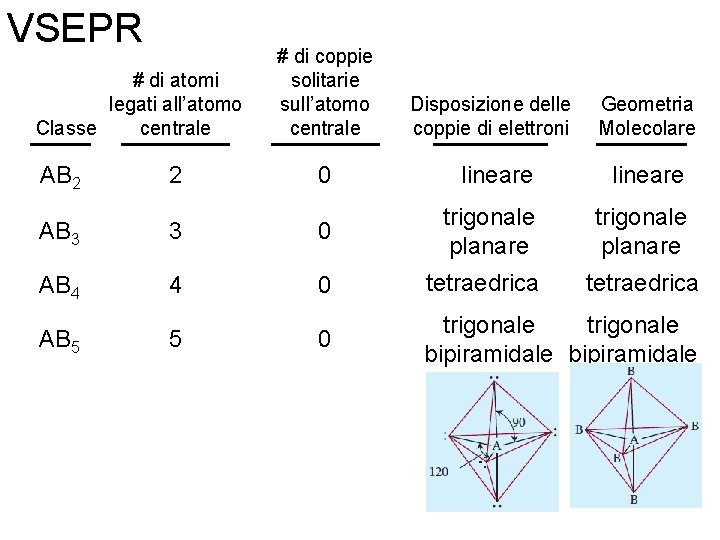
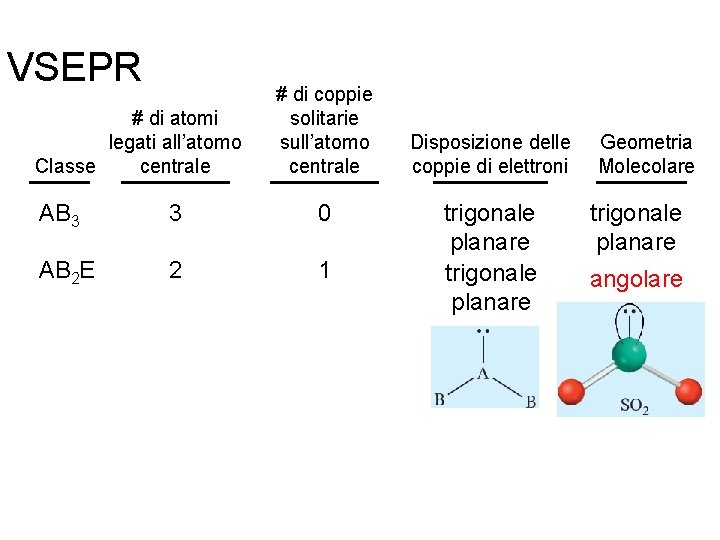
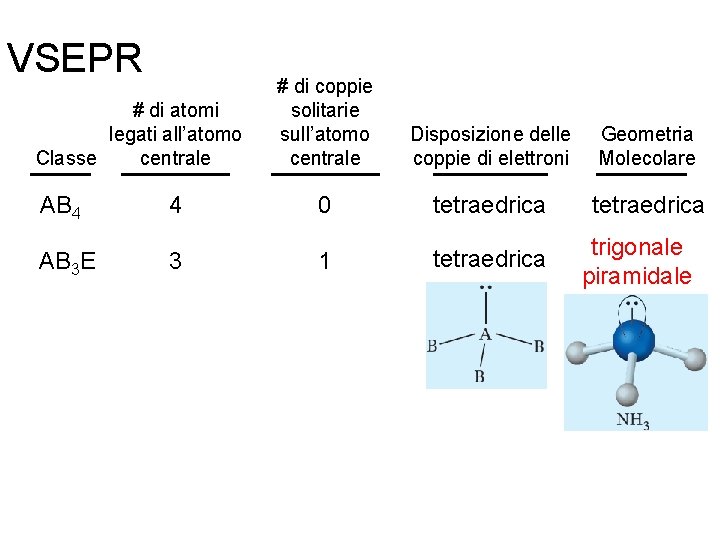
VSEPR # di atomi legati all’atomo centrale Classe # di coppie solitarie sull’atomo centrale Disposizione delle coppie di elettroni Geometria Molecolare AB 2 2 0 lineare AB 3 3 0 trigonale planare Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

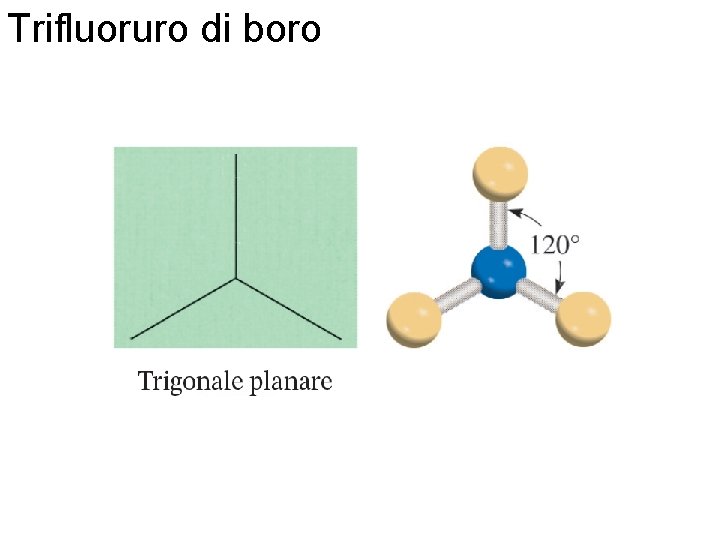
Trifluoruro di boro Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

VSEPR # di atomi legati all’atomo centrale Classe # di coppie solitarie sull’atomo centrale Disposizione delle coppie di elettroni Geometria Molecolare AB 2 2 0 lineare AB 3 3 0 trigonale planare AB 4 4 0 tetraedrica Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

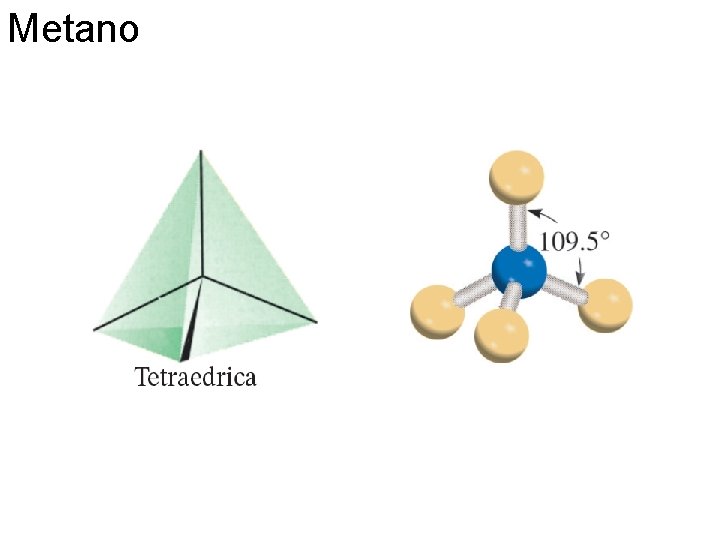
Metano Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

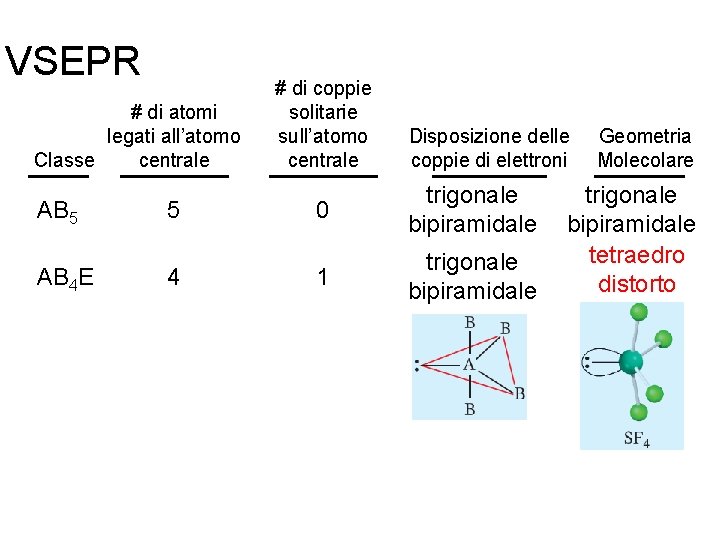
VSEPR # di atomi legati all’atomo centrale Classe # di coppie solitarie sull’atomo centrale Disposizione delle coppie di elettroni Geometria Molecolare AB 2 2 0 lineare AB 3 3 0 trigonale planare AB 4 4 0 tetraedrica AB 5 5 0 trigonale bipiramidale Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

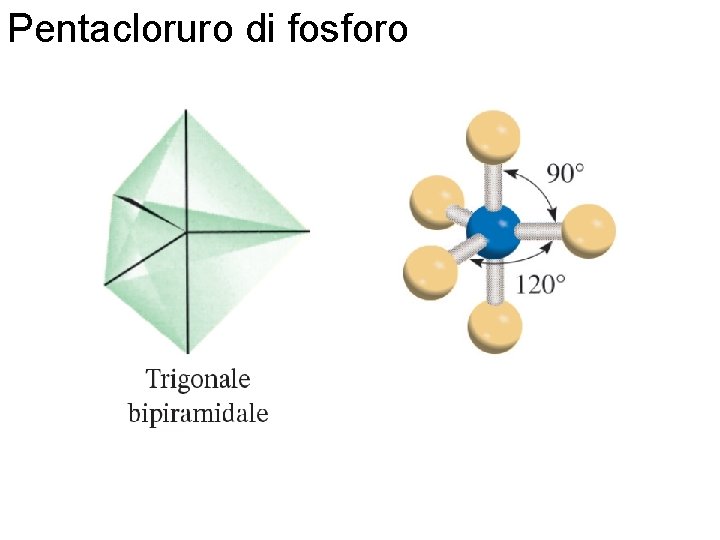
Pentacloruro di fosforo Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

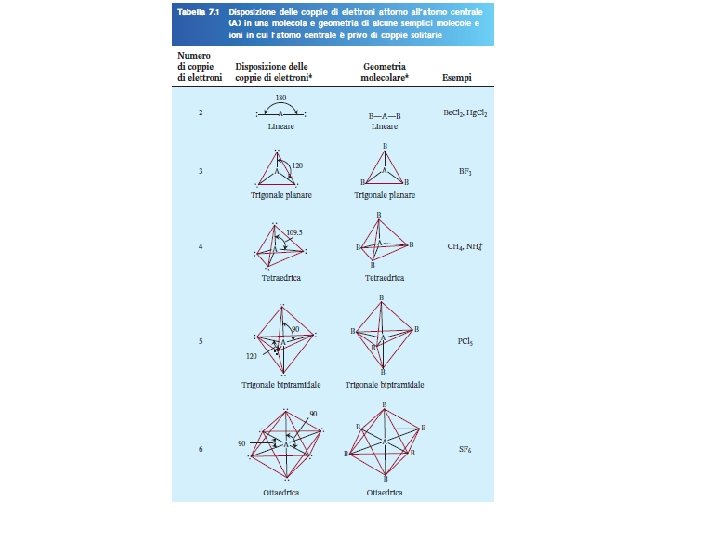
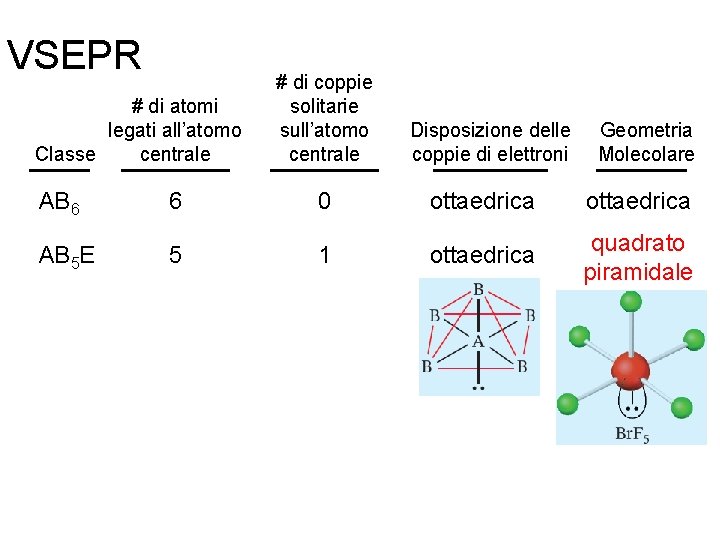
VSEPR # di atomi legati all’atomo centrale Classe # di coppie solitarie sull’atomo centrale Disposizione delle coppie di elettroni AB 2 2 0 AB 3 3 0 lineare trigonale planare AB 4 4 0 tetraedrica AB 5 5 0 trigonale bipiramidale AB 6 6 0 ottaedrica 10. 1 Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Geometria Molecolare lineare trigonale planare tetraedrica trigonale bipiramidale ottaedrica Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

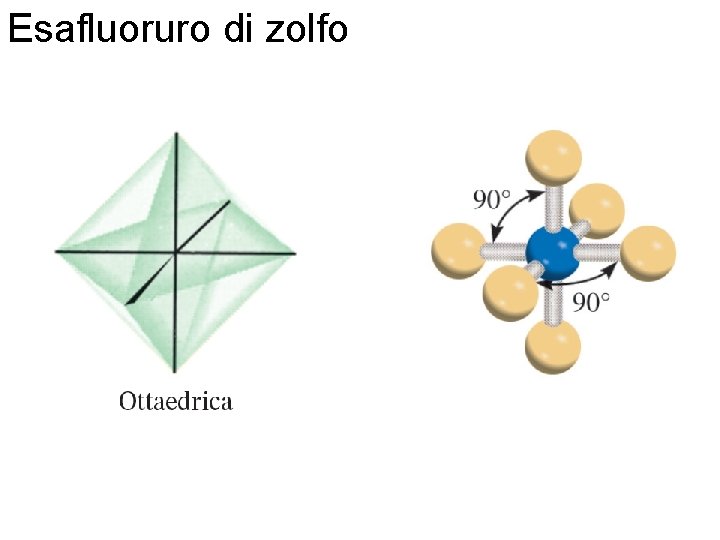
Esafluoruro di zolfo Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

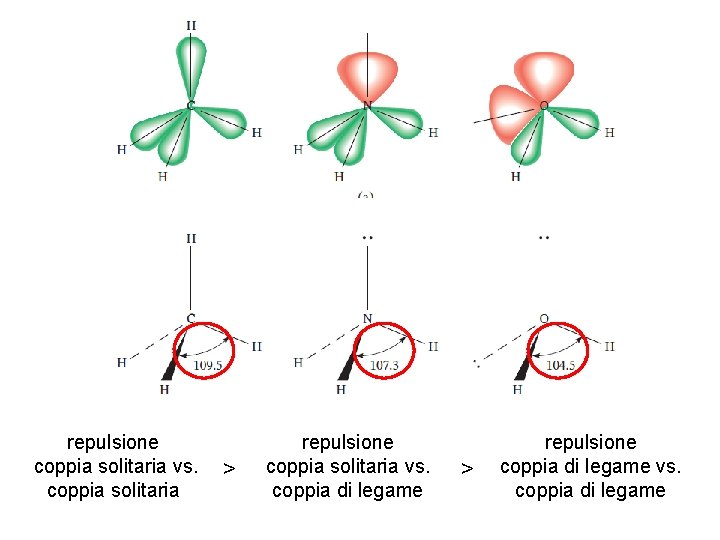
repulsione coppia solitaria vs. coppia solitaria > Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby repulsione coppia solitaria vs. coppia di legame > repulsione coppia di legame vs. coppia di legame Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

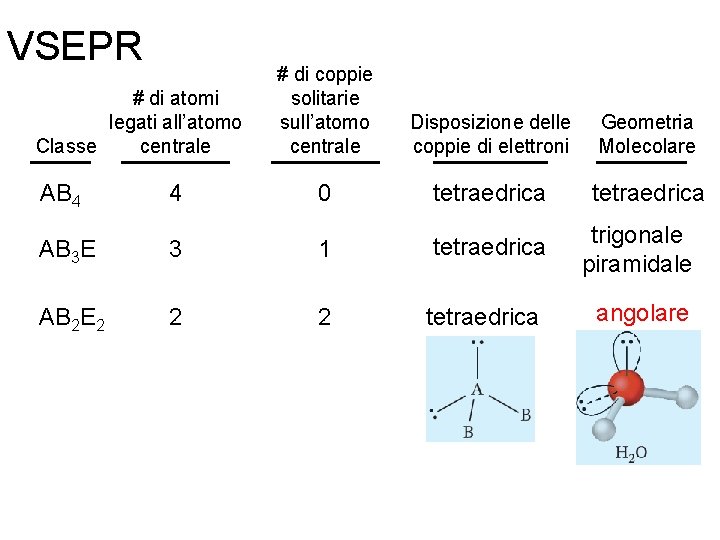
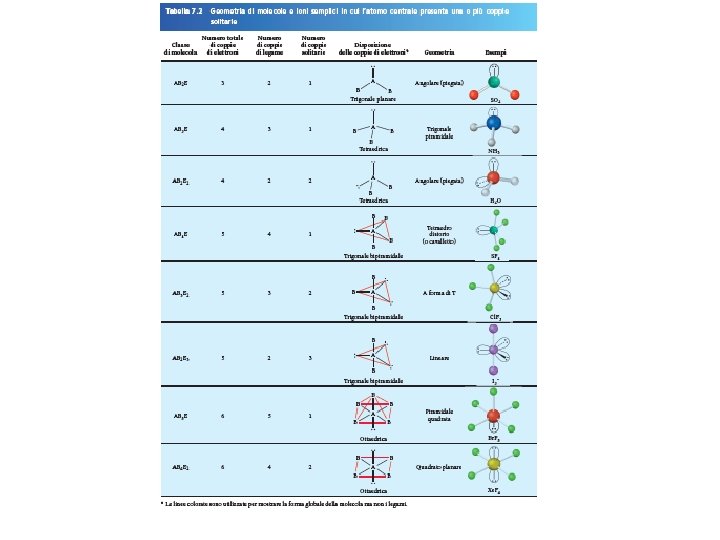
VSEPR # di atomi legati all’atomo centrale Classe # di coppie solitarie sull’atomo centrale AB 3 3 0 AB 2 E 2 1 Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Disposizione delle coppie di elettroni trigonale planare Geometria Molecolare trigonale planare angolare Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

VSEPR # di atomi legati all’atomo centrale Classe AB 4 AB 3 E 4 3 Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby # di coppie solitarie sull’atomo centrale Disposizione delle coppie di elettroni Geometria Molecolare 0 tetraedrica 1 tetraedrica trigonale piramidale Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

VSEPR # di atomi legati all’atomo centrale Classe AB 4 4 # di coppie solitarie sull’atomo centrale Disposizione delle coppie di elettroni Geometria Molecolare 0 tetraedrica trigonale piramidale angolare AB 3 E 3 1 tetraedrica AB 2 E 2 2 2 tetraedrica Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

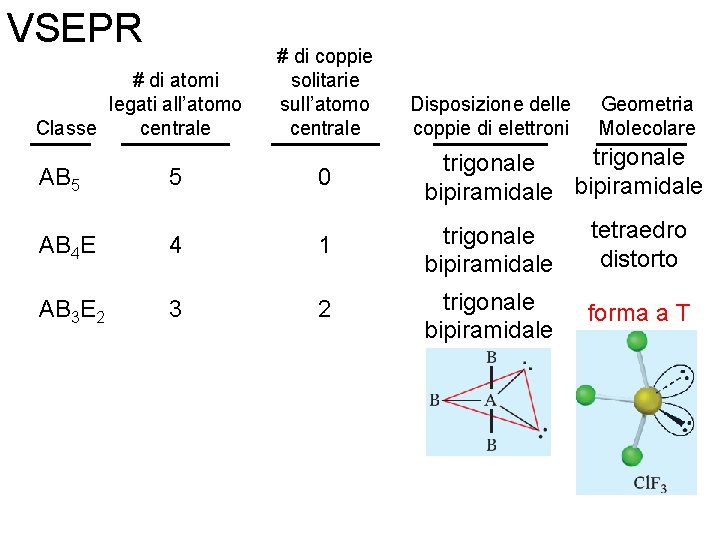
VSEPR # di atomi legati all’atomo centrale Classe AB 5 AB 4 E 5 4 Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby # di coppie solitarie sull’atomo centrale Disposizione delle coppie di elettroni 0 trigonale bipiramidale 1 trigonale bipiramidale Geometria Molecolare trigonale bipiramidale tetraedro distorto Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

VSEPR # di atomi legati all’atomo centrale Classe AB 5 5 # di coppie solitarie sull’atomo centrale Disposizione delle coppie di elettroni 0 trigonale bipiramidale tetraedro distorto forma a T AB 4 E 4 1 trigonale bipiramidale AB 3 E 2 3 2 trigonale bipiramidale Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Geometria Molecolare Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

VSEPR # di atomi legati all’atomo centrale Classe # di coppie solitarie sull’atomo centrale AB 5 5 0 AB 4 E 4 1 AB 3 E 2 3 2 AB 2 E 3 2 Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby 3 Disposizione delle coppie di elettroni trigonale bipiramidale Geometria Molecolare trigonale bipiramidale tetraedro distorto forma a T lineare Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

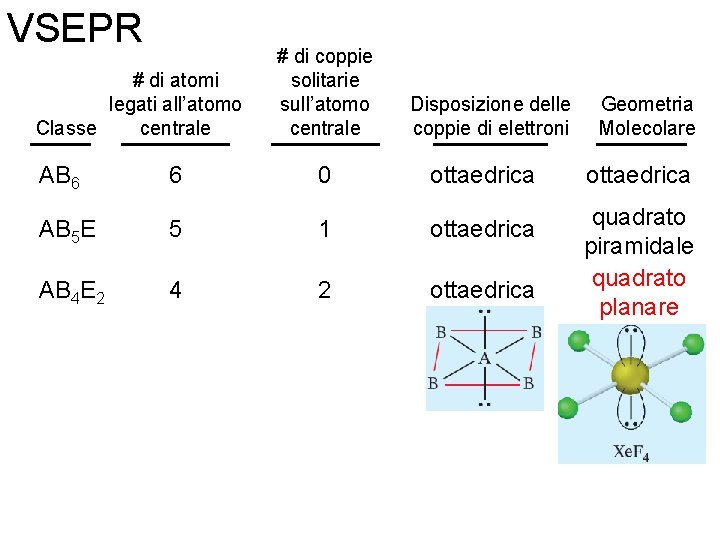
VSEPR # di atomi legati all’atomo centrale Classe # di coppie solitarie sull’atomo centrale Disposizione delle coppie di elettroni Geometria Molecolare AB 6 6 0 ottaedrica AB 5 E 5 1 ottaedrica quadrato piramidale Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

VSEPR # di atomi legati all’atomo centrale Classe # di coppie solitarie sull’atomo centrale Disposizione delle coppie di elettroni Geometria Molecolare AB 6 6 0 ottaedrica AB 5 E 5 1 ottaedrica AB 4 E 2 4 2 ottaedrica quadrato piramidale quadrato planare Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

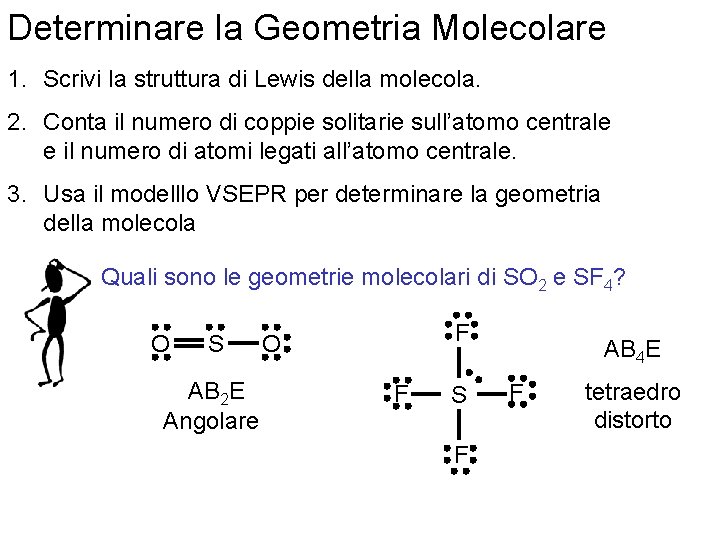
Determinare la Geometria Molecolare 1. Scrivi la struttura di Lewis della molecola. 2. Conta il numero di coppie solitarie sull’atomo centrale e il numero di atomi legati all’atomo centrale. 3. Usa il modelllo VSEPR per determinare la geometria della molecola Quali sono le geometrie molecolari di SO 2 e SF 4? O S AB 2 E Angolare F O F S AB 4 E F tetraedro distorto F Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

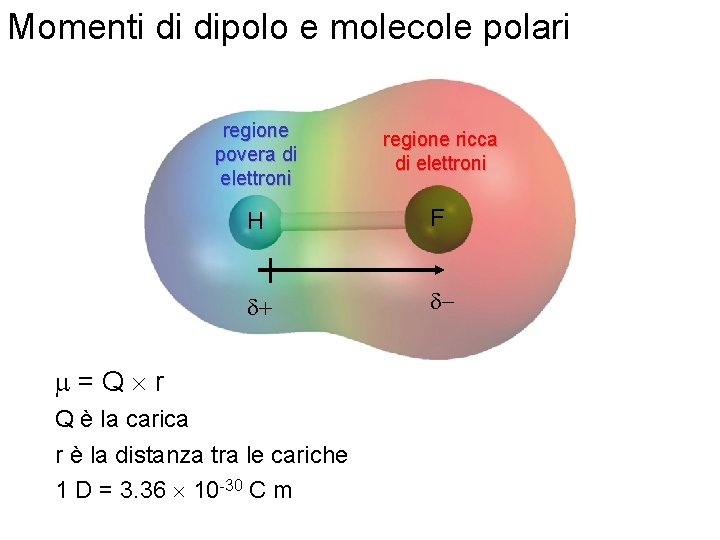
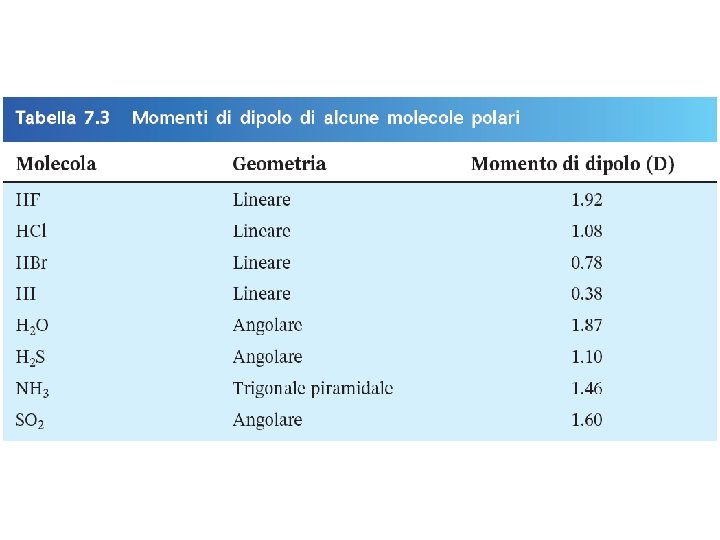
Momenti di dipolo e molecole polari regione povera di elettroni regione ricca di elettroni H F d+ d- m=Q r Q è la carica r è la distanza tra le cariche 1 D = 3. 36 10 -30 C m Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

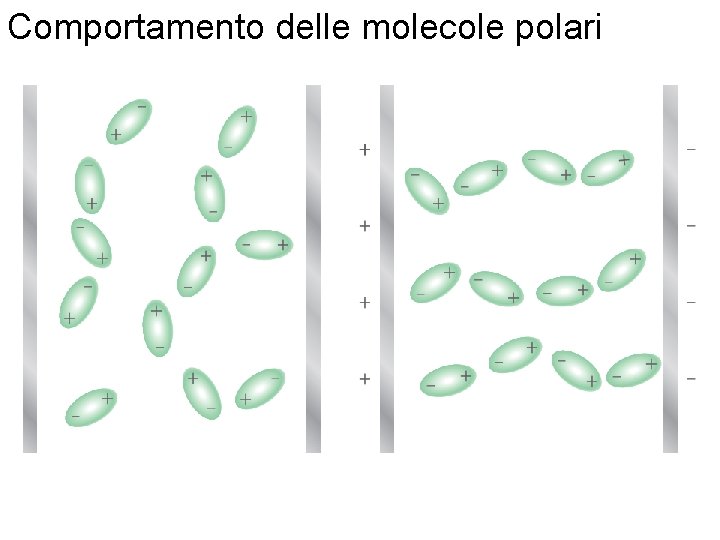
Comportamento delle molecole polari Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

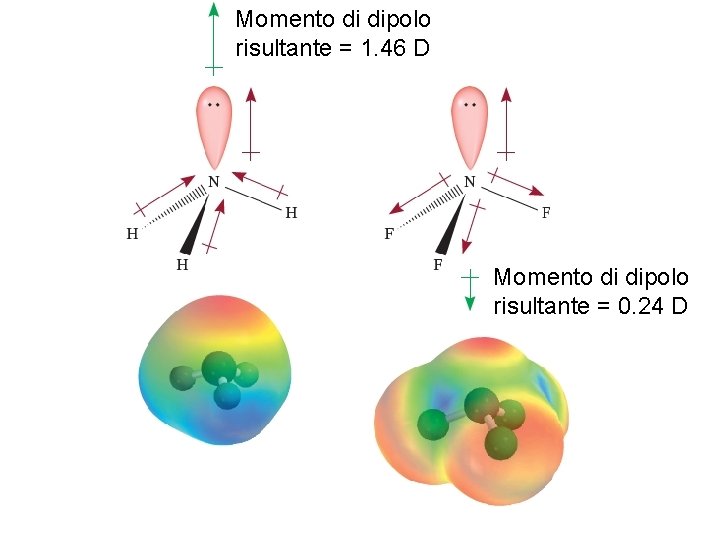
Momento di dipolo risultante = 1. 46 D Momento di dipolo risultante = 0. 24 D Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

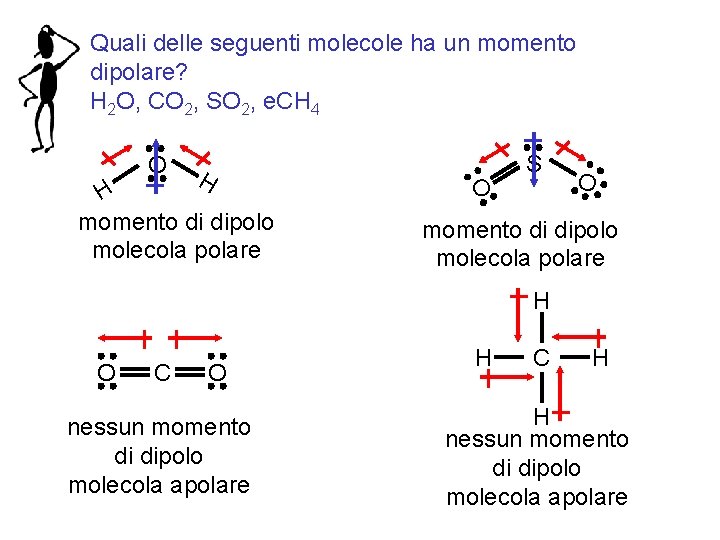
Quali delle seguenti molecole ha un momento dipolare? H 2 O, CO 2, SO 2, e. CH 4 O H H momento di dipolo molecola polare S O O momento di dipolo molecola polare H O C O nessun momento di dipolo molecola apolare Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby H C H H nessun momento di dipolo molecola apolare Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

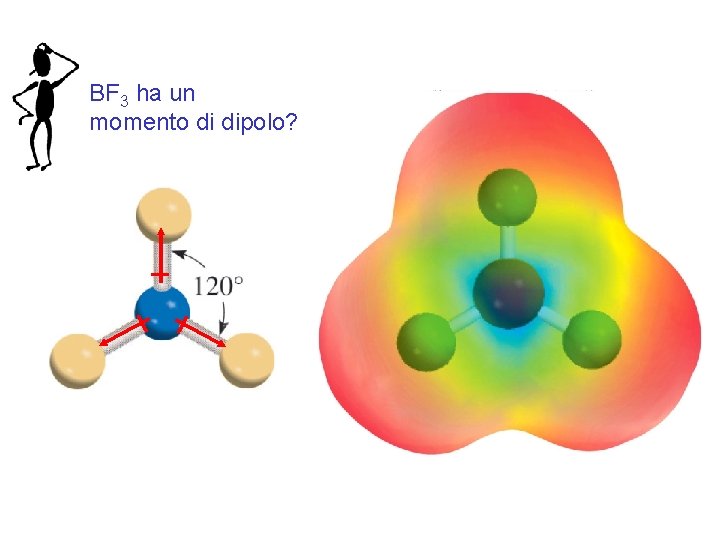
BF 3 ha un momento di dipolo? Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

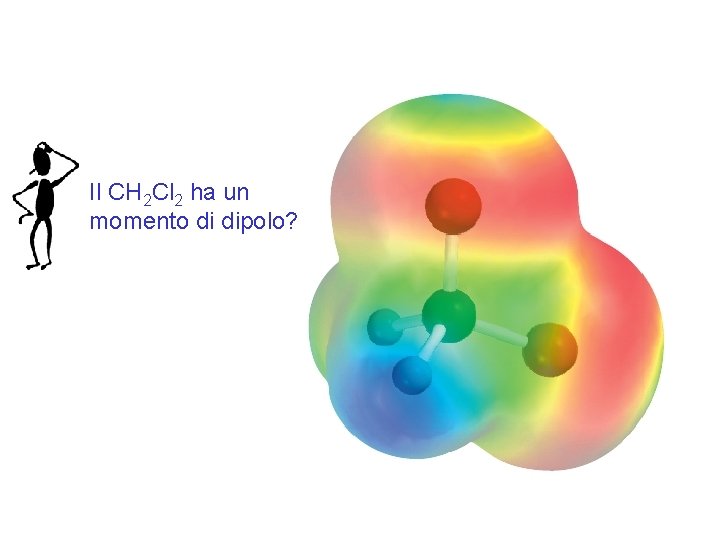
Il CH 2 Cl 2 ha un momento di dipolo? Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

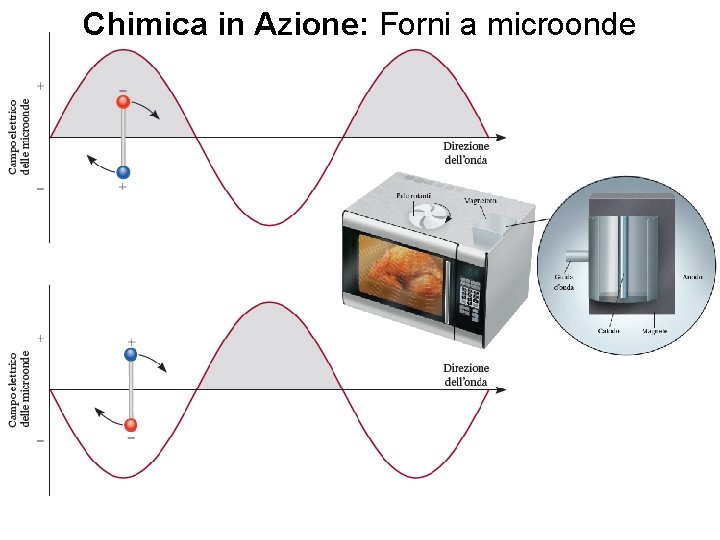
Chimica in Azione: Forni a microonde Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

In che modo la teoria di Lewis spiega i legami in H 2 e F 2? Condivisione di due elettroni tra due atomi. Energia di dissociazione di legame Lunghezza di legame Sovrapposizione H 2 436. 4 k. J/mole 74 pm 2 1 s F 2 150. 6 k. J/mole 142 pm 2 2 p Teoria del legame di valenza: i legami sono formati dalla condivisione di e– ottenuta mediante sovrapposizione di orbitali atomici. Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

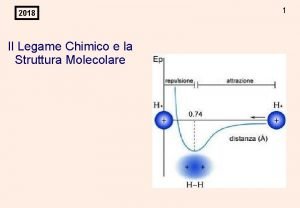
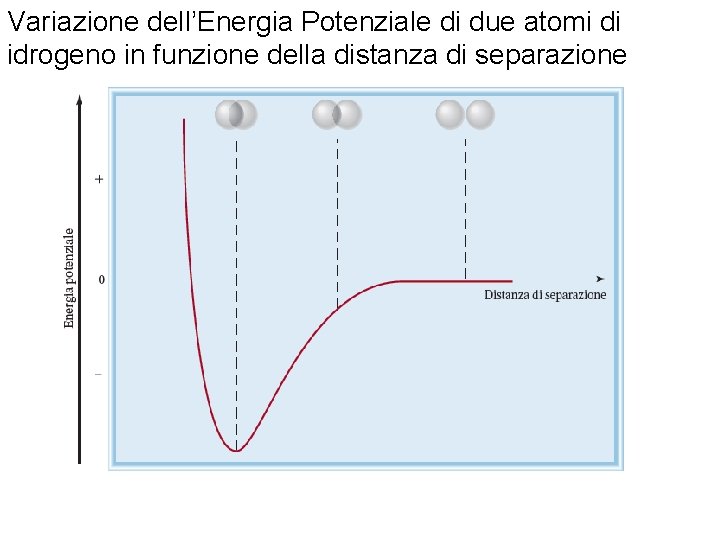
Variazione dell’Energia Potenziale di due atomi di idrogeno in funzione della distanza di separazione Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

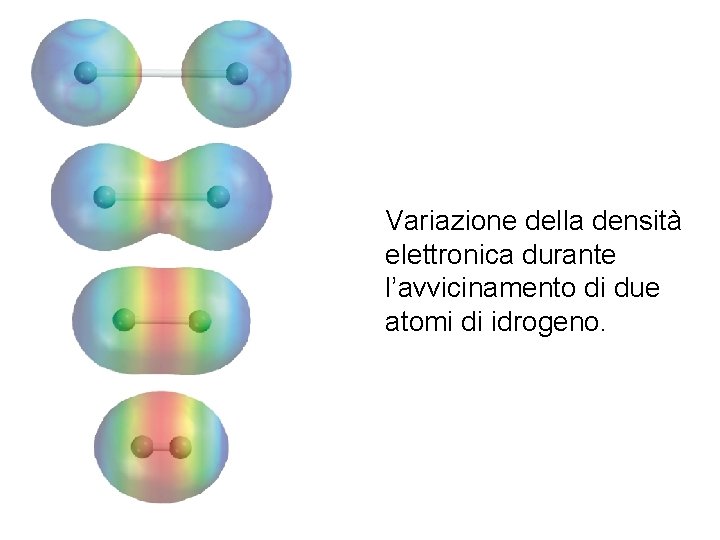
Variazione della densità elettronica durante l’avvicinamento di due atomi di idrogeno. Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

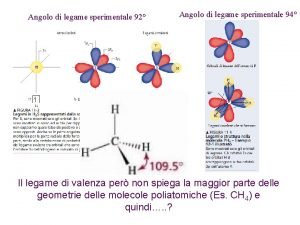
Teoria del legame di valenza e NH 3 N: 1 s 22 p 3 3 H: 1 s 1 Se il legame si forma dalla sovrapposizione di 3 orbitali 2 p dell’azoto con l’orbitale 1 s di ciascun atomo di idrogeno, quale dovrebbe essere la geometria di NH 3? se uso i 3 orbitali 2 p prevedo 900 Effettivamente l’angolo di legame H-N-H è 107. 30 Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

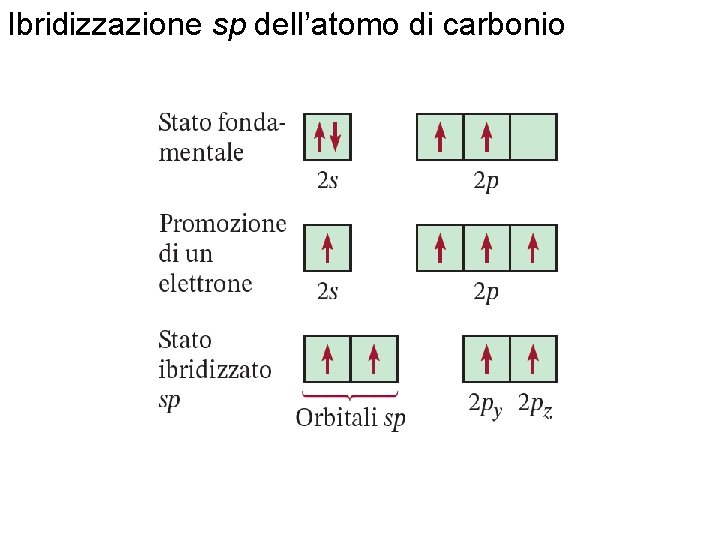
Ibridizzazione – mescolamento di due o più orbitali atomici a formare un nuovo set di orbitali ibridi. 1. Mescolare almeno 2 orbitali atomici nonequivalenti (es. s e p). Gli orbitali ibridi hanno delle forme molto diverse dagli orbitali atomici originari. 2. Il numero degli orbitali ibridi è uguale al numero degli orbitali atomici utilizzati nel processo di ibridizzazione. 3. I legami covalenti sono formati dalla: a. sovrapposizione di orbitali ibridi con orbitali atomici b. sovrapposizione di orbitali ibridi con altri orbitali ibridi Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

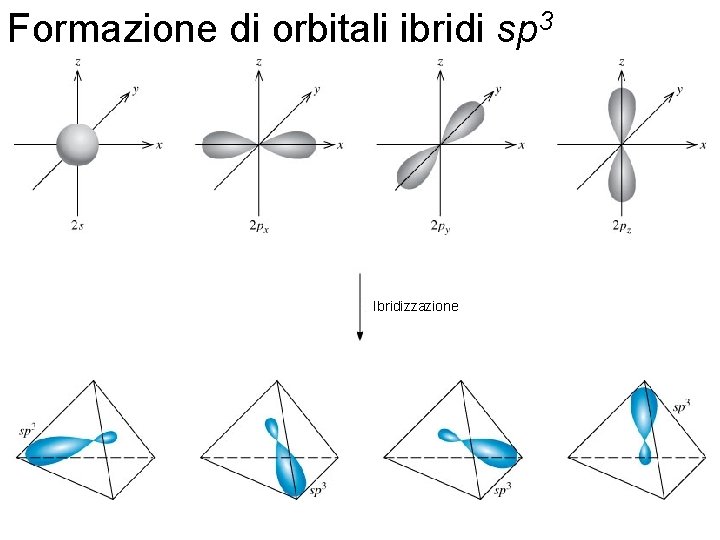
Formazione di orbitali ibridi sp 3 Ibridizzazione Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

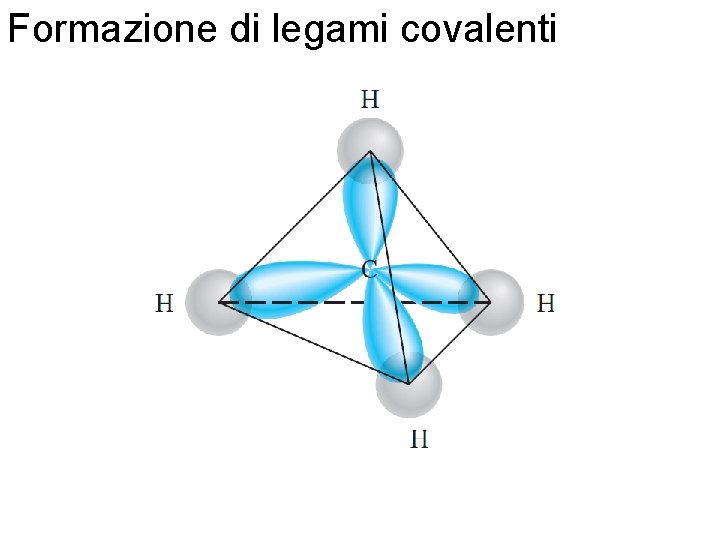
Formazione di legami covalenti Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

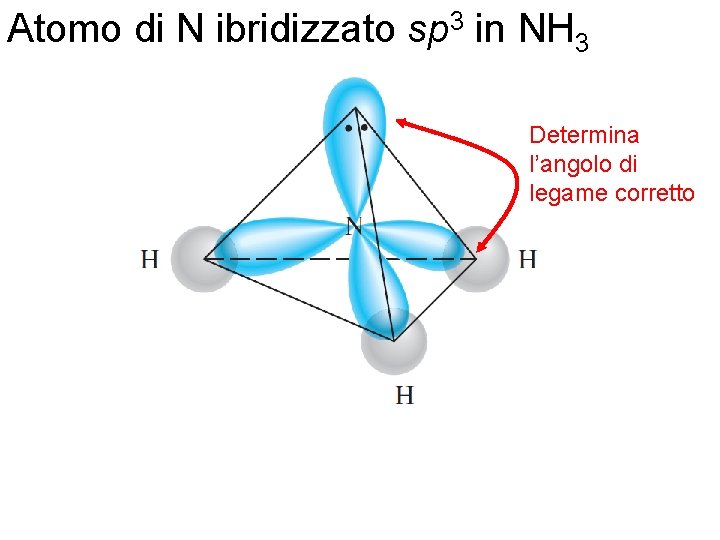
Atomo di N ibridizzato sp 3 in NH 3 Determina l’angolo di legame corretto Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

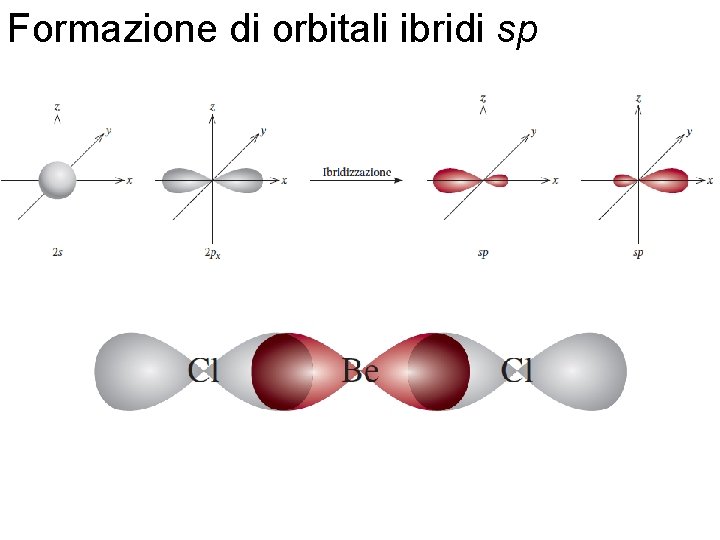
Formazione di orbitali ibridi sp Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

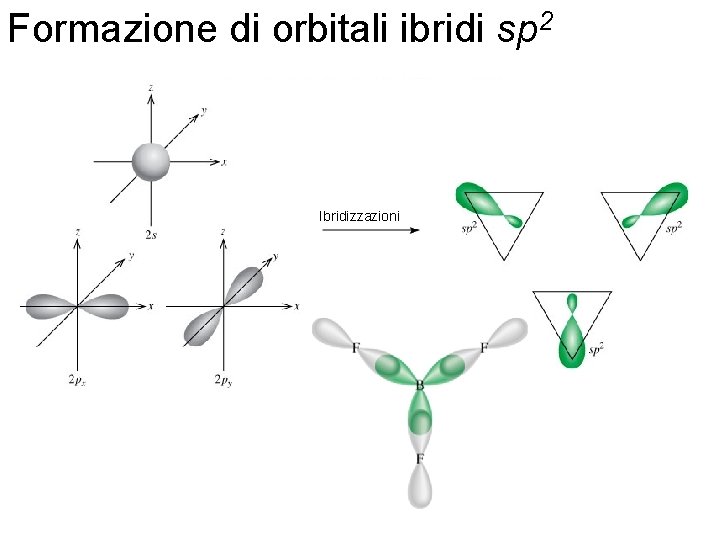
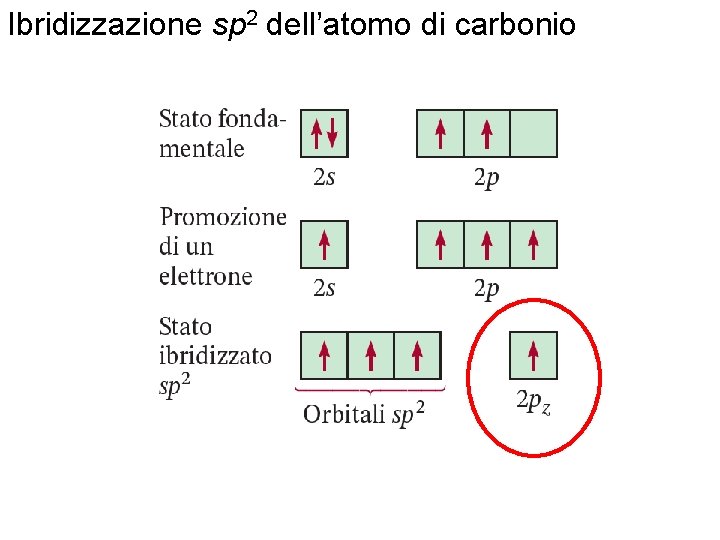
Formazione di orbitali ibridi sp 2 Ibridizzazioni Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

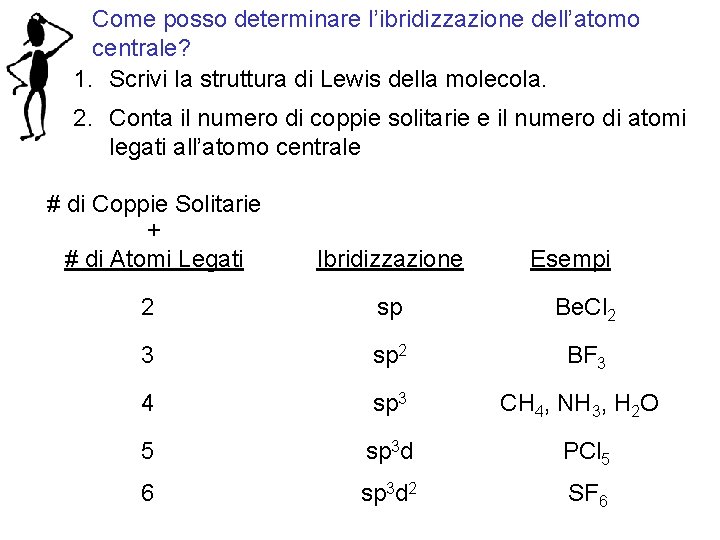
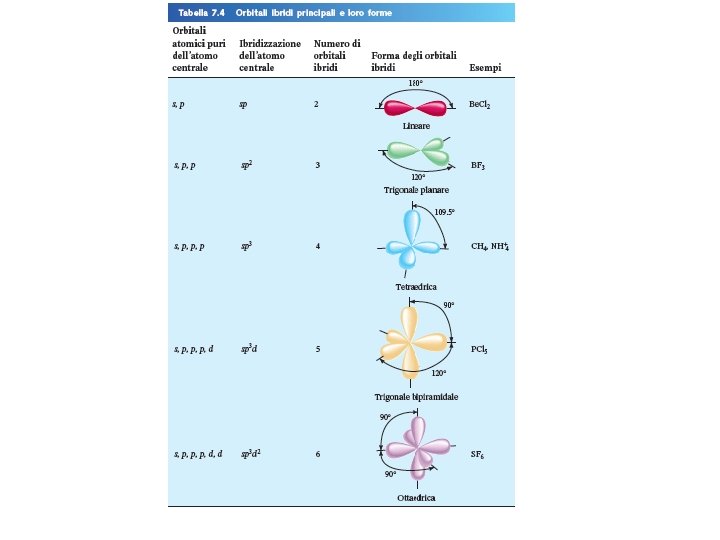
Come posso determinare l’ibridizzazione dell’atomo centrale? 1. Scrivi la struttura di Lewis della molecola. 2. Conta il numero di coppie solitarie e il numero di atomi legati all’atomo centrale # di Coppie Solitarie + # di Atomi Legati Ibridizzazione 2 sp Be. Cl 2 3 sp 2 BF 3 4 sp 3 CH 4, NH 3, H 2 O 5 sp 3 d PCl 5 6 sp 3 d 2 SF 6 Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Esempi Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

Ibridizzazione sp 2 dell’atomo di carbonio Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

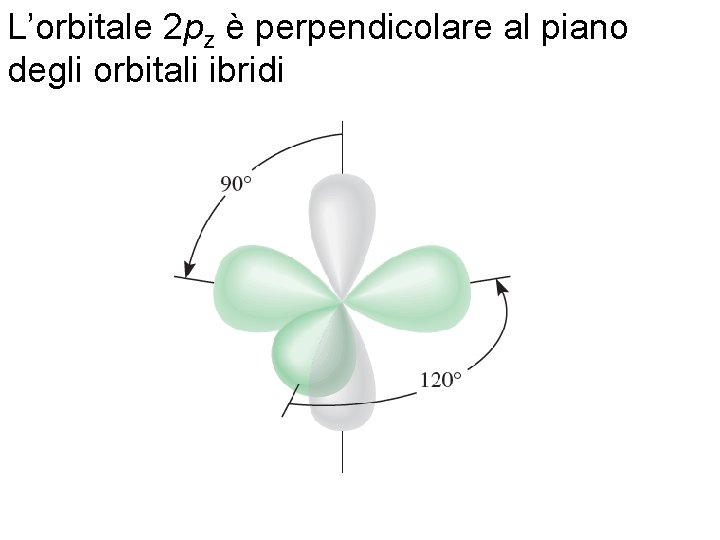
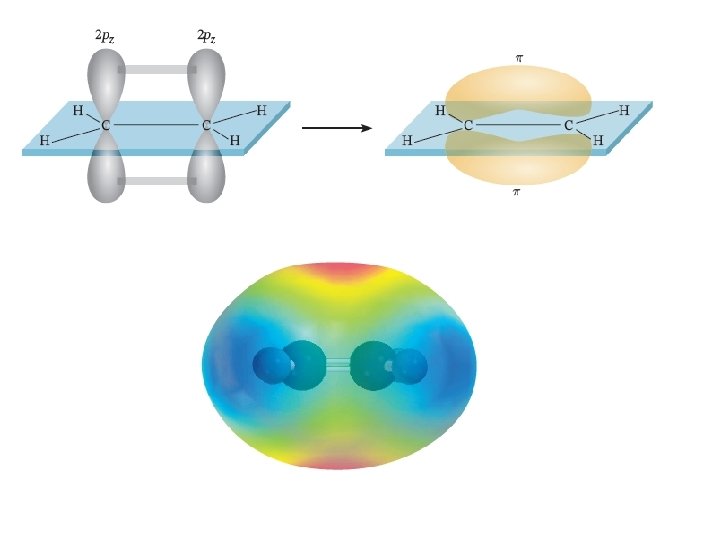
L’orbitale 2 pz è perpendicolare al piano degli orbitali ibridi Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

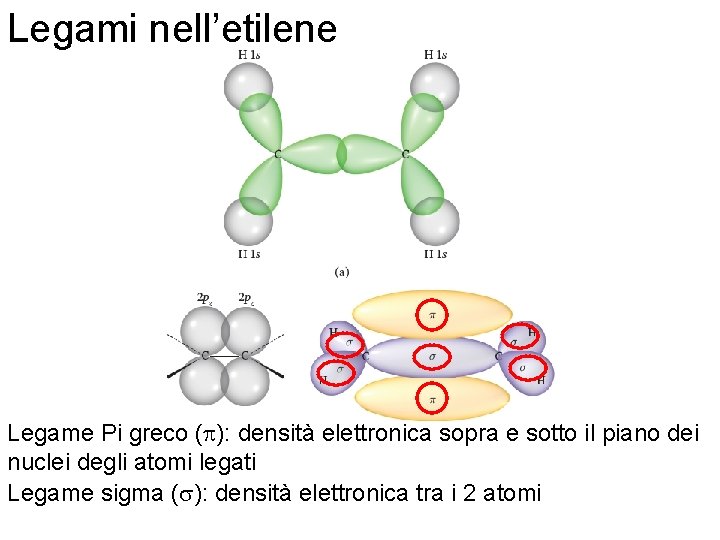
Legami nell’etilene Legame Pi greco (p): densità elettronica sopra e sotto il piano dei nuclei degli atomi legati Legame sigma (s): densità elettronica tra i 2 atomi Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

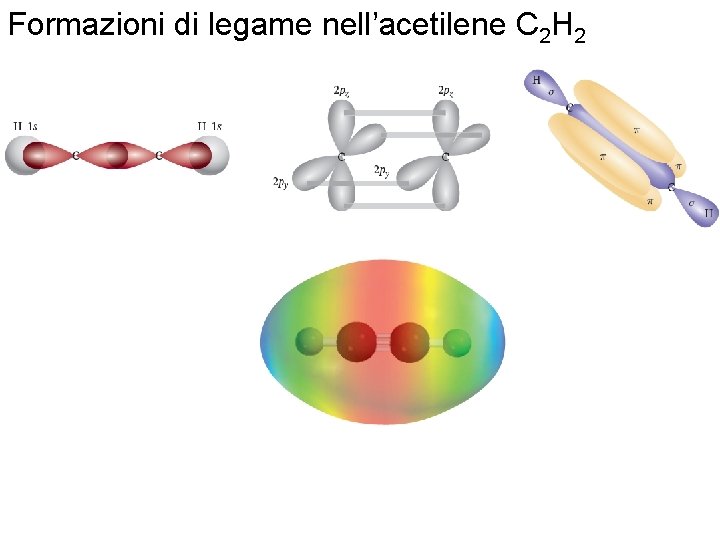
Ibridizzazione sp dell’atomo di carbonio Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

Formazioni di legame nell’acetilene C 2 H 2 Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

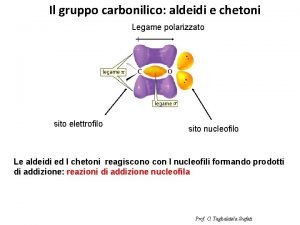
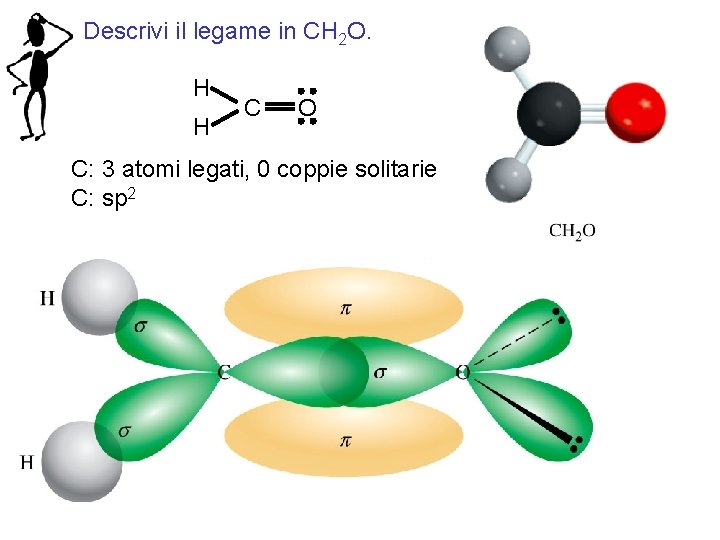
Descrivi il legame in CH 2 O. H H C O C: 3 atomi legati, 0 coppie solitarie C: sp 2 Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

Legami Sigma (s) and Pi greco (p) Legame singolo 1 legame sigma Legame doppio 1 legame sigma e 1 legame pi greco Legame triplo 1 legame sigma e 2 legami pi greco Quanti legami s e p sono presenti nella molecola di acido acetico CH 3 COOH? H C O H legami s = 6 + 1 = 7 legami p = 1 H Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

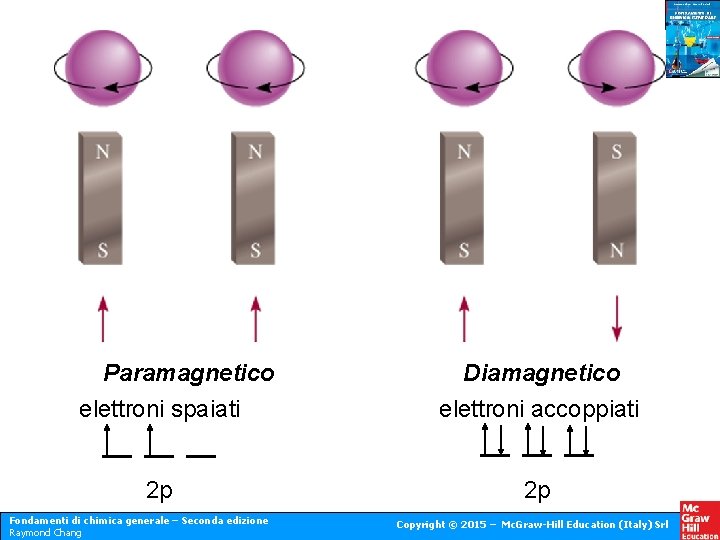
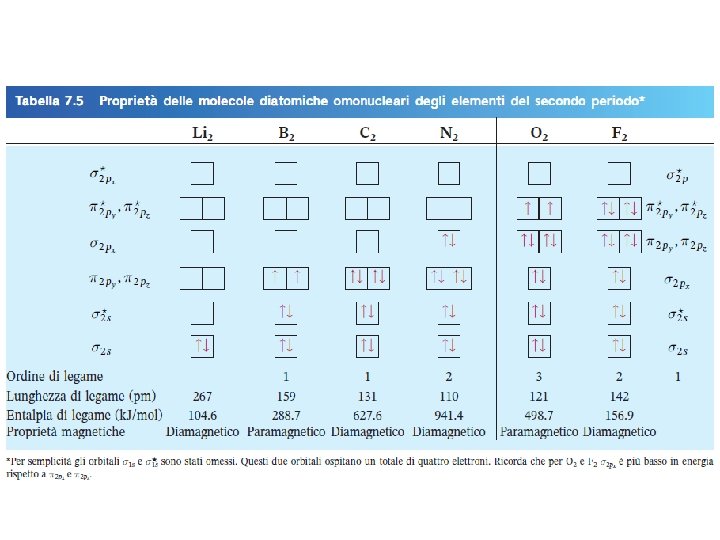
Paramagnetico elettroni spaiati 2 p Fondamenti di chimica generale – Seconda edizione Raymond Chang Diamagnetico elettroni accoppiati 2 p Copyright © 2015 – Mc. Graw-Hill Education (Italy) Srl

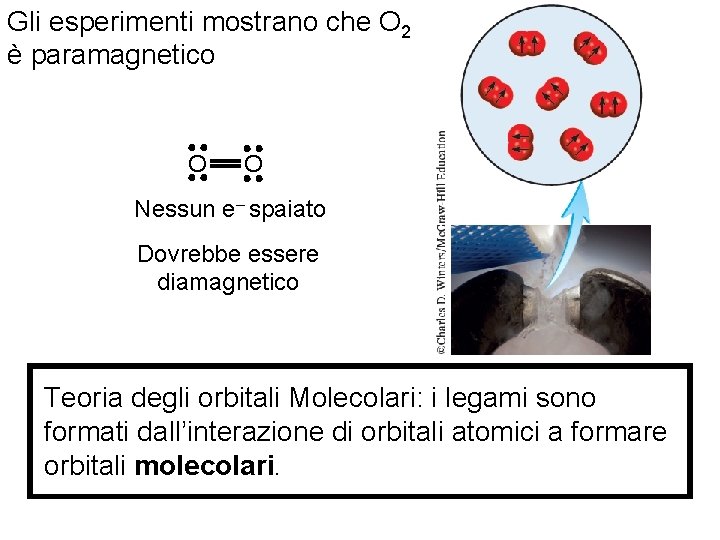
Gli esperimenti mostrano che O 2 è paramagnetico O O Nessun e– spaiato Dovrebbe essere diamagnetico Teoria degli orbitali Molecolari: i legami sono formati dall’interazione di orbitali atomici a formare orbitali molecolari. Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

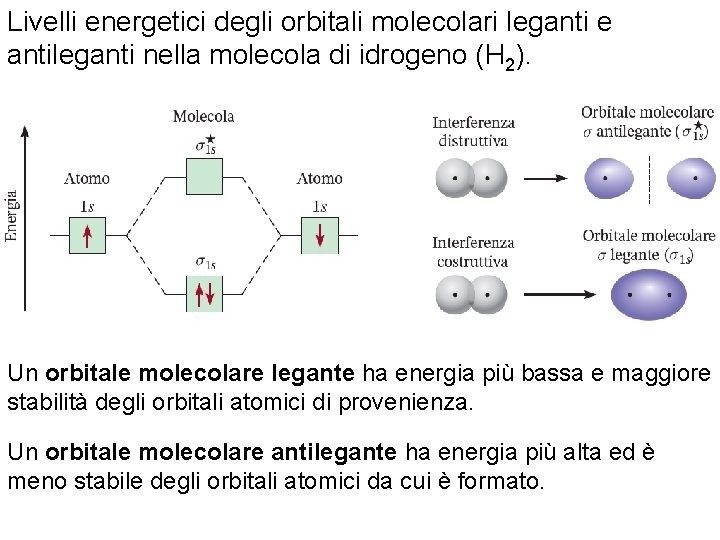
Livelli energetici degli orbitali molecolari leganti e antileganti nella molecola di idrogeno (H 2). Un orbitale molecolare legante ha energia più bassa e maggiore stabilità degli orbitali atomici di provenienza. Un orbitale molecolare antilegante ha energia più alta ed è meno stabile degli orbitali atomici da cui è formato. Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

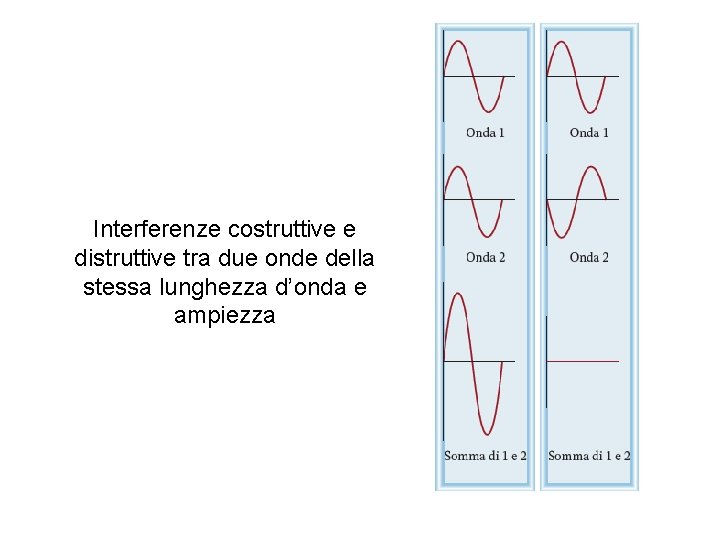
Interferenze costruttive e distruttive tra due onde della stessa lunghezza d’onda e ampiezza Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

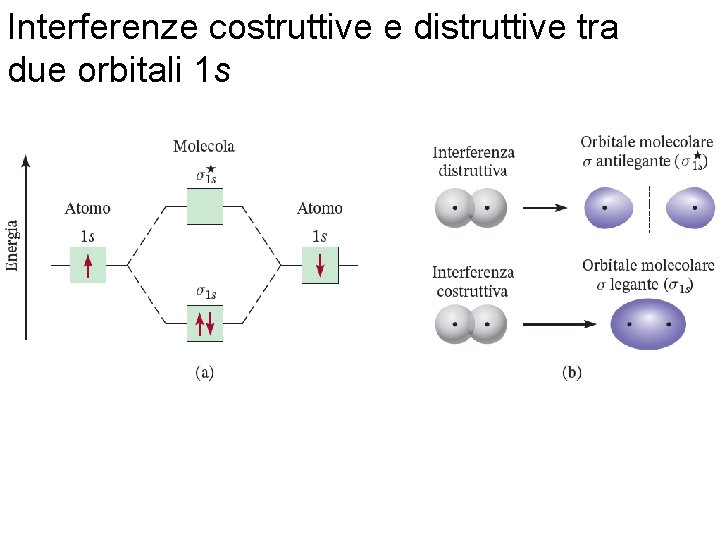
Interferenze costruttive e distruttive tra due orbitali 1 s Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

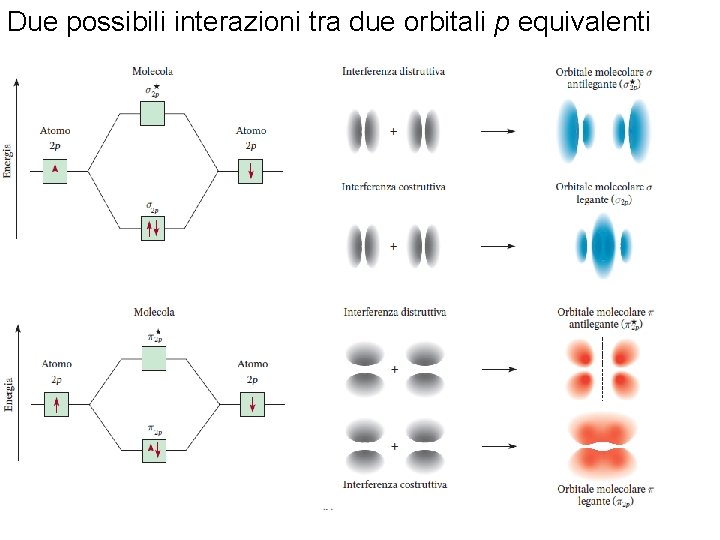
Due possibili interazioni tra due orbitali p equivalenti Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

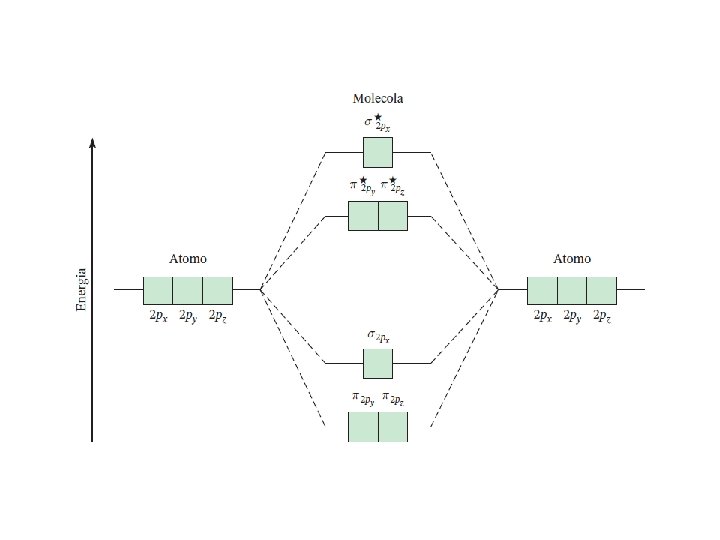
Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

Configurazioni di Orbitali Molecolari (OM) 1. Il numero di orbitali molecolari formato è sempre uguale al numero di orbitali atomici combinati. 2. Tanto più è stabile un OM legante tanto più sara poco stabile il suo corrispondente OM antilegante. 3. Il riempimento degli OM procede da quelli a più bassa energia a quelli a energia più alta. 4. Ogni OM può ospitare finoa due elettroni. 5. Quando si addizionano elettroni a OM della stessa energia si segue la regola di Hund. 6. Il numero di elettroni negli OM è uguale alla somma di tutti gli elettroni degli atomi leganti. Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

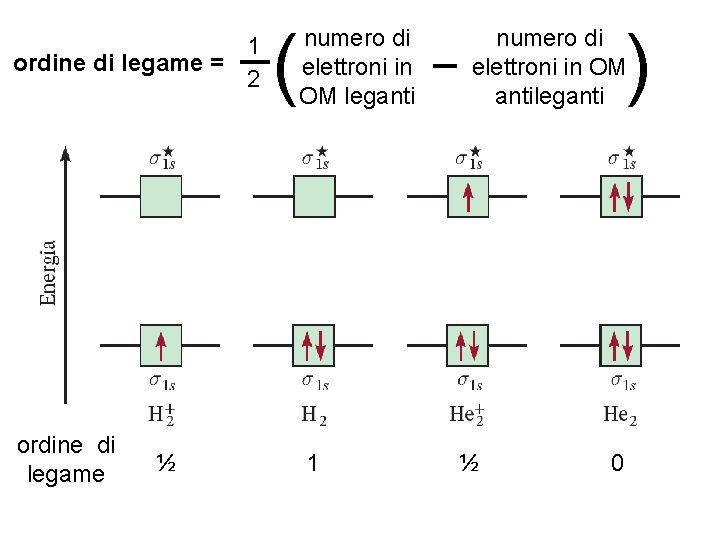
1 ordine di legame = 2 ordine di legame ½ Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby ( numero di elettroni in OM leganti 1 – ) numero di elettroni in OM antileganti ½ 0 Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

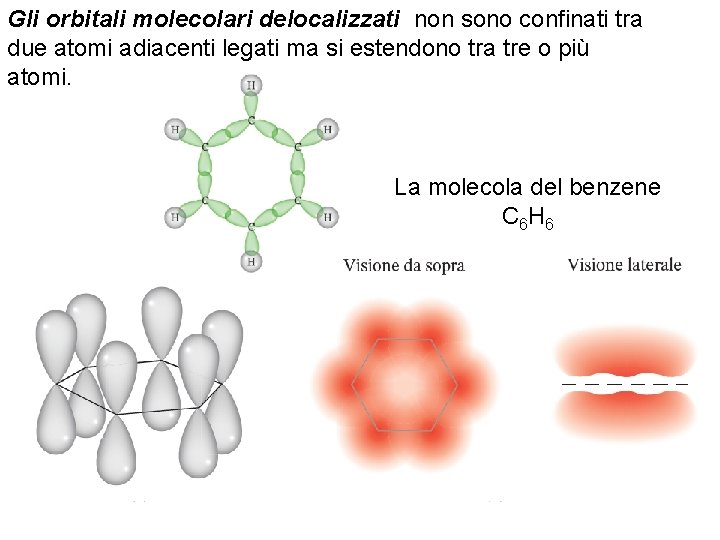
Gli orbitali molecolari delocalizzati non sono confinati tra due atomi adiacenti legati ma si estendono tra tre o più atomi. La molecola del benzene C 6 H 6 Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

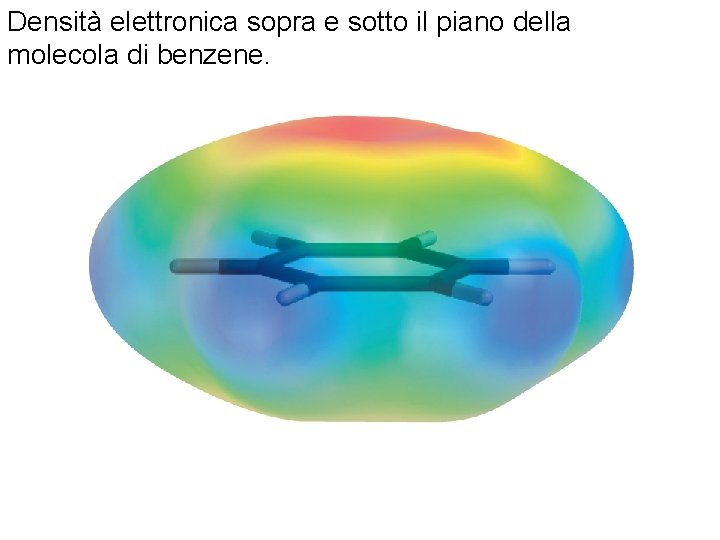
Densità elettronica sopra e sotto il piano della molecola di benzene. Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

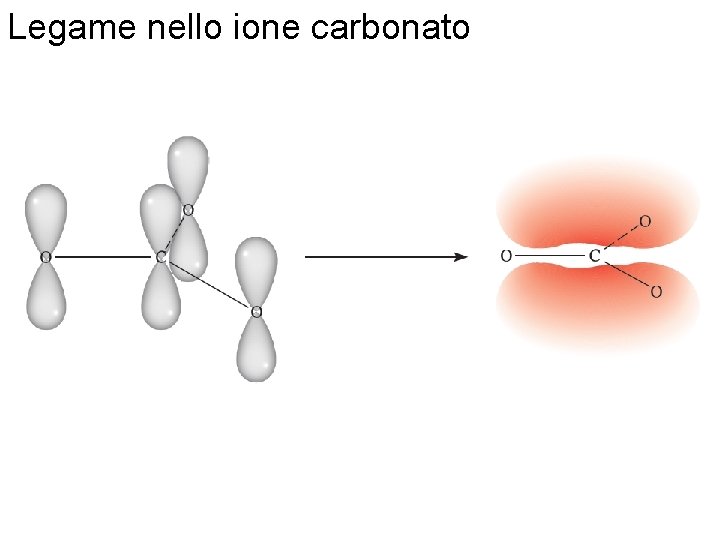
Legame nello ione carbonato Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

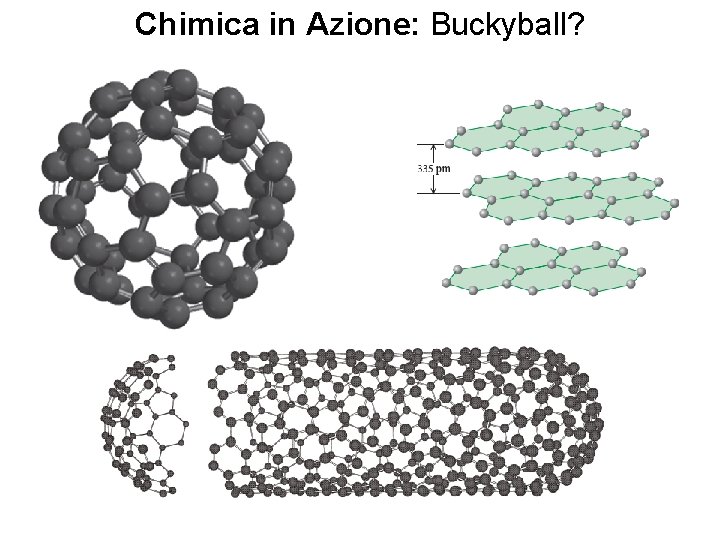
Chimica in Azione: Buckyball? Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

Legame metallico: il modello del mare di elettroni Fondamenti di chimica generale – Terza edizione Raymond Chang, Jason Overby Copyright © 2020 – Mc. Graw-Hill Education (Italy) Srl

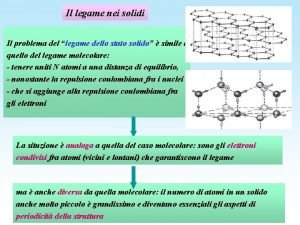
6. 3 Legame metallico Caratteristiche dei metalli • buona conducibilità termica • buona conducibilità elettrica • bassa energia di ionizzazione • riflessione della luce • duttilità • malleabilità Mobilità degli elettroni Il legame che tiene uniti gli atomi metallici all'interno del solido è detto legame metallico. Tra i modelli più semplici ed intuitivi che descrivono il legame metallico vi è quello di P. Drude, secondo il quale gli atomi metallici perdono facilmente gli elettroni superficiali trasformandosi in ioni positivi. Gli ioni si accatastano in modo da lasciare il minor spazio vuoto possibile (massimo impaccamento), andando così ad occupare posizioni ben determinate all'interno di precise strutture geometriche. Gli elettroni persi non appartengono più ai singoli atomi, ma a tutto il reticolo solido (modello a mare di elettroni). Essi sono liberi di muoversi (elettroni delocalizzati) tra gli ioni positivi garantendo la neutralità del sistema e agendo da collante per i cationi. La libertà di movimento degli elettroni all’interno del reticolato cationico fa sì che il legame metallico manifesti una natura non direzionale. Non vi sono elettroni localizzati, come nel legame covalente, che irrigidiscono la struttura. Gli stessi cationi possono, se sollecitati meccanicamente, muoversi all’interno del mare di elettroni senza che il legame venga spezzato, a differenza di quanto accade in un legame ionico in cui anioni e catoni devono mantenere le loro posizioni reciproche. Il legame metallico è adirezionale. Ciò spiega le caratteristiche di duttilità e malleabilità dei metalli i quali, se sottoposti a sollecitazioni meccaniche, si deformano in modo permanente senza spezzarsi.

6. 3 Legame metallico + + + + + + + + Secondo il modello proposto da Lorentz, i metalli sono costituiti da un reticolo di cationi immerso in un mare di elettroni La combinazione lineare degli orbitali degli strati di valenza di tutti gli atomi metallici presenti nel cristallo (che supponiamo essere N) porta alla formazione di N orbitali molecolari. Poiché all’aumentare di N la distanza tra livelli energetici adiacenti diminuisce, la differenza di energia tra un orbitale molecolare ed il successivo è infinitesima. Si ottengono così bande di energia che rendono conto della delocalizzazione degli elettroni in tutto il cristallo. Se associamo la disponibilità di livelli vuoti a bassa energia alla mobilità degli elettroni, responsabile delle caratteristiche metalliche, si può facilmente razionalizzare quali sono le proprietà. Banda di valenza di conduzione nei metalli alcalini E I gruppo In questi metalli caratterizzati dalla configurazione elettronica esterna ns 1 la combinazione lineare degli N orbitali ns (N=numero di atomi nel cristallo considerato) porta alla formazione di una banda di valenza contenente N livelli che può ospitare 2 N elettroni. Poiché gli elettroni esterni da allocare nella banda sono N, essa resta per metà vuota, con N/2 livelli disponibili ad essere occupati con una modesta spesa di energia.

6. 3 Legame metallico Banda di valenza di conduzione nei metalli alcalino terrosi Rispettando le regole di combinazione della teoria LCAO gli elementi alcalino-terrosi daranno luogo a DUE bande: una dovuta all’interazione degli orbitali s, e una dovuta all’interazione degli orbitali p. La parziale sovrapposizione delle bande spiega la conducibilità dei metalli alcalino-terrosi. Banda di conduzione Banda di valenza I gruppo III gruppo In questi metalli caratterizzati dalla configurazione elettronica esterna ns 2 si ottiene, dalla combinazione lineare degli orbitali s, una banda che in questo caso è totalmente occupata, visto che gli elettroni da sistemare sono 2 N. La combinazione lineare degli orbitali np tra di loro reca alla formazione di un’ulteriore banda di energia, che si sovrappone parzialmente alla banda s. I livelli disponibili per gli elettroni della banda s sono quelli (in numero 3 N) della banda p. la banda formata dai livelli ns è detta banda di valenza, mentre quella vuota (originata dai livelli np) viene chiamata banda di conduzione.

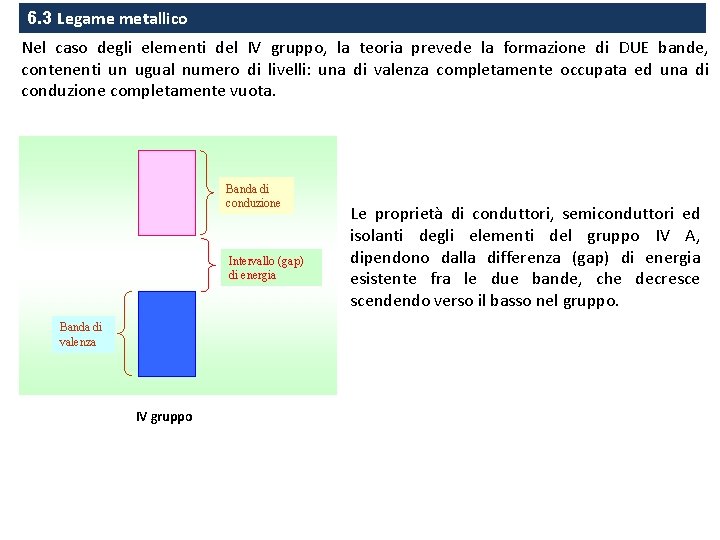
6. 3 Legame metallico Nel caso degli elementi del IV gruppo, la teoria prevede la formazione di DUE bande, contenenti un ugual numero di livelli: una di valenza completamente occupata ed una di conduzione completamente vuota. Banda di conduzione Intervallo (gap) di energia Banda di valenza IV gruppo Le proprietà di conduttori, semiconduttori ed isolanti degli elementi del gruppo IV A, dipendono dalla differenza (gap) di energia esistente fra le due bande, che decresce scendendo verso il basso nel gruppo.

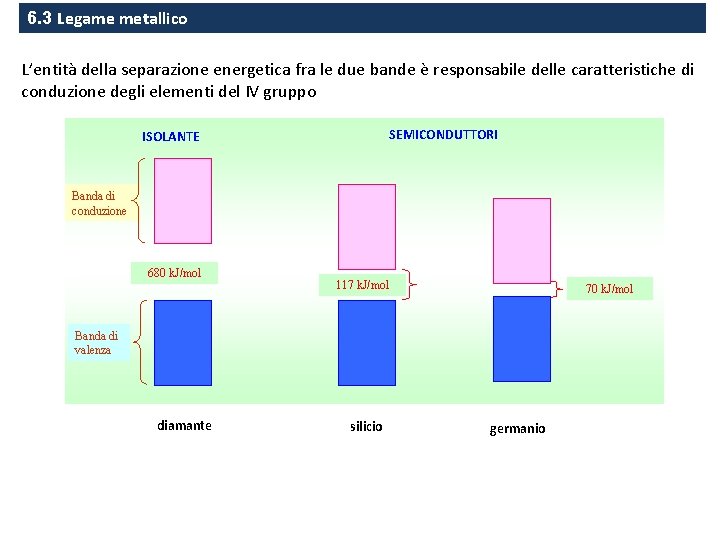
6. 3 Legame metallico L’entità della separazione energetica fra le due bande è responsabile delle caratteristiche di conduzione degli elementi del IV gruppo SEMICONDUTTORI ISOLANTE Banda di conduzione 680 k. J/mol 117 k. J/mol 70 k. J/mol Banda di valenza diamante silicio germanio

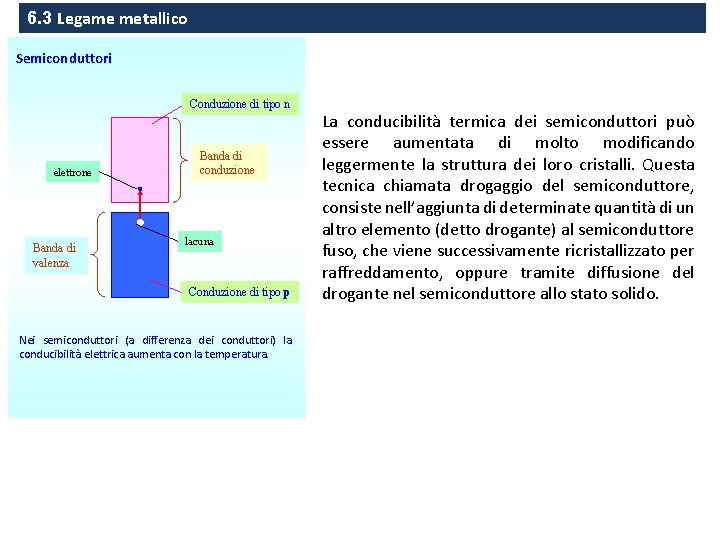
6. 3 Legame metallico Semiconduttori Conduzione di tipo n elettrone Banda di valenza Banda di conduzione lacuna Conduzione di tipo p Nei semiconduttori (a differenza dei conduttori) la conducibilità elettrica aumenta con la temperatura. La conducibilità termica dei semiconduttori può essere aumentata di molto modificando leggermente la struttura dei loro cristalli. Questa tecnica chiamata drogaggio del semiconduttore, consiste nell’aggiunta di determinate quantità di un altro elemento (detto drogante) al semiconduttore fuso, che viene successivamente ricristallizzato per raffreddamento, oppure tramite diffusione del drogante nel semiconduttore allo stato solido.

6. 3 Legame metallico Consideriamo un cristallo di silicio drogato con un elemento del III gruppo, per esempio il gallio. Dato l’esiguo numero di atomi di gallio uniformemente dispersi nel reticolo del silicio, la struttura in bande del silicio viene conservata. La sostituzione di alcuni atomi di silicio con atomi di gallio, ciascuno con un elettrone di valenza in meno rispetto al silicio, lascia alcuni livelli (quelli a più alta energia) della banda di valenza vuoti. Gli elettroni della banda di valenza possono occupare i livelli vuoti creatisi a seguito del drogaggio, e ciò si traduce in un aumento di molti ordini di grandezza della conducibilità elettrica del silicio. L’occupazione di un livello vuoto sulla sommità della banda di valenza da parte di un elettrone sottostante crea una lacuna nel livello da cui è partito l’elettrone. Questa lacuna è un livello energetico vuoto che può veneire occupato, sotto l’azione di un campo elettrico, da un elettrone a minore energia. Drogaggio di tipo “p” I semiconduttori drogati con elementi del III gruppo sono detti di tipo p (positivo), ad indicare il movimento di lacune di cariche negative (che formalmente può assimilarsi al movimento di cariche positive) responsabile della conducibilità.

6. 3 Legame metallico Drogaggio di tipo “n” Se il drogaggio del silicio avviene con un elemento del V gruppo, con un elettrone di valenza in più rispetto al silicio, per esempio l’arsenico, la banda di valenza non è più sufficiente a contenere tutti gli elettroni del cristallo. Un numero di elettroni uguale a quello degli atomi di As che sono stati introdotti occuperà i livelli più bassi della banda di conduzione e potrà muoversi sotto l’azione di un campo elettrico. I semiconduttori drogati con elementi del V gruppo sono detti di tipo n ( iniziale di negativo), ad indicare il movimento di cariche negative nella banda di conduzione, responsabile della conducibilità. Si noti che in assenza di drogante e a temperatura ambiente, la presenza di un certo numero di elettroni nella banda di conduzione e di un ugual numero di lacune nella banda di valenza innesca contemporaneamente movimenti di elettroni, sotto l’effetto di una differenza di potenziale, che producono conducibilità di tipo n (per quelli nella banda di conduzione) e di tipo p (per quelli nella banda di valenza).

6. 3 Legame metallico Oltre a quelli costituiti da un’unica specie atomica, esistono semiconduttori costituiti da composti che presentano un numero medio di elettroni di valenza pari a 4. ciò si realizza in composti 1: 1 di elementi del III e del V gruppo (come l’arsenurio di gallio Ga. As o l’antimoniuro di indio In. Sb), o dei gruppi II B e VI (come il solfuro di zinco Zn. S o di cadmio Cd. S).
 Teoria vsepr
Teoria vsepr Cl2co geometria
Cl2co geometria Cl2co geometria molecolare
Cl2co geometria molecolare Nf3 struttura di lewis
Nf3 struttura di lewis Pittogrammi rischio chimico
Pittogrammi rischio chimico Rischio chimico
Rischio chimico Boro elemento chimico
Boro elemento chimico Principio di le chatelier
Principio di le chatelier Formazione specifica lavoratori rischio alto pdf
Formazione specifica lavoratori rischio alto pdf Agente chimico significato
Agente chimico significato Tabella potenziali standard di riduzione zanichelli
Tabella potenziali standard di riduzione zanichelli Rischio chimico
Rischio chimico Costante di equilibrio
Costante di equilibrio Chimica cosa studia
Chimica cosa studia Idrolisi salina
Idrolisi salina Pericoli chimici fisici e biologici negli alimenti
Pericoli chimici fisici e biologici negli alimenti Quoziente di reazione
Quoziente di reazione Simbolo equilibrio chimico
Simbolo equilibrio chimico Patologia vegetale molecolare
Patologia vegetale molecolare Come si calcola massa molecolare
Come si calcola massa molecolare La teoria cinetico molecolare della materia
La teoria cinetico molecolare della materia Polidispersità
Polidispersità Biologia
Biologia La teoria cinetico-molecolare della materia zanichelli
La teoria cinetico-molecolare della materia zanichelli Formula moli
Formula moli Formule moli
Formule moli Biologia molecolare amaldi
Biologia molecolare amaldi Che,
Che, Come calcolare il numero di moli
Come calcolare il numero di moli Calcolo mol
Calcolo mol Peso molecolare
Peso molecolare Estremità coesive e piatte
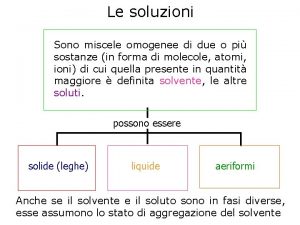
Estremità coesive e piatte Soluzioni chimica zanichelli capitolo 13
Soluzioni chimica zanichelli capitolo 13 Legame fosfodiesterico
Legame fosfodiesterico Polisaccaridi
Polisaccaridi Reattivo di fehling
Reattivo di fehling C triplo legame n
C triplo legame n Legame di london
Legame di london Legami intermolecolari
Legami intermolecolari B d fruttosio
B d fruttosio Ponte disolfuro legame covalente
Ponte disolfuro legame covalente Teoria del legame di valenza
Teoria del legame di valenza Amminoacidi
Amminoacidi Legame peptidico risonanza
Legame peptidico risonanza Ossido vanadioso
Ossido vanadioso Soluzioni capitolo 12 chimica più
Soluzioni capitolo 12 chimica più Blocchi tavola periodica
Blocchi tavola periodica Legame peptidico planare
Legame peptidico planare Legame covalente apolare
Legame covalente apolare Esempio di doppio legame
Esempio di doppio legame Ordine di legame
Ordine di legame Legame covalente dativo
Legame covalente dativo Legame adirezionale
Legame adirezionale Legame polare e apolare
Legame polare e apolare Terziaria
Terziaria Mappa concettuale parole legame
Mappa concettuale parole legame La scala dell'elettronegatività e i legami
La scala dell'elettronegatività e i legami Legame covalente apolare
Legame covalente apolare Fruttopiranosio
Fruttopiranosio Legame polare e apolare
Legame polare e apolare Ribulosio haworth
Ribulosio haworth Legami fosfoanidridici
Legami fosfoanidridici Endiolo
Endiolo Legame covalente dativo
Legame covalente dativo Limiti della teoria di lewis
Limiti della teoria di lewis Legame ionico
Legame ionico Legame covalente apolare
Legame covalente apolare Legame peptidico
Legame peptidico Le nuove teorie di legame zanichelli
Le nuove teorie di legame zanichelli Cardinalità delle associazioni
Cardinalità delle associazioni Recettore muscarinico
Recettore muscarinico Legame glicosidico saccarosio
Legame glicosidico saccarosio Legami idrogeno
Legami idrogeno Legame fosfodiesterico
Legame fosfodiesterico Legame covalente puro
Legame covalente puro Legame metallico
Legame metallico Legame estereo
Legame estereo