Valitutti Falasca Amadio Chimica concetti e modelli Seconda





























- Slides: 34


Valitutti, Falasca, Amadio Chimica: concetti e modelli Seconda edizione

Capitolo 4 La teoria cinetico-molecolare della materia

Sommario 1. Energia, lavoro e calore 2. Analisi termica di una sostanza pura 3. Le particelle e l’energia 4. I passaggi di stato spiegati dalla teoria cinetico-molecolare Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 4

Energia, lavoro e calore L’energia è una grandezza fisica che assume forme diverse, si conserva, si trasforma, si trasferisce e determina dei cambiamenti nei sistemi interessati. Il lavoro è l’utilizzo di una forza per spostare un corpo. L=F∙s La capacità di compiere un lavoro è energia: un corpo possiede energia se può compiere un lavoro. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 5

Energia, lavoro e calore, nel SI, hanno la stessa unità di misura: il joule (J). 1 J corrisponde, quindi, al lavoro effettuato dalla forza di 1 N per generare uno spostamento di 1 m. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 6

Energia, lavoro e calore La caloria è definita come la quantità di calore necessaria per riscaldare 1, 00 g di acqua da 14, 5 a 15, 5 °C. Caloria e joule sono legati tra loro dalla seguente relazione: 1 cal = 4, 18 J Per valori di energia molto piccoli, in ambito atomico e subatomico, si utilizza invece l’elettronvolt, e. V Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 7

Energia, lavoro e calore L’energia cinetica, Ec, è associata al movimento di un corpo e dipende dalla massa m del corpo e dalla sua velocità v. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 8

Energia, lavoro e calore L’energia potenziale, Ep , deriva dalla posizione di un corpo. Quella posseduta da un corpo di massa m che si trova a un’altezza h dal suolo, è: Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 9

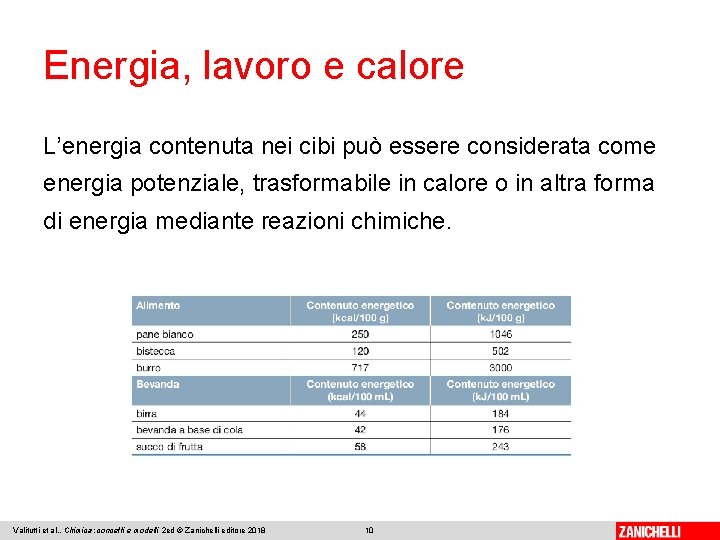
Energia, lavoro e calore L’energia contenuta nei cibi può essere considerata come energia potenziale, trasformabile in calore o in altra forma di energia mediante reazioni chimiche. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 10

Energia, lavoro e calore Ogni volta che l’energia si trasforma, cambia aspetto ma non scompare, né si crea dal nulla. La legge di conservazione dell’energia stabilisce che, in un qualsiasi processo, l’energia totale si conserva. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 11

Energia, lavoro e calore Il calore specifico è la quantità di energia assorbita (o ceduta) da 1 kg di materiale che provoca un aumento (o una diminuzione) di temperatura di 1 K. L’unità di misura del calore specifico nel SI è J/(kg K). Il calore specifico è una proprietà intensiva caratteristica per ogni materiale e può essere adoperato per identificare le diverse sostanze. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 12

Energia, lavoro e calore La quantità di energia assorbita o ceduta dipende dalla quantità del materiale, dal tipo di materiale e dalla variazione di temperatura secondo la relazione: Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 13

Analisi termica di una sostanza pura Fornire calore a un corpo aumenta la sua temperatura e il calore fornito può provocare un cambiamento di stato. Per studiare che cosa avviene quando si fornisce calore a una sostanza pura, si possono registrare le variazioni di temperatura a intervalli di tempo regolari e riportare i valori in un grafico; si ottiene in tal modo una curva di riscaldamento. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 14

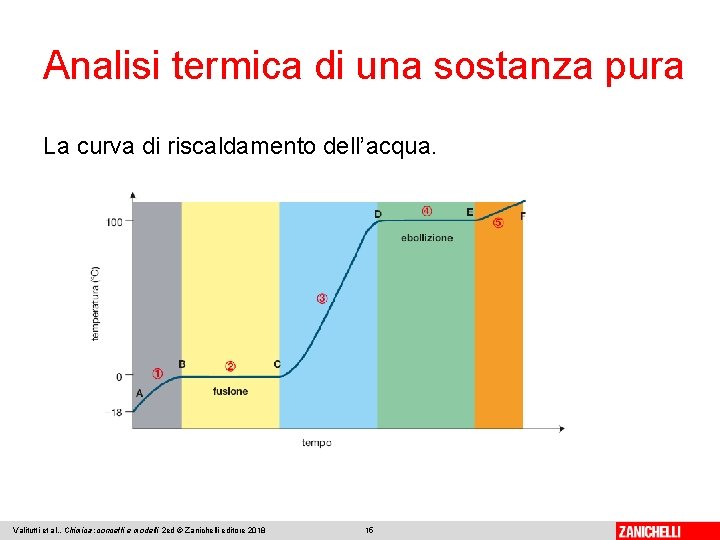
Analisi termica di una sostanza pura La curva di riscaldamento dell’acqua. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 15

Analisi termica di una sostanza pura 1. La temperatura cresce dapprima in maniera regolare, passando da − 18 °C a 0 °C (tratto A-B). 2. Quando il ghiaccio comincia a fondere, sulla curva compare una sosta termica (tratto B-C). 3. Terminata la fusione di tutto il ghiaccio, la temperatura ricomincia a salire, fino a 100 °C (tratto C-D). 4. Raggiunti i 100 °C (alla pressione di 1 atm), ha inizio l’ebollizione e si ha un’altra sosta termica (tratto D-E). 5. Una volta scomparso il liquido, la temperatura del vapore riprende a salire in maniera regolare (tratto E-F). Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 16

Analisi termica di una sostanza pura La temperatura alla quale coesistono stato solido e stato liquido è denominata temperatura di fusione. La lunghezza del tratto B-C, chiamato sosta termica, dipende dalla quantità di ghiaccio che deve fondere: maggiore è la quantità di ghiaccio, più lunga sarà la sosta termica. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 17

Analisi termica di una sostanza pura Dal momento in cui inizia a formarsi, il vapore esercita una pressione, chiamata tensione di vapore. La temperatura alla quale la tensione di vapore eguaglia la pressione esterna è detta temperatura di ebollizione. La temperatura di ebollizione dell’acqua è sempre la stessa e non dipende dalla quantità. La lunghezza delle soste termiche dipende invece dalla quantità di sostanza. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 18

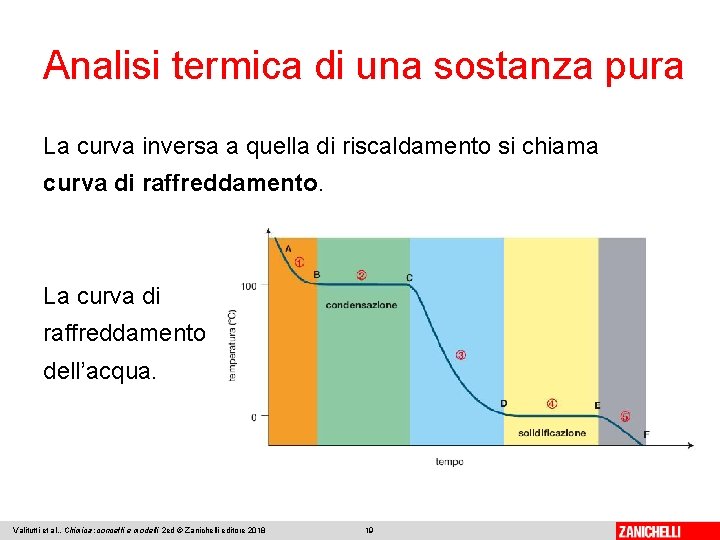
Analisi termica di una sostanza pura La curva inversa a quella di riscaldamento si chiama curva di raffreddamento. La curva di raffreddamento dell’acqua. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 19

Analisi termica di una sostanza pura Anche nella curva di raffreddamento si possono evidenziare due soste termiche. La fusione e la solidificazione dell’acqua avvengono alla stessa temperatura, 0 °C, che rimane costante durante il passaggio di stato. Anche l’ebollizione e la condensazione dell’acqua, se la pressione rimane costante, avvengono alla stessa temperatura (100 °C). Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 20

Analisi termica di una sostanza pura Per ogni sostanza pura si possono disegnare una curva di riscaldamento e una di raffreddamento. Tutte le sostanze pure presentano soste termiche in corrispondenza dei passaggi di stato. Le temperature di fusione (tf) e di ebollizione (teb) sono proprietà intensive caratteristiche delle sostanze pure. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 21

Analisi termica di una sostanza pura I passaggi di stato delle soluzioni e dei miscugli, generalmente non avvengono a temperature costanti. La riduzione della pressione esterna favorisce l’ebollizione delle sostanze. La fusione e la solidificazione sono poco influenzate dalle variazioni esterne di pressione. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 22

Le particelle e l’energia La teoria cinetica, alla cui formulazione hanno contribuito Ludwig Boltzmann e James Maxwell, nasce per spiegare il comportamento dei gas, ma si può estendere a tutta la materia. La teoria si riassume nei seguenti postulati fondamentali: • le particelle microscopiche di tutti i materiali sono separate da spazio vuoto e sono in continuo e inarrestabile movimento; Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 23

Le particelle e l’energia • temperatura e calore sono manifestazioni del moto delle particelle; • ciascuna specie di atomo, molecola o ione ha massa e proprietà chimiche caratteristiche, mentre non ha senso parlare di proprietà fisiche per le singole particelle. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 24

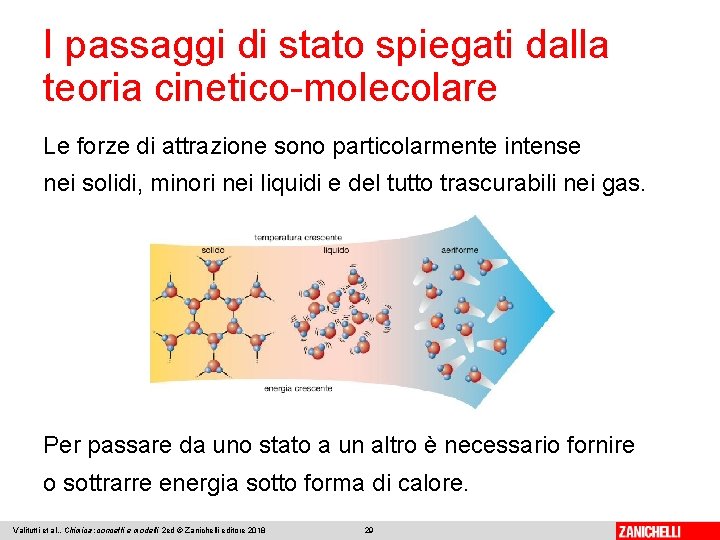
Le particelle e l’energia Nei solidi, le particelle oscillano e vibrano intorno a posizioni fisse ben precise. Nei liquidi le particelle sono ancora a contatto, ma hanno maggiore libertà di movimento. Per i gas la libertà di movimento è massima e il moto delle particelle è assolutamente disordinato. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 25

Le particelle e l’energia La temperatura assoluta di un corpo è direttamente proporzionale all’energia cinetica media delle particelle che lo costituiscono. Se si scalda un corpo, non soltanto aumenta l’energia cinetica delle sue particelle, ma aumenta anche la loro energia potenziale, perché le particelle si allontanano l’una dall’altra e si riducono le forze di coesione. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 26

Le particelle e l’energia La somma dell’energia cinetica, Ec, e dell’energia potenziale, Ep, delle particelle che costituiscono un sistema è chiamata energia interna del sistema: Esistema = Ec + Ep Fornire calore a un oggetto significa aumentare la sua energia interna. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 27

I passaggi di stato spiegati dalla teoria cinetico-molecolare In base alla teoria cinetico-molecolare, lo stato di aggregazione di un materiale dipende dalla sua temperatura. All’aumentare della temperatura si ha un aumento dell’energia interna, crescono sia l’agitazione delle particelle sia la tendenza a passare da uno stato ordinato a uno disordinato, perché diviene più facile vincere le forze di attrazione fra le molecole. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 28

I passaggi di stato spiegati dalla teoria cinetico-molecolare Le forze di attrazione sono particolarmente intense nei solidi, minori nei liquidi e del tutto trascurabili nei gas. Per passare da uno stato a un altro è necessario fornire o sottrarre energia sotto forma di calore. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 29

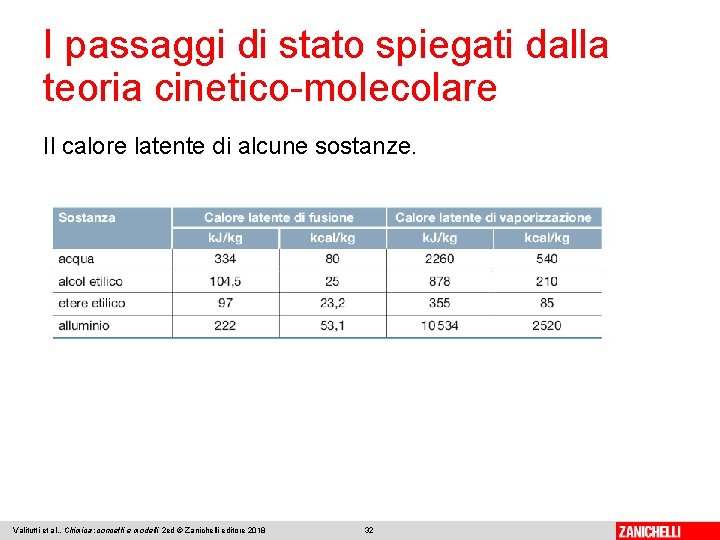
I passaggi di stato spiegati dalla teoria cinetico-molecolare Il calore latente di fusione è la quantità di energia necessaria per fondere completamente 1 kg di sostanza alla sua temperatura di fusione. È una proprietà intensiva della materia che si misura in J/kg e che è spesso utilizzata per identificare le sostanze pure. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 30

I passaggi di stato spiegati dalla teoria cinetico-molecolare Il calore latente di vaporizzazione è la quantità di energia necessaria per vaporizzare completamente 1 kg di sostanza alla sua temperatura di ebollizione, quando la pressione esterna è di 1 atmosfera. È una proprietà intensiva, caratteristica per ogni sostanza pura. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 31

I passaggi di stato spiegati dalla teoria cinetico-molecolare Il calore latente di alcune sostanze. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 32

I passaggi di stato spiegati dalla teoria cinetico-molecolare In merito alle forze di coesione, si può rilevare che è più difficile annullarle in un liquido che diventa vapore, piuttosto che ridurle all’interno di un solido. Esistono però alcuni solidi in cui le molecole sono così debolmente legate le une alle altre che alcune si liberano dal reticolo cristallino e passano direttamente allo stato aeriforme, cioè sublimano. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 33

I passaggi di stato spiegati dalla teoria cinetico-molecolare Se si fornisce calore a un miscuglio omogeneo, non si registrano soste termiche, perché le diverse molecole che lo compongono richiedono diverse temperature per evaporare. Il comportamento di miscele di sostanze con punti di ebollizione diversi è alla base della distillazione frazionata, una tecnica di separazione che a livello industriale è usata per separare i diversi componenti del petrolio. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 34