Valitutti Falasca Amadio Chimica concetti e modelli Seconda



































- Slides: 43


Valitutti, Falasca, Amadio Chimica: concetti e modelli Seconda edizione

Capitolo 7 Le particelle dell’atomo

Sommario 1. La natura elettrica della materia 2. La scoperta delle particelle subatomiche 3. Le particelle fondamentali dell’atomo 4. I modelli atomici di Thomson e Rutherford 5. Il numero atomico identifica gli elementi 6. Le trasformazioni del nucleo 7. I tipi di decadimento radioattivo 8. L’energia nucleare Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 4

La natura elettrica della materia Gli antichi Greci chiamavano l’ambra elektron, da cui deriva il termine elettricità. • Lo strofinìo di qualsiasi materiale provoca la comparsa su di esso di una carica elettrica. • La carica elettrica può essere di due tipi: per convenzione si distingue in positiva (+) e negativa (−); • Le cariche dello stesso segno, (+) e (+) oppure (−), si respingono e si dicono «concordi» ; • Le cariche di segno opposto, (+) e (−), si attraggono e si dicono «discordi» . Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 5

La scoperta delle particelle subatomiche Per studiare gli effetti del passaggio di corrente elettrica in un gas, si può adoperare un tubo di vetro trasparente, alla cui estremità sono fissate due placche metalliche, chiamate elettrodi, collegate a un generatore elettrico. La placca negativa è chiamata catodo (−) e la placca positiva anodo (+). Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 6

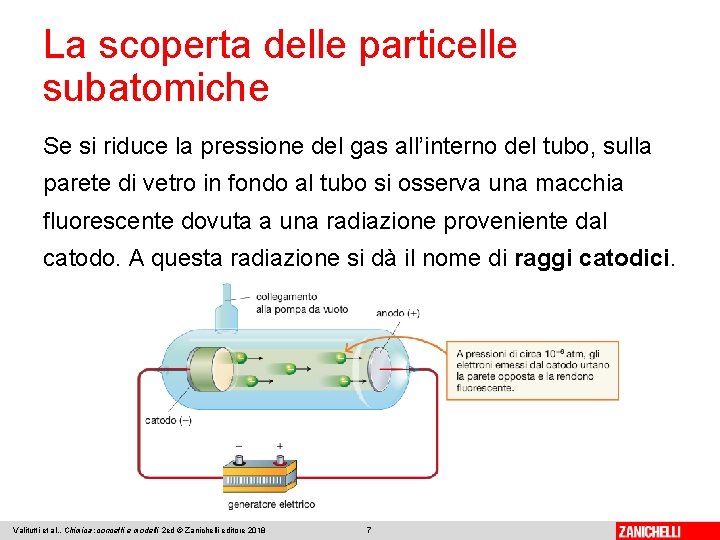
La scoperta delle particelle subatomiche Se si riduce la pressione del gas all’interno del tubo, sulla parete di vetro in fondo al tubo si osserva una macchia fluorescente dovuta a una radiazione proveniente dal catodo. A questa radiazione si dà il nome di raggi catodici. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 7

La scoperta delle particelle subatomiche Nel 1897, Joseph John Thomson utilizza tubi di vetro progettati da William Crookes per dimostrare che la radiazione catodica è formata da particelle cariche negativamente a cui assegna il nome di elettroni. Thomson riesce anche a misurare il rapporto carica/massa di tali particelle e a dimostrare che il valore del rapporto non cambia al variare del gas contenuto nel tubo o del metallo che costituisce il catodo. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 8

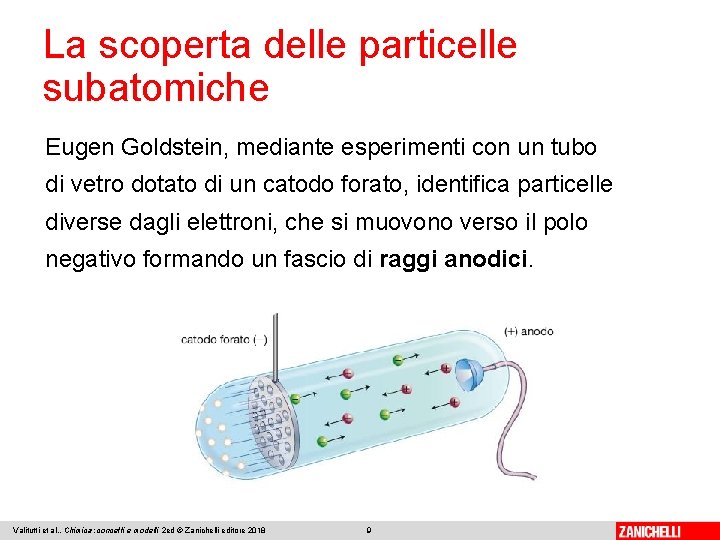
La scoperta delle particelle subatomiche Eugen Goldstein, mediante esperimenti con un tubo di vetro dotato di un catodo forato, identifica particelle diverse dagli elettroni, che si muovono verso il polo negativo formando un fascio di raggi anodici. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 9

La scoperta delle particelle subatomiche Si tratta di particelle con carica positiva, che provengono dal gas rarefatto contenuto nel tubo, e a cui Ernest Rutherford assegna, nel 1920, il nome di protoni. Nel 1932, viene scoperta da James Chadwick una terza particella subatomica denominata neutrone, che è elettricamente neutra, cioè priva di carica. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 10

La scoperta delle particelle subatomiche Lo strofinìo di un materiale comporta il trasferimento di cariche da un corpo all’altro ed è sempre legato a uno spostamento di elettroni. Il numero delle cariche acquistate deve sempre essere uguale al numero delle cariche cedute, in base al principio di conservazione della carica. L’unità di misura della carica elettrica nel SI è il coulomb (C), dal nome dello scienziato Charles-Augustin de Coulomb. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 11

Le particelle fondamentali dell’atomo Gli atomi di tutti gli elementi sono formati da tre particelle fondamentali: • elettrone (e−), massa pari a 9, 109 10− 31 kg, carica elettrica negativa pari a – 1, 602 10− 19 C; • protone (p+), massa pari a 1, 673 10− 27 kg, carica elettrica positiva pari a +1, 602 10− 19 C; • neutrone (n), massa pari a 1, 675 10− 27 kg, privo di carica elettrica. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 12

Le particelle fondamentali dell’atomo Ogni atomo contiene un nucleo, cioè una zona molto piccola e densa in cui sono confinati i protoni e i neutroni: a tali particelle di dà il nome di nucleoni. Acceleratori e collisori di particelle, hanno consentito di dimostrare che neutroni e protoni non sono affatto particelle elementari, ma sono composte a loro volta da altri componenti, chiamati quark. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 13

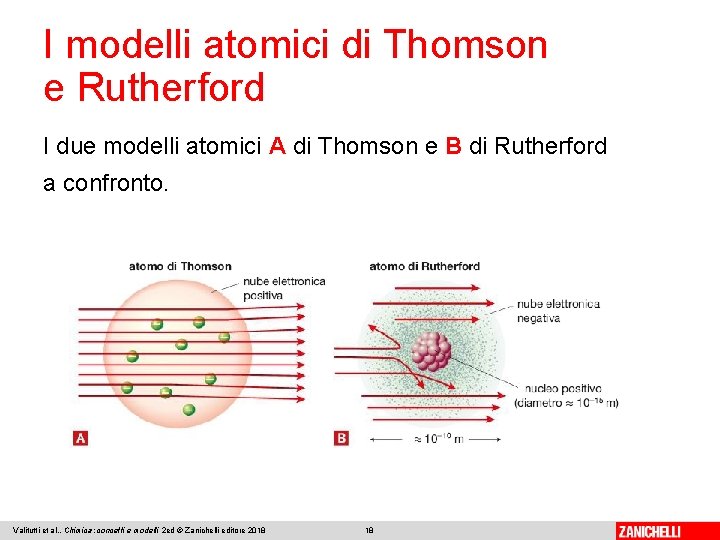
I modelli atomici di Thomson e Rutherford Thomson propone per l’atomo un modello continuo: la carica positiva occupa, come una nube, tutto il volume dell’atomo, mentre gli elettroni sono dispersi in modo regolare, come l’uvetta nell’impasto di un panettone, il modello viene quindi definito atomo a panettone. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 14

I modelli atomici di Thomson e Rutherford È possibile studiare la struttura degli atomi bombardandoli con particelle radioattive. Gli studi condotti da Ernest Rutherford permettono di determinare la natura delle particelle alfa (α), nuclei positivi di elio (He 2+), utilizzate per bombardare gli atomi di un sottilissimo foglio d’oro. Dopo l’urto, le particelle α sono raccolte da uno schermo in grado di evidenziarne la presenza. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 15

I modelli atomici di Thomson e Rutherford I risultati dell’esperimento mostrano che: • gran parte delle particelle α attraversa la lamina senza subire deviazioni; • alcune particelle sono deviate di angoli più o meno grandi rispetto alla direzione iniziale; • una piccolissima frazione viene respinta all’indietro con violenza. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 16

I modelli atomici di Thomson e Rutherford propone quindi un nuovo modello atomico: • l’atomo è composto da un nucleo centrale, in cui sono concentrate tutta la carica positiva e la massa dell’atomo; • gli elettroni occupano lo spazio vuoto intorno al nucleo; • il diametro del nucleo deve essere centomila volte più piccolo (10− 15 m) del diametro dell’atomo (10− 10 m); • gli elettroni, carichi negativamente, sono in numero tale da bilanciare esattamente la carica positiva del nucleo. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 17

I modelli atomici di Thomson e Rutherford I due modelli atomici A di Thomson e B di Rutherford a confronto. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 18

Il numero atomico identifica gli elementi Il numero di protoni presenti nel nucleo di un atomo si chiama numero atomico (Z). Se l’atomo è neutro, questo numero è uguale a quello degli elettroni. Il numero di massa (A) è uguale alla somma del numero di protoni (Z) e del numero di neutroni (n) contenuti nel nucleo. Il nucleo di un atomo di cui si conoscono Z e A è chiamato nuclide. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 19

Il numero atomico identifica gli elementi Gli isotopi sono atomi dello stesso elemento aventi le stesse proprietà chimiche ma masse diverse, perché contengono un diverso numero di neutroni. I tre isotopi dell’idrogeno. Gli isotopi hanno diverse proprietà fisiche. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 20

Il numero atomico identifica gli elementi La massa atomica relativa presente sulla tavola periodica è una massa media, che tiene conto sia della percentuale di ciascun isotopo nella miscela, sia della sua massa. La media calcolata in questo modo si dice media ponderata. Per calcolare la massa atomica media, si moltiplica la massa di ciascun isotopo per la sua abbondanza percentuale, si sommano i vari prodotti e si divide per 100. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 21

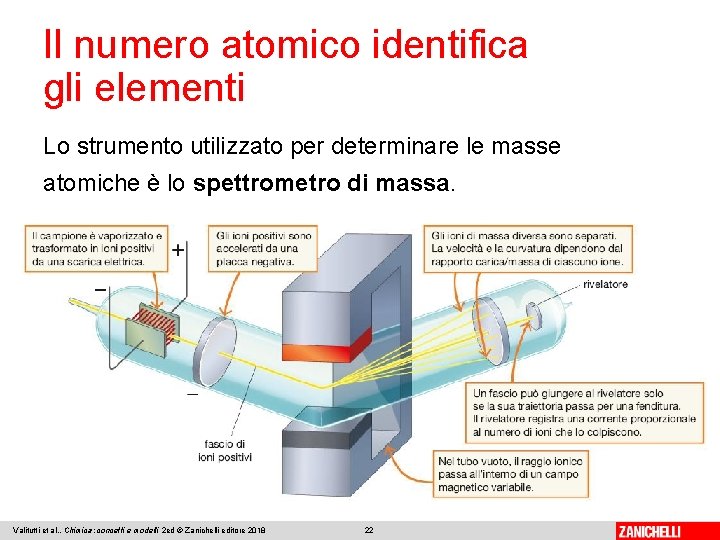
Il numero atomico identifica gli elementi Lo strumento utilizzato per determinare le masse atomiche è lo spettrometro di massa. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 22

Le trasformazioni del nucleo Tra i nucleoni, agisce una forza attrattiva molto grande, chiamata forza nucleare forte, che prevale nettamente sulle forze elettriche repulsive e consente al nucleo di non disintegrarsi. Alcuni isotopi, invece, sono instabili ed emettono spontaneamente una particella trasformandosi nel nucleo di un altro elemento. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 23

Le trasformazioni del nucleo Il decadimento radioattivo è un processo che trasforma il nucleo di un elemento nel nucleo di un elemento diverso. Il processo di emissione di radiazione viene scoperto nel 1896 da Antoine Henri Becquerel e denominato radioattività. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 24

Le trasformazioni del nucleo Alcuni anni dopo gli studi di Becquerel e dei coniugi Curie, Rutherford dimostra che le radiazioni emesse dal nucleo di un elemento radioattivo sono di tre tipi differenti: • raggi alfa (α), costituiti da nuclei di elio (carica 2+, massa 4); • raggi beta (β), fasci di elettroni veloci, non hanno massa rilevante e portano una carica elettrica negativa; • raggi gamma (γ), radiazioni elettromagnetiche, come la luce e i raggi X, ma di frequenza ed energia ancora maggiori. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 25

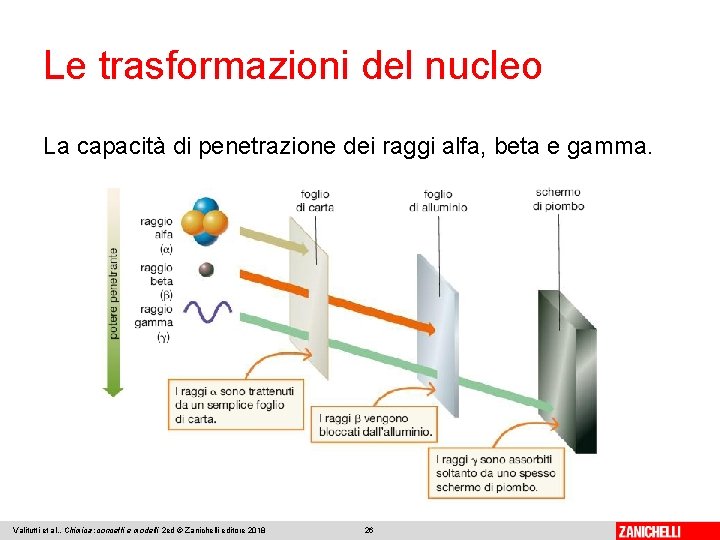
Le trasformazioni del nucleo La capacità di penetrazione dei raggi alfa, beta e gamma. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 26

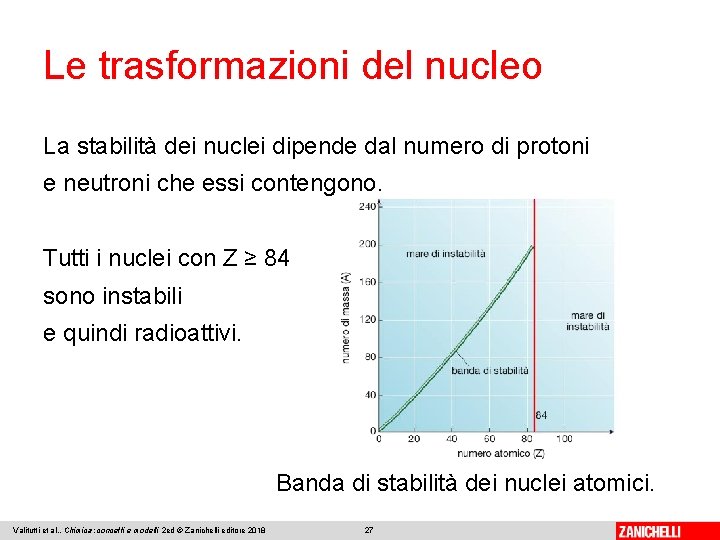
Le trasformazioni del nucleo La stabilità dei nuclei dipende dal numero di protoni e neutroni che essi contengono. Tutti i nuclei con Z ≥ 84 sono instabili e quindi radioattivi. Banda di stabilità dei nuclei atomici. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 27

I tipi di decadimento radioattivo Il decadimento di un nucleo è descritto da un’equazione nucleare, che è bilanciata quando: • la somma dei numeri di massa, A, dei reagenti è uguale alla somma dei numeri di massa dei prodotti; • la somma dei protoni dei reagenti è uguale alla somma dei protoni dei prodotti. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 28

I tipi di decadimento radioattivo Vi sono quattro tipi di fenomeni radioattivi. 1. Decadimento alfa (α). Nuclei con numero atomico superiore a 83 e numero di massa superiore a 220 decadono emettendo particelle α positive (nuclei di elio). Il numero di massa diminuisce di quattro unità, mentre Z diminuisce di due unità. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 29

I tipi di decadimento radioattivo 2. Decadimento beta (β). Nuclei troppo ricchi di neutroni decadono emettendo elettroni veloci (particelle β) che derivano dalla trasformazione di un neutrone in protone. Ciò accade perché il neutrone, quando è isolato, è instabile e può disintegrarsi spontaneamente originando un protone e una coppia di particelle, l’elettrone e l’antineutrino: Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 30

I tipi di decadimento radioattivo Il nuovo nuclide risulta quindi spostato di una posizione a destra nella tavola periodica. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 31

I tipi di decadimento radioattivo 3. Emissione β+ e cattura elettronica. L’emissione di elettroni positivi (β+ o positroni), o la cattura di elettroni, avviene quando il numero di protoni è troppo elevato rispetto ai neutroni. Un protone può trasformarsi in neutrone emettendo una particella equivalente in massa all’elettrone, ma con carica opposta, positrone, oppure assorbendo un elettrone orbitante tra quelli più vicini al nucleo. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 32

I tipi di decadimento radioattivo Il nuovo nuclide risulta spostato di una posizione a sinistra nella tavola periodica. Sull’emissione β+ si basa un’importante tecnica di medicina nucleare: la tomografia a emissione di positroni, o PET. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 33

I tipi di decadimento radioattivo 4. Emissione gamma (γ). Dopo un’emissione α o β viene liberata energia dal nucleo, in forma di raggi γ. Nell’emissione γ restano invariati sia il numero atomico sia il numero di massa. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 34

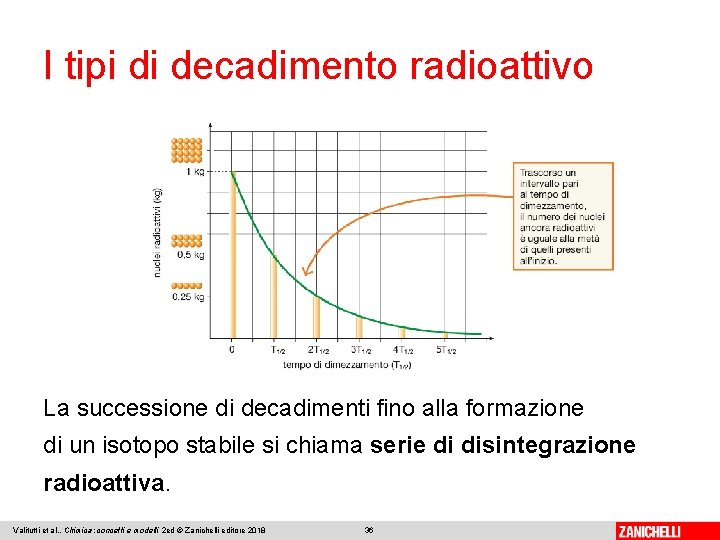
I tipi di decadimento radioattivo Tutti i processi di decadimento evolvono nel tempo secondo uno stesso schema, descritto da una curva con andamento esponenziale decrescente, detta curva di decadimento. Il tempo di dimezzamento (o emivita, T 1/2) è il tempo occorrente per ridurre alla metà la quantità di un isotopo radioattivo. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 35

I tipi di decadimento radioattivo La successione di decadimenti fino alla formazione di un isotopo stabile si chiama serie di disintegrazione radioattiva. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 36

I tipi di decadimento radioattivo Il carbonio-14 è un isotopo radioattivo del carbonio. Si forma nell’atmosfera per effetto dell’urto dei neutroni prodotti dai raggi cosmici con l’azoto. Entra nei tessuti di ogni organismo vivente in percentuale costante e cessa di essere assimilato quando l’organismo muore. Dato che la quantità di 14 C si riduce, dimezzandosi ogni 5730 anni, è possibile risalire su un reperto fossile al tempo trascorso dalla morte dell’organismo. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 37

I tipi di decadimento radioattivo Nella tavola periodica, gli elementi con numero atomico maggiore di 92 sono chiamati elementi transuranici. Non sono presenti in natura, se non in tracce minime, e sono prodotti artificialmente tramite reazioni nucleari. Alla fine del 2015, la IUPAC ha confermato l’esistenza di quattro nuovi elementi, che completano la settima riga della tavola periodica, fino all’elemento che ha Z = 118. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 38

L’energia nucleare è l’energia che bisognerebbe spendere per separare i nucleoni uno dall’altro. La stessa quantità di energia è ceduta nel processo di aggregazione dei nucleoni che costituiscono il nucleo. L’entità dell’energia nucleare di un nucleo corrisponde al difetto di massa, che è la differenza tra la somma delle masse dei nucleoni che si devono aggregare per formare un nucleo e la massa nucleare effettiva. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 39

L’energia nucleare La relazione che consente di calcolare l’energia nucleare a partire dal valore del difetto di massa di un nucleo deriva dalla teoria della relatività di Albert Einstein, che stabilisce un’equivalenza tra massa ed energia: E = m ∙ c 2 Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 40

L’energia nucleare Le reazioni nucleari di maggior interesse, per la produzione di energia, sono le reazioni di fissione nucleare e di fusione nucleare. Si ha fissione nucleare quando un nucleo pesante si scinde in due nuclei più piccoli di massa simile. La trasformazione può avvenire spontaneamente o essere stimolata bombardando con neutroni un nucleo pesante, che viene detto fissile, in una reazione a catena. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 41

L’energia nucleare Schema di funzionamento di un reattore. L’impiego di reattori nucleari per la produzione di energia, benché molto vantaggioso in termini di resa, porta con sé due importanti e gravi problemi: uno legato alle scorie di fissione e uno connesso alla possibilità di incidenti. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 42

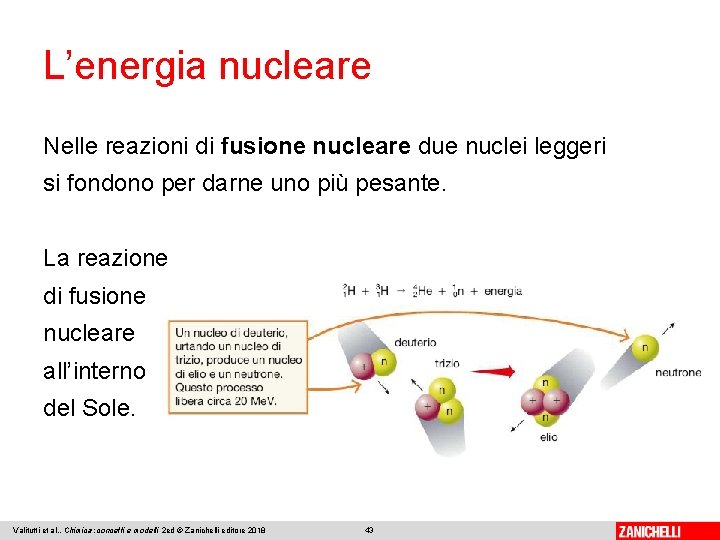
L’energia nucleare Nelle reazioni di fusione nucleare due nuclei leggeri si fondono per darne uno più pesante. La reazione di fusione nucleare all’interno del Sole. Valitutti et al. , Chimica: concetti e modelli 2 ed © Zanichelli editore 2018 43