I LEGAMI CHIMICI Gli atomi si legano tra























- Slides: 32

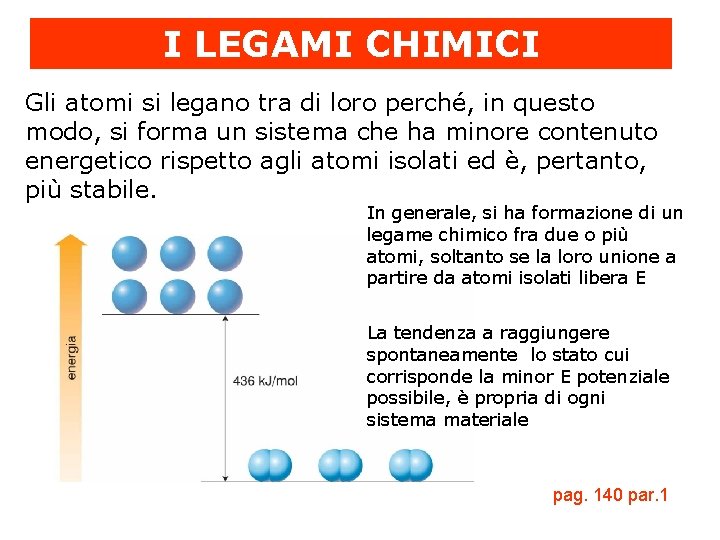
I LEGAMI CHIMICI Gli atomi si legano tra di loro perché, in questo modo, si forma un sistema che ha minore contenuto energetico rispetto agli atomi isolati ed è, pertanto, più stabile. In generale, si ha formazione di un legame chimico fra due o più atomi, soltanto se la loro unione a partire da atomi isolati libera E La tendenza a raggiungere spontaneamente lo stato cui corrisponde la minor E potenziale possibile, è propria di ogni sistema materiale pag. 140 par. 1

L’energia di legame Per allontanare atomi legati chimicamente e riportarli allo stato di atomi isolati, bisogna fornire E: la quantità di E necessaria è esattamente uguale a quella liberata durante la formazione del legame. Si definisce energia di legame (k. J/mol) la quantità di energia che è necessario fornire a una mole di sostanza per rompere il legame che tiene uniti i suoi atomi. Tanto maggiore è l’energia di legame, tanto più stabile è il composto e, tanto più forte è il legame che unisce gli atomi.

La regola dell’ottetto pag. 141 -142 par. 2 La formazione del legame chimico abbassa l’E del sistema perché gli atomi, legandosi, raggiungono la configurazione elettronica esterna s 2 p 6 cioè l’ottetto, che è una configurazione stabile, a bassa E. I gas nobili sono costituiti da atomi isolati perché avendo configurazione elettronica esterna s 2 p 6 sono già stabili.

L’interpretazione elettronica del legame chimico fu avanzata nel 1904 dal chimico Abegg il quale, partendo dall’osservazione dell’inerzia degli elementi aventi otto elettroni esterni, propose la teoria secondo la quale gli atomi si scambierebbero elettroni proprio per raggiungere la stessa configurazione dei gas nobili. Nel 1916, Lewis estese questa interpretazione, sostenendo che gli atomi possono raggiungere la configurazione stabile anche condividendo gli elettroni. Lewis definì questa tendenza degli atomi a raggiungere la configurazione dei gas nobili Regola dell’ottetto: gli atomi tendono a raggiungere la stabilità acquistando, cedendo o condividendo elettroni con un altro atomo in modo da raggiungere l’ottetto cioè una configurazione elettronica esterna simile a quella del gas nobile più vicino nella tavola periodica. La regola dell’ottetto non è tuttavia assoluta: molecole quali Be. H 2 e BH 3 non raggiungono l’ottetto mentre molecole quali PCl 5 e SF 6 hanno più di otto elettroni nel livello esterno.

La tavola periodica e i legami tra gli elementi pag. 153 par. 8 Il tipo e il numero di legami sono determinati dalla configurazione elettronica esterna degli atomi che si legano e quindi, dai loro valori di E di ionizzazione ed Affinità elettronica ovvero dalla loro differenza di Elettronegatività (∆E). ∆E < 0, 4: legame covalente puro / legame metallico 0, 4 < ∆E < 1, 9 : legame covalente polare ∆E > 1, 9: legame ionico

Osservando la tavola periodica si può affermare che: 1. I non metalli formano tra loro legami covalenti: se gli atomi di non metallo sono uguali il legame è covalente puro; se sono diversi e hanno diversa elettronegatività, il legame è covalente polare. 2. I metalli e i non metalli formano fra loro legami ionici: il carattere ionico del legame cresce all’aumentare della differenza di elettronegatività fra gli atomi del composto. 3. I metalli formano tra loro legami metallici. Il passaggio da un legame all’altro non è netto ma graduale. In particolare il legame ionico può essere considerato un caso estremo di legame covalente polare: i composti con spiccato carattere ionico sono quelli formati dagli elementi del primo e del secondo gruppo con gli alogeni e con l’ossigeno.

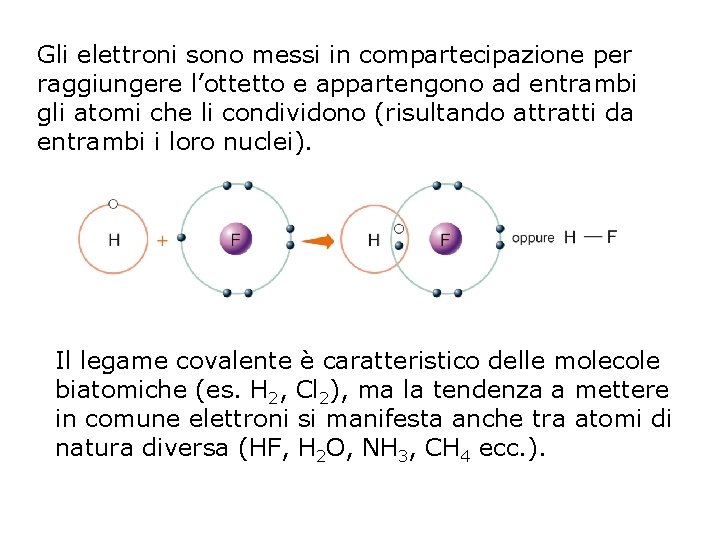
IL LEGAME COVALENTE Il legame covalente si forma quando due atomi mettono in comune una o più coppie di elettroni. Atomi uniti da un legame covalente formano una molecola. Si forma tra non metalli in quanto atomi con: - bassa E di ionizzazione - elevata Affinità elettronica - elevata Elettronegatività pag. 142 -144 par. 3

Gli elettroni sono messi in compartecipazione per raggiungere l’ottetto e appartengono ad entrambi gli atomi che li condividono (risultando attratti da entrambi i loro nuclei). Il legame covalente è caratteristico delle molecole biatomiche (es. H 2, Cl 2), ma la tendenza a mettere in comune elettroni si manifesta anche tra atomi di natura diversa (HF, H 2 O, NH 3, CH 4 ecc. ).

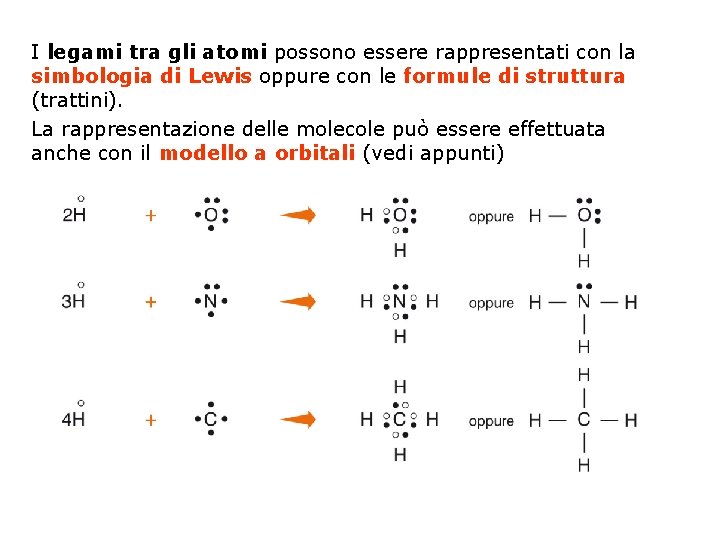
I legami tra gli atomi possono essere rappresentati con la simbologia di Lewis oppure con le formule di struttura (trattini). La rappresentazione delle molecole può essere effettuata anche con il modello a orbitali (vedi appunti)

Lunghezza di legame pag. 144 -145 La lunghezza di legame è la distanza che intercorre tra i nuclei di due atomi uniti da un legame covalente. Essa dipende dall’insieme delle forze attrattive e repulsive tra nuclei ed elettroni. A distanze minori di quella di legame prevalgono le forze repulsive La lunghezza di legame è misurabile sperimentalmente. Essa aumenta all’aumentare delle dimensioni atomiche e al diminuire della forza di legame.

I legami covalenti multipli Il legame covalente può essere • singolo: se è condivisa una sola coppia di elettroni; • doppio: se sono condivise due coppie di elettroni; • triplo: se sono condivise tre coppie di elettroni. Un legame doppio è più corto e più forte di uno semplice Un legame triplo è più corto e più forte di uno doppio

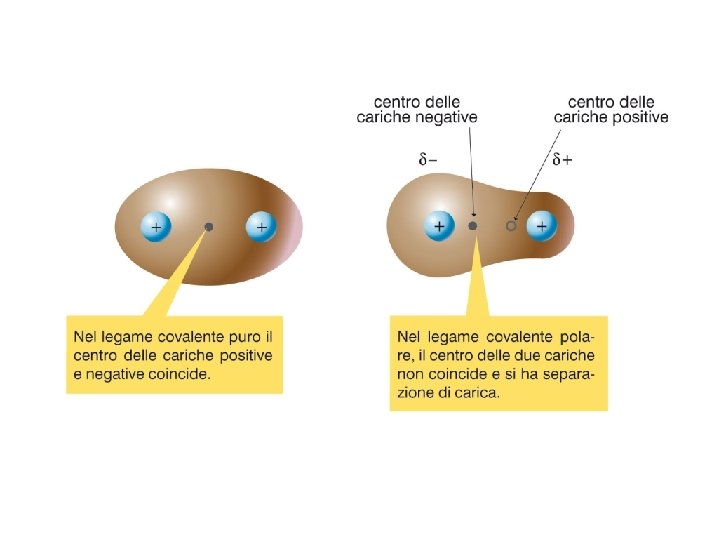
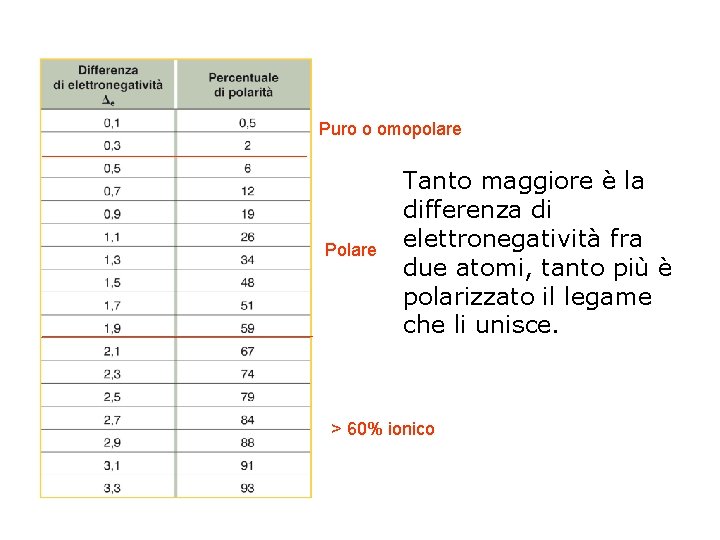
Legame covalente puro, omopolare e polare pag. 148 -149 par 5 Se i due atomi legati da legame covalente sono identici il legame è covalente puro. Atomi diversi possono mettere in compartecipazione i loro elettroni di valenza: se gli atomi, pur essendo diversi, hanno elettronegatività uguale (o ∆E < 0, 4) il legame è covalente omopolare, se invece esercitano sugli elettroni di legame una diversa forza attrattiva (∆E > 0, 4) si forma un legame covalente polare. Gli elettroni non si trovano più al centro fra i due atomi, ma sono spostati verso l’atomo a maggiore elettronegatività su cui si forma una parziale carica negativa (δ–). L’altro atomo acquisisce una parziale carica positiva (δ+). La molecola prende il nome di dipolo


Puro o omopolare Polare Tanto maggiore è la differenza di elettronegatività fra due atomi, tanto più è polarizzato il legame che li unisce. > 60% ionico

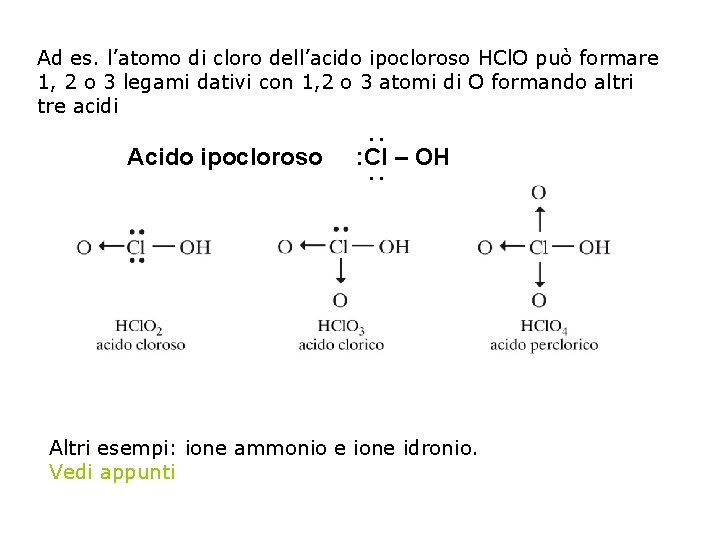
IL LEGAME COVALENTE DATIVO Pag. 146 -147 par. 4 Il legame covalente dativo si forma quando la coppia di elettroni di legame è fornita da uno solo dei due atomi che partecipano al legame. L’atomo che dona gli elettroni si dice donatore, quello che li riceve prende il nome di accettore. Questo legame si può realizzare quando un atomo che, impegnato in altri legami ha già raggiunto l’ottetto, possiede coppie elettroniche libere. Si indica con una freccia rivolta verso l’atomo accettore.

Ad es. l’atomo di cloro dell’acido ipocloroso HCl. O può formare 1, 2 o 3 legami dativi con 1, 2 o 3 atomi di O formando altri tre acidi Acido ipocloroso . . : Cl – OH. . Altri esempi: ione ammonio e ione idronio. Vedi appunti

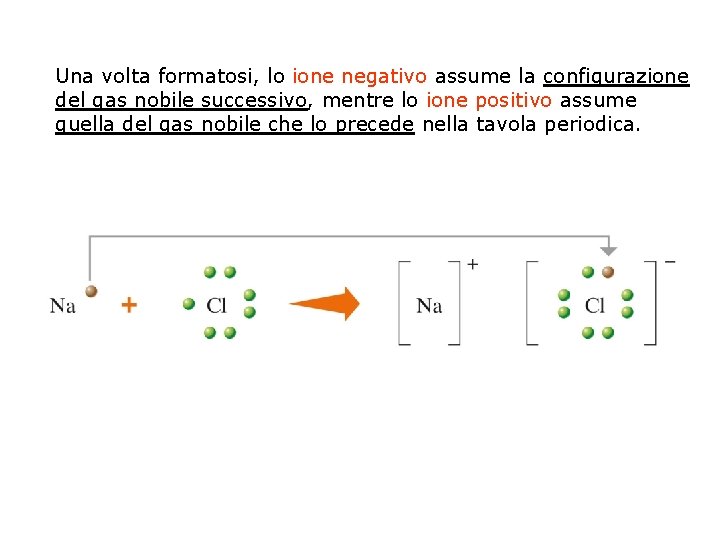
IL LEGAME IONICO Il legame ionico si forma quando la differenza di elettronegatività tra due atomi è maggiore di 1, 9 ovvero superiore al 60%. In questo caso l’atomo più elettronegativo strappa l’elettrone all’altro atomo, assumendo su di sé l’intera carica negativa, mentre l’atomo che ha perso l’elettrone acquisisce una carica positiva: l’atomo più elettronegativo diventa uno ione negativo (ANIONE), l’altro uno ione positivo (CATIONE) Gli ioni si attraggono per forza elettrostatica formando un legame ionico.

Una volta formatosi, lo ione negativo assume la configurazione del gas nobile successivo, mentre lo ione positivo assume quella del gas nobile che lo precede nella tavola periodica.

Dalla posizione sulla tavola periodica si può dedurre che: • gli elementi metallici (a sinistra nella tavola periodica) tendono a cedere elettroni diventando ioni positivi; • i non metalli (a destra nella tavola periodica) tendono ad acquistare elettroni trasformandosi in ioni negativi.

In generale: • i metalli dei gruppi I, II e III tendono a perdere, rispettivamente, 1, 2 o 3 elettroni (elettroni livello esterno), formando cationi di carica +1, +2 e +3 • i non metalli dei gruppi V, VI e VII, tendono ad acquistare, rispettivamente, 3, 2 ed 1 elettrone, trasformandosi in anioni di carica -3, -2 e -1 Il numero degli atomi coinvolti dovrà essere tale da consentire che il numero degli elettroni persi sia uguale a quello degli elettroni acquistati. Vedi appunti: Rappresentazione del legame ionico con le formule di Lewis e con l’equazione chimica

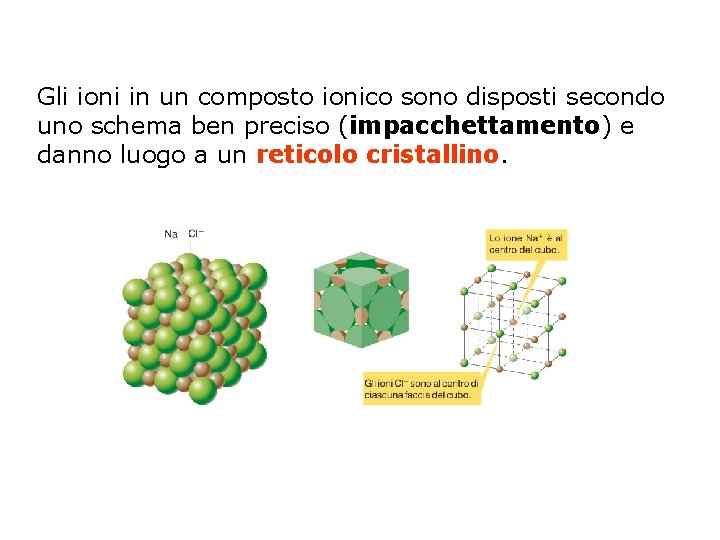
Gli ioni in un composto ionico sono disposti secondo uno schema ben preciso (impacchettamento) e danno luogo a un reticolo cristallino.

LA FORMULA MINIMA La formula dei composti ionici indica il rapporto di combinazione tra ioni positivi e negativi ma non rappresenta la molecola di un composto perché nei cristalli non si distinguono unità molecolari. E’ pertanto definita formula minima.

CARATTERISTICHE DEI COMPOSTI IONICI I composti ionici sono solidi a temperatura ambiente e hanno alti punti di fusione (a causa delle forti forze attrattive tra uno ione e l’altro), sono buoni conduttori di elettricità sia allo stato fuso che in soluzione.

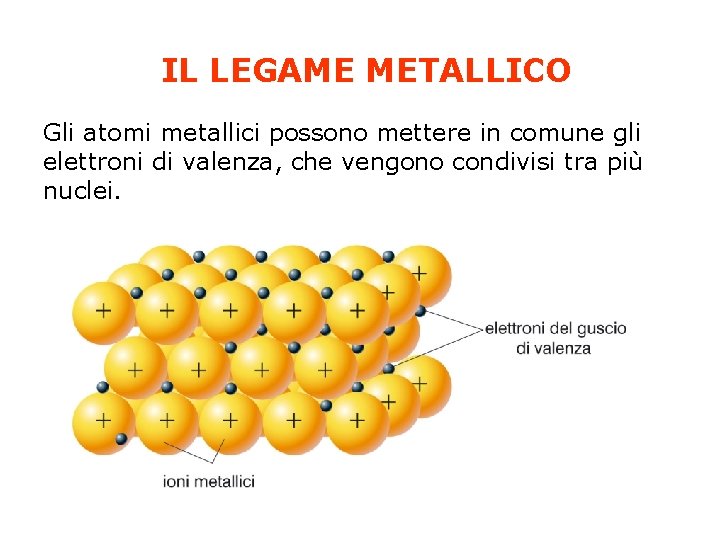
IL LEGAME METALLICO Gli atomi metallici possono mettere in comune gli elettroni di valenza, che vengono condivisi tra più nuclei.

Il legame metallico è dovuto all’attrazione fra gli ioni metallici positivi e gli elettroni mobili che li circondano. Gli ioni metallici positivi occupano posizioni quasi fisse nel cristallo e tutti gli elettroni più esterni passano liberamente da un atomo all’altro. La nuvola elettronica avvolge e tiene uniti tutti i cationi metallici del cristallo. Tanto più sono numerosi gli elettroni mobili tanto più forte è il legame metallico. La mobilità degli elettroni più esterni conferisce le caratteristiche proprietà metalliche: lucentezza, conducibilità termica ed elettrica, malleabilità, duttilità.

LA FORMA DELLE MOLECOLE pag. 153 -154 par. 9 Le proprietà peculiari di una sostanza dipendono dal modo in cui sono disposti gli atomi delle molecole che la costituiscono, cioè dalla sua geometria. Ciò che definisce la geometria di una molecola è l’angolo di legame, ovvero l’angolo formato dagli assi congiungenti i nuclei degli atomi che si legano. Es. molecola di acqua: presenta due coppie elettroniche di legame e due coppie elettroniche libere

La teoria VSEPR pag. 154 -157 par. 10 La geometria delle molecole è ricavabile utilizzando la teoria VSEPR (Valence Shell Electron-Pair Repulsion) ovvero teoria della repulsione delle coppie di elettroni del guscio di valenza (perché presuppone che gli elettroni di valenza si respingano reciprocamente) I principi fondamentali della teoria VSEPR sono: • la disposizione degli atomi in una molecola dipende dal numero totale di coppie elettroniche di valenza (di legame e libere) che circondano l’atomo centrale; • le coppie elettroniche, avendo uguale segno, si respingono collocandosi alla maggiore distanza possibile le une dalle altre.

MOLECOLE CON TUTTE LE COPPIE ELETTRONICHE IMPEGNATE IN LEGAMI In base al numero di coppie elettroniche condivise intorno all’atomo centrale (ricavabili dalle formule di Lewis) si ha che: • due coppie individuano una geometria lineare con angoli di 180° • tre coppie determinano un assetto triangolare equilatero con angoli di 120° • quattro coppie individuano una geometria tetraedrica con angoli di 109, 5°


MOLECOLE CON COPPIE ELETTRONICHE LIBERE O CON LEGAMI MULTIPLI La forma della molecola dipende anche delle coppie elettroniche libere che, essendo attratte da un solo nucleo, risultano più vicine ad esso. Le coppie di elettroni liberi hanno un comportamento simile a quello delle coppie condivise ma la repulsione tra le coppie di elettroni liberi è maggiore della repulsione tra una coppia libera e una condivisa che, a sua volta, è maggiore della repulsione tra due coppie di elettroni condivisi. La conseguenza è che esse, generando una repulsione maggiore, costringono le coppie elettroniche condivise ad avvicinarsi: ciò comporta una diminuzione degli angoli di legame (vedi es. ammoniaca e acqua). I legami covalenti doppi e tripli valgono come un legame singolo ai fini della geometria molecolare (anche se determinano una repulsione maggiore sulle coppie adiacenti).


Molecola di NH 3: 4 coppie elettroniche di cui una libera La geometria di riferimento è quella tetraedrica. Tuttavia, a causa della maggiore repulsione esercitata dalla coppia di elettroni liberi, gli angoli di legame anziché essere di 109, 5° sono pari a circa 107, 3°. Inoltre, poiché la molecola presenta solo tre legami, la molecola non ha forma tetraedrica ma piramidale triangolare. Molecola di H 2 O: 4 coppie elettroniche di cui due libere La geometria di riferimento è quella tetraedrica. Per la presenza di due coppie elettroniche libere, l’angolo di legame diminuisce ulteriormente, è infatti di 104, 5°. Avendo solo due legami la molecola assume una forma detta piegata.
 Legame dativo
Legame dativo Legame covalente dativo
Legame covalente dativo Ossido nichelico
Ossido nichelico Legame covalente
Legame covalente Soluzioni capitolo 13 zanichelli chimica
Soluzioni capitolo 13 zanichelli chimica Esempio forze di london
Esempio forze di london Adenina numerazione
Adenina numerazione Forze di van der waals
Forze di van der waals Mappa concettuale legami chimici
Mappa concettuale legami chimici Geometria molecolare tabella
Geometria molecolare tabella Molul de atomi
Molul de atomi Budowa atomi
Budowa atomi Atomi di carbonio tetraedrici
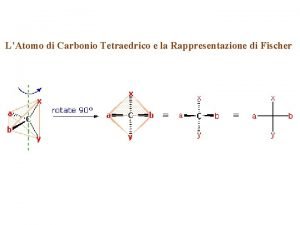
Atomi di carbonio tetraedrici Atomi tömegegység jele
Atomi tömegegység jele Atomi studio youtube
Atomi studio youtube S2p6d10f14
S2p6d10f14 Kemija 7 razred atomi
Kemija 7 razred atomi Adicija vodika na eten
Adicija vodika na eten Oxizi denumire
Oxizi denumire Nomenclatura mappa concettuale
Nomenclatura mappa concettuale Classificazione e nomenclatura dei composti zanichelli
Classificazione e nomenclatura dei composti zanichelli Mappa nomenclatura chimica
Mappa nomenclatura chimica Pericoli chimici fisici e biologici negli alimenti
Pericoli chimici fisici e biologici negli alimenti Agente chimico definizione
Agente chimico definizione Nomenclatura mappa concettuale
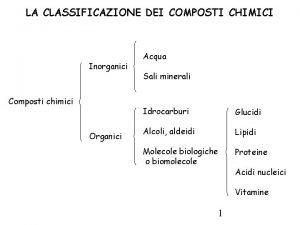
Nomenclatura mappa concettuale Composti chimici inorganici
Composti chimici inorganici Prostaglandine vasodilatazione
Prostaglandine vasodilatazione Evaginazione
Evaginazione Filamento dna
Filamento dna Forze intermolecolari mappa concettuale
Forze intermolecolari mappa concettuale Legame metallico
Legame metallico Legami secondari chimica
Legami secondari chimica Reazione di condensazione
Reazione di condensazione