MASA ATOMICA MOLUL DE ATOMI STIATI CA Intrun
















- Slides: 16

MASA ATOMICA MOLUL DE ATOMI

STIATI CA…. . -Intr-un varf de ac se gasesc 100 milioane atomi de Fe ; -daca s-ar reduce dimensiunea unui om la dimensiunea atomului atunci intr-un cm 3 ar intra de 20 miliarde de ori populatia globului; -pe lungimea de 1 cm se pot aseza unul langa altul 108 atomi;

Masele atomice reale: -23 10 - m. H = 0, 1673 g - m. C = 1, 9923 10 -23 g -23 - m. O = 2, 6564 10 g

Datorita dimensiunilor extrem de reduse ale atomilor in cele mai mici cantitati de substante exista un numar foarte mare de atomi.

EXEMPLU: Intr-o zecime de mg de hidrogen(10 -4 g) exista: 18 60 · 10 atomi (60 de miliarde).

SA NE IMAGINAM… Cu un numar echivalent de fire de nisip s-ar putea acoperi toate plajele din Europa cu un strat de cativa zeci de metri grosime.

Masele atomice reale apartin unor scari extrem de incomode si din acest motiv s-a impus necesitatea introducerii unui alt sistem cel al maselor atomice relative care au valori usor utilizabile.

In anul 1961 s-a introdus u. a. m. sau etalonul care reprezinta a 12 -a parte din m 12 C= u. a. m. =1/12 m 1, 9923 10 -23 g/12=0, 166 10 -23 g

MASELE ATOMICE RELATIVE: AH =0, 1673 10 -23 g/0, 166 10 -23 g= =1, 0078 AO =15, 999 AC =12 ATENTIE! Masele atomice relative sunt marimi adimensionale(se obtin prin raportul dintre doua mase).

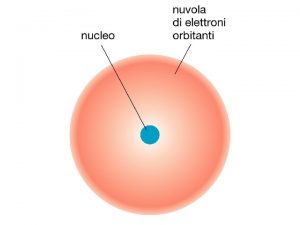
D. p. v. al structurii atomului, masa atomica relativa ar reprezenta masa nucleului deci ar trebui sa fie egala cu suma protonilor si a neutronilor(numar intreg). In realitate A are valori fractionare deoarece se tine cont de ponderea izotopilor.

35 Cl 37 Cl 75, 4% 24, 6% ACl=35· 75, 4/100+37· 24, 6/100 =35, 49

Calculati A Mg 24 Mg 25 Mg 26 Mg 78% 10, 1% 11, 3% A Mg=…. .

Cuvant cheie: MOLUL -Cantitatea dintr-un element ce contine 6, 023 1023 atomi se numeste MOL DE ATOMI. 6, 023 1023 = numarul lui Avogadro -Cantitatea dintr-un element egala cu masa lui atomica exprimata in grame se numeste MOL DE ATOMI.

Importanta teoretica si practica a numarului Avogadro. 1. D. p. v. teoretic NA ne ajuta sa definim corect si simplu molul de atomi. 2. D. p. v. practic NA ne ajuta la efectuarea calculelor chimice.

APLICATII: Ce deosebiri exista intre masa atomica reala , masa atomica relativa, molul de atomi? Cati atomi sunt cuprinsi in: 32 g S, 4 g. He, 27 g. Al, 16 g. O? In cate g de N, Mg, Na se gasesc 6, 023 1023 atomi? Cati moli reprezinta 35, 5 g Cl, 71 g Cl?

Prof. AURORA FAGARAS
 Masa atomica
Masa atomica Stiati ca columna lui traian
Stiati ca columna lui traian Cunoscand masa molara a carbonului
Cunoscand masa molara a carbonului Partículas subatómicas
Partículas subatómicas Masa atmica
Masa atmica Atomi studio youtube
Atomi studio youtube Atomi polielettronici
Atomi polielettronici Compusi binari ai oxigenului
Compusi binari ai oxigenului Kemija 7 razred svojstva tvari
Kemija 7 razred svojstva tvari Nepopolno gorenje metana
Nepopolno gorenje metana Svi metali
Svi metali Teoria vsepr
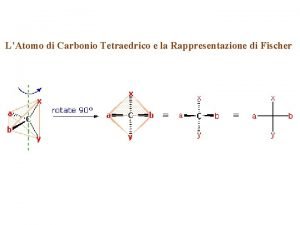
Teoria vsepr Atomi di carbonio tetraedrici
Atomi di carbonio tetraedrici Atomi tömegegység jele
Atomi tömegegység jele Masa molecular y masa molar
Masa molecular y masa molar Perkembangan desain dari masa ke masa
Perkembangan desain dari masa ke masa Masa molar ba(oh)2
Masa molar ba(oh)2