Ejercicios de soluciones FRMULAS en masa masa del
























- Slides: 27

Ejercicios de soluciones

FÓRMULAS % en masa= masa del soluto * 100% masa de la solución Si tengo una solución de Na. Cl al 10 %en masa significa que hay 10 gramos de Na. Cl en 100 gramos de solución. % masa - volumen = masa del soluto * 100% volumen de la solución Solución= Soluto + solvente

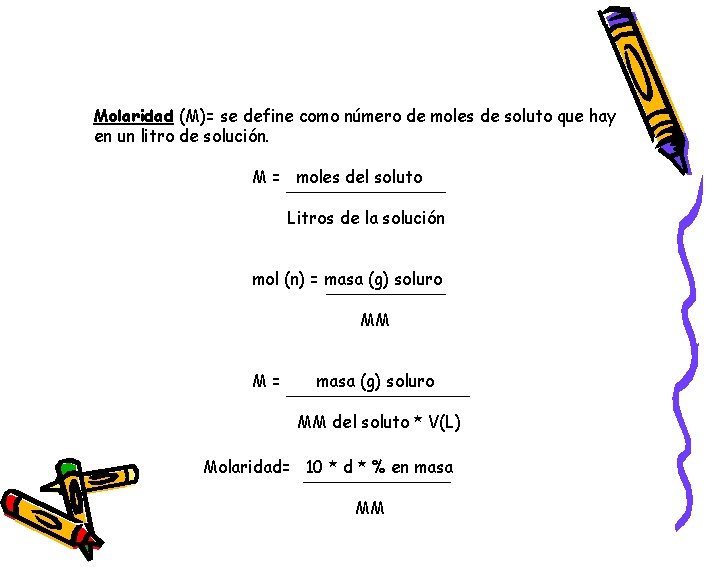
Molaridad (M)= se define como número de moles de soluto que hay en un litro de solución. M = moles del soluto Litros de la solución mol (n) = masa (g) soluro MM M= masa (g) soluro MM del soluto * V(L) Molaridad= 10 * d * % en masa MM

Dilución: preparar una solución a partir de una solución concentrada. C 1*V 1 = C 2 * V 2 ó M 1 * V 1 = M 2 * V 2 Molalidad (m) = es el número de moles de soluto por kilogramo de disolvente. m= n° de moles de soluto n° de kilogramo de disolvente m= gramos de soluto MM de soluto * Kg solvente

Guía de ejercicios 1. - Determine el % en masa de una solución que se prepara disolviendo 15 gramos de Na. Cl en 60 gramos de agua H 2 O 2. - Determine el % masa - volumen de una solución que se prepara disolviendo 40 gramos de un soluto en 160 m. L de solución. 3. - Se desea preparar 450 m. L de una solución al 65% masa - volumen. Determine los gramos de soluto y solvente necesarios para preparar dicha solución. S abiendo que la densidad de la solución es 1, 05 g/m. L 4. - Calcular la masa de sulfato de Níquel Ni. SO 4, contenidos en 200 gramos de una solución al 6 % en masa de Ni. SO 4

5. -Calcular la masa de una disolución al 6 % en masa de Ni. SO 4 que contiene 40, 0 gramos de Ni. SO 4 6. - Calcular la masa de Ni. SO 4 contenida en 200 m. L de disolución al 6 % en masa de Ni. SO 4. La densidad de la solución es de 1, 06 g/m. L 7. -¿Qué volumen de una disolución que es del 15, 0 % en masa en nitrato de hierro ( III), contiene 30, 0 gramos de Fe(NO 3)3. La densidad de la solución es de 1, 16 g/m. L a 25°C. 8. - Se disuelven 5, 25 gramos de KMn. O 4 en agua suficiente para preparar 500 m. L de solución. Determine la molaridad.

9. - ¿Cuántos gramos de Na. Cl se necesitan para prepara 200 m. L de solución, cuya concentración molar es de 0, 00250. 10. -Determine la molalidad de una disolución de ácido sulfúrico H 2 SO 4 que contiene 24, 4 gramos de ácido en 198 gramos de agua. 11. Calcular la molaridad de una disolución que contiene 3, 65 gramos de HCl en 2 litros de disolución. 12. - Calcular la masa de Ba(OH)2 necesaria para preparar 2, 50 litros de una solución 0, 06 molar de Ba(OH)2.

13. - Una muestra de ácido sulfúrico comercial tiene 96, 4 % en masa de H 2 SO 4 y la densidad es 1, 84 g/m. L. Calcular la M de esta disolución de H 2 SO 4. 14. - Calcular el volumen de H 2 SO 4 18 M necesario para preparar 1, 0 litro de una solución 0, 9 M de H 2 SO 4. 15. Se tiene 500 m. L de una solución de ácido sulfúrico 0, 34 M. Calcular: a)Moles de H 2 SO 4 b)Milimoles de H 2 SO 4 c)Los gramos de H 2 SO 4 16. - ¿Cuántos gramos de soluto hay presentes en 100 gramos de solución acuosa al 0, 250 % en masa de Na 2 S? ¿Cuántos moles de soluto hay? ¿Cuántos gramos de H 2 O ( el disolvente ) están contenidos en la disolución?

17. -La densidad de una solución al 18 % en masa de sulfato de amonio (NH 4)2 SO 4 es de 1, 10 g/m. L ¿Qué masa de sulfato de amonio se necesitará para preparar 425 m. L de esta disolución? 18. - ¿Cuál es la molaridad (M) de una disolución que contiene 650 gramos de ácido fosfórico H 3 PO 4 en 3 L de disolución? 19. -¿Cuál es la M de una disolución que contiene 0, 335 moles de H 3 PO 4 en 250 m. L de disolución? 20. - El ácido clorhídrico HCl comercial tiene una concentración de 12, 0 M ¿ Qué volumen de este ácido se necesitan para preparar 4, 50 L de una disolución de HCl 1, 80 M?

Evalúa tus conocimientos I. -Del ejercicio 1 de la guía cual es la solución correcta es: a) 25 % b) 20 %

I. - Recuerda que la solución es el soluto + solvente , por lo tanto gramos de solución: 15 gramos del soluto + 60 gramos el solvente gramos de solución = 75 gramos % en masa = 15 gramos del soluto * 100% 75 gramos de solución % en masa = 20

II. - del ejercicio 3 de la guía cual es solución correcta: a) 65 gramos de soluto y 35 gramos de solvente b) 292, 5 gramos de soluto y 472 gramos de solvente c) 292, 5 gramo de soluto y 180 gramos de solvente

II Reemplazando en la fórmula de % masa - volumen 65 % masa - volumen = X gramos de soluto *100% 450 ml X= 292, 5 gramos de soluto Enseguida y de acuerdo con los datos que tenemos calculo los gramos de solución: Tengo la densidad de la solución y el volumen de la solución por los tanto y de acuerdo a la fórmula de densidad puedo calcular la masa de la solución. d= m v 1, 16 g/m. L = m 450 m. L m= 472, 5 gramos de solución Ahora podemos calcular los gramos de solvente según: Solución = Soluto + Solvente 472, 5 gramos = 292, 5 gramos + X= 180 gramos de H 2 O X

III. -La respuesta correcta del ejercicio 6 de la guía es: a) 12, 72 gramos b) 6 gramos c) 3 gramos

III. - Disponemos de los siguientes datos: 200 m. L de solución 6% en masa d= 1, 06 g/m. L de la solución masa de soluto = X Según estos datos debo emplear la fórmula de % en masa , para lo cual el volumen de la solución debo pasarlo a masa utilizando para ello la fórmula de densidad. d=m v 1, 06 g/m. L = m 200 m. L la masa de la solución es igual 212 g Ahora podemos reemplazar en la fórmula: 6% en masa = x gramos de soluto 212 gramos de solución * 100% X= 12, 72 gramos de Ni. SO

IV. - Según los datos del ejercicio 10 de la guía la respuesta correcta sería: a) 1, 26 * 10 -3 m -6 m b)1, 26 m c) 1, 26 * 10

IV. -Disponemos de los siguientes datos: gramos el soluto = 24, 4 de H 2 SO 4 gramos del solvente = 198 de H 2 O Antes de reemplazar en la fórmula necesito los gramos de agua en kilogramos para lo cual establezco la siguiente relación: 1 Kg x 1000 g 198 g x = 0, 198 Kg La MM del H 2 SO 4 se calcula de la siguiente manera: número de átomos Número másico H= 2 * 1 = S= 1 * 32 = O= 4 * 16 = 2 32 64 98 g/mol Ahora reemplazamos en la fórmula de molalidad: m= 24, 4 g 98 g/mol 0, 198 Kg = 1, 26 m

V. - La respuesta correcta del ejercicio 13 de la guía es: a)18, 1 * 10 b) 18, 1 M -3 M

V. - Este ejercicio lo podemos resolver de dos formas: Disponemos de los siguientes datos: 96, 4 % en masa de H 2 SO 4 d= 1, 84 g/m. L MM= 98 g/mol • Una de ellas es reemplazar en la fórmula M= 10 * d *% en masa MM M= 10 * 1, 84 * 96, 4 = 18, 1 98

• La otra forma es ir estableciendo relaciones para realizar los cálculos necesarios de siguiente manera: • Del 96, 4 % podemos concluir que hay 96, 4 gramos de soluto en 100 gramos de soluci • Luego como tenemos los gramos de soluto podemos calcular los moles de soluto: Mol= 96, 4 g = 0, 984 moles de H 2 SO 4 98 g/mol • Tenemos la densidad de la solución y los gramos de la solución por lo tanto podemos calcular el volumen de la solución: d=m v 1 litro X 1, 84 g/m. L = 100 g X 1000 m. L 54, 3 m. L X= 54, 3 m. L X = 0, 0543 L • Ahora reemplazamos los datos obtenidos en la fórmula de molaridad: M = Moles de soluto L de solución M= 0, 98 4 moles 0, 0543 L = 18, 1

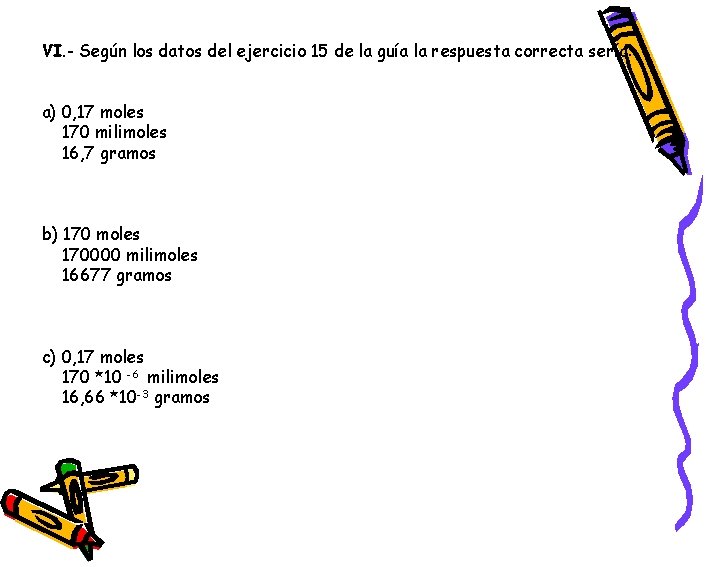
VI. - Según los datos del ejercicio 15 de la guía la respuesta correcta sería: a) 0, 17 moles 170 milimoles 16, 7 gramos b) 170 moles 170000 milimoles 16677 gramos c) 0, 17 moles 170 *10 -6 milimoles 16, 66 *10 -3 gramos

VI. - Disponemos de los siguientes datos: 500 m. L de solución de H 2 SO 4 0, 34 M De acuerdo a la fórmula de M= moles de soluto / L de solución podemos despejar los moles, pero antes hay que pasar los m. L a L , por lo tanto 500 m. L /1000 = 0, 5 L 0, 34 = Moles V(L) 0, 5 = 0, 17 moles esto es lo mismo que decir que mol = M * Como ya tenemos los moles hacemos la siguiente relación: 1 mol 0, 17 1000 milimoles x= 170 milimoles Otra forma sería multiplicar la molaridad por el volumen en m. L: 0, 34 M * 500 m. L= 170 milimoles ó 170 mn Sabemos que mol (n) = g despejando nos queda que : MM g= mol * MM g= 0, 17 n * 98 g/n = 16, 7

VII. - Según los datos del ejercicio 20 de la guía la respuesta correcta sería: a) 97, 2 L b) 0, 675 L c) 30 L

VII. -Utilizamos la fórmula de dilución que dice: C 1 * V 1 = C 2 *V 2 12 * V 1 = 1, 80 * 4, 50 V 1= 0, 675 L

Respuestas 1. - 20 % 2. - 25 % 3. - soluto = 292, 5 gramos solvente = 180 gramos 4. - 12 gramos 5. - 666, 7 gramos de solución 6. - 12, 72 gramos

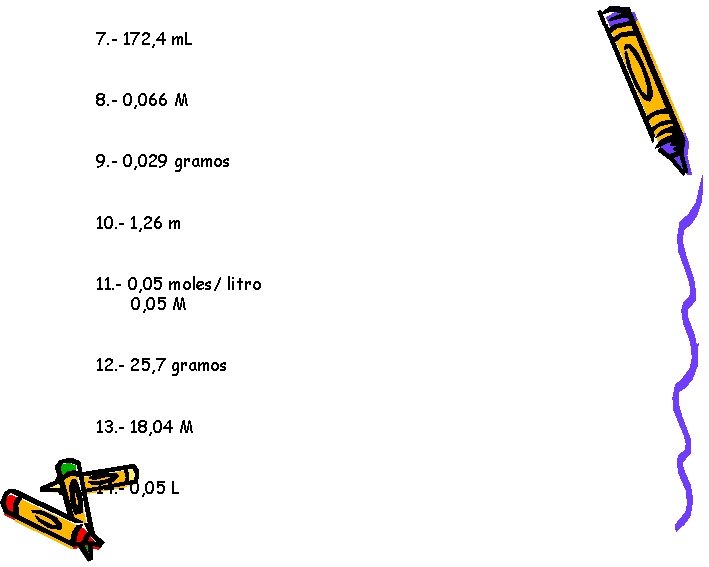
7. - 172, 4 m. L 8. - 0, 066 M 9. - 0, 029 gramos 10. - 1, 26 m 11. - 0, 05 moles/ litro 0, 05 M 12. - 25, 7 gramos 13. - 18, 04 M 14. - 0, 05 L

15. - a) 0, 17 moles de H 2 SO 4 b) 170 milimoles c) 16, 7 gramos 16. - 0, 250 gramos de Na 2 S 3, 2 * 10 – 3 moles Na 2 S 99, 75 gramos de H 2 O 17. - 84, 15 gramos de (NH 4)2 SO 4 18. - 2, 21 M 19. - 1, 34 M 20. - 0, 675 L