PONAVLJANJE GRADIVA 7 RAZREDA TO JE KEMIJA Kemija






















- Slides: 29

PONAVLJANJE GRADIVA 7. RAZREDA

ŠTO JE KEMIJA?

�Kemija je prirodna znanost koja proučava građu, svojstva i promjene tvari. �Pokus je namjerno izazivanje nekih promjena u određenim uvjetima radi njihova praćenja i proučavanja. �Demonstracijski pokusi- oni pokusi koje izvode nastavnik/nastavnica, a učenici pozorno prate.

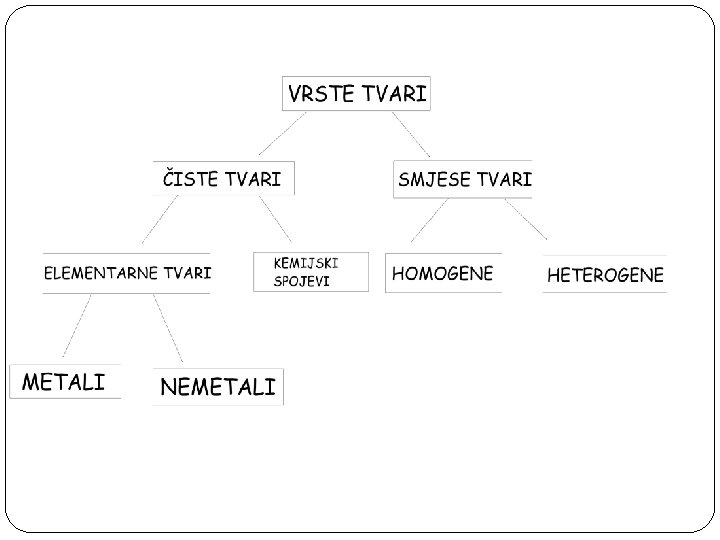
TVARI

� Tvar- svaka tvar ima masu i zauzima prostor. � Tijela su građena od tvari. � Ako želimo pobliže upoznati neku tvar, uzmemo manju količinu te tvari tj. uzorak. bakar Modra galica Sol kuhinjska

�Tvari različito provode struju, pa ih dijelimo na vodiče i izolatore. �Agregacijska stanja tvari: čvrsto(s-solid), tekuće(lliqid) i plinovito(g-gas) �Čvrsto stanje- stalan oblik i stalan volumen �Tekuće stanje- stalan volumen i nestalan oblik �Plinovito stanje- nestalan oblik i nestalan volumen Zlato je dobar vodič struje

VRSTE TVARI I RAZDVAJANJE SASTOJAKA IZ SMJESA


Kiseline, lužine i soli � Indikatori-kiseline: plavi lakmusov papir, metiloranž � Indikatori-lužine: crveni lakmusov papir, fenolftalein � Sol- otopine kuhinjske soli ne mijenja boju indikatora, stoga je neutralna kiseline kuhinjska sol lužine

Nazivi kiselina �HCl – klorovodična kiselina � H 2 SO 4 – sumporna kiselina �H 3 PO 4 – fosforna kiselina �H 2 SO 3 – sumporasta kiselina �H 2 CO 3 – ugljična kiselina �H 2 S – sumporovodična kiselina �HNO 3 – dušična kiselina

Smjese tvari �Smjesa se sastoje od dviju ili više tvari, a pojedini sastojsci u smjesi sadržavaju svoja svojstva. �Smjese mogu biti - heterogene - homogene

�Heterogene - sastojci se mogu razlikovati golim okom, povećalom ili mikroskopom -primjer: ptičja hrana, žbuka, ulje i voda. . . -postupci za odvajanje: čavlićima od drvene piljevine magnetom � Homogene-sastojci se ne mogu razlikovati golim okom, povećalom ili mikroskopom npr. zrak, morska voda, . . . - postupci za odvajanje: kristalizacija, hlapljenje, destilacija, . . . HETEROGENA SMJESA HOMOGENA SMJESA

Zrak koji udišemo i voda koju pijemo

Zrak � 21 %-kisik � 78%-dušik �ostali plinovi �Atmosferski tlak-atmosfera tlači Zemlju i sve što je na njoj �Troposfera-događaju se sve atmosferske pojave(kiša, vjetar, . . . )

�Kisik - najzastupljenije tvari u prirodi - tri bitna svojstva: teži od zraka, podržava gorenje, ali ne gori -topljivost kisika je relativno mala -kisik se iz smjese može izdvojiti: elektrolizom, frakcijskom destilacijom �Dušik-bezbojan plin -vrlo slabo se otapa u vodi -ne gori

Voda �Najrasprostraniji i najvažniji spoj na Zemlji �Bez nje nije moguć ni jedan oblik života �Voda u prirodi stalno kruži i usput otapa mnoge tvari �Anomalija vode-najgušća pri 4°C �Vrste vode: -meke vode(sadrže vrlo malo otopljenih tvari) -tvrde vode(imaju otopljene velike količine soli) POSLJEDICA TVRDIH VODA

Vodik �Vodik je pri sobnoj temperaturi plin bez boje i mirisa, lakši od zraka , gori, ali ne podržava gorenje �Dobivamo ga u kippovom aparatu �Plin praskavac-smjesa zraka i vodika KIPPOV APARAT

Atom

�Atom-čestice kuglastog oblika, različitih veličina -subatomske čestice-elektroni, protoni, neutroni -protonski broj: Z=N(p)=N(e) -maseni broj: A=N(p)+N(n) DMITRIJ IVANOVIČ MENDELJEJEV


�Izotopi-atomi istog kemijskog elementa s različitim brojem neutrona -vodik: procij, deuterij, tricij 12 13 14 -ugljik: C 6 6 C 6 C -24 �Relativna atomska masau 1, 66 = g=x 10 �Kemijski spojevi - H O-voda 2 -3 NH - amonijak -4 CH -metan MODEL MOLEKULE METANA -27 1, 66 kg MODEL MOLEKULE AMONIJAKA x 10

Ioni �Ioni-električki nabijene čestice, nastale primanjem ili otpuštanjem elektrona. �Kationi-pozitivno nabijeni ioni nastali otpuštanjem elektrona �Anioni-negativno nabijeni ioni nastali primanjem elektrona

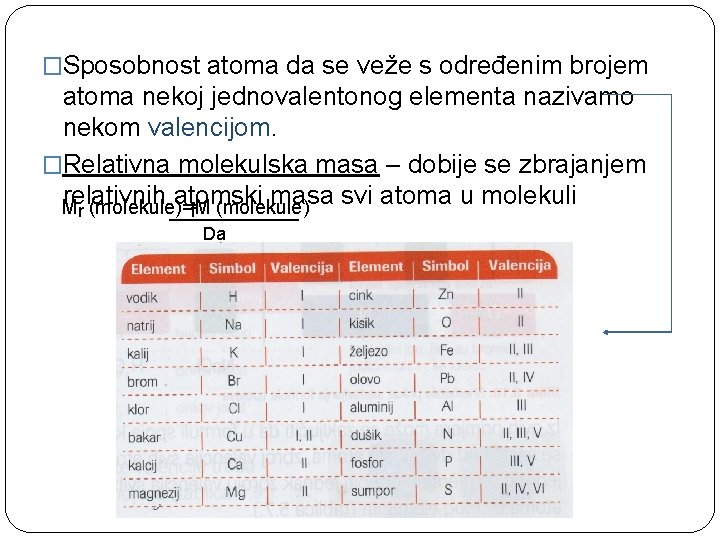
�Sposobnost atoma da se veže s određenim brojem atoma nekoj jednovalentonog elementa nazivamo nekom valencijom. �Relativna molekulska masa – dobije se zbrajanjem relativnih atomski masa svi atoma u molekuli M r (molekule)=M _______ f (molekule) Da

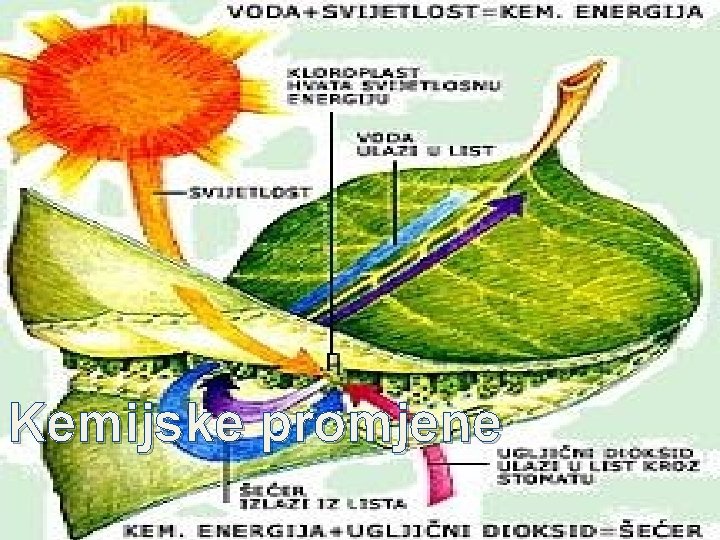
Kemijske promjene

�Reaktanti-tvari koje reagiraju �Produkti-tvari koje nastaju nakon kemijske reakcije �Kemijska sinteza-iz 2 jednostavne tvari dobije se nova, složenija tvar �Kemijska analiza-složenija tvar koja je razlažena na jednostavnije tvari �Zakon o očuvanju mase glasi: masa tvari nakon kemijske reakcije ostaje nepromjenjena H 2 + O 2 2 H O IZJEDNAČAVANJE JEDNADŽBE

Energija � Energija ne može nestati � Egzotermna promjena-energija se oslobađa � Endotermna promjena-energija iz okoline dolazi u sustav � Što sve ovisi o brzini kemijske reakcije-tempereatura reaktanata, vrsta reaktanata, količina katalizatora ENERGIJA SUNCA

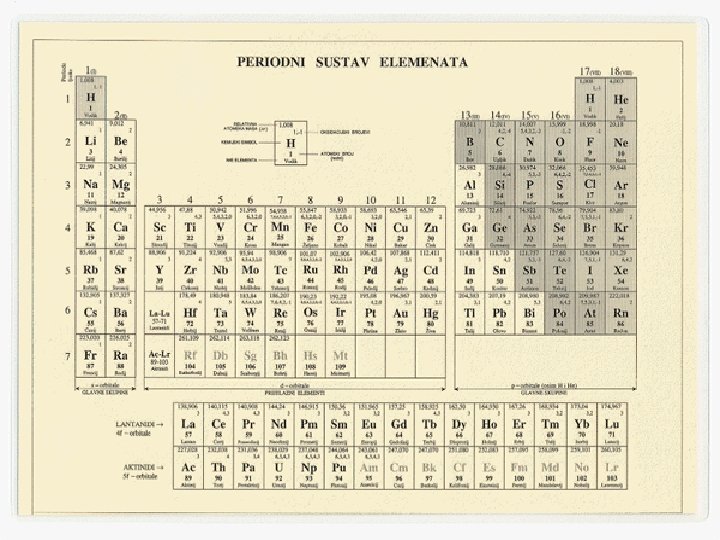
Kemijski elementi i njihova svojstva

�Metali-imaju metalni sjaj -najčesšće su sive boje -dobro provode elektricitet i toplinu -mnogi se mogu kovati -legiranje-svojstva metala se poboljšavaju -najčešći su alkalijski metali �Nemetali-nemaju metalni sjaj -nalaze se u sva 3 agregacijska stanja -ne provode elektricitet i toplinu -ne mogu se kovati -halogeni

Prezentaciju uredile i napravile: �Natalija Debeljak �Gabriela Marić 7. a