Struttura atomica struttura nucleare n Fisica Atomica n

















- Slides: 23

Struttura atomica –struttura nucleare

n Fisica Atomica n n n n n Primi modelli atomici Esperienza di Rutherford Atomo di idrogeno Spin Funzione d’onda Numeri quantici Spin dell’elettrone Principio di Pauli Spettri X Transizioni atomiche

n Fisica Nucleare n n n Proprietà dei nuclei Carica e massa Dimensioni del nucleo Stabilità del nucleo Spin del nucleo e momento magnetico Energia di legame Radioattività Decadimenti alfa, beta Radiazione gamma Datazione con il metodo del carbonio 14. Radioattività naturale

Modelli atomici n n n Modello di Newton: sfera rigida Modello di Thomson Esperimento di Rutherford: confuta il modello di Thomson. Nucleo piccolo al centro positivo e nube elettronica negativa. n Due problemi: n n Frequenze caratteristiche Emissione di radiazione assente

Struttura dell’atomo (2) n Ipotesi di Bohr: n n n La fisica classica non può essere applicata su scala atomica. Livelli energetici quantizzati (Planck). Frequenza emessa nel passaggio da un livello all’altro (emissione di fotoni) Miglioramenti: gruppi di righe nello spettro dell’idrogeno Ipotesi di De Broglie: l’elettrone ha una natura ondulatoria.

n n n Energia potenziale dell’atomo di idrogeno Livelli energetici. Numero quantico principale n (è sufficiente nei problemi unidimensionali). Numeri quantici orbitale (l ) e magnetico. n da 1 a infinito (shell K, L, M, …) l da 0 a n-1 (sottostrati s, p, d, f. . ) m da –l a l

n n Spin. Esistono il doppio dei sottostrati previsti da n, l. Numero quantico di spin ms Doppietto del sodio Descrizione semplificata in termini di rotazione dell’elettrone attorno al suo asse. L’energia dell’elettrone è leggermente differente nelle due direzioni di rotazione.

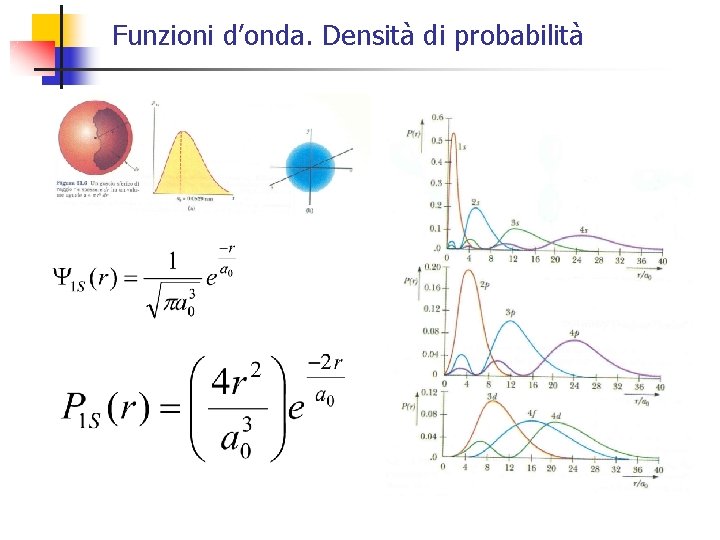
Funzioni d’onda. Densità di probabilità

Contributo degli altri numeri quantici n n Momento angolare L=mvr (classico) Bohr: quantizzato mvr=n h/2 p

Numero quantico magnetico La proiezione z del momento angolare orbiltale risulta quantizzata. A causa del principio di indeterminazione, L non punta in una direzione specifica, ma descrive un cono nello spazio. Principio di esclusione di Pauli. Non possono esistere due particelle identiche con gli stessi numeri quantici. Riempimento dei livelli energetici. Tavola periodica degli elementi di Mendeleev.

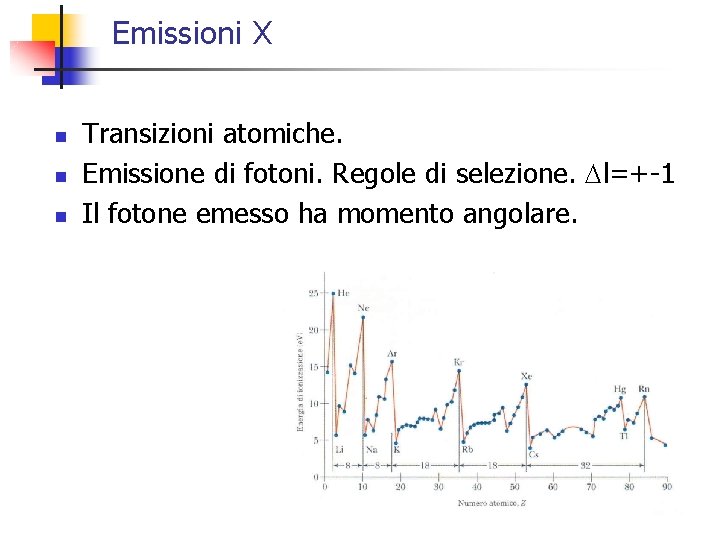
Emissioni X n n n Transizioni atomiche. Emissione di fotoni. Regole di selezione. Dl=+-1 Il fotone emesso ha momento angolare.

Fisica Nucleare n n n 1896 Bequerel. Radioattività naturale nell’uranio. 1932. Neutrone. Chadwick 1933. Radioattività artificiale. J. e I. Curie 1938. Fissione nucleare. Hahn e Strassman 1942. Primo reattore nucleare. Fermi.

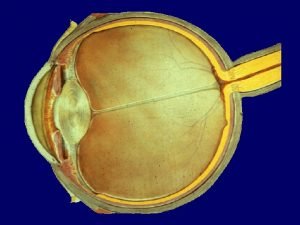
Proprietà del nucleo Numero atomico Z, numero di massa A. n Isotopi. Esempio C. Isotopi artificiali. n Carica del protone ed elettrone: 1, 6 10 -19 C Massa: protone mp=1. 67 10 -27 kg elettrone me=1/1836 mp Massa in unità di energia. Dimensioni dei nuclei. n

La struttura del nucleo atomico Particella Massa (g) Carica (C) Protone Neutrone Simbolo 1. 673· 10 -24 +1. 6028· 10 -19 p+ 1. 675· 10 -24 0 n Nucleoni Numero di massa A numero protoni + numero neutroni Numero atomico Z numero protoni Atomi con uguale numero atomico Z hanno uguali proprietà chimiche Atomi con uguale numero atomico Z sono classificati come atomi dello stesso elemento e identificati dallo stesso simbolo chimico (X) A Z X

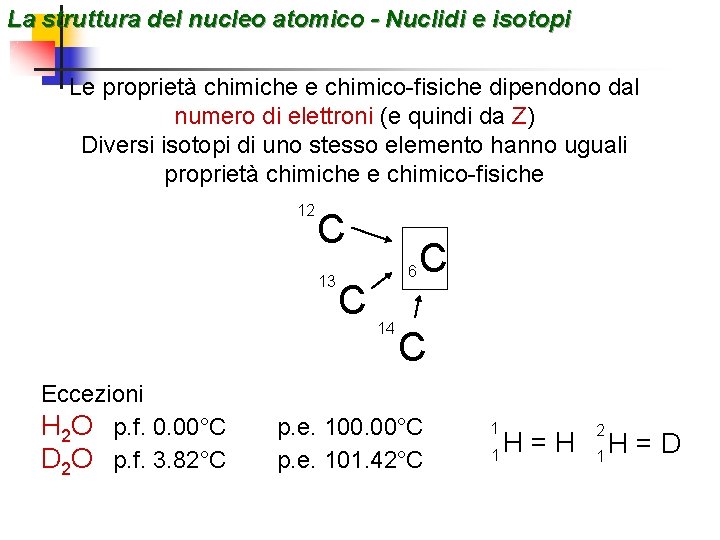
La struttura del nucleo atomico - Nuclidi e isotopi Nuclide specie atomica caratterizzata da una determinata composizione del nucleo (sono noti A e Z) 14 7 N 16 Z = 7 A-Z = 7 8 O Z = 8 A-Z = 8 Isotopi nuclidi di uno stesso elemento (con uguale numero atomico Z) con diverso numero di massa A (isos topos = stesso posto) Isobari nuclidi con diverso numero atomico Z ma con uguale numero di massa A (isos baros = stesso peso) 12 C 13 54 26 Fe C 54 24 6 14 C C Cr

La struttura del nucleo atomico - Nuclidi e isotopi Le proprietà chimiche e chimico-fisiche dipendono dal numero di elettroni (e quindi da Z) Diversi isotopi di uno stesso elemento hanno uguali proprietà chimiche e chimico-fisiche 12 C 13 Eccezioni H 2 O p. f. 0. 00°C D 2 O p. f. 3. 82°C C 6 14 C C p. e. 100. 00°C p. e. 101. 42°C 1 1 H=H 2 1 H=D

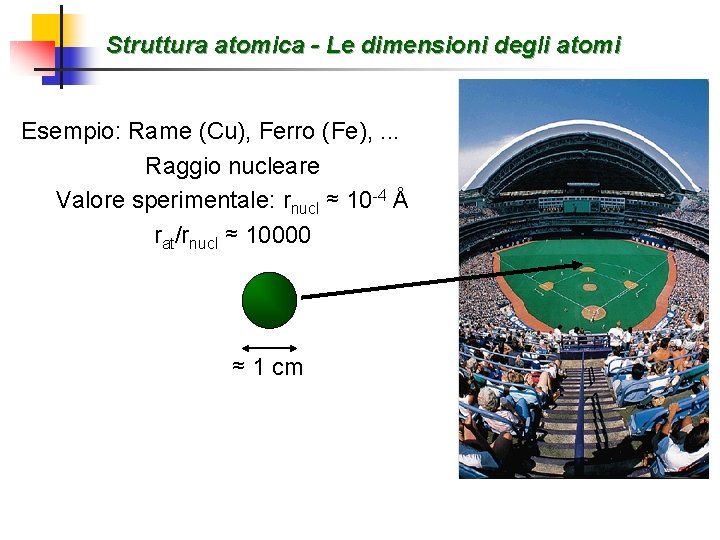
Struttura atomica - Le dimensioni degli atomi Esempio: Rame (Cu), Ferro (Fe), . . . Raggio nucleare Valore sperimentale: rnucl ≈ 10 -4 Å rat/rnucl ≈ 10000 ≈ 1 cm

n n Dimensione del nucleo dall’esperienza di Rutherford. Unità di misura su scala nucleare fm=10 -15 m r=r 0 A 1/3 I nuclei hanno la stessa densità Volume e densità del nucleo

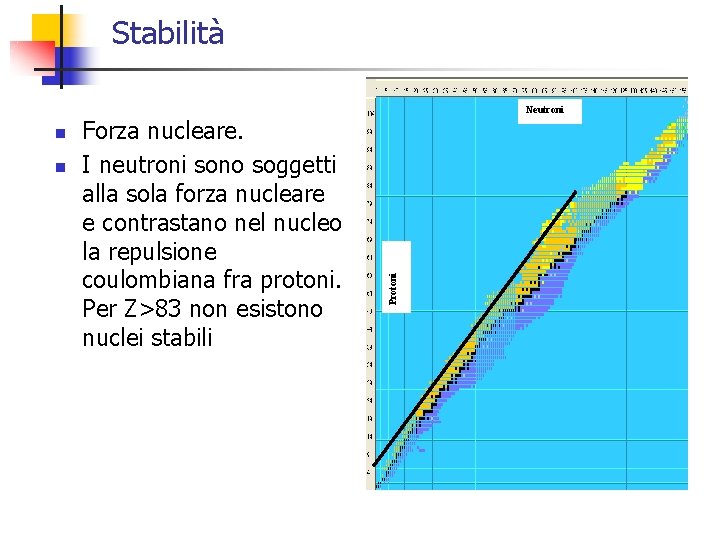
Stabilità n Forza nucleare. I neutroni sono soggetti alla sola forza nucleare e contrastano nel nucleo la repulsione coulombiana fra protoni. Per Z>83 non esistono nuclei stabili Protoni n Neutroni

Spin nucleare e momento magnetico n n n Momento angolare nucleare I: spin nucleare Magnetone nucleare. Analogo del magnetone di Bohr ma 2000 volte più piccolo.

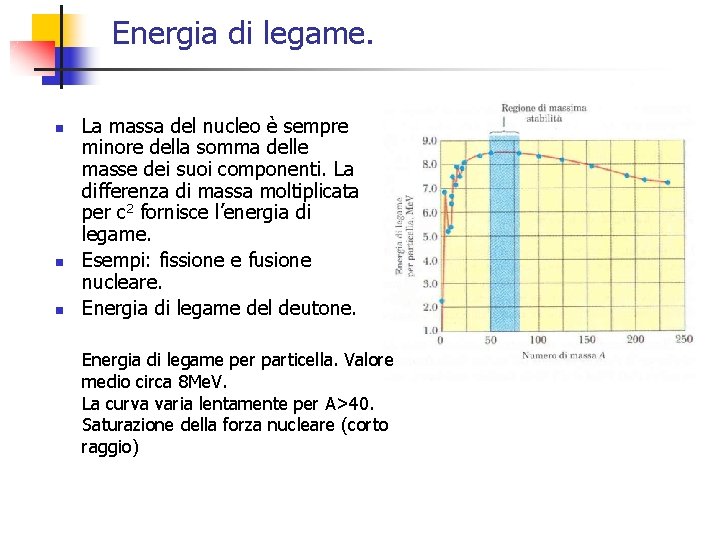
Energia di legame. n n n La massa del nucleo è sempre minore della somma delle masse dei suoi componenti. La differenza di massa moltiplicata per c 2 fornisce l’energia di legame. Esempi: fissione e fusione nucleare. Energia di legame del deutone. Energia di legame per particella. Valore medio circa 8 Me. V. La curva varia lentamente per A>40. Saturazione della forza nucleare (corto raggio)

Processi di decadimento n n n Decadimento alfa Decadimento beta Emissione gamma

Radioattività
 Fermi unità di misura
Fermi unità di misura Struttura fisica del magazzino
Struttura fisica del magazzino Interazione nucleare debole
Interazione nucleare debole Sequenza nls
Sequenza nls Detector de radiatii nucleare
Detector de radiatii nucleare Fusione nucleare
Fusione nucleare Interazione nucleare debole
Interazione nucleare debole Luranio
Luranio Isotopi
Isotopi Cataratta cortico nucleare
Cataratta cortico nucleare Fissione nucleare
Fissione nucleare Fusione nucleare schema
Fusione nucleare schema Interazione nucleare debole
Interazione nucleare debole Energia nucleare riassunto
Energia nucleare riassunto Esempio di testo espositivo
Esempio di testo espositivo Marcato pleomorfismo nucleare
Marcato pleomorfismo nucleare Funzionamento centrale nucleare
Funzionamento centrale nucleare La frase nucleare scuola primaria
La frase nucleare scuola primaria Fissione nucleare
Fissione nucleare Interazione nucleare debole
Interazione nucleare debole Forza
Forza Fusione nucleare
Fusione nucleare Medicina nucleare brescia
Medicina nucleare brescia Cosa fa il nucleo
Cosa fa il nucleo