Relaciones de masa en las reacciones qumicas Captulo














- Slides: 25

Relaciones de masa en las reacciones químicas Capítulo 3 Copyright © The Mc. Graw-Hill Companies, Inc. Permission required for reproduction or display.

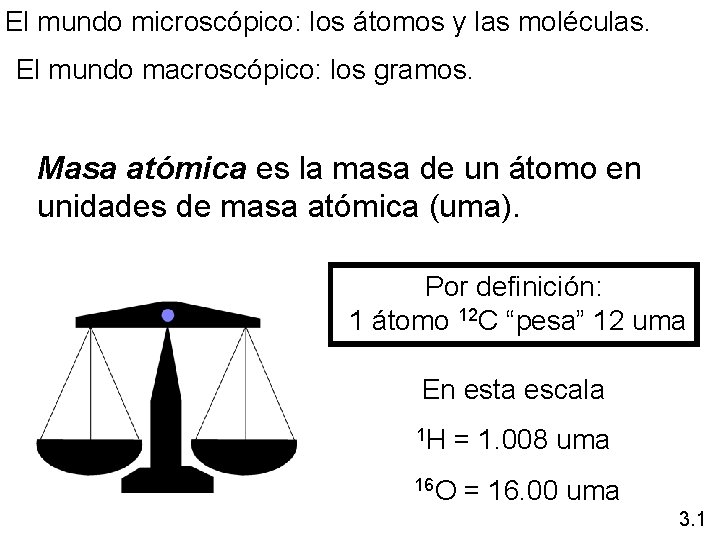
El mundo microscópico: los átomos y las moléculas. El mundo macroscópico: los gramos. Masa atómica es la masa de un átomo en unidades de masa atómica (uma). Por definición: 1 átomo 12 C “pesa” 12 uma En esta escala 1 H = 1. 008 uma 16 O = 16. 00 uma 3. 1

El litio natural es : 7. 42% 6 Li (6. 015 uma) 92. 58% 7 Li (7. 016 uma) Masa atómica promedio del litio: 7. 42 x 6. 015 + 92. 58 x 7. 016 = 6. 941 uma 100 3. 1

Número atómico Masa atómica promedio (6. 941) Metales Metaloides No metales

El mol es la cantidad de una sustancia que contiene tantas unidades elementales como átomos hay exactamente en 12. 00 gramos de 12 C 1 mol = NA = 6. 0221367 x 1023 Número de Avogadro (NA) 3. 2

huevos zapatos Masa molar es la masa de 1 mol de en gramos canicas átomos 1 mol 12 C átomos = 6. 022 x 1023 átomos = 12. 00 g 1 12 C átomo = 12. 00 uma 1 mol 12 C átomos = 12. 00 g 12 C 1 mol átomos de litio= 6. 941 g de Li Para cualquier elemento masa atómica (uma) = masa molar (gramos) 3. 2

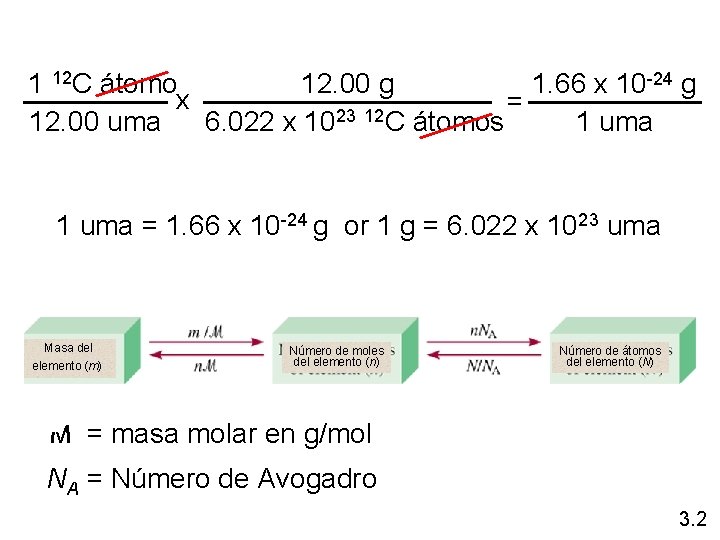
1 12 C átomo 12. 00 g 1. 66 x 10 -24 g x = 23 12 12. 00 uma 6. 022 x 10 C átomos 1 uma = 1. 66 x 10 -24 g or 1 g = 6. 022 x 1023 uma Masa del elemento (m) Número de moles del elemento (n) Número de átomos del elemento (N) M = masa molar en g/mol NA = Número de Avogadro 3. 2

¿Sabe qué es la masa molar? ¿Cuántos átomos están en 0. 551 g de potasio (K) ? 1 mol K = 39. 10 g K 1 mol K = 6. 022 x 1023 átomos K 1 mol K 6. 022 x 1023 átomos K 0. 551 g K x x = 1 mol K 39. 10 g K 8. 49 x 1021 átomos K 3. 2

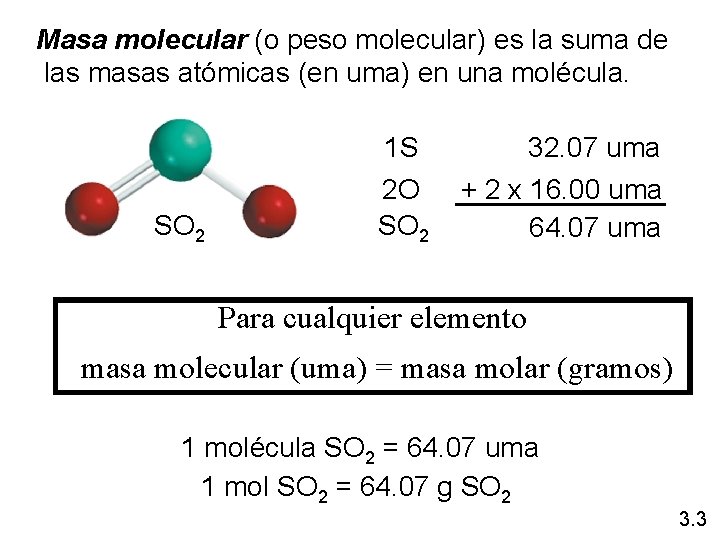
Masa molecular (o peso molecular) es la suma de las masas atómicas (en uma) en una molécula. 1 S SO 2 2 O SO 2 32. 07 uma + 2 x 16. 00 uma 64. 07 uma Para cualquier elemento masa molecular (uma) = masa molar (gramos) 1 molécula SO 2 = 64. 07 uma 1 mol SO 2 = 64. 07 g SO 2 3. 3

¿Sabe qué es la masa molecular? ¿Cuántos átomos H están en 72. 5 g de C 3 H 8 O? 1 mol C 3 H 8 O = (3 x 12) + (8 x 1) + 16 = 60 g C 3 H 8 O 1 mol C 3 H 8 O moléculas = 8 mol H átomos 1 mol H = 6. 022 x 1023 átomos H 1 mol C 3 H 8 O 8 mol H átomos 6. 022 x 1023 H átomos 72. 5 g C 3 H 8 O x x x = 1 mol C 3 H 8 O 1 mol H átomos 60 g C 3 H 8 O 5. 82 x 1024 átomos H 3. 3

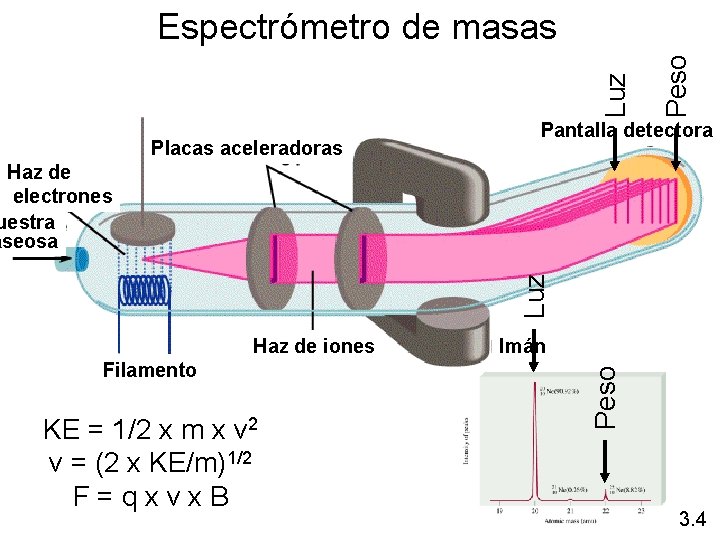
Placas aceleradoras Peso Luz Espectrómetro de masas Pantalla detectora Luz Haz de electrones uestra aseosa Filamento KE = 1/2 x m x v 2 v = (2 x KE/m)1/2 F = q x v x B Imán Peso Haz de iones 3. 4

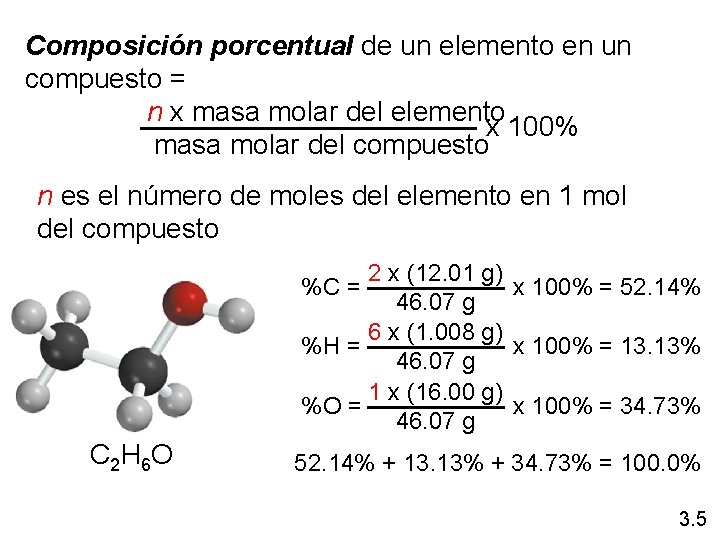
Composición porcentual de un elemento en un compuesto = n x masa molar del elemento x 100% masa molar del compuesto n es el número de moles del elemento en 1 mol del compuesto 2 x (12. 01 g) x 100% = 52. 14% 46. 07 g 6 x (1. 008 g) %H = x 100% = 13. 13% 46. 07 g 1 x (16. 00 g) %O = x 100% = 34. 73% 46. 07 g %C = C 2 H 6 O 52. 14% + 13. 13% + 34. 73% = 100. 0% 3. 5

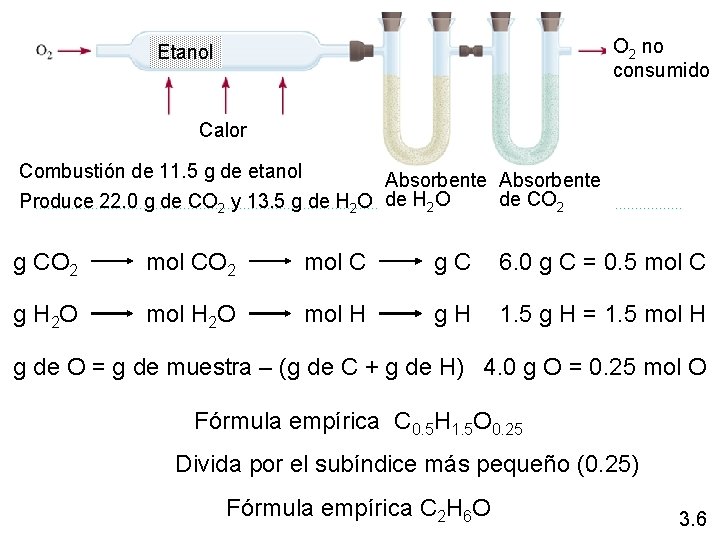
O 2 no consumido Etanol Calor Combustión de 11. 5 g de etanol Absorbente de CO 2 Produce 22. 0 g de CO 2 y 13. 5 g de H 2 O g CO 2 mol C g C 6. 0 g C = 0. 5 mol C g H 2 O mol H g H 1. 5 g H = 1. 5 mol H g de O = g de muestra – (g de C + g de H) 4. 0 g O = 0. 25 mol O Fórmula empírica C 0. 5 H 1. 5 O 0. 25 Divida por el subíndice más pequeño (0. 25) Fórmula empírica C 2 H 6 O 3. 6

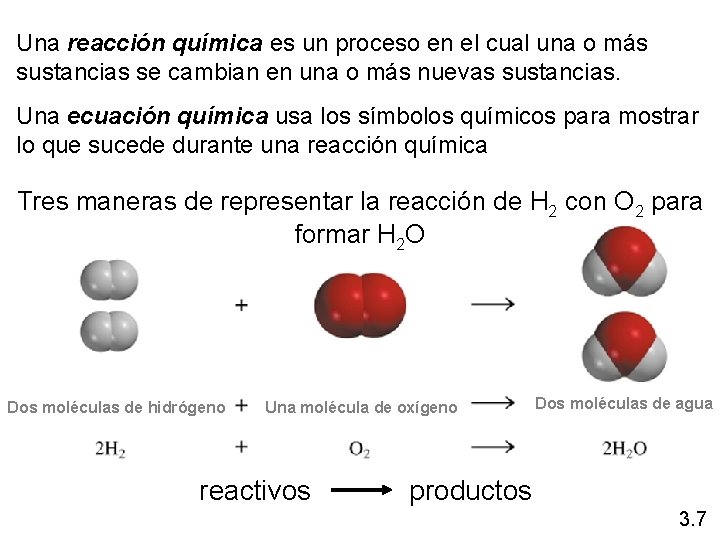
Una reacción química es un proceso en el cual una o más sustancias se cambian en una o más nuevas sustancias. Una ecuación química usa los símbolos químicos para mostrar lo que sucede durante una reacción química Tres maneras de representar la reacción de H 2 con O 2 para formar H 2 O Dos moléculas de hidrógeno Una molécula de oxígeno reactivos Dos moléculas de agua productos 3. 7

Cómo “leer” las ecuaciones químicas 2 Mg + O 2 2 Mg. O 2 átomos Mg + 1 molécula O 2 produce 2 unidades de la fórmula Mg. O 2 moles Mg + 1 mole O 2 produce 2 moles de Mg. O 48. 6 gramos Mg + 32. 0 gramos O 2 produce 80. 6 g de Mg. O NO ES 2 gramos de Mg + 1 gramo de O 2 produce 2 g de Mg. O 3. 7

Balance de ecuaciones químicas 1. Escriba la fórmula(s) correcta para los reactivos en el lado izquierdo y la fórmula(s) correcta para el producto(s) en el lado derecho de la ecuación. El etano reacciona con el oxígeno para formar dióxido de carbono y agua C 2 H 6 + O 2 CO 2 + H 2 O 2. Cambie los números delante de las fórmulas (los coeficientes) para hacer el número de átomos de cada elemento el mismo en ambos lados de la ecuación. No cambie los subíndices. 2 C 2 H 6 NO C 4 H 12 3. 7

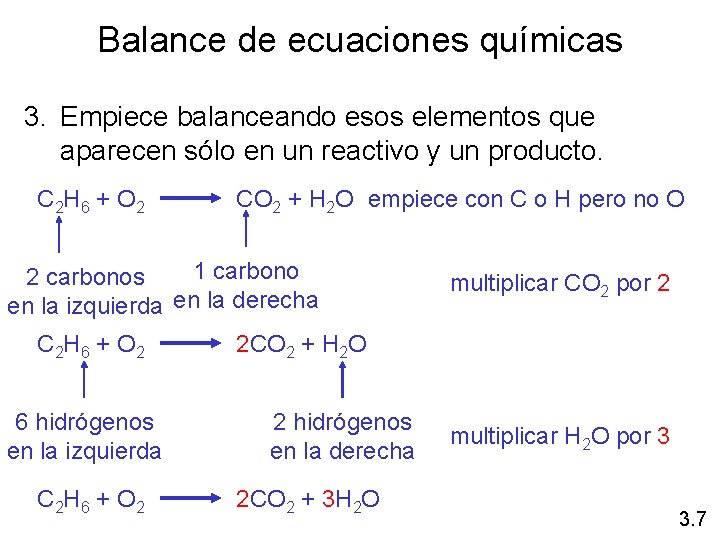
Balance de ecuaciones químicas 3. Empiece balanceando esos elementos que aparecen sólo en un reactivo y un producto. C 2 H 6 + O 2 CO 2 + H 2 O empiece con C o H pero no O 1 carbono 2 carbonos en la izquierda en la derecha C 2 H 6 + O 2 6 hidrógenos en la izquierda C 2 H 6 + O 2 multiplicar CO 2 por 2 2 CO 2 + H 2 O 2 hidrógenos en la derecha 2 CO 2 + 3 H 2 O multiplicar H 2 O por 3 3. 7

Balance de ecuaciones químicas 4. Balancee esos elementos que aparecen en dos o más reactivos o productos. C 2 H 6 + O 2 2 CO 2 + 3 H 2 O multiplicar O 2 por 7 2 2 oxígenos 4 oxígenos+ 3 oxígenos = 7 oxígenos (3 x 1) en la izquierda (2 x 2) en la derecha 7 C 2 H 6 + O 2 2 2 CO 2 + 3 H 2 O 2 C 2 H 6 + 7 O 2 4 CO 2 + 6 H 2 O quite la fracción multiplique ambos lados por 2 3. 7

Balance de ecuaciones químicas 5. Verifique para asegurarse de que tiene el mismo número de cada tipo de átomo en ambos lados de la ecuación. 2 C 2 H 6 + 7 O 2 4 C (2 x 2) 12 H (2 x 6) 14 O (7 x 2) 4 CO 2 + 6 H 2 O 4 C 12 H (6 x 2) 14 O (4 x 2 + 6) Reactivos 4 C 12 H 14 O Productos 4 C 12 H 14 O 3. 7

Cambios de masa en las reacciones químicas Masa de reactivo Moles de producto Moles de reactivo Moles de producto Masa de producto 1. Escriba la ecuación química balanceada. 2. Convierta cantidades de sustancias conocidas en moles. 3. Use los coeficientes en la ecuación balanceada para calcular el número de moles de la cantidad buscada. 4. Convierta los moles de la cantidad buscada en las unidades deseadas. 3. 8

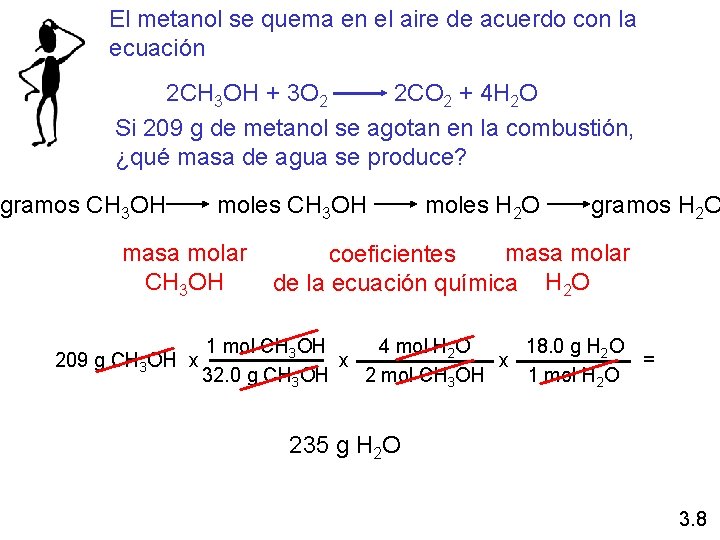
El metanol se quema en el aire de acuerdo con la ecuación 2 CH 3 OH + 3 O 2 2 CO 2 + 4 H 2 O Si 209 g de metanol se agotan en la combustión, ¿qué masa de agua se produce? gramos CH 3 OH moles CH 3 OH masa molar CH 3 OH 209 g CH 3 OH x moles H 2 O gramos H 2 O masa molar coeficientes de la ecuación química H 2 O 4 mol H 2 O 18. 0 g H 2 O 1 mol CH 3 OH = x x 32. 0 g CH 3 OH 1 mol H 2 O 2 mol CH 3 OH 235 g H 2 O 3. 8

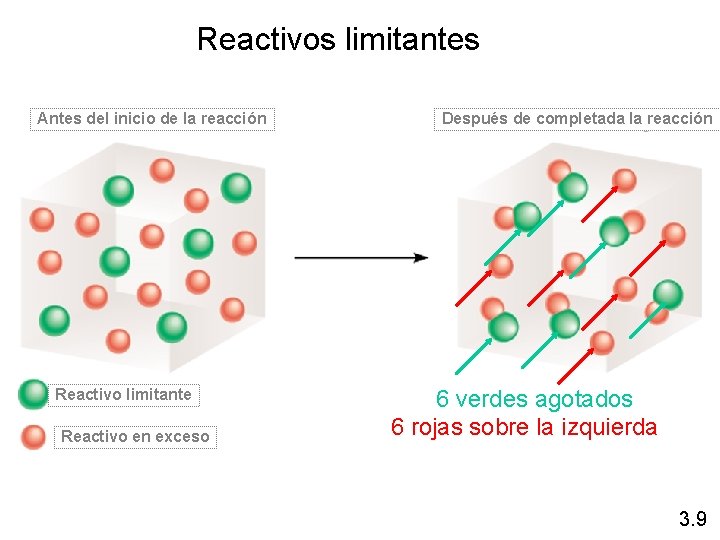
Reactivos limitantes Antes del inicio de la reacción Reactivo limitante Reactivo en exceso Después de completada la reacción 6 verdes agotados 6 rojas sobre la izquierda 3. 9

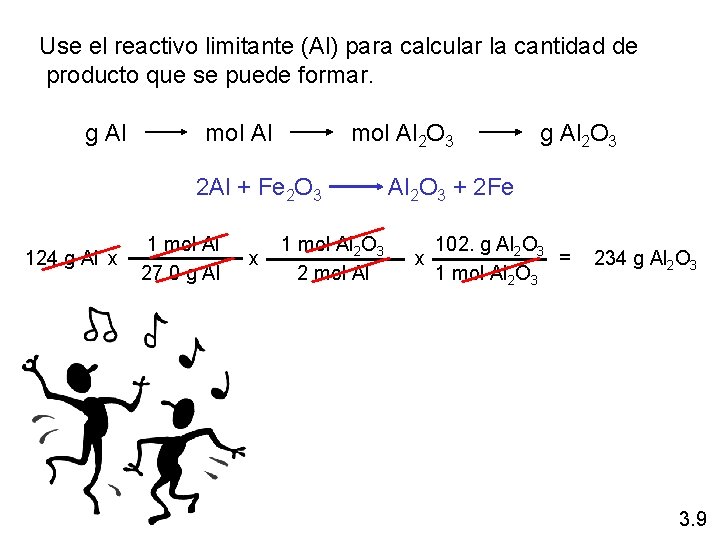
¿Sabe qué son los reactivos limitantes? En un proceso, 124 g de Al reaccionan con 601 g de Fe 2 O 3 2 Al + Fe 2 O 3 Al 2 O 3 + 2 Fe Calcular la masa de Al 2 O 3 formada. g Al mol Fe 2 O 3 necesitado O g Fe 2 O 3 mol Al necesitado 124 g Al x 1 mol Al 27. 0 g Al x 1 mol Fe 2 O 3 2 mol Al g Fe 2 O 3 necesitado 160. g Fe 2 O 3 = x 1 mol Fe 2 O 3 g Al necesitado 367 g Fe 2 O 3 Empiece con necesita 367 g Fe 2 O 3 124 g Al Tiene más Fe 2 O 3 (601 g) así el Al es reactivo limitante 3. 9

Use el reactivo limitante (Al) para calcular la cantidad de producto que se puede formar. g Al mol Al 2 O 3 g Al 2 O 3 2 Al + Fe 2 O 3 Al 2 O 3 + 2 Fe 124 g Al x 1 mol Al 27. 0 g Al x 1 mol Al 2 O 3 2 mol Al 102. g Al 2 O 3 = x 1 mol Al 2 O 3 234 g Al 2 O 3 3. 9

El rendimiento teórico es la cantidad de producto que resultaría si todo el reactivo limitante reaccionara. El rendimiento real es la cantidad de producto realmente obtenida de una reacción. % Rendimiento = Rendimiento real Rendimiento teórico x 100 3. 10
 Qumicas
Qumicas Https://slidetodoc.com/captulo-2-o-sudeste-e-o-sul-do/
Https://slidetodoc.com/captulo-2-o-sudeste-e-o-sul-do/ Https://slidetodoc.com/captulo-2-o-sudeste-e-o-sul-do/
Https://slidetodoc.com/captulo-2-o-sudeste-e-o-sul-do/ Leyes de reacciones quimicas
Leyes de reacciones quimicas Que son reacciones irreversibles
Que son reacciones irreversibles La debilidad de las reacciones
La debilidad de las reacciones Desforilacion
Desforilacion Reduccion oxidación
Reduccion oxidación Exergónico
Exergónico Reacciones catabolicas
Reacciones catabolicas Perkembangan mobil dari masa ke masa
Perkembangan mobil dari masa ke masa Ejercicios de m/m
Ejercicios de m/m Tantangan pendidikan di masa depan
Tantangan pendidikan di masa depan Ejercicios de concentracion de soluciones m/m m/v v/v
Ejercicios de concentracion de soluciones m/m m/v v/v Perkembangan desain dari masa ke masa
Perkembangan desain dari masa ke masa Perkembangan hardware
Perkembangan hardware Relativna atomska i molekulska masa zadaci
Relativna atomska i molekulska masa zadaci Masa de 1 mol
Masa de 1 mol Relación interpersonal
Relación interpersonal Concepto de relaciones interpersonales
Concepto de relaciones interpersonales Relaciones intrespecificas
Relaciones intrespecificas Modelo de iceberg en las relaciones humanas
Modelo de iceberg en las relaciones humanas Caracteristicas de las relaciones publicas
Caracteristicas de las relaciones publicas Relaciones gramaticales ejemplos
Relaciones gramaticales ejemplos Funciones de las relaciones humanas
Funciones de las relaciones humanas Que es una relación intertextual
Que es una relación intertextual















































