CAPITOLO I legami chimici 7 Indice 1 Legami









- Slides: 16

CAPITOLO I legami chimici 7 Indice 1. Legami chimici e simboli di Lewis 2. Il legame covalente 3. I legami multipli 4. Il legame covalente polare 5. L’elettronegatività 6. Il legame covalente dativo 7. Il legame ionico e i composti ionici 8. Gli ioni poliatomici 9. Geometria delle molecole: la teoria VSEPR 10. Le forze intermolecolari © Paolo Pistarà © Istituto Italiano Edizioni Atlas 1

1 Legami chimici e simboli di Lewis CAPITOLO 7. I LEGAMI CHIMICI Le forze che tengono uniti gli atomi in una molecola sono dette legami chimici. Sono gli elettroni del livello più esterno di un atomo che partecipano al legame (elettroni di valenza). © Paolo Pistarà © Istituto Italiano Edizioni Atlas 2

1 Legami chimici e simboli di Lewis CAPITOLO 7. I LEGAMI CHIMICI Con il nome di simboli di Lewis s’intende il simbolo dell’elemento circondato in modo simmetrico dagli elettroni di valenza. Il numero di elettroni di valenza di un atomo è uguale al numero del gruppo a cui l’elemento appartiene. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 3

CAPITOLO 7. I LEGAMI CHIMICI 2 Il legame covalente Un legame covalente consiste di una coppia di elettroni messi in comune tra due atomi. H + H H H In modo più pratico la coppia di elettroni di legame è rappresentata da un trattino che unisce i due atomi: H−H In presenza del legame covalente esistono forze di attrazione e di repulsione che si bilanciano. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 4

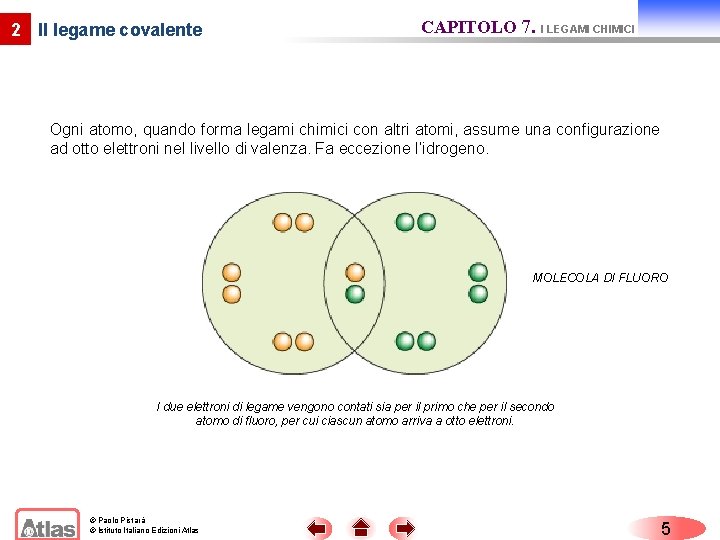
2 Il legame covalente CAPITOLO 7. I LEGAMI CHIMICI Ogni atomo, quando forma legami chimici con altri atomi, assume una configurazione ad otto elettroni nel livello di valenza. Fa eccezione l’idrogeno. MOLECOLA DI FLUORO I due elettroni di legame vengono contati sia per il primo che per il secondo atomo di fluoro, per cui ciascun atomo arriva a otto elettroni. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 5

CAPITOLO 7. I LEGAMI CHIMICI 3 I legami multipli La molecola dell’etilene (o etene), C 2 H 4, presenta un doppio legame carbonio-carbonio, come è mostrato dalla seguente struttura di Lewis: Nella molecola N 2 si ha un triplo legame tra due atomi. N + N N N N Ξ N Nella molecola N 2 ciascun atomo mette in comune tre elettroni. Ogni atomo raggiunge la configurazione ad ottetto. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 6

CAPITOLO 7. I LEGAMI CHIMICI 4 Il legame covalente polare Un legame covalente è detto covalente polare quando il doppietto elettronico non è equamente condiviso: un elemento presenta una maggiore forza di attrazione per gli elettroni e l’altro elemento una minore forza. Nella molecola δ+ δ− H − Cl il cloro assume una lieve carica negativa ( ) mentre l’idrogeno una lieve carica positiva ( +). Il legame in H Cl è “covalente polare”. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 7

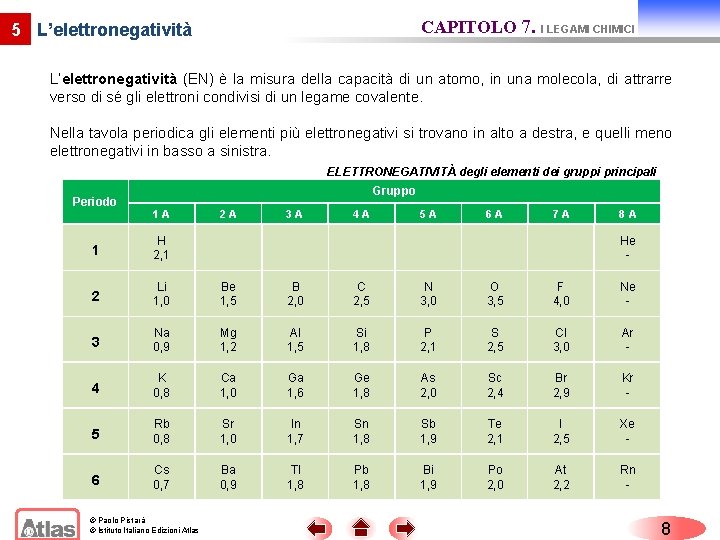
CAPITOLO 7. I LEGAMI CHIMICI 5 L’elettronegatività (EN) è la misura della capacità di un atomo, in una molecola, di attrarre verso di sé gli elettroni condivisi di un legame covalente. Nella tavola periodica gli elementi più elettronegativi si trovano in alto a destra, e quelli meno elettronegativi in basso a sinistra. ELETTRONEGATIVITÀ degli elementi dei gruppi principali Periodo Gruppo 1 A 2 A 3 A 4 A 5 A 6 A 7 A 8 A 1 H 2, 1 2 Li 1, 0 Be 1, 5 B 2, 0 C 2, 5 N 3, 0 O 3, 5 F 4, 0 Ne - 3 Na 0, 9 Mg 1, 2 Al 1, 5 Si 1, 8 P 2, 1 S 2, 5 Cl 3, 0 Ar - 4 K 0, 8 Ca 1, 0 Ga 1, 6 Ge 1, 8 As 2, 0 Sc 2, 4 Br 2, 9 Kr - 5 Rb 0, 8 Sr 1, 0 In 1, 7 Sn 1, 8 Sb 1, 9 Te 2, 1 I 2, 5 Xe - 6 Cs 0, 7 Ba 0, 9 Tl 1, 8 Pb 1, 8 Bi 1, 9 Po 2, 0 At 2, 2 Rn - © Paolo Pistarà © Istituto Italiano Edizioni Atlas He - 8

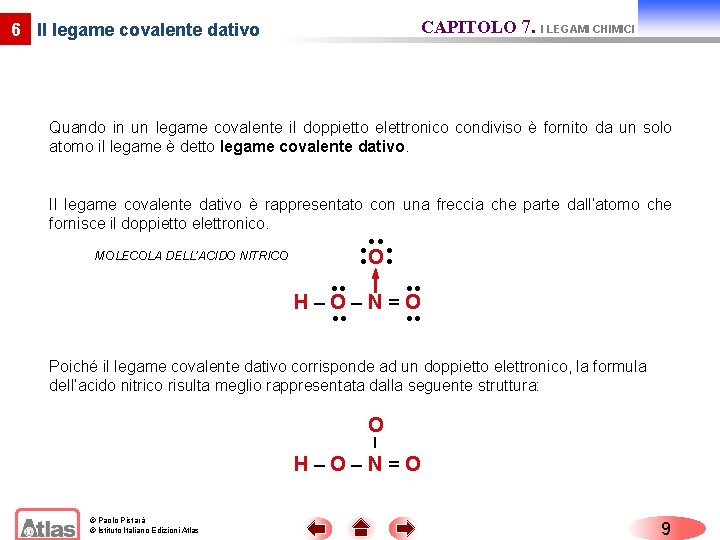
CAPITOLO 7. I LEGAMI CHIMICI 6 Il legame covalente dativo Quando in un legame covalente il doppietto elettronico condiviso è fornito da un solo atomo il legame è detto legame covalente dativo. Il legame covalente dativo è rappresentato con una freccia che parte dall’atomo che fornisce il doppietto elettronico. O MOLECOLA DELL’ACIDO NITRICO H–O–N=O Poiché il legame covalente dativo corrisponde ad un doppietto elettronico, la formula dell’acido nitrico risulta meglio rappresentata dalla seguente struttura: O – H–O–N=O © Paolo Pistarà © Istituto Italiano Edizioni Atlas 9

7 CAPITOLO 7. I LEGAMI CHIMICI Il legame ionico e i composti ionici Si definisce legame ionico l’attrazione tra ioni aventi carica opposta. Adottando la simbologia di Lewis, nella reazione tra un atomo di sodio e un atomo di cloro si verifica il trasferimento di un elettrone dal sodio al cloro. Na + Cl Na+ [ Na + Cl ] Cl− Tra cariche di segno opposto si crea un’attrazione elettrostatica, per cui gli ioni Na+ e Cl si attraggono. Le coppie ioniche Na+Cl costituiscono il cloruro di sodio, un solido cristallino tridimensionale. Cl− Na+ © Paolo Pistarà © Istituto Italiano Edizioni Atlas 10

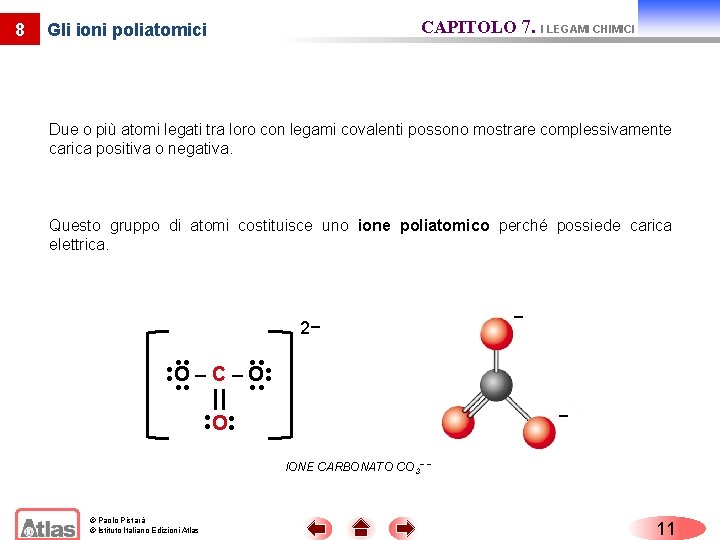
CAPITOLO 7. I LEGAMI CHIMICI Gli ioni poliatomici Due o più atomi legati tra loro con legami covalenti possono mostrare complessivamente carica positiva o negativa. Questo gruppo di atomi costituisce uno ione poliatomico perché possiede carica elettrica. 2− − O–C–O − O 8 IONE CARBONATO CO 3− − © Paolo Pistarà © Istituto Italiano Edizioni Atlas 11

9 Geometria delle molecole: la teoria VSEPR CAPITOLO 7. I LEGAMI CHIMICI La teoria VSEPR si basa sull’idea che: nella struttura di una molecola, gli elettroni di legame e le coppie di elettroni liberi si dispongono, per repulsione, attorno all’atomo centrale alla massima distanza possibile tra loro. La molecola del metano risulta tridimensionale, e i legami si trovano alla massima distanza quando formano angoli 109, 5°, cioè sono disposti secondo un tetraedro. tetraedrica (angolo di 109, 5°) Modello della molecola del metano. © Paolo Pistarà © Istituto Italiano Edizioni Atlas Geometria tetraedrica del metano. 12

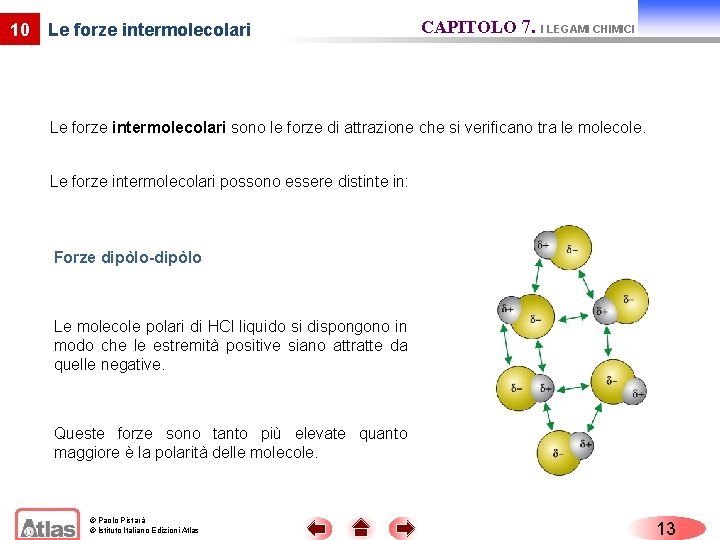
10 Le forze intermolecolari CAPITOLO 7. I LEGAMI CHIMICI Le forze intermolecolari sono le forze di attrazione che si verificano tra le molecole. Le forze intermolecolari possono essere distinte in: Forze dipòlo-dipòlo Le molecole polari di HCl liquido si dispongono in modo che le estremità positive siano attratte da quelle negative. Queste forze sono tanto più elevate quanto maggiore è la polarità delle molecole. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 13

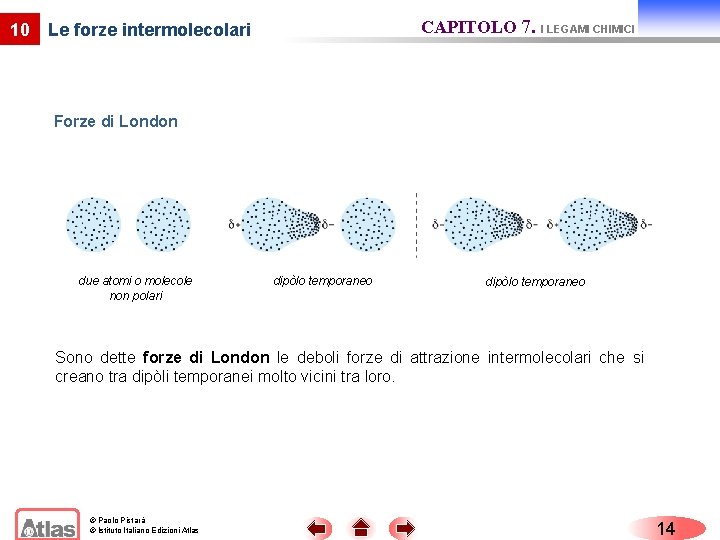
10 CAPITOLO 7. I LEGAMI CHIMICI Le forze intermolecolari Forze di London due atomi o molecole non polari dipòlo temporaneo Sono dette forze di London le deboli forze di attrazione intermolecolari che si creano tra dipòli temporanei molto vicini tra loro. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 14

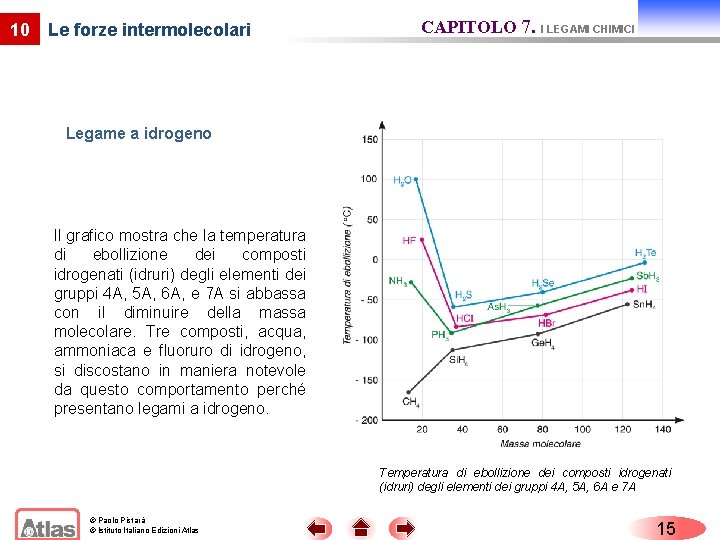
10 Le forze intermolecolari CAPITOLO 7. I LEGAMI CHIMICI Legame a idrogeno Il grafico mostra che la temperatura di ebollizione dei composti idrogenati (idruri) degli elementi dei gruppi 4 A, 5 A, 6 A, e 7 A si abbassa con il diminuire della massa molecolare. Tre composti, acqua, ammoniaca e fluoruro di idrogeno, si discostano in maniera notevole da questo comportamento perché presentano legami a idrogeno. Temperatura di ebollizione dei composti idrogenati (idruri) degli elementi dei gruppi 4 A, 5 A, 6 A e 7 A © Paolo Pistarà © Istituto Italiano Edizioni Atlas 15

10 Le forze intermolecolari CAPITOLO 7. I LEGAMI CHIMICI Il legame a idrogeno è l’attrazione tra un atomo di idrogeno, con una parziale carica negativa, e una coppia di elettroni di atomi piccoli e di elevata elettronegatività (F, O, N). δ+ δ− H – O H Il legame a idrogeno nell’acqua. L’idrogeno agisce da “ponte” tra due atomi di ossigeno; il legame a idrogeno è rappresentato con un tratteggio, quello covalente con una linea continua. Il legame a idrogeno risulta importante in campo biologico perché gioca un ruolo fondamentale nel determinare la struttura delle proteine. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 16
 Soluzioni chimica capitolo 13
Soluzioni chimica capitolo 13 Legami dipolo dipolo
Legami dipolo dipolo Basi azotate numerazione
Basi azotate numerazione Tiziana bellini
Tiziana bellini Mappa concettuale legami chimici
Mappa concettuale legami chimici Gas nobili
Gas nobili Legami primari
Legami primari Mappa concettuale nomenclatura
Mappa concettuale nomenclatura Legame dativo esempio
Legame dativo esempio Definizione di agente chimico
Definizione di agente chimico Mappa nomenclatura chimica
Mappa nomenclatura chimica Pericoli fisici
Pericoli fisici Mediatori chimici
Mediatori chimici Messaggeri chimici
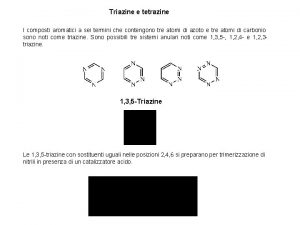
Messaggeri chimici Trimerizzazione
Trimerizzazione Ossiacidi
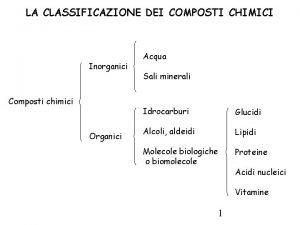
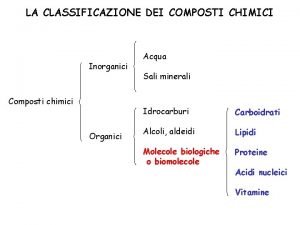
Ossiacidi Classificazione dei composti chimici inorganici
Classificazione dei composti chimici inorganici