Capitolo 6 Dai legami chimici alla forma delle
























- Slides: 38

Capitolo 6 Dai legami chimici alla forma delle molecole Copyright © 2012 Zanichelli editore 6. 1 La simbologia di Lewis permette di ricostruire le formule di struttura 6. 2 La risonanza: quando le strutture di Lewis falliscono 6. 3 Nel legame covalente di coordinazione la coppia di elettroni di legame proviene dallo stesso atomo 6. 4 La forma delle molecole deriva da cinque strutture di base 6. 5 La teoria VSEPR consente di prevedere la forma delle molecole 6. 6 Le molecole polari sono asimmetriche Small differences in the shapes of objects can make a large difference in the way they function. A key operates a lock because of the way their shapes fit together, and a small change in the shape of the key will cause it to no longer open the lock. In a similar way, living things recognize molecules by the way one fits onto another.

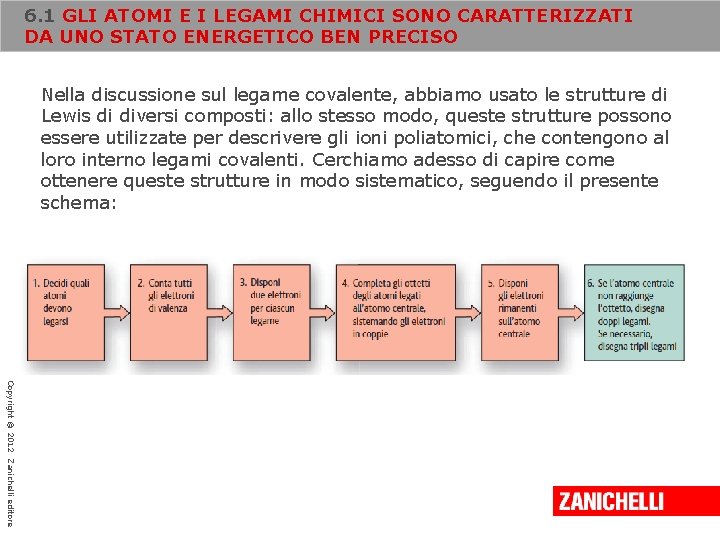
6. 1 GLI ATOMI E I LEGAMI CHIMICI SONO CARATTERIZZATI DA UNO STATO ENERGETICO BEN PRECISO Nella discussione sul legame covalente, abbiamo usato le strutture di Lewis di diversi composti: allo stesso modo, queste strutture possono essere utilizzate per descrivere gli ioni poliatomici, che contengono al loro interno legami covalenti. Cerchiamo adesso di capire come ottenere queste strutture in modo sistematico, seguendo il presente schema: Copyright © 2012 Zanichelli editore

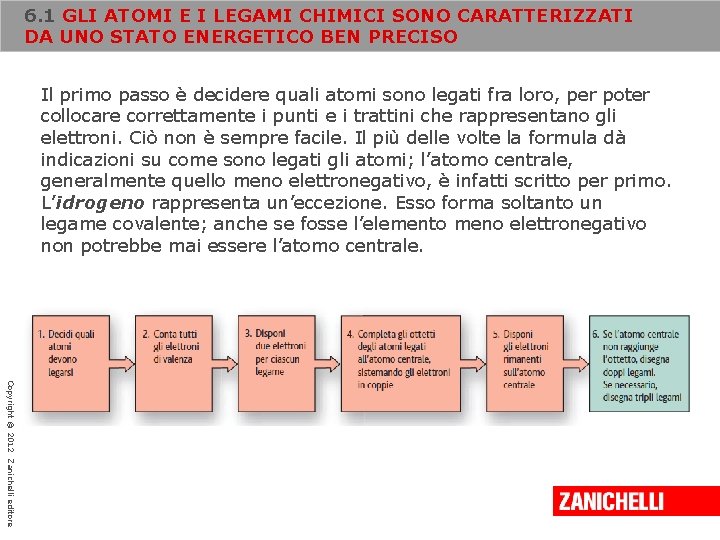
6. 1 GLI ATOMI E I LEGAMI CHIMICI SONO CARATTERIZZATI DA UNO STATO ENERGETICO BEN PRECISO Il primo passo è decidere quali atomi sono legati fra loro, per poter collocare correttamente i punti e i trattini che rappresentano gli elettroni. Ciò non è sempre facile. Il più delle volte la formula dà indicazioni su come sono legati gli atomi; l’atomo centrale, generalmente quello meno elettronegativo, è infatti scritto per primo. L’idrogeno rappresenta un’eccezione. Esso forma soltanto un legame covalente; anche se fosse l’elemento meno elettronegativo non potrebbe mai essere l’atomo centrale. Copyright © 2012 Zanichelli editore

6. 1 GLI ATOMI E I LEGAMI CHIMICI SONO CARATTERIZZATI DA UNO STATO ENERGETICO BEN PRECISO A volte, però, la disposizione di base non è così semplice, soprattutto quando sono presenti più di due elementi. È tuttavia possibile indicare delle regole generali. Per esempio, perché la disposizione strutturale degli atomi dell’acido nitrico, HNO 3, è: Copyright © 2012 Zanichelli editore

6. 1 GLI ATOMI E I LEGAMI CHIMICI SONO CARATTERIZZATI DA UNO STATO ENERGETICO BEN PRECISO Copyright © 2012 Zanichelli editore L’acido nitrico è un ossiacido, un composto in cui gli atomi di idrogeno sono sempre legati agli atomi di ossigeno, a loro volta legati al nonmetallo. Quindi, una volta riconosciuto che HNO 3 è la formula di un ossiacido, sappiamo che i tre atomi di ossigeno sono legati all’azoto e che l’idrogeno è legato a uno dei tre atomi di ossigeno. Se dobbiamo fare un tentativo, è preferibile scegliere la disposizione più simmetrica che è quella che ha le maggiori probabilità di essere corretta. Una volta decisa la disposizione degli atomi, il passo successivo è contare tutti gli elettroni di valenza per trovare il numero di punti che deve apparire nella formula finale. A tale scopo, con l’ausilio della tavola periodica, dobbiamo cercare i gruppi a cui appartengono gli elementi della formula e quindi determinare il numero di elettroni di valenza forniti da ciascun atomo. Se la struttura che dobbiamo rappresentare è quella di uno ione, si deve aggiungere o sottrarre un elettrone di valenza, rispettivamente, per ciascuna carica negativa o positiva.

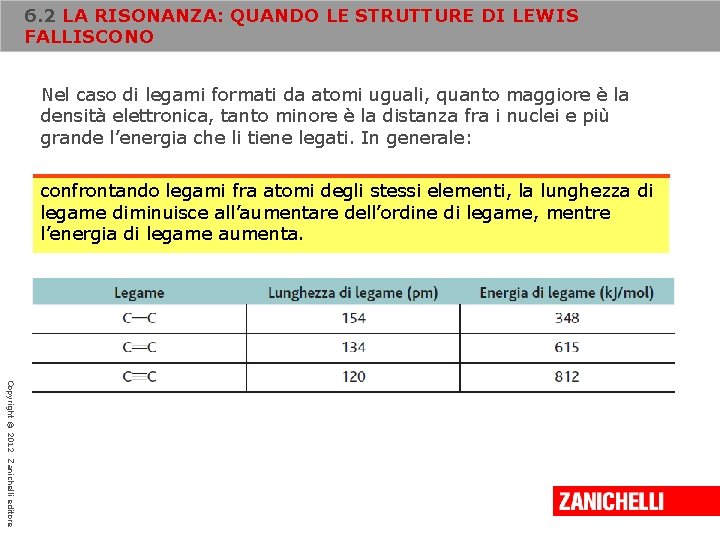
6. 2 LA RISONANZA: QUANDO LE STRUTTURE DI LEWIS FALLISCONO La lunghezza di legame, intesa come distanza fra i nuclei di due atomi legati, e l’energia di legame, definita come energia richiesta per separare due atomi legati, dipendono dal numero di coppie di elettroni condivise L’ordine di legame, definito come numero di coppie di elettroni condivise fra due atomi è una misura della quantità di densità elettronica presente tra due atomi. Copyright © 2012 Zanichelli editore

6. 2 LA RISONANZA: QUANDO LE STRUTTURE DI LEWIS FALLISCONO Nel caso di legami formati da atomi uguali, quanto maggiore è la densità elettronica, tanto minore è la distanza fra i nuclei e più grande l’energia che li tiene legati. In generale: confrontando legami fra atomi degli stessi elementi, la lunghezza di legame diminuisce all’aumentare dell’ordine di legame, mentre l’energia di legame aumenta. Copyright © 2012 Zanichelli editore

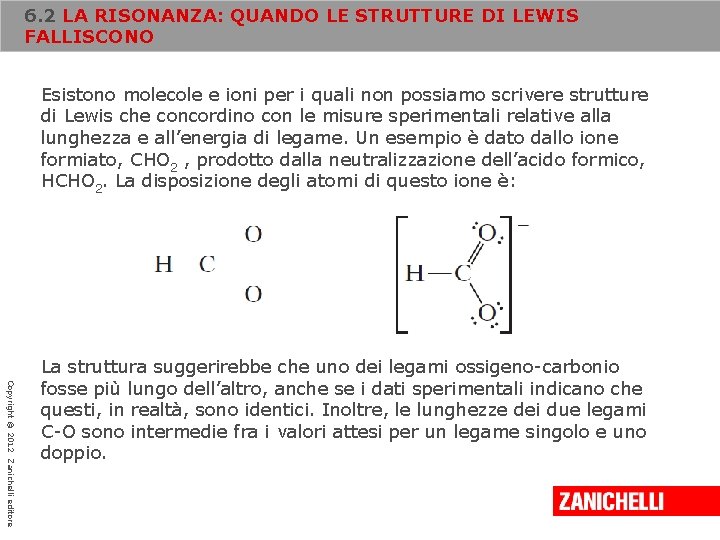
6. 2 LA RISONANZA: QUANDO LE STRUTTURE DI LEWIS FALLISCONO Esistono molecole e ioni per i quali non possiamo scrivere strutture di Lewis che concordino con le misure sperimentali relative alla lunghezza e all’energia di legame. Un esempio è dato dallo ione formiato, CHO 2 , prodotto dalla neutralizzazione dell’acido formico, HCHO 2. La disposizione degli atomi di questo ione è: Copyright © 2012 Zanichelli editore La struttura suggerirebbe che uno dei legami ossigeno-carbonio fosse più lungo dell’altro, anche se i dati sperimentali indicano che questi, in realtà, sono identici. Inoltre, le lunghezze dei due legami C-O sono intermedie fra i valori attesi per un legame singolo e uno doppio.

6. 2 LA RISONANZA: QUANDO LE STRUTTURE DI LEWIS FALLISCONO La struttura di Lewis non corrisponde quindi ai dati sperimentali e non vi è modo di scrivere alcuna struttura che mostri tutti gli elettroni sotto forma di coppie e, allo stesso tempo, 1, 5 coppie di elettroni per ciascun legame C-O. Per aggirare questo problema possiamo fare riferimento al concetto di risonanza. Lareale struttura della molecola o dello ione, che non può essere adeguatamente rappresentatada una sola formula, è data dall’insieme, o dalla media, delle strutture di Lewis possibili. Per esempio, per lo ione formiato possiamo scrivere: Copyright © 2012 Zanichelli editore

6. 2 LA RISONANZA: QUANDO LE STRUTTURE DI LEWIS FALLISCONO Queste due strutture di Lewis sono chiamate strutture di risonanza o strutture limite, mentre la struttura reale dello ione è definita un ibrido di risonanza, derivato dalle due strutture precedenti. La freccia a due punte segnala che le strutture sono risonanti e che alla vera struttura ibrida contribuiscono entrambe. Se ci troviamo costretti a spostare gli elettroni per creare uno o più doppi legami seguendo la procedura illustrata nel paragrafo precedente, il numero delle strutture di risonanza è pari al numero delle possibili scelte alternative per la disposizione dei doppi legami. Copyright © 2012 Zanichelli editore

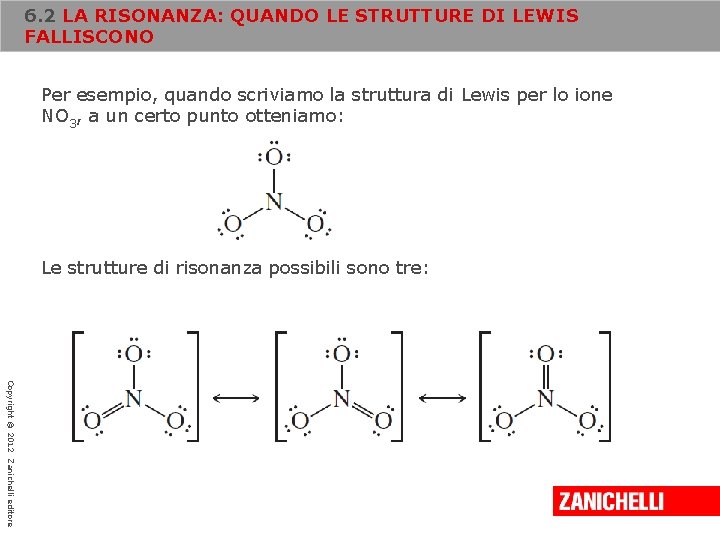
6. 2 LA RISONANZA: QUANDO LE STRUTTURE DI LEWIS FALLISCONO Per esempio, quando scriviamo la struttura di Lewis per lo ione NO 3, a un certo punto otteniamo: Le strutture di risonanza possibili sono tre: Copyright © 2012 Zanichelli editore

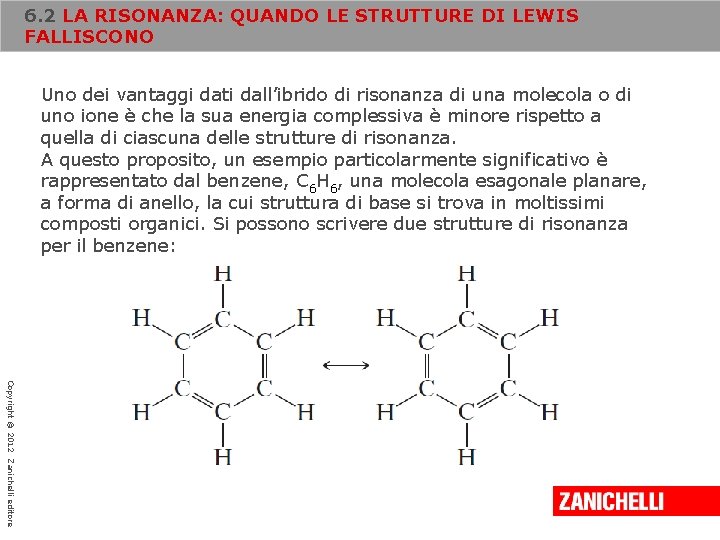
6. 2 LA RISONANZA: QUANDO LE STRUTTURE DI LEWIS FALLISCONO Uno dei vantaggi dati dall’ibrido di risonanza di una molecola o di uno ione è che la sua energia complessiva è minore rispetto a quella di ciascuna delle strutture di risonanza. A questo proposito, un esempio particolarmente significativo è rappresentato dal benzene, C 6 H 6, una molecola esagonale planare, a forma di anello, la cui struttura di base si trova in moltissimi composti organici. Si possono scrivere due strutture di risonanza per il benzene: Copyright © 2012 Zanichelli editore

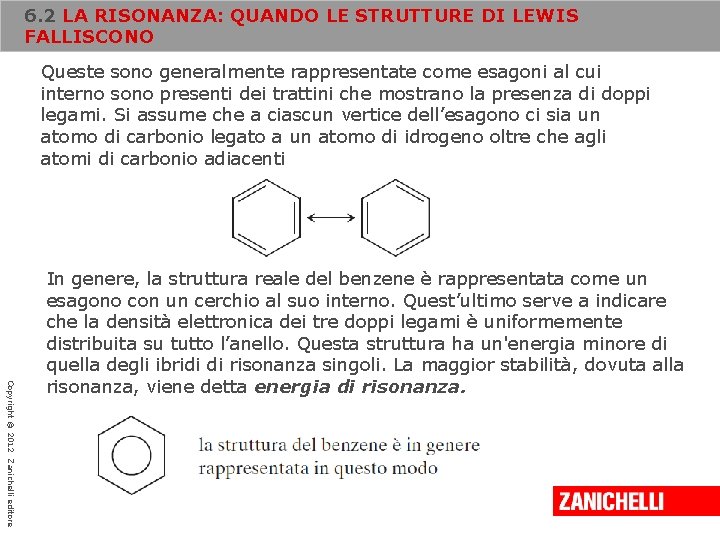
6. 2 LA RISONANZA: QUANDO LE STRUTTURE DI LEWIS FALLISCONO Queste sono generalmente rappresentate come esagoni al cui interno sono presenti dei trattini che mostrano la presenza di doppi legami. Si assume che a ciascun vertice dell’esagono ci sia un atomo di carbonio legato a un atomo di idrogeno oltre che agli atomi di carbonio adiacenti Copyright © 2012 Zanichelli editore In genere, la struttura reale del benzene è rappresentata come un esagono con un cerchio al suo interno. Quest’ultimo serve a indicare che la densità elettronica dei tre doppi legami è uniformemente distribuita su tutto l’anello. Questa struttura ha un'energia minore di quella degli ibridi di risonanza singoli. La maggior stabilità, dovuta alla risonanza, viene detta energia di risonanza.

6. 3 NEL LEGAME COVALENTE DI COORDINAZIONE LA COPPIA DI ELETTRONI DI LEGAME Quando una molecola di ammoniaca si forma dai suoi elementi, ciascuno dei tre atomi di idrogeno condivide un elettrone con l’atomo di azoto. In tal modo, l’azoto forma tre legami e raggiunge l’ottetto: Copyright © 2012 Zanichelli editore A questo punto, ci potremmo attendere che l’azoto non formi altri legami. In soluzione acida, però, l’ammoniaca acquista uno ione idrogeno, H+, e diventa NH 4+, uno ione in cui sono presenti quattro legami tra azoto e idrogeno. Per comprendere come ciò possa avvenire, scriviamo in nero gli elettroni forniti dall’azoto e in rosso quelli forniti dagli atomi di idrogeno:

6. 3 NEL LEGAME COVALENTE DI COORDINAZIONE LA COPPIA DI ELETTRONI DI LEGAME Tre dei legami N-H si formano in modo normale; ogni atomo contribuisce con un elettrone alla formazione della coppia di legame, mentre il quarto legame si genera in modo diverso poiché entrambi gli elettroni sono forniti dall’atomo di azoto. Quest’ultimo legame si può formare perché lo ione H + possiede un orbitale 1 s vuoto nel suo strato di valenza, che può essere occupato da entrambi gli elettroni dell’azoto. Il risultato è che, quando H + si lega a NH 3, l’azoto dona entrambi gli elettroni per formare il quarto legame. Un legame covalente, in cui entrambi gli elettroni della coppia condivisa provengono da uno solo dei due atomi, è chiamato legame covalente di coordinazione. Copyright © 2012 Zanichelli editore

6. 3 NEL LEGAME COVALENTE DI COORDINAZIONE LA COPPIA DI ELETTRONI DI LEGAME È importante comprendere che, nonostante una diversa origine degli elettroni, il legame di coordinazione è un legame covalente uguale a tutti gli altri. In altri termini, una volta che il legame si è formato, non possiamo stabilire da dove provengono gli elettroni. Nello ione NH 4+ , per esempio, i quattro legami N-H sono equivalenti e, una volta formati, non possono essere distinti. La struttura di NH 4+ si scrive così: Copyright © 2012 Zanichelli editore

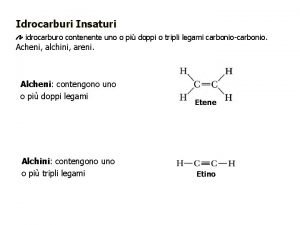
6. 4 LA FORMA DELLE MOLECOLE DERIVA DA CINQUE STRUTTURE DI BASE Quando una molecola è costituita da due soli atomi, non vi è alcun dubbio sulla sua forma: gli atomi sono semplicemente disposti uno accanto all’altro. Le molecole formate da tre o più atomi possono invece assumere forme diverse, a volte complesse, ma che derivano quasi sempre da cinque strutture geometriche di base. In una molecola lineare, gli atomi sono disposti in linea retta. Tutte le molecole biatomiche sono lineari. Quando sono presenti tre atomi, l’angolo formato dai legami covalenti, noto come angolo di legame, è di 180°: Copyright © 2012 Zanichelli editore

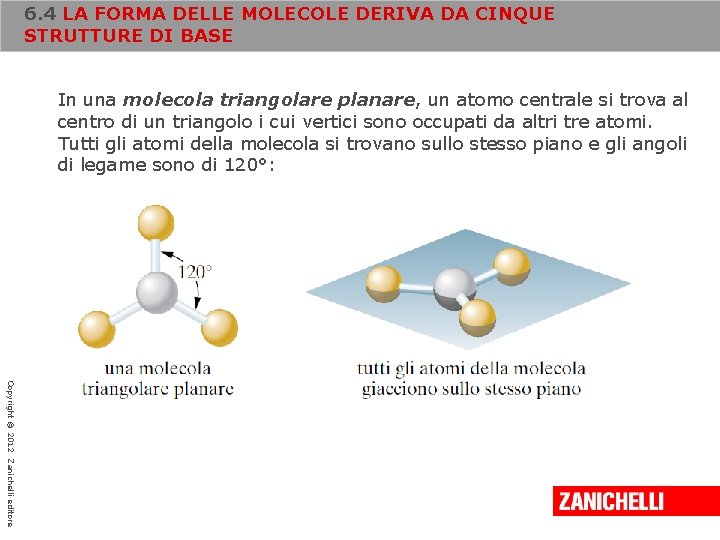
6. 4 LA FORMA DELLE MOLECOLE DERIVA DA CINQUE STRUTTURE DI BASE In una molecola triangolare planare, un atomo centrale si trova al centro di un triangolo i cui vertici sono occupati da altri tre atomi. Tutti gli atomi della molecola si trovano sullo stesso piano e gli angoli di legame sono di 120°: Copyright © 2012 Zanichelli editore

6. 4 LA FORMA DELLE MOLECOLE DERIVA DA CINQUE STRUTTURE DI BASE Il tetraedro è un solido regolare con quattro facce triangolari equilatere. In una molecola tetraedrica, l’atomo centrale sta al centro di un tetraedro i cui vertici sono occupati da altri quattro atomi. I quattro legami di una molecola tetraedrica sono uguali fra loro, con angoli di legame di 109, 5°: Copyright © 2012 Zanichelli editore

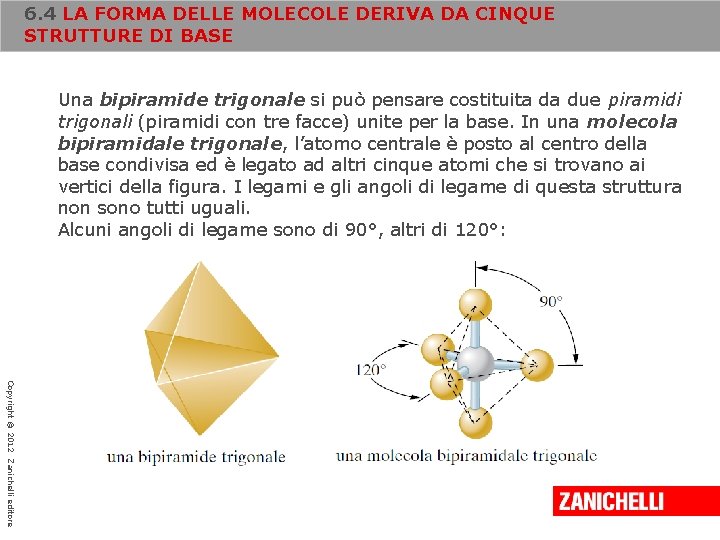
6. 4 LA FORMA DELLE MOLECOLE DERIVA DA CINQUE STRUTTURE DI BASE Una bipiramide trigonale si può pensare costituita da due piramidi trigonali (piramidi con tre facce) unite per la base. In una molecola bipiramidale trigonale, l’atomo centrale è posto al centro della base condivisa ed è legato ad altri cinque atomi che si trovano ai vertici della figura. I legami e gli angoli di legame di questa struttura non sono tutti uguali. Alcuni angoli di legame sono di 90°, altri di 120°: Copyright © 2012 Zanichelli editore

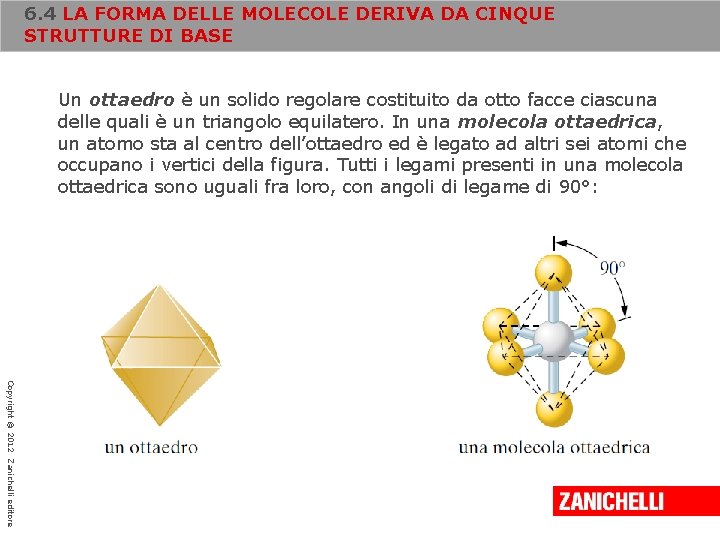
6. 4 LA FORMA DELLE MOLECOLE DERIVA DA CINQUE STRUTTURE DI BASE Un ottaedro è un solido regolare costituito da otto facce ciascuna delle quali è un triangolo equilatero. In una molecola ottaedrica, un atomo sta al centro dell’ottaedro ed è legato ad altri sei atomi che occupano i vertici della figura. Tutti i legami presenti in una molecola ottaedrica sono uguali fra loro, con angoli di legame di 90°: Copyright © 2012 Zanichelli editore

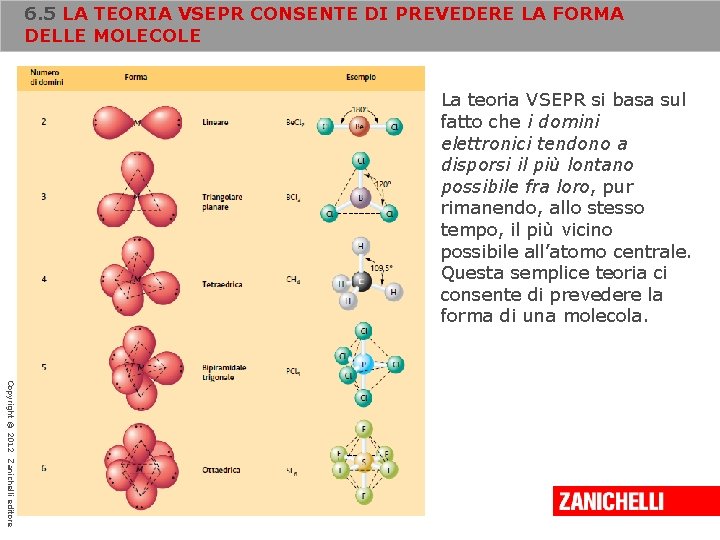
6. 5 LA TEORIA VSEPR CONSENTE DI PREVEDERE LA FORMA DELLE MOLECOLE Un buon modello teorico dovrebbe spiegare tutte le osservazioni note e, allo stesso tempo, consentire previsioni accurate. Il modello della repulsione delle coppie di elettroni del livello di valenza (noto come modello VSEPR, dall’inglese Valence Shell Electron Pair Repulsion) soddisfa entrambi i requisiti ed è concettualmente semplice. Si basa, infatti, sul principio che le coppie di elettroni, sia di legame sia non condivise, si respingono reciprocamente e si dispongono perciò nello spazio in modo da essere il più lontano possibile fra loro. Copyright © 2012 Zanichelli editore

6. 5 LA TEORIA VSEPR CONSENTE DI PREVEDERE LA FORMA DELLE MOLECOLE Copyright © 2012 Zanichelli editore Per comprendere il funzionamento di questo modello, è utile introdurre il concetto di dominio elettronico, inteso come regione di spazio in cui è possibile trovare gli elettroni. Esistono due tipi di domini elettronici: i domini di legame contengono coppie di elettroni condivise fra due atomi che formano un legame. Anche se un legame multiplo occupa uno spazio maggiore rispetto a un legame singolo, tutti gli elettroni del legame si trovano nella stessa porzione di spazio e appartengono allo stesso dominio di legame. Gli elettroni che formano un dato legame singolo, doppio o triplo appartengono dunque allo stesso dominio di legame; i domini di non legame contengono elettroni di valenza che appartengono a un singolo atomo. Un dominio di non legame può essere rappresentato da una coppia di elettroni non condivisa (detta anche coppia solitaria) o da un elettrone spaiato (presente nelle molecole che contengono un numero dispari di elettroni di valenza).

6. 5 LA TEORIA VSEPR CONSENTE DI PREVEDERE LA FORMA DELLE MOLECOLE La teoria VSEPR si basa sul fatto che i domini elettronici tendono a disporsi il più lontano possibile fra loro, pur rimanendo, allo stesso tempo, il più vicino possibile all’atomo centrale. Questa semplice teoria ci consente di prevedere la forma di una molecola. Copyright © 2012 Zanichelli editore

6. 5 LA TEORIA VSEPR CONSENTE DI PREVEDERE LA FORMA DELLE MOLECOLE Consideriamo, per esempio, la molecola Be. Cl 2, la cui struttura di Lewis è: Secondo la teoria VSEPR, la forma della molecola dipende dalla tendenza dei domini elettronici a disporsi il più lontano possibile l’uno dall’altro. Nella molecola Be. Cl 2 ci sono due domini di legame intorno all’atomo di berillio che cercheranno di posizionarsi alla massima distanza fra loro, cioè da parti opposte rispetto al nucleo. Possiamo rappresentare questa condizione come: Copyright © 2012 Zanichelli editore

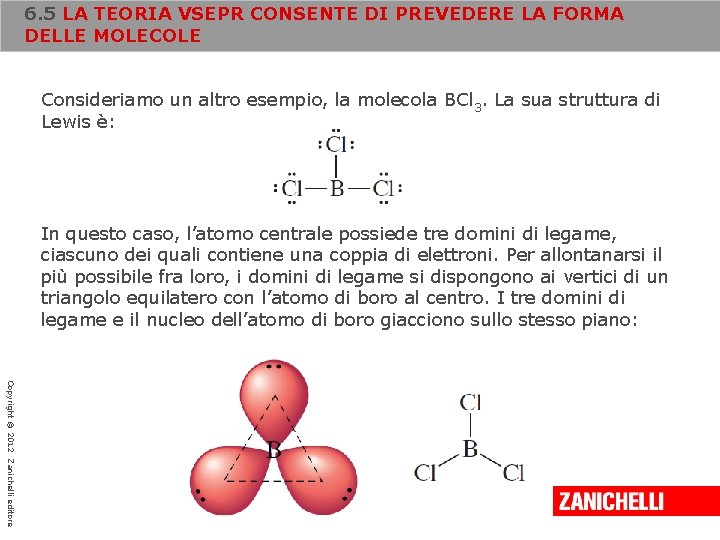
6. 5 LA TEORIA VSEPR CONSENTE DI PREVEDERE LA FORMA DELLE MOLECOLE Consideriamo un altro esempio, la molecola BCl 3. La sua struttura di Lewis è: In questo caso, l’atomo centrale possiede tre domini di legame, ciascuno dei quali contiene una coppia di elettroni. Per allontanarsi il più possibile fra loro, i domini di legame si dispongono ai vertici di un triangolo equilatero con l’atomo di boro al centro. I tre domini di legame e il nucleo dell’atomo di boro giacciono sullo stesso piano: Copyright © 2012 Zanichelli editore

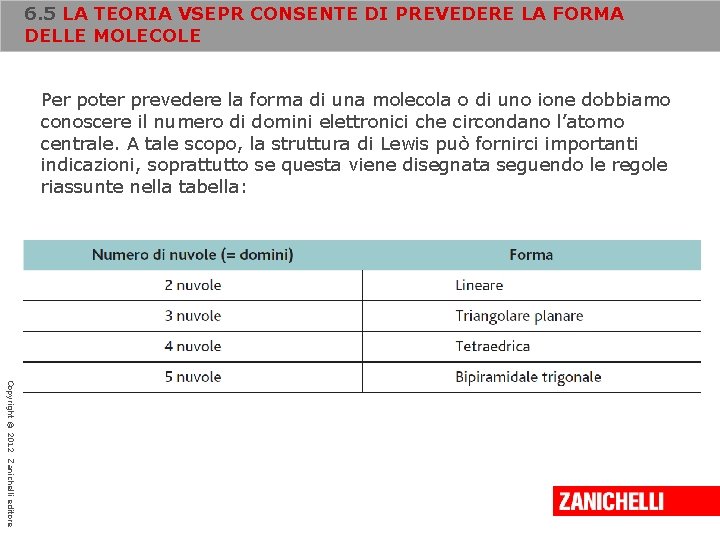
6. 5 LA TEORIA VSEPR CONSENTE DI PREVEDERE LA FORMA DELLE MOLECOLE Per poter prevedere la forma di una molecola o di uno ione dobbiamo conoscere il numero di domini elettronici che circondano l’atomo centrale. A tale scopo, la struttura di Lewis può fornirci importanti indicazioni, soprattutto se questa viene disegnata seguendo le regole riassunte nella tabella: Copyright © 2012 Zanichelli editore

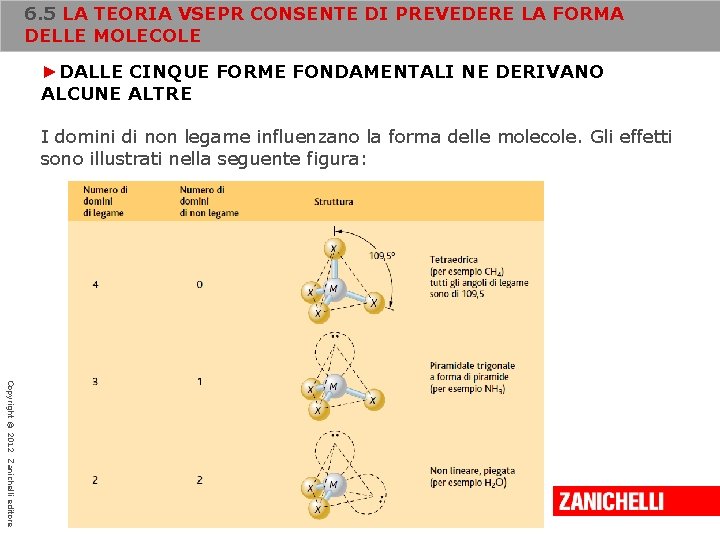
6. 5 LA TEORIA VSEPR CONSENTE DI PREVEDERE LA FORMA DELLE MOLECOLE ►DALLE CINQUE FORME FONDAMENTALI NE DERIVANO ALCUNE ALTRE Nelle molecole considerate finora, tutti i domini elettronici disposti intorno all’atomo centrale sono impegnati nella formazione di legami. In alcune molecole, l’atomo centrale possiede uno o più domini di non legame, costituiti da coppie di elettroni non condivise o da elettroni di valenza spaiati. Come possiamo vedere nel caso di Sn. Cl 2, i domini di non legame influenzano la geometria della molecola: Copyright © 2012 Zanichelli editore Intorno all’atomo di stagno si trovano tre domini, di cui due di legame e uno di non legame (la coppia non condivisa).

6. 5 LA TEORIA VSEPR CONSENTE DI PREVEDERE LA FORMA DELLE MOLECOLE ►DALLE CINQUE FORME FONDAMENTALI NE DERIVANO ALCUNE ALTRE Anche in questo caso, i domini si dispongono il più lontano possibile fra loro, ai vertici di un triangolo La forma della molecola è la seguente: Copyright © 2012 Zanichelli editore Anche se i domini sono disposti in questo modo, la molecola non è triangolare. Infatti, la forma delle molecole descrive la disposizione degli atomi, non quella dei domini. La molecola Sn. Cl 2 ha perciò una struttura non lineare o piegata o a forma di V

6. 5 LA TEORIA VSEPR CONSENTE DI PREVEDERE LA FORMA DELLE MOLECOLE ►DALLE CINQUE FORME FONDAMENTALI NE DERIVANO ALCUNE ALTRE Le molecole e gli ioni più comuni presentano un atomo centrale con quattro coppie di elettroni (ottetto) nello strato di valenza. Se le quattro coppie di elettroni formano altrettanti legami, come nel caso del metano (CH 4) o del tetracloruro di carbonio (CCl 4), la molecola ha una forma tetraedrica. Vi sono però importanti esempi di molecole in cui sono presenti domini di non legame: Copyright © 2012 Zanichelli editore

6. 5 LA TEORIA VSEPR CONSENTE DI PREVEDERE LA FORMA DELLE MOLECOLE ►DALLE CINQUE FORME FONDAMENTALI NE DERIVANO ALCUNE ALTRE I domini di non legame influenzano la forma delle molecole. Gli effetti sono illustrati nella seguente figura: Copyright © 2012 Zanichelli editore

6. 5 LA TEORIA VSEPR CONSENTE DI PREVEDERE LA FORMA DELLE MOLECOLE ►DALLE CINQUE FORME FONDAMENTALI NE DERIVANO ALCUNE ALTRE Fino a questo punto abbiamo discusso della forma di molecole o ioni in cui sono presenti solo legami singoli. Fortunatamente, la presenza di doppi o tripli legami non complica le cose. In un doppio legame, entrambe le coppie di elettroni sono disposte fra i due atomi e non possono spostarsi. Ciò vale anche per le tre coppie di elettroni di un triplo legame. Un doppio e un triplo legame contano come un solo dominio di legame. Per esempio, la formula di Lewis per CO 2 è: Copyright © 2012 Zanichelli editore

6. 6 LE MOLECOLE POLARI SONO ASIMMETRICHE La polarità di una molecola influenza molte proprietà fisiche della sostanza a cui appartiene, per esempio i suoi punti di ebollizione e di fusione. Ciò è dovuto al fatto che le molecole polari si attraggono reciprocamente. Come si può osservare nella, l’estremità positiva di una molecola attrae l’estremità negativa dell’altra e viceversa. La forza di attrazione dipende sia dalla quantità di carica presente alle due estremità sia dalla distanza fra le cariche. Il grado di polarità è espresso quantitativamente dal momento di dipolo (simbolo μ), che si ottiene moltiplicando la carica parziale presente ai due estremi per la distanza fra le cariche. Copyright © 2012 Zanichelli editore

6. 6 LE MOLECOLE POLARI SONO ASIMMETRICHE Il momento di dipolo di una molecola può essere determinato sperimentalmente e ciò porta a un’interessante osservazione. Esistono molte molecole che mostrano un momento nullo nonostante contengano legami polari. Si tratta, quindi, di molecole non polari che contengono legami polari. Questo fatto può essere spiegato esaminando il ruolo chiave giocato dalla struttura molecolare nel determinare la polarità delle molecole Copyright © 2012 Zanichelli editore

6. 6 LE MOLECOLE POLARI SONO ASIMMETRICHE Consideriamo, per esempio, la molecola HCl, in cui sono presenti due soli atomi e quindi un solo legame. Questo legame è polare perché l’elettronegatività dei due atomi è diversa; ciò significa che gli atomi alle due estremità del legame presentano un addensamento di carica di segno opposto. Una molecola di questo tipo, con cariche uguali ma di segno opposto alle sue estremità, è una molecola polare. In effetti, qualsiasi molecola formata da due soli atomi con elettronegatività diversa è necessariamente polare. Copyright © 2012 Zanichelli editore

6. 6 LE MOLECOLE POLARI SONO ASIMMETRICHE Nel caso di molecole che contengono più di due atomi, occorre invece considerare l’effetto combinato di tutti i legami polari. A volte, quando gli atomi legati all’atomo centrale sono uguali fra loro, l’effetto dei singoli legami polari si annulla e la molecola nel suo insieme è apolare (non polare). La illustra alcuni esempi; i dipoli associati ai legami, noti come dipoli di legame, sono qui rappresentati con frecce tagliate rivolte verso l’estremità negativa del dipolo. Copyright © 2012 Zanichelli editore

6. 6 LE MOLECOLE POLARI SONO ASIMMETRICHE Se tutti gli atomi legati all’atomo centrale sono uguali, anche le molecole con geometria bipiramidale trigonale e ottaedrica sono apolari. Tutte le forme geometriche di base sono «bilanciate» o simmetriche quando gli atomi periferici sono identici fra loro. Se, invece, l’atomo centrale è legato ad atomi diversi fra loro o presenta domini di non legame, la molecola è generalmente polare. Per esempio, in CHCl 3 uno degli atomi della struttura tetraedrica è diverso dagli altri. Il legame C-H ha una polarità diversa rispetto ai legami C-Cl e i dipoli non si annullano. Una struttura «sbilanciata» come questa si dice asimmetrica. Copyright © 2012 Zanichelli editore

6. 6 LE MOLECOLE POLARI SONO ASIMMETRICHE La figura mostra due molecole comuni in cui sono presenti domini di non legame sull’atomo centrale. In questi casi, l’orientamento dei dipoli di legame è tale che, nel complesso, i loro effetti non si annullano. Nell’acqua, per esempio, i due dipoli di legame puntano in direzione dell’atomo di ossigeno. Il risultato è che si sommano per dare un momento dipolare netto della molecola. Lo stesso avviene nell’ammoniaca, in cui i tre dipoli di legame puntano tutti in direzione dell’azoto e si sommano rendendo polare la molecola. Copyright © 2012 Zanichelli editore
 Mappa francesco petrarca
Mappa francesco petrarca Gas nobili
Gas nobili Legami primari e secondari
Legami primari e secondari Classificazione dei composti chimici mappa concettuale
Classificazione dei composti chimici mappa concettuale Legame dativo esempio
Legame dativo esempio Soluzioni capitolo 13 zanichelli chimica
Soluzioni capitolo 13 zanichelli chimica Interazione intermolecolare
Interazione intermolecolare Gruppo fosfato formula
Gruppo fosfato formula Tiziana bellini
Tiziana bellini Frasi dalla forma attiva alla forma passiva
Frasi dalla forma attiva alla forma passiva Dalla forma implicita alla forma esplicita
Dalla forma implicita alla forma esplicita Diagramma delle masse
Diagramma delle masse Molecole in movimento soluzioni capitolo 14
Molecole in movimento soluzioni capitolo 14 Chimica più soluzioni capitolo 14
Chimica più soluzioni capitolo 14 Pasodoble banderita
Pasodoble banderita Mas alla de mi inseguridad letra
Mas alla de mi inseguridad letra Soluzioni chimica capitolo 13
Soluzioni chimica capitolo 13 Pressione oncotica
Pressione oncotica La nascita delle lingue e delle letterature romanze
La nascita delle lingue e delle letterature romanze L esperienza delle cose moderne e la lezione delle antique
L esperienza delle cose moderne e la lezione delle antique La lezione delle antique cose
La lezione delle antique cose Forma negativa francese frasi
Forma negativa francese frasi Prostaglandine vasodilatazione
Prostaglandine vasodilatazione Composti chimici inorganici
Composti chimici inorganici Messaggeri chimici
Messaggeri chimici Classificazione dei composti chimici mappa concettuale
Classificazione dei composti chimici mappa concettuale Classificazione composti inorganici
Classificazione composti inorganici Ossiacidi
Ossiacidi Classificazione dei composti chimici mappa concettuale
Classificazione dei composti chimici mappa concettuale Pericoli fisici
Pericoli fisici Definizione di agente chimico
Definizione di agente chimico Classificazione e nomenclatura dei composti riassunto
Classificazione e nomenclatura dei composti riassunto O
O Legame polare e apolare
Legame polare e apolare Dot
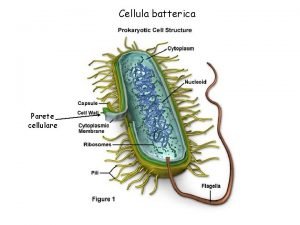
Dot Cellula
Cellula Legami crociati collagene
Legami crociati collagene Forze di van der waals
Forze di van der waals Legami secondari chimica
Legami secondari chimica