CAPITOLO I composti chimici e la nomenclatura 8









- Slides: 14

CAPITOLO I composti chimici e la nomenclatura 8 Indice 1. Il concetto di valenza 2. Il numero di ossidazione 3. Classificazione e nomenclatura dei composti chimici 4. Composti binari 5. Composti ternari Mappa concettuale: classificazione dei composti chimici © Paolo Pistarà © Istituto Italiano Edizioni Atlas 1

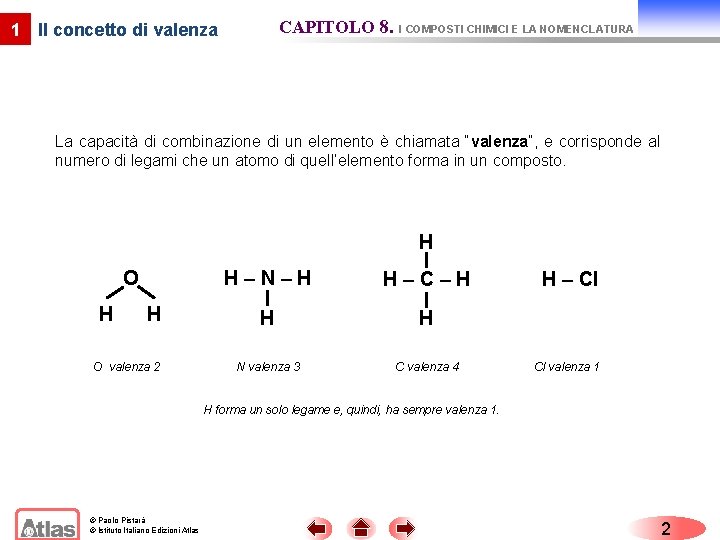
CAPITOLO 8. I COMPOSTI CHIMICI E LA NOMENCLATURA 1 Il concetto di valenza La capacità di combinazione di un elemento è chiamata “valenza”, e corrisponde al numero di legami che un atomo di quell’elemento forma in un composto. H O H H O valenza 2 H–N–H H–C–H H H N valenza 3 C valenza 4 H – Cl Cl valenza 1 H forma un solo legame e, quindi, ha sempre valenza 1. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 2

2 Il numero di ossidazione CAPITOLO 8. I COMPOSTI CHIMICI E LA NOMENCLATURA La valenza di un elemento non considera né la polarità dei legami chimici né gli ioni dei composti ionici, pertanto dai chimici è stata sostituita con il concetto di numero di ossidazione (n. o. ) o stato di ossidazione, che è collegato all’elettronegatività. Il numero di ossidazione, a differenza della valenza, può assumere valore positivo o negativo oppure zero. “Il numero di ossidazione di un atomo in un composto covalente polare è la carica che l’atomo assumerebbe se gli elettroni di legame venissero assegnati all’atomo più elettronegativo”. Il n. o. di uno ione monoatomico corrisponde alla carica elettrica reale dell’atomo. Mediante alcune regole pratiche è possibile assegnare il n. o. ad un elemento in un composto senza conoscere la sua formula di struttura. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 3

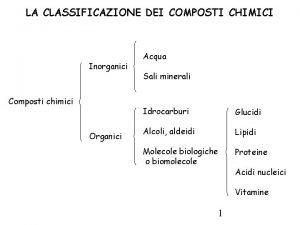
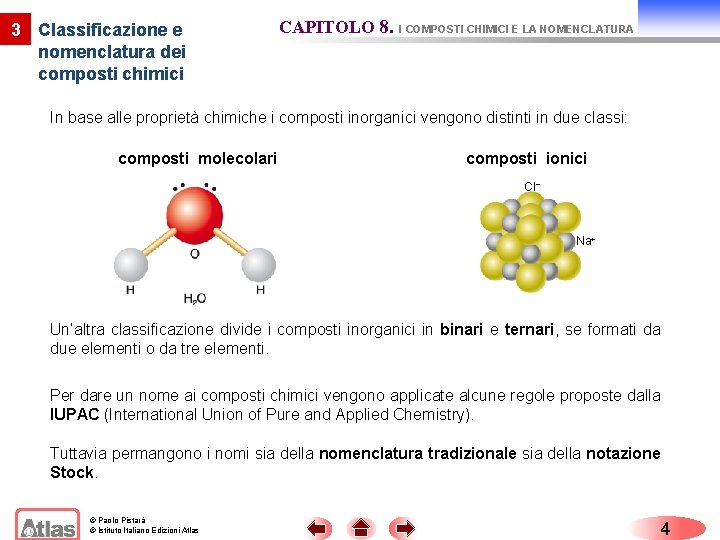
3 Classificazione e nomenclatura dei composti chimici CAPITOLO 8. I COMPOSTI CHIMICI E LA NOMENCLATURA In base alle proprietà chimiche i composti inorganici vengono distinti in due classi: composti molecolari composti ionici Cl− Na+ Un’altra classificazione divide i composti inorganici in binari e ternari, se formati da due elementi o da tre elementi. Per dare un nome ai composti chimici vengono applicate alcune regole proposte dalla IUPAC (International Union of Pure and Applied Chemistry). Tuttavia permangono i nomi sia della nomenclatura tradizionale sia della notazione Stock. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 4

4 Composti binari CAPITOLO 8. I COMPOSTI CHIMICI E LA NOMENCLATURA I composti binari si classificano in: u Ossidi di non metalli Costituiti da atomi di un non metallo e da atomi di ossigeno. Per assegnare il nome a questi composti, la IUPAC tiene conto del numero degli atomi della molecola utilizzando prefissi greci. PREFISSI GRECI La nomenclatura tradizionale usa i suffissi - oso e – ico. Formula N. O. di S Nome tradizionale IUPAC octa = 8 SO 2 +4 anidride solforosa diossido di zolfo tetra = 4 nona = 9 SO 3 +6 anidride solforica triossido di zolfo penta = 5 deca = 10 mono = 1 esa = 6 di = 2 epta = 7 tri = 3 © Paolo Pistarà © Istituto Italiano Edizioni Atlas Nei composti in cui un elemento presenta più di due numeri di ossidazione, si ricorre a ulteriori prefissi, ipo- e per -. 5

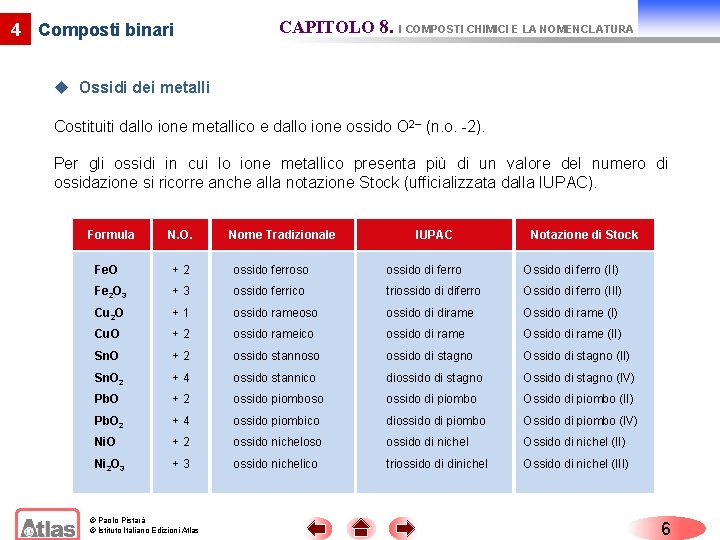
4 Composti binari CAPITOLO 8. I COMPOSTI CHIMICI E LA NOMENCLATURA u Ossidi dei metalli Costituiti dallo ione metallico e dallo ione ossido O 2 (n. o. -2). Per gli ossidi in cui lo ione metallico presenta più di un valore del numero di ossidazione si ricorre anche alla notazione Stock (ufficializzata dalla IUPAC). Formula N. O. Nome Tradizionale IUPAC Notazione di Stock Fe. O +2 ossido ferroso ossido di ferro Ossido di ferro (II) Fe 2 O 3 +3 ossido ferrico triossido di diferro Ossido di ferro (III) Cu 2 O +1 ossido rameoso ossido di dirame Ossido di rame (I) Cu. O +2 ossido rameico ossido di rame Ossido di rame (II) Sn. O +2 ossido stannoso ossido di stagno Ossido di stagno (II) Sn. O 2 +4 ossido stannico diossido di stagno Ossido di stagno (IV) Pb. O +2 ossido piomboso ossido di piombo Ossido di piombo (II) Pb. O 2 +4 ossido piombico diossido di piombo Ossido di piombo (IV) Ni. O +2 ossido nicheloso ossido di nichel Ossido di nichel (II) Ni 2 O 3 +3 ossido nichelico triossido di dinichel Ossido di nichel (III) © Paolo Pistarà © Istituto Italiano Edizioni Atlas 6

CAPITOLO 8. I COMPOSTI CHIMICI E LA NOMENCLATURA 4 Composti binari u Perossidi Composti binari in cui sono presenti due atomi di ossigeno. H–O (acqua ossigenata) u Idracidi Composti binari caratterizzati dalla presenza dell’idrogeno come primo elemento e di un elemento del gruppo 6 A (escluso l’ossigeno) o del gruppo 7 A. Formula Nome del composto Nome in soluzione acquosa HF fluoruro di idrogeno acido fluoridrico HCl cloruro di idrogeno acido cloridrico HBr bromuro di idrogeno acido bromidrico Hl ioduro di idrogeno acido iodidrico H 2 S solfuro di idrogeno acido solfidrico © Paolo Pistarà © Istituto Italiano Edizioni Atlas Dagli idracidi deriva una classe di composti, chiamati sali, che presentano il suffisso -uro. 7

4 Composti binari CAPITOLO 8. I COMPOSTI CHIMICI E LA NOMENCLATURA u Idruri covalenti Composti binari dell’idrogeno con un semimetallo o con i non metalli dei gruppi 4 A, 5 A e 6 A. Sono esempi di idruri covalenti CH 4 (metano), NH 3 (ammoniaca), H 2 O (acqua). u Idruri salini Composti ionici binari dell’idrogeno (n. o. -1) con metalli (in particolare del 1° e del 2° gruppo A). © Paolo Pistarà © Istituto Italiano Edizioni Atlas 8

5 Composti ternari CAPITOLO 8. I COMPOSTI CHIMICI E LA NOMENCLATURA I composti ternari, costituiti da tre elementi, si classificano in: u Idrossidi (o basi) Composti ionici formati da un catione metallico e da uno o più gruppi OH (ione idrossido). Per la nomenclatura di questi composti il termine idrossido è seguito dal nome del catione metallico. Formula Nome tradizionale Na. OH idrossido di sodio Ca(OH)2 idrossido di calcio Fe(OH)2 idrossido ferroso idrossido di ferro (II) Fe(OH)3 idrossido ferrico idrossido di ferro (III) © Paolo Pistarà © Istituto Italiano Edizioni Atlas Notazione di Stock 9

5 Composti ternari CAPITOLO 8. I COMPOSTI CHIMICI E LA NOMENCLATURA u Ossiacidi Sono composti ternari molecolari nella cui formula si scrive l’idrogeno come primo elemento, segue un non metallo e quindi l’ossigeno. Formula Nome tradizionale IUPAC H 2 CO 3 acido carbonico acido triossocarbonico (IV) H 2 Si. O 3 acido silicico acido triossosilicico (IV) HNO 2 acido nitroso acido diossonitrico (III) HNO 3 acido nitrico acido triossonitrico (V) H 2 SO 3 acido solforoso acido triossosolforico (IV) H 2 SO 4 acido solforico acido tetraossosolforico (VI) H 3 PO 3 acido fosforoso acido triossofosforico (III) H 3 PO 4 acido fosforico acido tetraossofosforico (V) HCl. O acido ipocloroso acido ossoclorico (I) HCl. O 2 acido cloroso acido diossoclorico (III) HCl. O 3 acido clorico acido triossoclorico (V) HCl. O 4 acido perclorico acido tetraossoclorico (VII) H 3 BO 3 acido borico acido triossoborico (III) © Paolo Pistarà © Istituto Italiano Edizioni Atlas 10

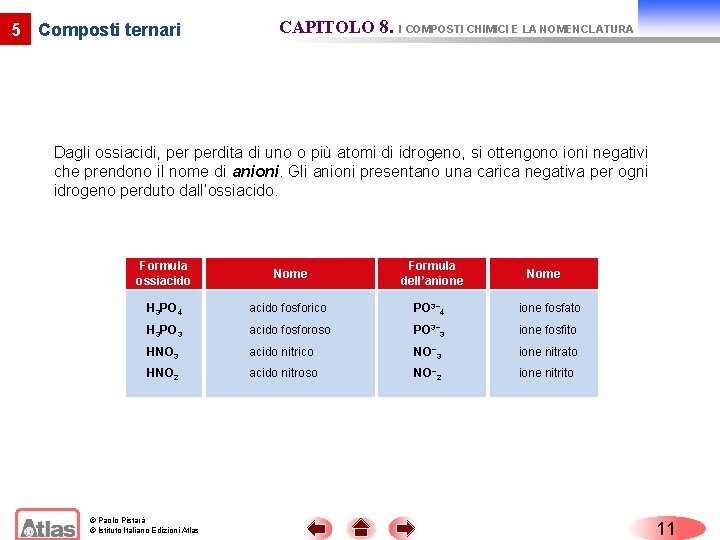
5 Composti ternari CAPITOLO 8. I COMPOSTI CHIMICI E LA NOMENCLATURA Dagli ossiacidi, perdita di uno o più atomi di idrogeno, si ottengono ioni negativi che prendono il nome di anioni. Gli anioni presentano una carica negativa per ogni idrogeno perduto dall’ossiacido. Formula ossiacido Nome Formula dell’anione H 3 PO 4 acido fosforico PO 3− 4 ione fosfato H 3 PO 3 acido fosforoso PO 3− 3 ione fosfito HNO 3 acido nitrico NO− 3 ione nitrato HNO 2 acido nitroso NO− 2 ione nitrito © Paolo Pistarà © Istituto Italiano Edizioni Atlas Nome 11

5 Composti ternari CAPITOLO 8. I COMPOSTI CHIMICI E LA NOMENCLATURA u Sali ternari Composti ionici che risultano dalla combinazione di un catione metallico con l’anione dell’ossiacido. Formula Nome Tradizionale IUPAC Notazione di Stock Na. NO 2 nitrito di sodio diossonitrato (III) di sodio nitrito di sodio Fe. SO 4 solfato ferroso tetraossosolfato (VI) di ferro (II) solfato di ferro (II) Cu. SO 4 solfato rameico tetraossosolfato (VI) di rame (II) solfato di rame (II) Na 2 CO 3 carbonato di sodio triossocarbonato di sodio Cu(NO 3)2 nitrato rameico di [triossonitrato (V)] di rame (II) nitrato di rame (II) Fe 2(SO 4)3 solfato ferrico tri [tetraossosolfato (VI)] di ferro (III) solfato di ferro (III) © Paolo Pistarà © Istituto Italiano Edizioni Atlas 12

5 Composti ternari CAPITOLO 8. I COMPOSTI CHIMICI E LA NOMENCLATURA u Sali idrati Composti che nei loro cristalli contengono una quantità ben definita e costante di acqua legata chimicamente. Il legame si rappresenta con un punto. Cu. Cl 2 2 H 2 O cloruro di rame (II) biidrato (azzurro) Co. Cl 2 6 H 2 O cloruro di cobalto (II) esaidrato (rosso) Appartengono alla classe dei sali anche i sali acidi, basici e doppi. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 13

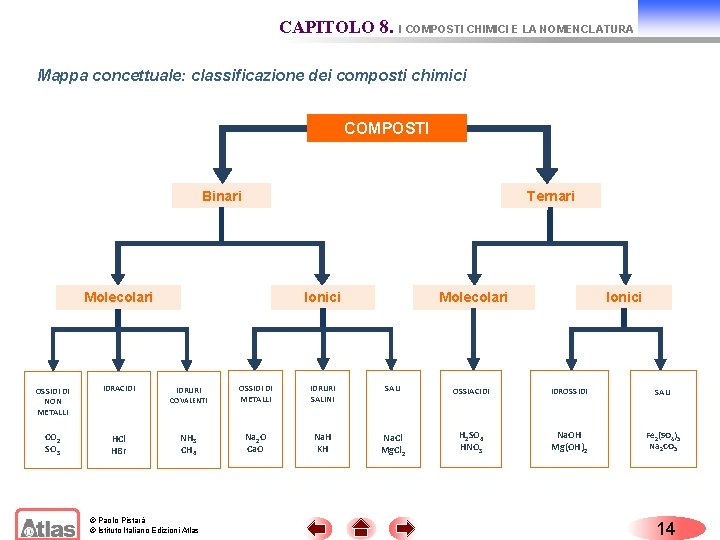
CAPITOLO 8. I COMPOSTI CHIMICI E LA NOMENCLATURA Mappa concettuale: classificazione dei composti chimici COMPOSTI Binari Ternari Molecolari OSSIDI DI NON METALLI IDRACIDI CO 2 SO 3 HCl HBr Ionici Molecolari Ionici IDRURI OSSIDI DI METALLI IDRURI SALINI SALI COVALENTI OSSIACIDI IDROSSIDI SALI NH 3 CH 4 Na 2 O Ca. O Na. H KH Na. Cl Mg. Cl 2 H 2 SO 4 HNO 3 Na. OH Mg(OH)2 Fe 2(SO 4)3 Na 2 CO 3 © Paolo Pistarà © Istituto Italiano Edizioni Atlas 14
 Nomenclatura chimica mappa concettuale
Nomenclatura chimica mappa concettuale Mappa concettuale nomenclatura chimica
Mappa concettuale nomenclatura chimica Ossiacidi
Ossiacidi Valenza
Valenza Composti chimici inorganici
Composti chimici inorganici Mappa nomenclatura chimica
Mappa nomenclatura chimica Classificazione dei composti chimici inorganici
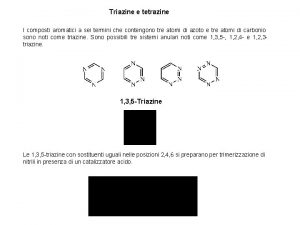
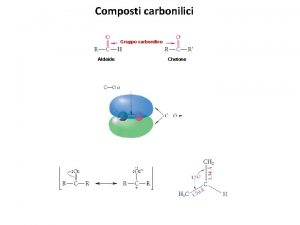
Classificazione dei composti chimici inorganici Composti aromatici
Composti aromatici Derivati benzene
Derivati benzene Gruppi protettori
Gruppi protettori Capitolo 14 chimica zanichelli soluzioni
Capitolo 14 chimica zanichelli soluzioni Chimica più soluzioni capitolo 14
Chimica più soluzioni capitolo 14 Tiziana bellini
Tiziana bellini Messaggeri chimici
Messaggeri chimici Prostaglandine vasodilatazione
Prostaglandine vasodilatazione