I COMPOSTI CHIMICI INORGANICI NOMENCLATURA TRADIZIONALE 1 OSSIDI




















- Slides: 20

I COMPOSTI CHIMICI INORGANICI NOMENCLATURA TRADIZIONALE 1

OSSIDI basici (C. binari) (in presenza di H 2 O hanno caratteristiche basiche) Sono composti dei Metalli (Me) con l’ossigeno (n° di ossidazione dell’ossigeno = -2) ü Se il Me ha 1 solo N° di ossidazione, la nomenclatura sarà: Ossido di…. (nome del Me) Es: K 2 O Ossido di Potassio (n° di ox = +1) (gruppo I A: metalli alcalini: n° ox +1) Es: Ca. O Ossido di Calcio (n° di ox = +2) 2 Mg + O 2 2 Mg. O (gruppo II A: metalli alcalino terrosi n° di ox = +2) 2

OSSIDI basici (composti binari) ü Se il Me ha 2 numeri di ossidazione, la nomenclatura dovrà tener conto: Ossido + nome del Me + desinenza oso per il metallo con il n° di ox più basso Es: Fe. O ossido ferr. OSO (n° ox Fe. O = +2) Ossido + nome del Me + desinenza ico per il metallo con n° di ox più alto Es: Fe 2 O 3 ossido ferr. ICO (n° di ox = +3) 3

OSSIDI acidi = anidridi (c. binari) (in presenza di H 2 O hanno caratteristiche acide) Sono composti di un Non. Metallo (non. Me) con l’ossigeno (ossigeno n° di ox = – 2) ü Se il non. Me ha 1 solo n° di ox , la nomenclatura sarà: Anidride + nome del non. Me di des. ica Es: B 2 O 3 Anidride bor. ICA (n° ox B = + 3) (NB: il pedice di B è il n° di ox di O e vicev. ) 4

OSSIDI acidi = anidridi (c. binari) ü Se il non. Me ha 2 n° di ox, la nomenclatura sarà: Anidride + nome del non. Me + des. osa, per il non. Me con il più basso n° di ox Es. SO 2 anidride solfor. OSA (n° di ox S = + 4) Anidride + nome del non. Me + des. ica, per il non. Me con il più alto n° di ox Es. SO 3 anidride solfor. ICA (n° di ox S = + 6) Altri Es: CO(eccez. ): ossido di carbonio(n°ox C+2) CO 2: anidride carbonica (n° ox C +4) 5

OSSIDI acidi = anidridi (c. binari) ü Se il non. Me ha 3 o più n° di ox la nom. sarà: Anidride+IPO+nome del non. Me+des. OSA (per il non. Me con il n° ox più basso) Anidride + nome del non. Me + des. OSA (per il non. Me con il n° ox successivo) Anidride + nome del non. Me + des. ICA (per il non. Me con il n° ox successivo) Anidride+PER+nome del non. Me+des. ICA (per il non. Me con il n° ox più alto) (vedi esempi) 6

OSSIDI acidi = anidridi (c. binari) Esempi Cl 2 O Anidride IPOclor. OSA Cl 2 O 3 Anidride clor. OSA Cl 2 O 5 Anidride clor. ICA Cl 2 O 7 Anidride PERclor. ICA (n° ox Cl +1) (n° ox Cl +3) (n°ox Cl + 5) (n°ox Cl +7) 7

OSSIDI acidi = anidridi (c. binari) Continua (vedi esempi ed eventuali eccezioni) N 2 O protossido di azoto NO ossido di azoto N 2 O 3 anidride nitr. OSA NO 2/ N 2 O 4 ipoazotide N 2 O 5 anidride nitr. ICA (n°ox N +1) (n°ox N +2) (n°ox N +3) (n°ox N +4) (n°ox N +5) 8

PEROSSIDI (C. Binari) Sono molecole in cui l’ossigeno ha n° ox -1, due atomi di ossigeno sono legati tra di loro. Il nome sarà: Perossido + nome dell’elemento Es: H 2 O 2 perossido di idrogeno (nome corrente: acqua ossigenata) 9

IDRURI(C. Binari) Sono formati da Me + idrogeno (n° ox di H – 1) Il nome sarà: Idruro di + nome del Me (idruri salini) Es: Li. H idruro di Li; Cu. H; Ca. H 2 (l’H è sempre scritto dopo il Me) Nel caso di idruri covalenti: non. Me o semi. ME +H, si usano i nomi comuni Es: CH 4 (metano), NH 3 (ammoniaca), PH 3(fosfina) 10

IDRACIDI (binari): Sono composti binari che in acqua liberano ioni H+ formati da non. Me + idrogeno (n°ox H +1) Il nome sarà: Acido + nome del non. Me di des. IDRICO Es: HBr acido bromidrico; HF acido fluoridrico H 2 S acido solfidrico; HCl ac. Cloridrico 11

SALI da IDRACIDI (C. binari) si ottengono da Me + idracido Es. Pb + 2 HCl Pb. Cl 2 + H 2 si ottengono da idracido + idrossido Es: HCl + Na. OH Na. Cl + H 2 O La nomenclatura sarà: nome del non. Me (des. URO) + nome del Me Es: Na. Cl Cloruro di Na; Cu. Br Bromuro di Cu(I) / rameoso Cu. Br 2 Bromuro di Cu(II) / rameico 12

IDROSSIDI (C. ternari) Sono composti costituiti da un Me legato al gruppo idrossido (OH-) Formula generica: ME(OH)n n = n° di ox del Me Il nome sarà: Idrossido di … + nome del Me Es: Na. OH idrossido di sodio (n° ox Na +1) Ca(OH)2 idrossido di calcio (n° ox Ca +2) 13

OSSOACIDI (ternari, n ox H +1 ) formati da anidride (non. Me +O) + H 2 O La nomenclatura seguirà i criteri usati per le anidridi, se il non. Me ha più di un n° di ox si procederà con prefissi e desinenze: Acido + IPO + nome del non. Me + des. OSO Acido + nome del non. Me + des. ICO Acido + PER +nome del non. Me + des. ICO Vedere esempi 14

OSSOACIDI Esempi dei principali CO 2+ H 2 O H 2 CO 3 Ac. Carbonico N 2 O 3+ H 2 O 2 HNO 2 Ac. Nitroso (n°ox N 2 O 5+ H 2 O 2 HNO 3 Ac. Nitrico P 2 O 3 + 3 H 2 O 2 H 3 PO 3 Ac. Fosforoso P 2 O 5 + 3 H 2 O 2 H 3 PO 4 Ac. Fosforico SO 2 + H 2 O H 2 SO 3 Ac. Solforoso SO 3 + H 2 O H 2 SO 4 Ac. Solforico (n°ox C + 4) N + 3) (n°ox N + 5) (n°ox P + 3) (n°ox P + 5) (n°ox S + 4) S + 6) 15

OSSOACIDI Esempi (più numeri di ox) Cl 2 O + H 2 O 2 HCl. O Ac. IPOclor. OSO (n°ox Cl +1) Cl 2 O 3 + H 2 O 2 HCl. O 2 Ac. clor. OSO (n°ox Cl +3) Cl 2 O 5 + H 2 O 2 HCl. O 3 Ac. clor. ICO (n°ox Cl +5) Cl 2 O 7 + H 2 O 2 HCl. O 4 Ac. PERclor. ICO (n°ox Cl +7) 16

SALI da OSSOACIDI (C. ternari) Si ottengono per reazione di un ossoacido con unon. Me La nomenclatura deve tener conto dei n° di ox del non. Me: con il n° di ox più basso: non. Me (des. ITO) di…+ nome del Me con il n° di ox più alto: non. Me (des. ATO) di…+ nome del Me Es: K 2 SO 3 solfito di K (n°ox S + 4) K 2 SO 4 Solfato di K (n°ox S + 6) 17

SALI NEUTRI Dagli idracidi e dagli ossiacidi si ottengono: ü SALI NEUTRI: se gli ioni H+ sono sottratti totalmente (Reaz. di neutralizzazione) Es: HCl +Na. OH Na. Cl + H 2 O 2 HNO 3+ Mg(OH)2 Mg(NO 3)2 +2 H 2 O (Nitrato di Mg) 18

SALI ACIDI se gli ioni H+ sono sottratti parzialmente, la nomenclatura prevede prefissi: Mono- di- a seconda degli H+ residui Es: KHS (mono)idrogenosolfuro di K Na. HCO 3 (mono)idrogenocarbonato di Sodio (detto comunemente Bicarbonato di Na o carbonato acido di Na) KH 2 PO 4 diidrogeno fosfato di K Na 2 HPO 4 (mono)idrogenofosfato di Na 19

SALI DI AMMONIO (contengono NH 4+ ione ammonio, un non. Me che si comporta nei composti come un Metallo) usati come fertilizzanti: Es: NH 4 NO 3 Nitrato di ammonio (NH 4)2 SO 4 Solfato di ammonio come sali per la rianimazione: Es: (NH 4)2 CO 3 Carbonato di ammonio 20
 Acido tetraosso manganico
Acido tetraosso manganico Trimerizzazione
Trimerizzazione Filamento dna
Filamento dna Sali acidi esempi
Sali acidi esempi Chimica organica
Chimica organica Mappa concettuale nomenclatura
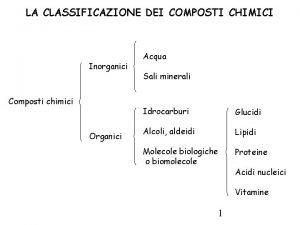
Mappa concettuale nomenclatura Classificazione dei composti chimici mappa concettuale
Classificazione dei composti chimici mappa concettuale Classificazione e nomenclatura dei composti zanichelli
Classificazione e nomenclatura dei composti zanichelli Valenza
Valenza Mappa nomenclatura chimica
Mappa nomenclatura chimica Idracido esempio
Idracido esempio Schema composti organici
Schema composti organici Pbcl2 nomenclatura tradizionale
Pbcl2 nomenclatura tradizionale Schema nomenclatura
Schema nomenclatura Un ossianione dell'elemento dal simbolo v
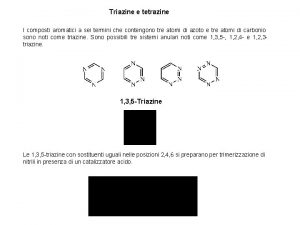
Un ossianione dell'elemento dal simbolo v Nomenclatura composti aromatici
Nomenclatura composti aromatici Derivati benzene
Derivati benzene Chetone nomenclatura
Chetone nomenclatura Nacl nomenclatura
Nacl nomenclatura Effetto corona
Effetto corona Ossidi dei non metalli
Ossidi dei non metalli