Cap 8 I composti chimici inorganici Gli elementi









- Slides: 17

Cap. 8 I composti chimici inorganici

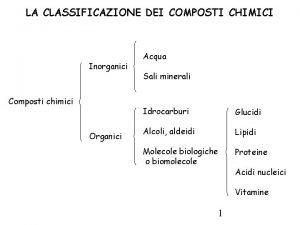
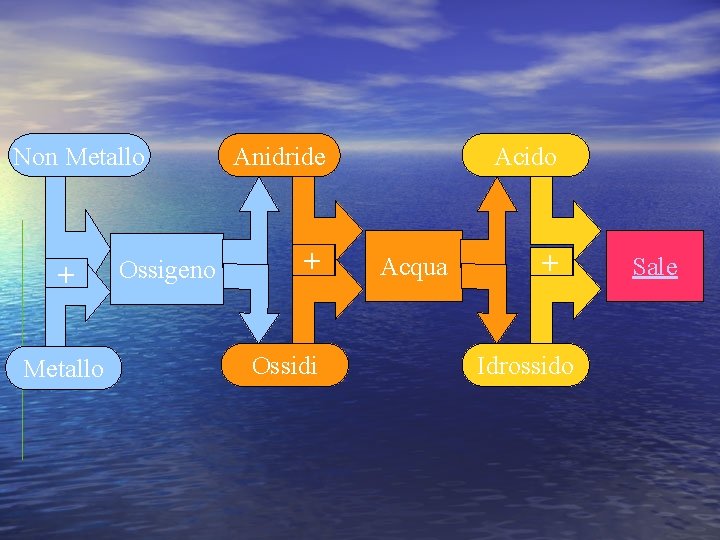
Gli elementi si possono suddividere in due gruppi metalli e non metalli Combinando un non metallo con l’ossigeno otteniamo un’anidride Combinando un metallo con l’ossigeno otteniamo un ossido Combinando un non metallo con l’acqua otteniamo un ossiacido o acido Combinando un metallo con l’acqua otteniamo un idrossido o base Combinando un idrossido con l’idracido otteniamo un sale con una reazione di condensazione che libera una molecola di acqua

Non Metallo + Metallo Ossigeno Anidride + Ossidi Acido Acqua + Idrossido Sale

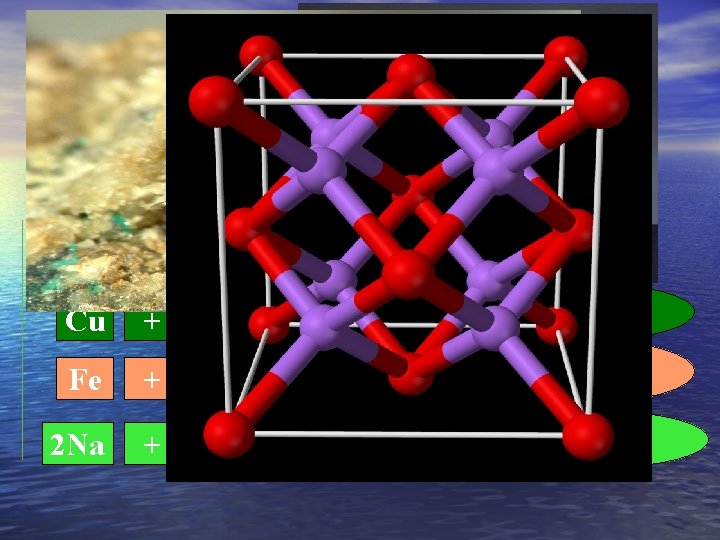
Gli Ossidi • Gli ossidi derivano dalla reazione di un metallo con l'ossigeno (reazione di ossidazione) Ca + O Ca. O (Ossido di calcio) Cu + O Cu. O Fe + O Fe. O 2 Na + O Tenorite Ossido di Na 2 O rame Ossido di ferro Ossido di sodio

Uraninite UO 2 Ematite Fe 2 O 3 Brookite Ti. O 2 Cuprite Cu 2 O Anatasio Ti. O 2 Rutilo Baddeleyte Ti. O 2 Zr O 2

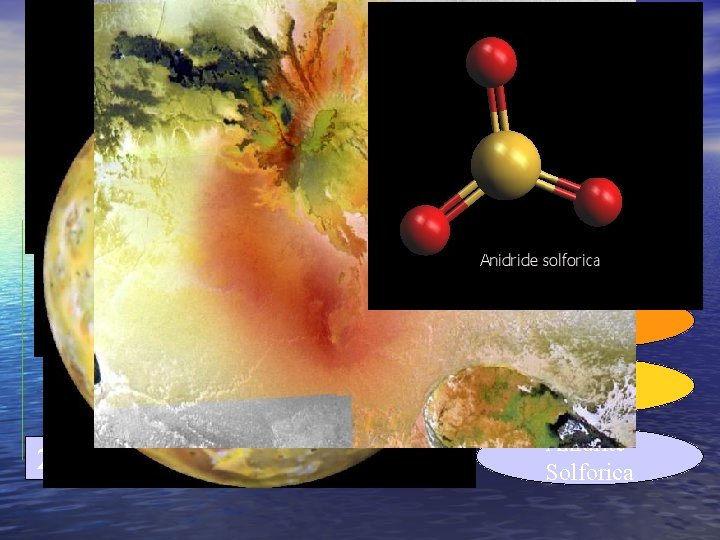
Le Anidridi • Le Anidridi derivano dalla reazione di un non metallo con l'ossigeno • Mentre gli ossidi sono generalmente solidi le anidridi sono gassose C S 2 S + + O 2 + 3 O 2 CO 2 Anidride carbonica SO 2 Anidrite Solforosa 2 SO 3 Anidrite Solforica

Le Basi o idrossidi • Le basi si ottengono facendo reagire gli ossidi con l'acqua Ca. O + H 2 O Ca(OH)2 Idrossido di calcio La Caratteristica degli idrossidi è quella di Portlandite Ca(OH)2 possedere un gruppi (OH) detto radicale ossidrilico di valenza 1 Gli idrossidi saranno formati da un metallo e gruppi (OH)

Fe. O Al 2 O 3 Na 2 O B 2 O 3 + H 2 O + 3 H 2 O + H 2 O Brucite Bernalite + 3 H 2 O Fe(OH)2 2 Al(OH)3 2 Na(OH) 2 B (OH)3 Idrossido di ferro Idrossido di alluminio Idrossido di sodio Gibsite Idrossido di boro

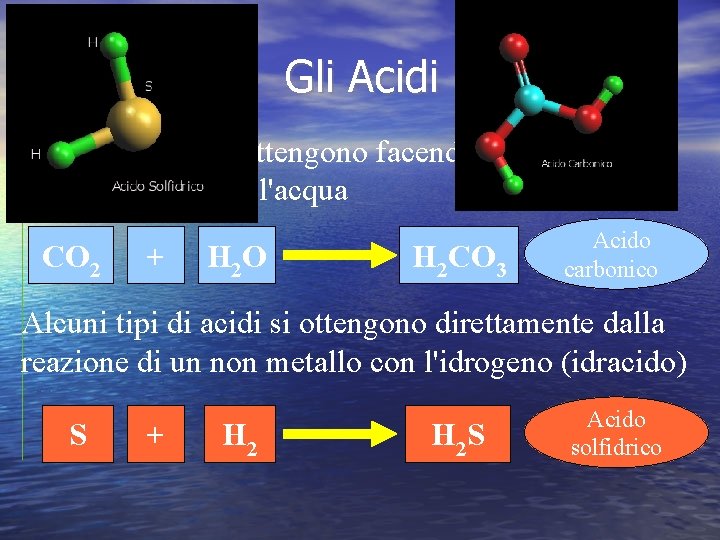
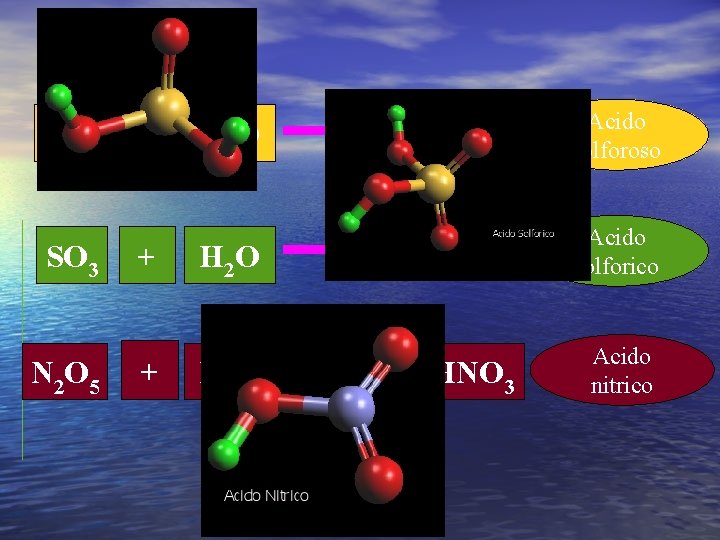
Gli Acidi Gli acidi si ottengono facendo reagire un anidride con l'acqua CO 2 + H 2 O H 2 CO 3 Acido carbonico Alcuni tipi di acidi si ottengono direttamente dalla reazione di un non metallo con l'idrogeno (idracido) S + H 2 S Acido solfidrico

SO 2 SO 3 N 2 O 5 + + + H 2 O H 2 SO 3 Acido solforoso H 2 SO 4 Acido solforico 2 HNO 3 Acido nitrico

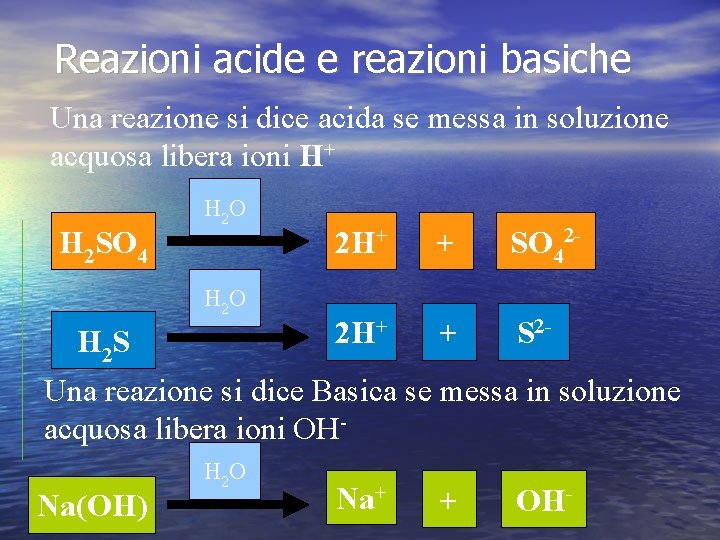
Reazioni acide e reazioni basiche Una reazione si dice acida se messa in soluzione acquosa libera ioni H+ H 2 SO 4 H 2 O H 2 S 2 H+ + SO 42 - 2 H+ + S 2 - Una reazione si dice Basica se messa in soluzione acquosa libera ioni OHNa(OH) H 2 O Na+ + OH-

I Sali I sali si ottengono facendo reagire un acido con una base Un sale si ottiene anche facendo reagire un metallo con l'acido base + acido = sale + acqua metallo + acido = sale + idrogeno

Halite + gesso Siderite + Ca. CO H 2 O Ca(OH)2 + H 2 CO 3 Ca(OH)2 + 2 HF Ca. F 2 + H 2 O Na. OH + HCl Na. Cl + H 2 O Fe + H 2 CO 3 Fe. CO 3 + H 2 3 Fluorite Calcite

Riassumiamo • calcio + ossigeno ossido di calcio • potassio + ossigeno ossido di potassio • Ossido di calcio + acqua idrossido di calcio • Ossido di potassio + acqua idrossido di potassio • Carbonio + ossigeno anidride carbonica • Zolfo +6 + ossigeno –> anidride solforica • Anidride carbonica + acqua acido carbonico • Anidride solforica + acqua acido solforico • Acido cloridrico + idrossido di sodio cloruro di sodio + acqua • Acido solforico + idrossido di calcio solfato di calcio + acqua

Acidi basi e sapore • Molte sostanze che a noi piacciono sono acide (limonata, aranciata, coca – cola) • Normalmente noi riconosciamo le sostanze acide dal sapore aspro • Non sono molti gli alimenti basici, un esempio è il caffè che e amaro • L’acqua che non ha sapore è neutra H 2 O H+ + OH- Una soluzione si dice neutra se libera esattamente lo stesso numero di ioni H+ e OH-

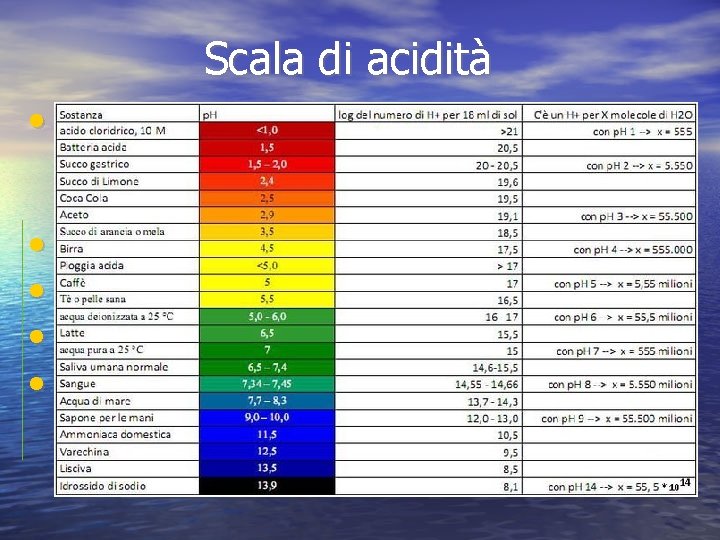
Scala di acidità • La scala di acidità (p. H) va da 0 a 14 a seconda del grado di acidità o basicità di una soluzione • Per p. H < 7 la soluzione è acida • Per p. H = 7 la soluzione è neutra • Per p. H > 7 la soluzione è basica • Per sapere se una soluzione è acida o basica si usano gli indicatori (cartine di tornasole)

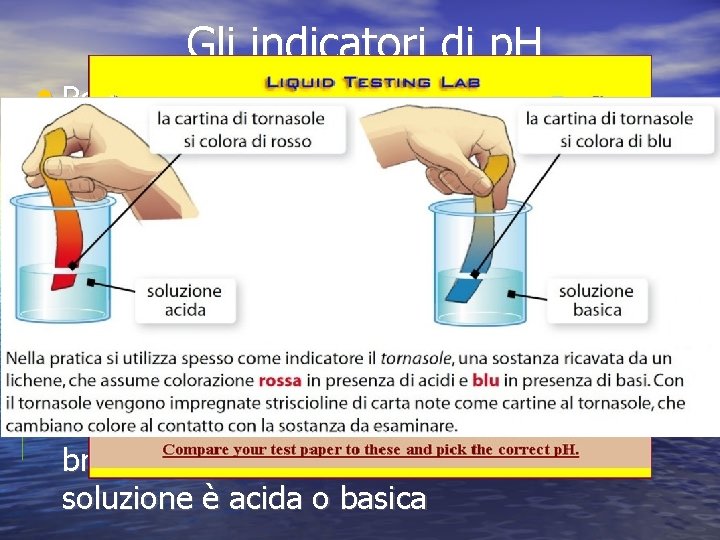
Gli indicatori di p. H • Per sapere il p. H di una soluzione si usano gli indicatori universali che è una cartina in grado di cambiare colore quando viene a contatto con una soluzione • Si bagna la cartina, si fa asciugare, poi si confronta il colore ottenuto con una scala cromatica e si stabilisce il valore del p. H • Altri tipi di indicatori come la cartina di tornasole, il metilarancio e il blu di bromotimolo ci dicono solo se una soluzione è acida o basica
 Classificazione dei composti chimici inorganici
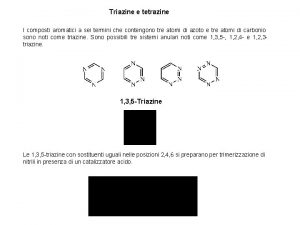
Classificazione dei composti chimici inorganici Trimerizzazione
Trimerizzazione Proteine funzioni
Proteine funzioni Nh5 nomenclatura
Nh5 nomenclatura Nomenclatura mappa concettuale
Nomenclatura mappa concettuale Classificazione composti chimici
Classificazione composti chimici Valenza
Valenza Mappa concettuale nomenclatura chimica
Mappa concettuale nomenclatura chimica Mappa concettuale legami chimici
Mappa concettuale legami chimici Elementi e composti scuola primaria
Elementi e composti scuola primaria Leganti chimica
Leganti chimica Elementi costitutivi del testo narrativo
Elementi costitutivi del testo narrativo Quali sono gli elementi fondamentali dello stato
Quali sono gli elementi fondamentali dello stato Gli elementi filler cream
Gli elementi filler cream Gli elementi della comunicazione
Gli elementi della comunicazione Elementi fondamentali dello stato
Elementi fondamentali dello stato Personaggi della fiaba
Personaggi della fiaba Quali fattori influenzano il clima
Quali fattori influenzano il clima