CROMO n o 2 3 6 n o







- Slides: 12

CROMO n. o. +2, +3, +6 n. o +2 Cr. O, monossido di cromo (IUPAC) o ossido cromoso (tradiz. ) ossido basico n. o. +3 Cr 2 O 3, triossido di dicromo (IUPAC) o ossido cromico (tradiz. ) ossido anfotero n. o. +6 Cr. O 3, triossido di cromo (IUPAC) o anidride cromica(tradiz) ossido acido o anidride MANGANESE (Mn) n. o. +2, +3, +4, +6, +7 n. o. +2 e +3 Mn. O monossido di manganese (IUPAC) ossido manganoso (tradiz. ) Mn 2 O 3 triossido di dimanganese (IUPAC) ossido manganico (tradiz. ) ossidi basici n. o. +4 Mn. O 2 diossido di manganese anfotero n. o. +6 e +7 Mn. O 3 triossido di manganese (IUPAC) anidride manganica (tradiz. ) ossidi acidi o anidridi Mn 2 O 7 eptossido di dimanganese (IUPAC) anidride permanganica (tradiz. )

IDRURI idrogeno + metallo o non metallo (- alogeni e zolfo) idruri ionici Li. H, Na. H, idruro di litio idruro di sodio Ca. H 2 idruro di calcio (diidruro di calcio) idruri covalenti (dal IV gruppo in poi) CH 4 NH 3 Si. H 4 PH 3 metano ammoniaca silano fosfina (tetraidruro di carbonio) (triidruro di azoto) (tetraidruro di silicio) (triidruro di fosforo)

IDRACIDI Non metallo (VII gruppo + zolfo) + idrogeno Idrogeno scritto a sn dell’altro elemento (che è meno elettronegativo) n. o. H 2 +1. nomenclatura tradizionale acido + nome del non metallo-idrico (es HCl acido cloridrico) IUPAC HCl HBr, HI, HF, H 2 S non metallo-uro + di idrogeno es. (es. HCl cloruro di idrogeno)

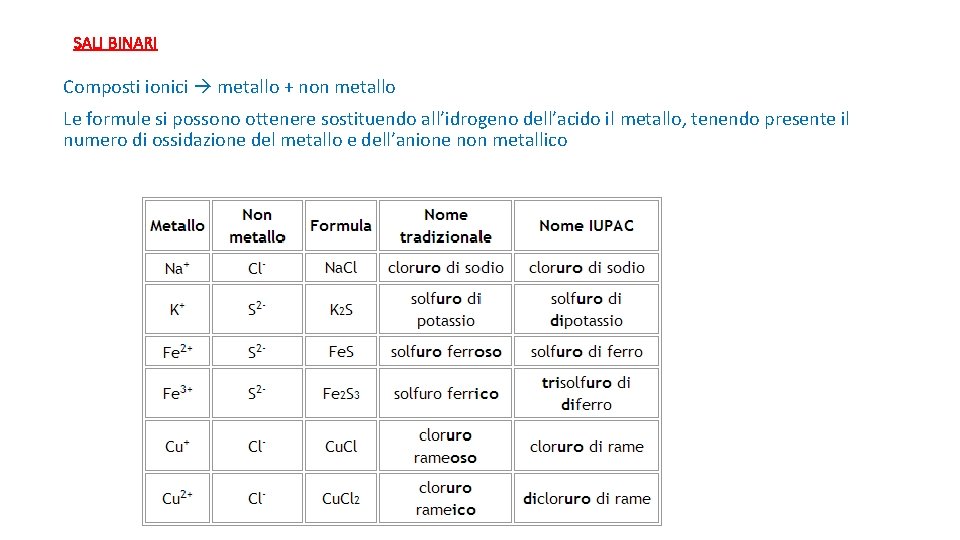
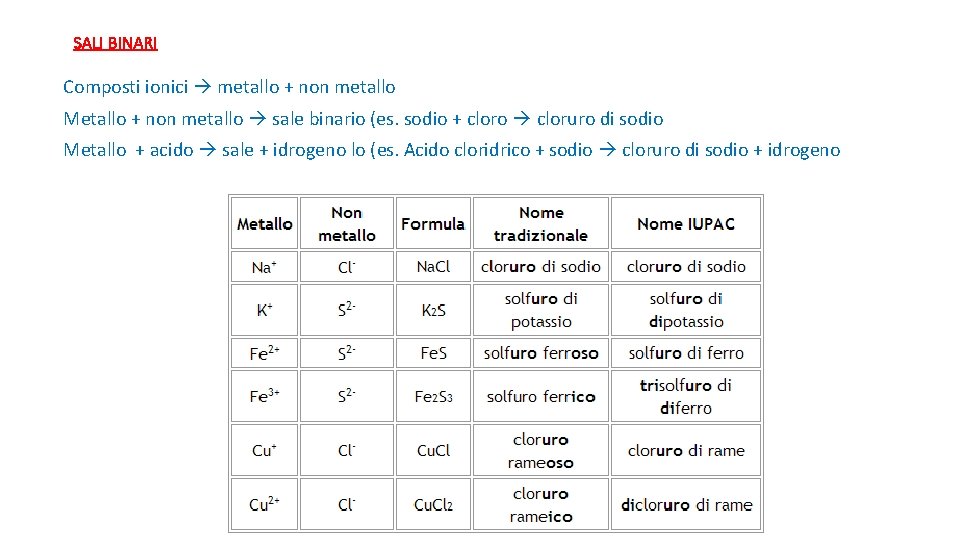
SALI BINARI Composti ionici metallo + non metallo Le formule si possono ottenere sostituendo all’idrogeno dell’acido il metallo, tenendo presente il numero di ossidazione del metallo e dell’anione non metallico

SALI BINARI Composti ionici metallo + non metallo Metallo + non metallo sale binario (es. sodio + cloro cloruro di sodio Metallo + acido sale + idrogeno lo (es. Acido cloridrico + sodio cloruro di sodio + idrogeno

Idrossidi Composti ternari di natura ionica formati da un metallo, ossigeno e idrogeno. si possono anche definire composti formati da un metallo e ioni OH (ioni idrossido) che avendo globalmente carica negativa 1−, hanno n. o. − 1. Nelle formule, il gruppo OH va considerato come se fosse un atomo solo e quando deve essere preso due o tre volte va scritto tra parentesi con l’indice numerico in basso a destra. Le formule degli idrossidi si scrivono secondo lo schema: Me−(OH)n. o. (dove n. o. è il numero di ossidazione del metallo; Nomenclatura: idrossido di + nome metallo Nella IUPAC va eventualmente aggiunto il prefisso di- o tri- (diidrossido o triidrossido). Ossido + H 2 O idrossido Na 2 O + H 2 O 2 Na. OH Ca. O + H 2 O Ca(OH)2 Al 2 O 3 + 3 H 2 O 2 Al(OH)3

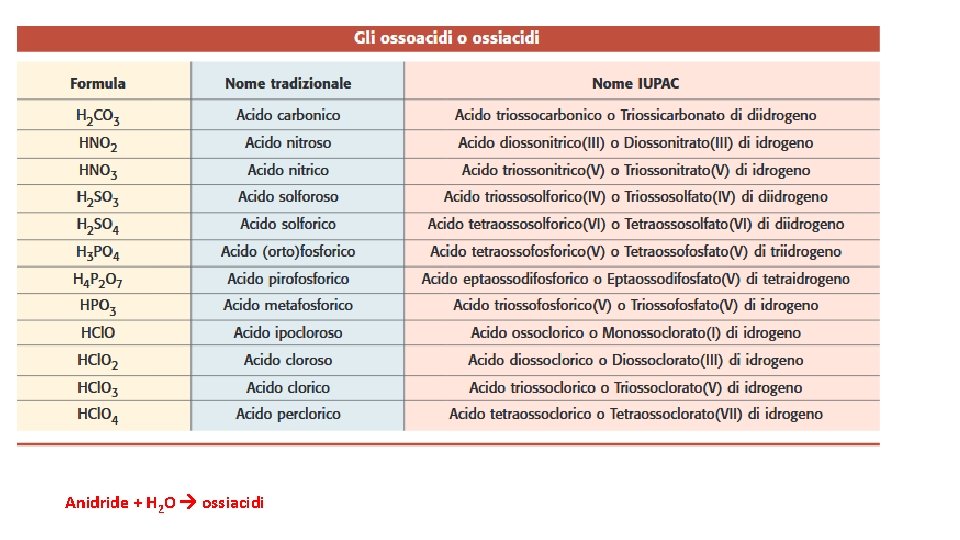
OSSIACIDI Composti ternari formati da: idrogeno, non metallo (oppure da un metallo il cui ossido abbia proprietà acide, per esempio: Cr, Mn), ossigeno Le formule degli ossiacidi si scrivono secondo lo schema: HXO idrogeno + non metallo + ossigeno nomenclatura tradizionale: suffissi –oso (n. o. + basso) e –ico (n. o. + alto) e, quando necessario, dei prefissi ipo- e per- come per le anidridi Es H 2 SO 4 acido solforico, HCl. O acido ipocloroso IUPAC: si «costruisce» il nome (acido di. . ) partendo dall’ossigeno, indicando con osso-, diosso-, triossoo tetraosso- la presenza nella formula rispettivamente di 1, 2, 3 o 4 atomi di ossigeno; segue poi il nome del non metallo con la desinenza “-ico” Es H 2 SO 4 acido tetraosso -solforico. In alternativa, si può utilizzare il nome dell’anione (come si fa per i sali ternari, descritti più avanti), seguito da “di idrogeno”, “di diidrogeno”, “di triidrogeno”, “di tetraidrogeno”, a seconda del numero di atomi di idrogeno presenti.

Anidride + H 2 O ossiacidi

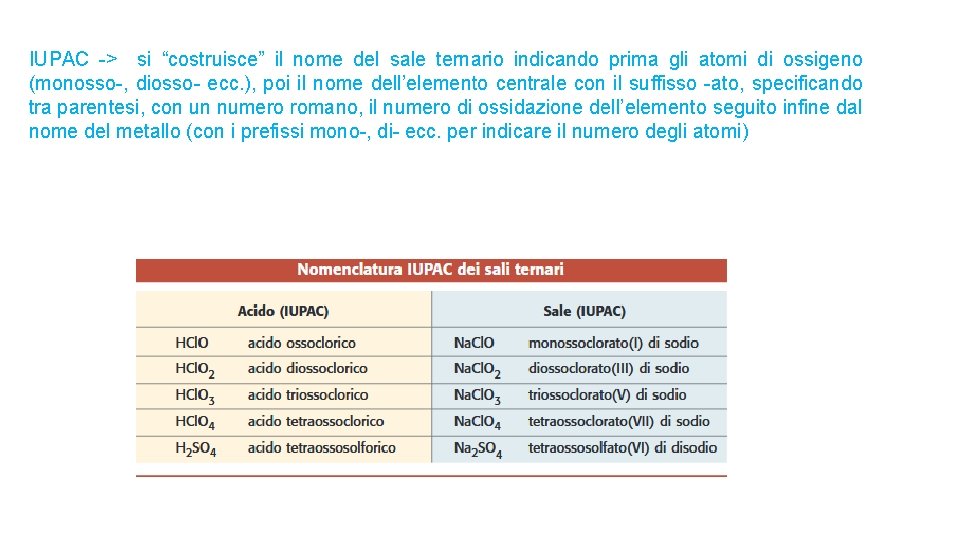
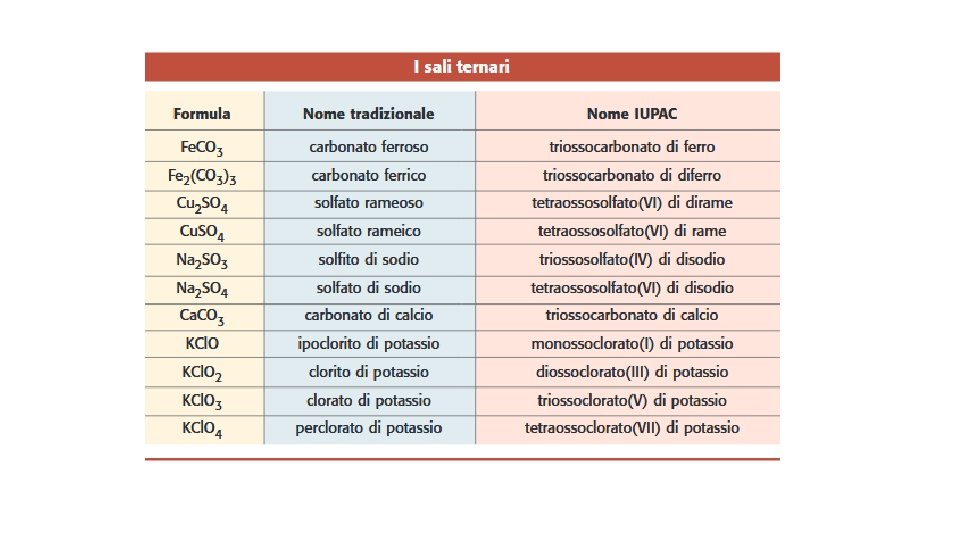
SALI TERNARI Composti ionici formati da metallo, non metallo e ossigeno derivano dalla reazione tra un idrossido e un acido ternario (ossiacido): idrossido + acido sale + acqua Esempio: 2 Na. OH + H 2 SO 4 Na 2 SO 4+ 2 H 2 O Le formule dei sali ternari si ottengono, come per i sali binari, mettendo il metallo al posto dell’idrogeno, sempre seguendo le regole di concordanza dei n. o. Nomenclatura tradizionale: parte da quella degli acidi ternari le desinenze –oso e –ico diventano rispettivamente -ito e –ato , mentre eventuali prefissi si conservano invariati, da acido ipocloroso (HCl. O) da acido cloroso (HCl. O 2) da acido clorico(HCl. O 3) da acidoperclorico(HCl. O 4) Na. Cl. O sale: ipoclorito di sodio Na. Cl. O 2 sale: clorito di sodio Na. Cl. O 3 sale: clorato di sodio Na. Cl. O 4 sale: perclorato di sodio

IUPAC -> si “costruisce” il nome del sale ternario indicando prima gli atomi di ossigeno (monosso-, diosso- ecc. ), poi il nome dell’elemento centrale con il suffisso -ato, specificando tra parentesi, con un numero romano, il numero di ossidazione dell’elemento seguito infine dal nome del metallo (con i prefissi mono-, di- ecc. per indicare il numero degli atomi)


ESERCIZI - Scrivi le formule brute dei seguenti composti: cloruro di sodio; acido solforoso; idrossido stannico; ipoclorito di calcio; ioduro ferroso; ossido mercurico; anidride manganica; anidride cromica; acido nitrico; acido pirofosforico. - Attribuisci il nome tradizionale e IUPAC a ciascuno dei seguenti composti: Cu 2 O; Ba(NO 2)2; Na. Cl. O 4; Pb(OH)4; Zn. Cl 2. - Riscrivi e completa in formule, bilancia le seguenti equazioni di reazione: Na. OH + H 2 CO 3 Hg 2 O + HMn. O 4 idrossido d’alluminio + acido solforico ossido di potassio + anidride solforosa idrossido di litio + acido ortofosforico