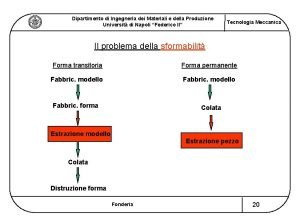
La struttura dei materiali Le propriet macroscopiche come











































- Slides: 134

La struttura dei materiali Le proprietà macroscopiche come effetto della struttura microscopica

Obiettivi • I diversi tipi di materiali hanno diverse proprietà (termiche, meccaniche, elettriche, ottiche etc) • Le diverse proprietà dei materiali (misurate su scala macroscopica) dipendono dalla struttura atomica o molecolare dei materiali stessi (analizzate su scala microscopica)

Legami atomici • Legami atomici primari: sono coinvolte forze interatomiche elevate – Legami ionici: uno o più elettroni vengono trasferiti da un atomo ad un altro per produrre ioni, legati tra di loro da forze coulombiane. E’ un legame non direzionale forte – Legami covalenti: elettroni vengono condivisi tra due atomi per formare un legame fortemente direzionale – Legami metallici: forze interatomiche sono generate dalla messa in comune di elettroni delocalizzati, a dare un legame non direzionale • Legami secondari: – A dipolo permanente: Legami deboli formati tra molecole che hanno dipoli (asimmetrie nella distribuzione di elettroni) permanenti – A dipolo fluttuante: Legami deboli formati tra molecole che hanno dipoli (asimmetrie nella distribuzione di elettroni) variabili nel tempo

Legame ionico • Il legame ionico si trova in molti composti inorganici ( Na. Cl, KCl, Ba. O) • Le molecole a legame ionico sono sempre eteronucleari, costituite da uno o più metalli (ioni positivi elettropositivi) e uno o più non metalli (ioni negativi elettronegativi) • Si formano quindi cationi carichi positivamente ed anioni carichi negativamente, che si attraggono attraverso forze di tipo coulombiano

Dimensione degli anioni • Nel sale l’atomo di sodio Na cede il suo elettrone 3 s 1 e lo trasferisce all’orbitale 3 p del Cl, che viene così saturato • Lo ione sodio Na+ ha perso un elettrone, il suo raggio diminuisce da 0. 192 nm a 0. 095 nm • Lo ione cloro aumenta il raggio (da 0. 099 a 0. 181 nm) • Gli anioni sono più grandi degli atomi neutri, mentre i cationi sono più piccoli • Dal momento che l’attrazione elettrostatica non dipende dall’orientamento, il legame non è direzionale • La disposizione degli ioni è governata dalla necessità di mantenere la distanza di equilibrio tra gli ioni e di mantenere la neutralità della carica

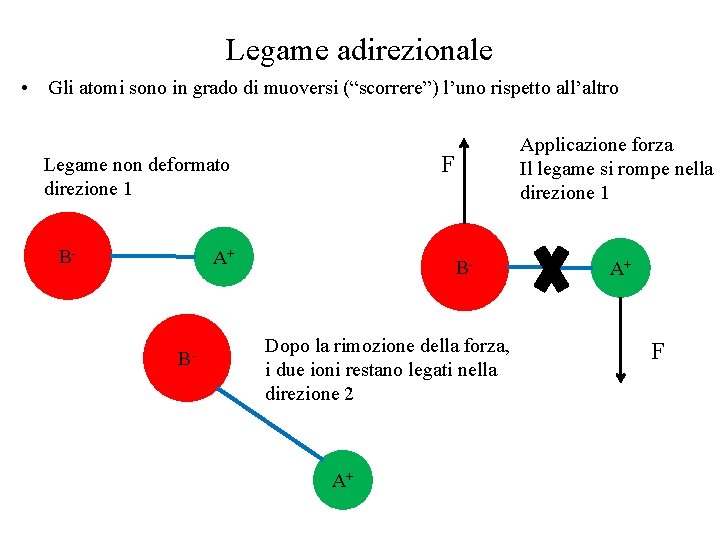
Legame adirezionale • Gli atomi sono in grado di muoversi (“scorrere”) l’uno rispetto all’altro F Legame non deformato direzione 1 B- A+ B- Applicazione forza Il legame si rompe nella direzione 1 B- Dopo la rimozione della forza, i due ioni restano legati nella direzione 2 A+ A+ F

Legame covalente • Il legame covalente si forma tra atomi aventi bassa differenza di elettronegatività • Gli atomi mettono in comune i loro elettroni esterni, appartenenti agli orbitali s e p, in modo che ciascun atomo raggiunga la stabilità riempiendo l’ultimo livello (cfr. gas nobile) • Nel legame covalente gli elettroni più esterni dell’atomo (elettroni di valenza) modificano la loro distribuzione di carica, che diventa massima nello spazio tra i due nuclei • Due elettroni di valenza di spin opposto si accoppiano e sovrappongono le loro funzioni d’onda

Legame tra atomi • Il numero di legami possibile per ogni atomo è pari al numero di elettroni di valenza • Solo elettroni atomici non accoppiati con spin opposto possono prendere parte ad un legame

Polarità del legame • In un legame covalente non polare gli elettroni sono condivisi in egual misura tra i due atomi • Gli elettroni si muovono attorno ai nuclei generando delle cariche temporanee positive e negative (ma integrate nel tempo le cariche sono nulle) • In un legame covalente polare un atomo ha maggiore capacità di attirare l’elettrone di legame verso il suo nucleo (maggiore elettronegatività) • In questo caso gli elettroni ruotano attorno ai due nuclei, ma sono per più tempo vicini all’atomo più elettronegativo • Questo genera una carica negativa vicino all’atomo più elettronegativo (ed una positiva sull’atomo meno elettronegativo)

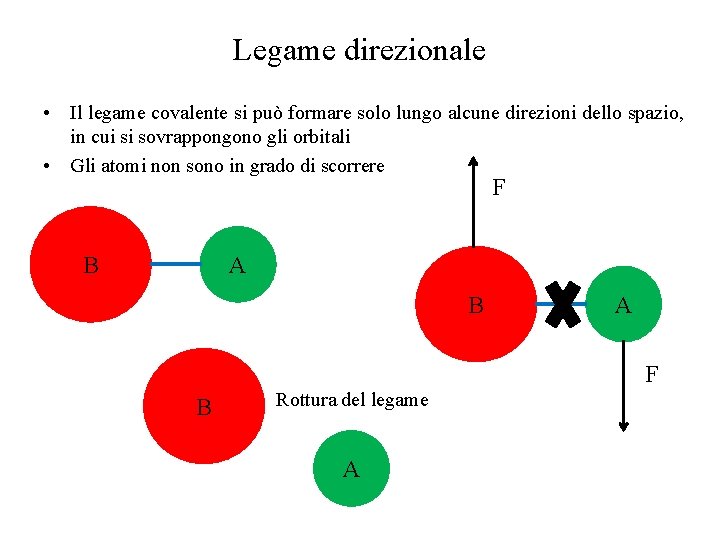
Legame direzionale • Il legame covalente si può formare solo lungo alcune direzioni dello spazio, in cui si sovrappongono gli orbitali • Gli atomi non sono in grado di scorrere F A B B A F B Rottura del legame A

Legami misti ionici-covalenti • L’energia di legame dei legami ionici è più alta dell’energia dei legami covalenti • La frazione di legame covalente fc dipende dalla differenza di elettronegatività E Eq. 2. 1 composto Tipo di legame Energia di legame (Kcal/mole) C (diamante) Covalente 170 Si Covalente 85 Li. F Ionico 245 Na. Cl Ionico 158 KCl Ionico 166 Mg. O Ionico 242

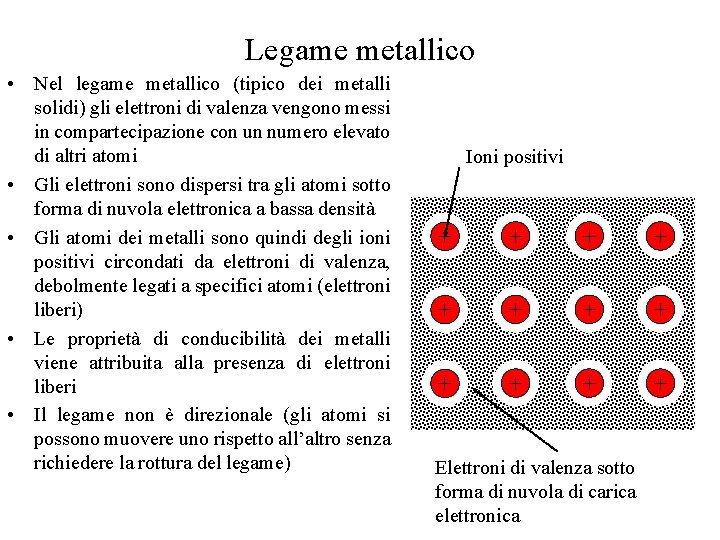
Legame metallico • Nel legame metallico (tipico dei metalli solidi) gli elettroni di valenza vengono messi in compartecipazione con un numero elevato di altri atomi • Gli elettroni sono dispersi tra gli atomi sotto forma di nuvola elettronica a bassa densità • Gli atomi dei metalli sono quindi degli ioni positivi circondati da elettroni di valenza, debolmente legati a specifici atomi (elettroni liberi) • Le proprietà di conducibilità dei metalli viene attribuita alla presenza di elettroni liberi • Il legame non è direzionale (gli atomi si possono muovere uno rispetto all’altro senza richiedere la rottura del legame) Ioni positivi + + + Elettroni di valenza sotto forma di nuvola di carica elettronica

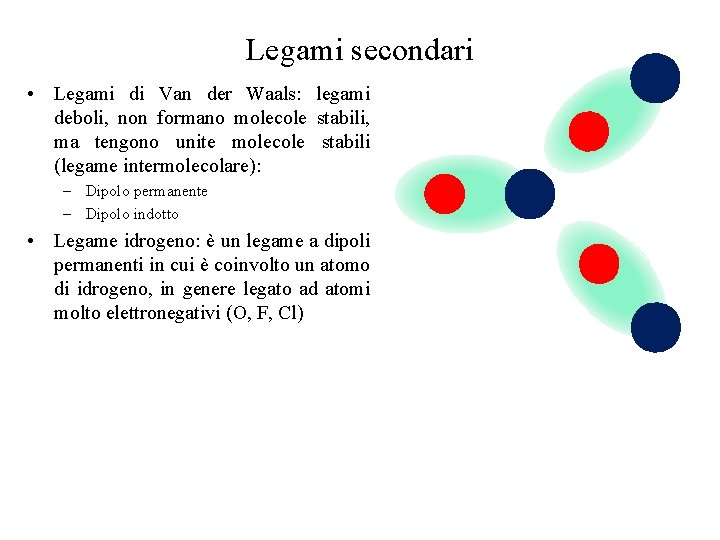
Legami secondari • Legami di Van der Waals: legami deboli, non formano molecole stabili, ma tengono unite molecole stabili (legame intermolecolare): – Dipolo permanente – Dipolo indotto • Legame idrogeno: è un legame a dipoli permanenti in cui è coinvolto un atomo di idrogeno, in genere legato ad atomi molto elettronegativi (O, F, Cl)

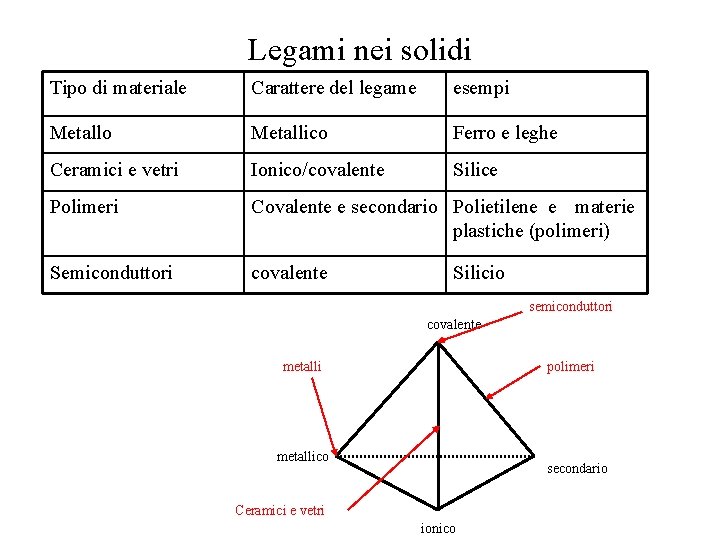
Legami nei solidi Tipo di materiale Carattere del legame esempi Metallo Metallico Ferro e leghe Ceramici e vetri Ionico/covalente Silice Polimeri Covalente e secondario Polietilene e materie plastiche (polimeri) Semiconduttori covalente Silicio semiconduttori covalente metalli polimeri metallico secondario Ceramici e vetri ionico

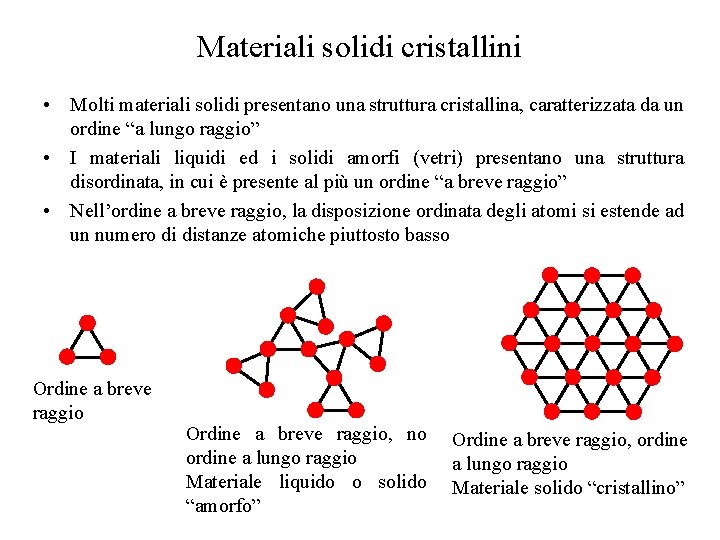
Materiali solidi cristallini • Molti materiali solidi presentano una struttura cristallina, caratterizzata da un ordine “a lungo raggio” • I materiali liquidi ed i solidi amorfi (vetri) presentano una struttura disordinata, in cui è presente al più un ordine “a breve raggio” • Nell’ordine a breve raggio, la disposizione ordinata degli atomi si estende ad un numero di distanze atomiche piuttosto basso Ordine a breve raggio, no ordine a lungo raggio Materiale liquido o solido “amorfo” Ordine a breve raggio, ordine a lungo raggio Materiale solido “cristallino”

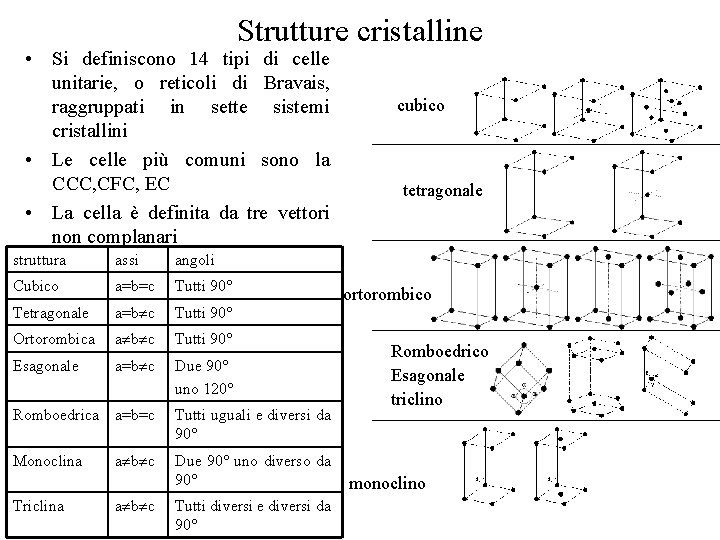
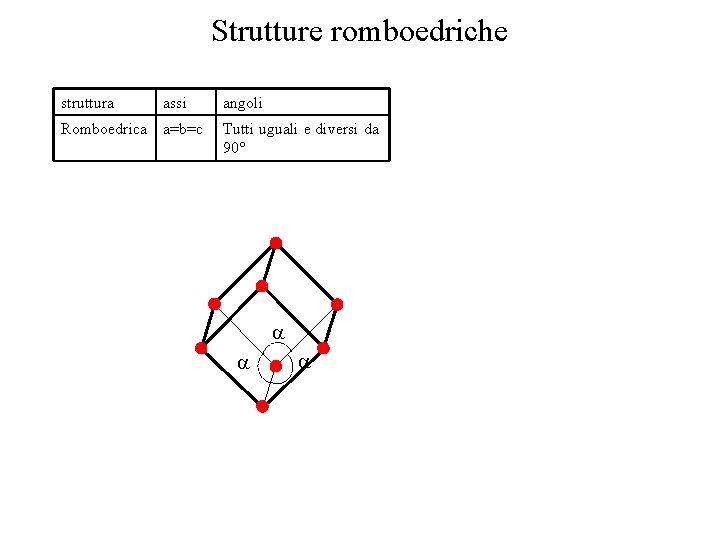
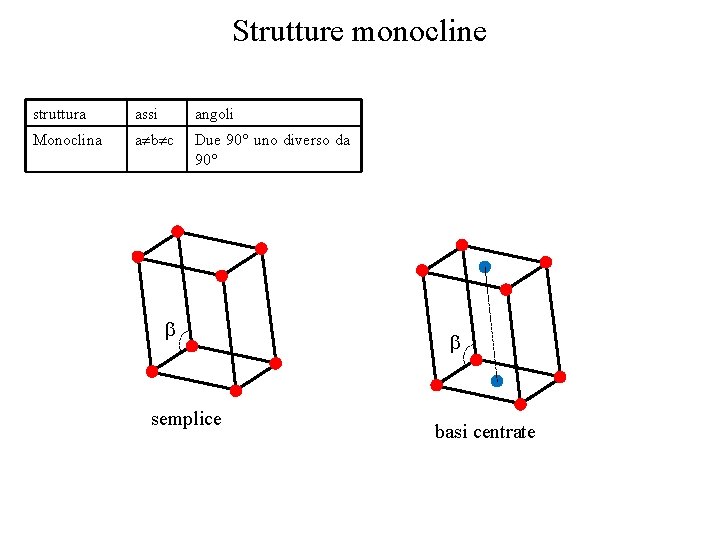
Strutture cristalline • Si definiscono 14 tipi di celle unitarie, o reticoli di Bravais, raggruppati in sette sistemi cristallini • Le celle più comuni sono la CCC, CFC, EC • La cella è definita da tre vettori non complanari struttura assi angoli Cubico a=b=c Tutti 90° Tetragonale a=b c Tutti 90° Ortorombica a b c Tutti 90° Esagonale a=b c Due 90° uno 120° Romboedrica a=b=c Tutti uguali e diversi da 90° Monoclina Due 90° uno diverso da 90° Triclina a b c Tutti diversi e diversi da 90° cubico tetragonale ortorombico Romboedrico Esagonale triclino monoclino

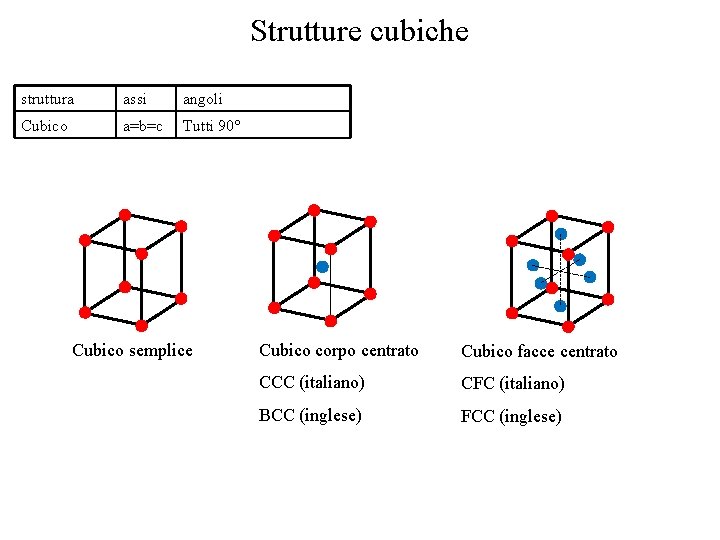
Strutture cubiche struttura assi angoli Cubico a=b=c Tutti 90° Cubico semplice Cubico corpo centrato Cubico facce centrato CCC (italiano) CFC (italiano) BCC (inglese) FCC (inglese)

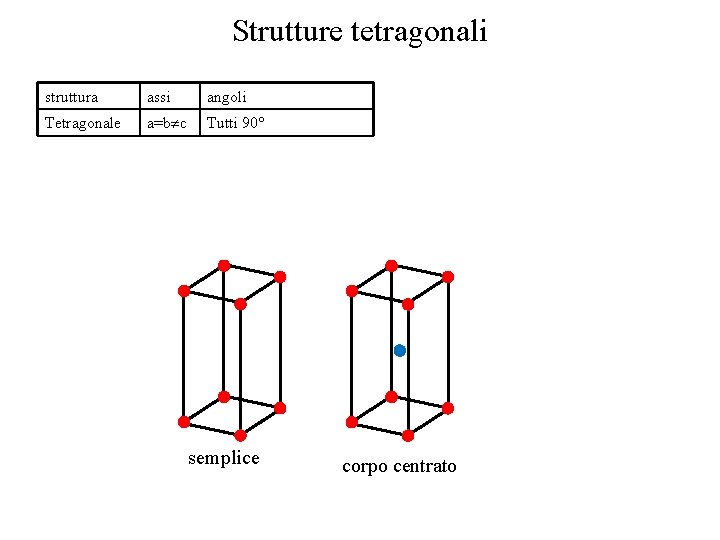
Strutture tetragonali struttura assi angoli Tetragonale a=b c Tutti 90° semplice corpo centrato

Strutture ortorombiche struttura assi angoli Ortorombica a b c Tutti 90° semplice corpo centrato basi centrate Facce centrate

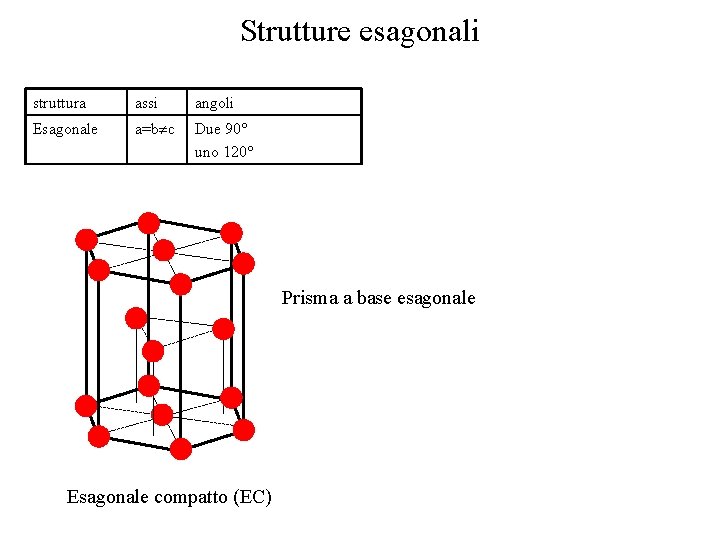
Strutture esagonali struttura assi angoli Esagonale a=b c Due 90° uno 120° Prisma a base esagonale Esagonale compatto (EC)

Strutture romboedriche struttura assi Romboedrica a=b=c angoli Tutti uguali e diversi da 90°

Strutture monocline struttura assi angoli Monoclina a b c Due 90° uno diverso da 90° semplice basi centrate

Strutture tricline struttura assi angoli Triclina a b c Tutti diversi e diversi da 90°

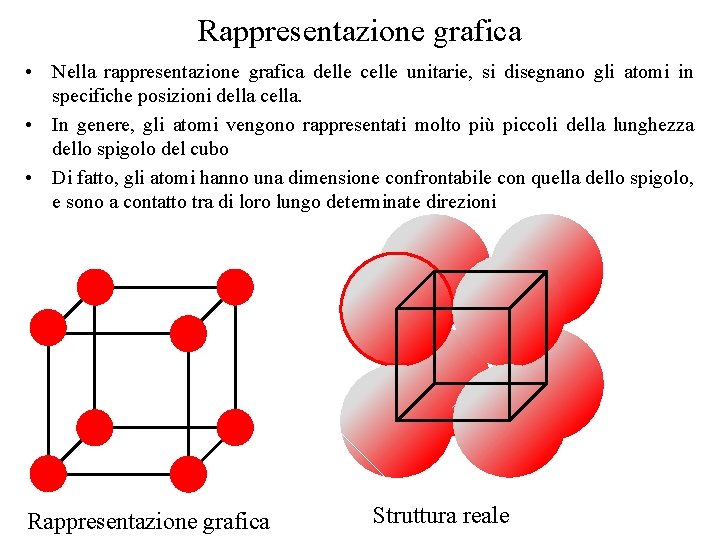
Rappresentazione grafica • Nella rappresentazione grafica delle celle unitarie, si disegnano gli atomi in specifiche posizioni della cella. • In genere, gli atomi vengono rappresentati molto più piccoli della lunghezza dello spigolo del cubo • Di fatto, gli atomi hanno una dimensione confrontabile con quella dello spigolo, e sono a contatto tra di loro lungo determinate direzioni Rappresentazione grafica Struttura reale

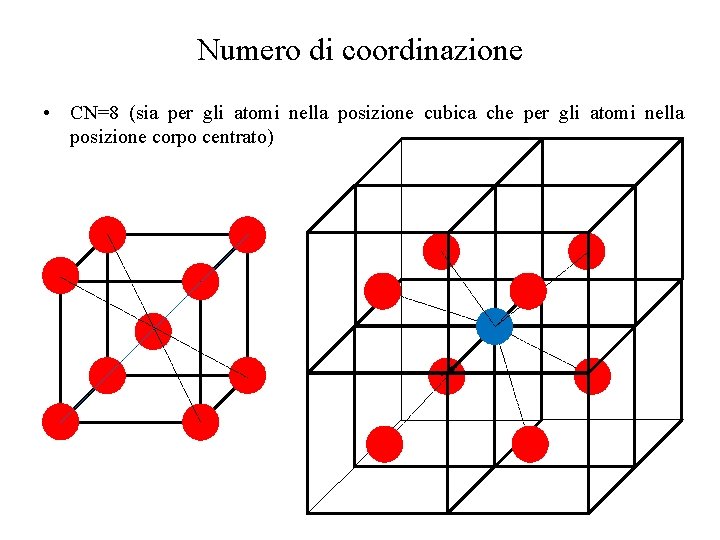
Proprietà delle celle • Fattore di impacchettamento FI Eq. 2. 2 • Numero di coordinazione CN: Numero di atomi che circonda ciascun atomo (tangenti al dato atomo) • Numero atomi per cella elementare: Numero di atomi “interi” contenuti all’interno della cella elementare – Gli atomi che appartengono a due celle diverse (al centro delle facce) contano per ½. – Gli atomi che appartengono a 4 celle diverse (centro degli spigoli in cella cubica) contano per ¼. – Gli atomi che si trovano sui vertici della cella (cubica) contano per ⅛.

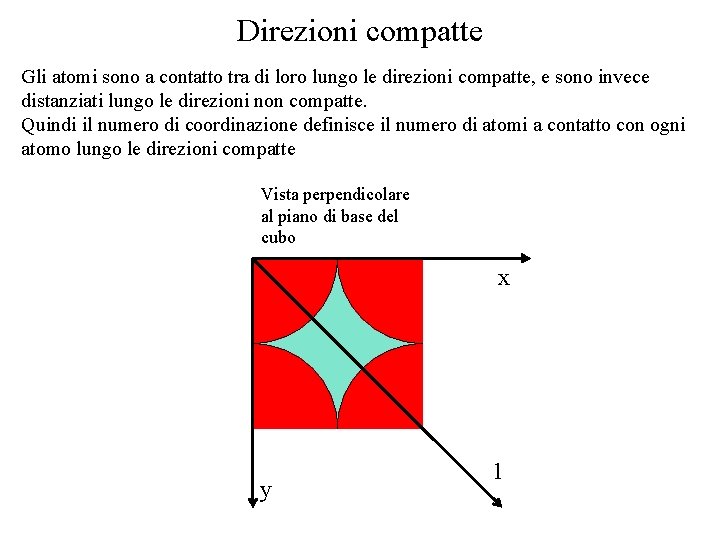
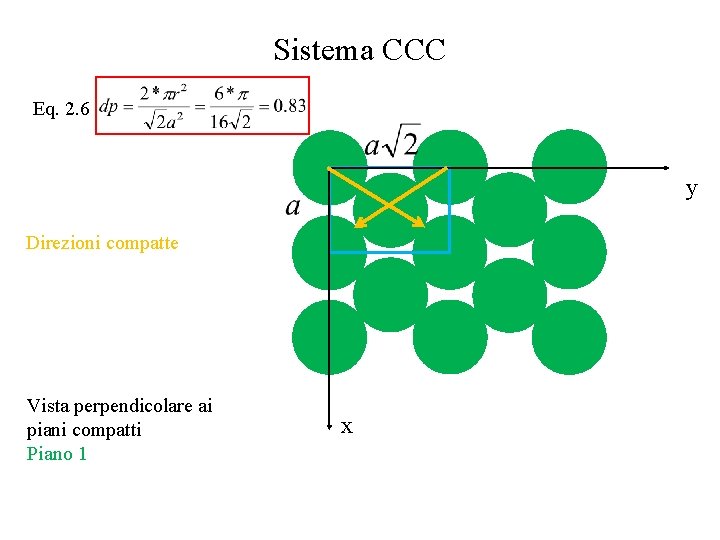
Piani e direzioni compatte • Esistono delle direzioni compatte, lungo le quali la densità lineare è massima ( e vale 1) • La densità lineare lungo una direzione è il rapporto fra la lunghezza occupata dagli atomi e la lunghezza totale della porzione di linea scelta per il calcolo • Esistono dei piani compatti, per i quali la densità planare è massima • La densità planare è il rapporto fra l’area occupata dagli atomi in tale piano e l’area totale del piano (o ad una sua porzione) Eq. 2. 3 Eq. 2. 4

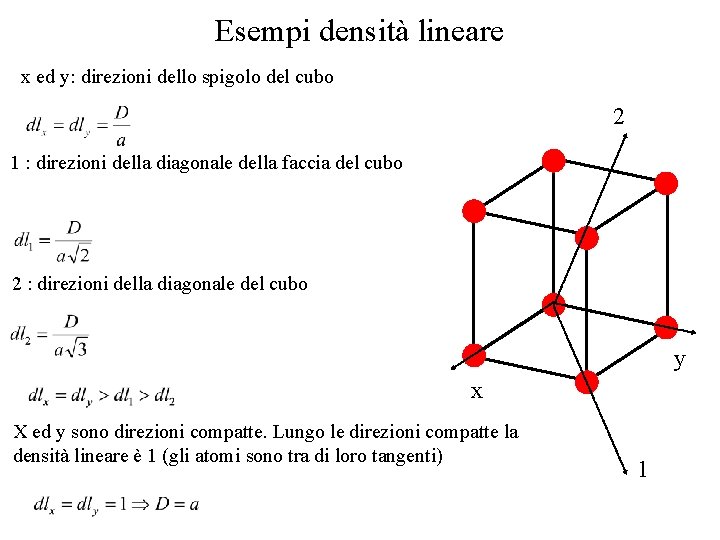
Esempi densità lineare x ed y: direzioni dello spigolo del cubo 2 1 : direzioni della diagonale della faccia del cubo 2 : direzioni della diagonale del cubo y x X ed y sono direzioni compatte. Lungo le direzioni compatte la densità lineare è 1 (gli atomi sono tra di loro tangenti) 1

Direzioni compatte Gli atomi sono a contatto tra di loro lungo le direzioni compatte, e sono invece distanziati lungo le direzioni non compatte. Quindi il numero di coordinazione definisce il numero di atomi a contatto con ogni atomo lungo le direzioni compatte Vista perpendicolare al piano di base del cubo x y 1

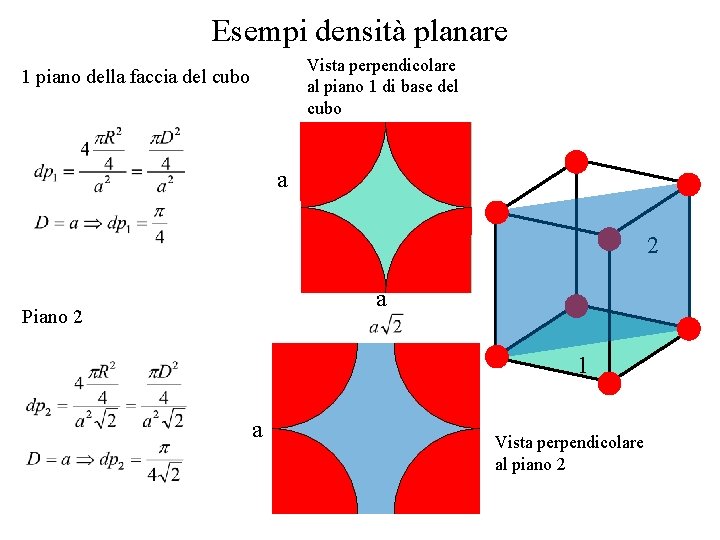
Esempi densità planare Vista perpendicolare al piano 1 di base del cubo 1 piano della faccia del cubo a 2 a Piano 2 1 a Vista perpendicolare al piano 2

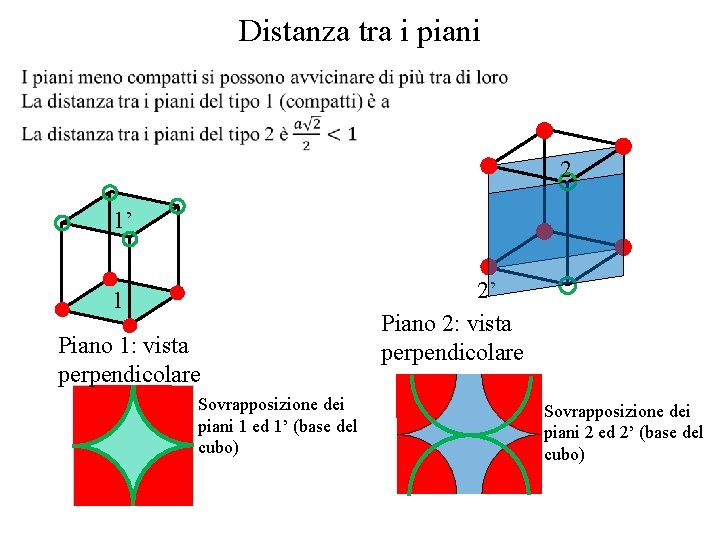
Distanza tra i piani 2 1’ 1 Piano 1: vista perpendicolare Sovrapposizione dei piani 1 ed 1’ (base del cubo) 2’ Piano 2: vista perpendicolare Sovrapposizione dei piani 2 ed 2’ (base del cubo)

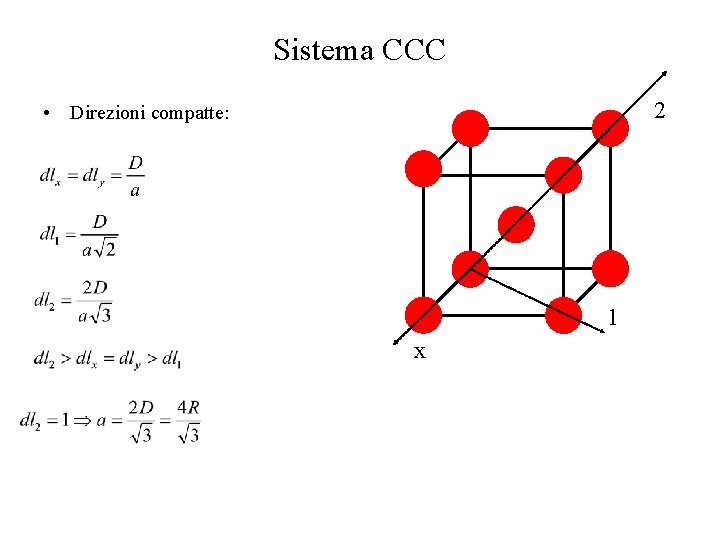
Sistema CCC 2 • Direzioni compatte: 1 x

Numero di coordinazione • CN=8 (sia per gli atomi nella posizione cubica che per gli atomi nella posizione corpo centrato)

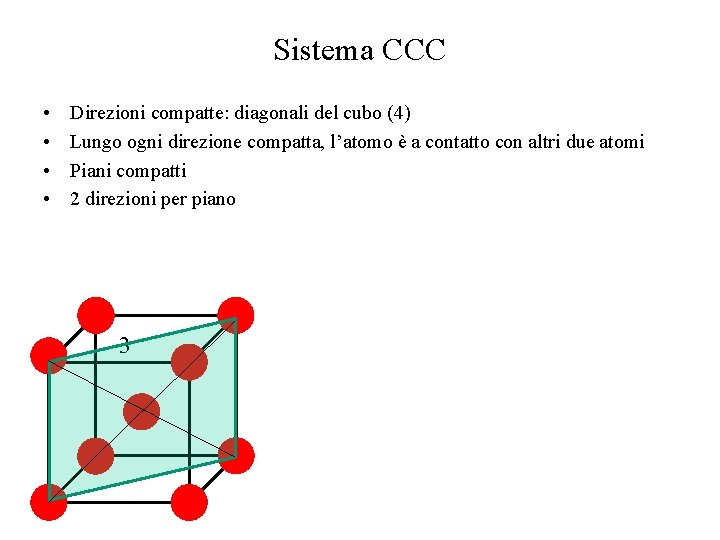
Sistema CCC • • Direzioni compatte: diagonali del cubo (4) Lungo ogni direzione compatta, l’atomo è a contatto con altri due atomi Piani compatti 2 direzioni per piano 3

Sistema CCC-FI • Numero atomi per cella elementare N: Eq. 2. 5 3

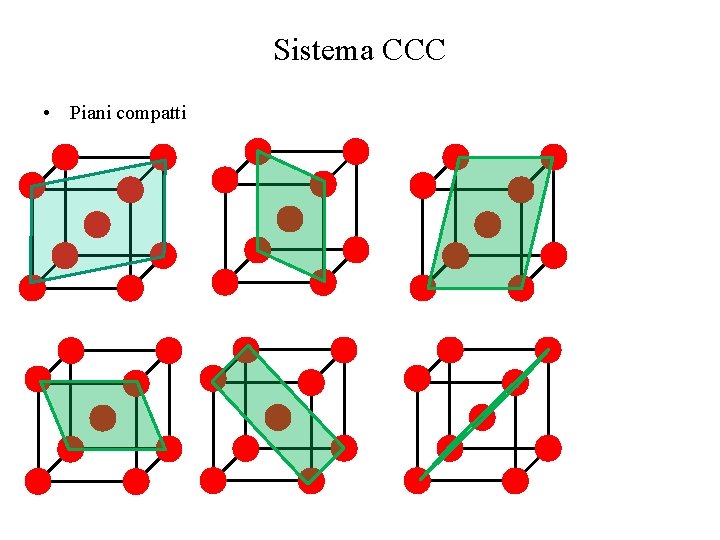
Sistema CCC • Piani compatti

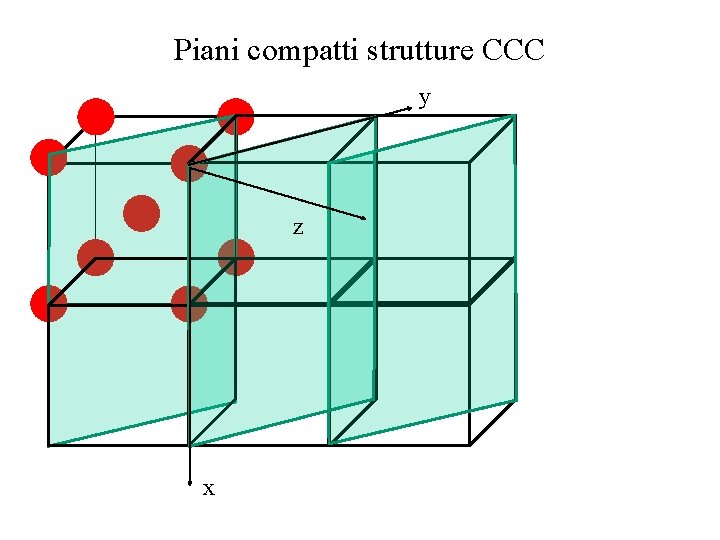
Piani compatti strutture CCC y z x

Sistema CCC Eq. 2. 6 y Direzioni compatte Vista perpendicolare ai piani compatti Piano 1 x

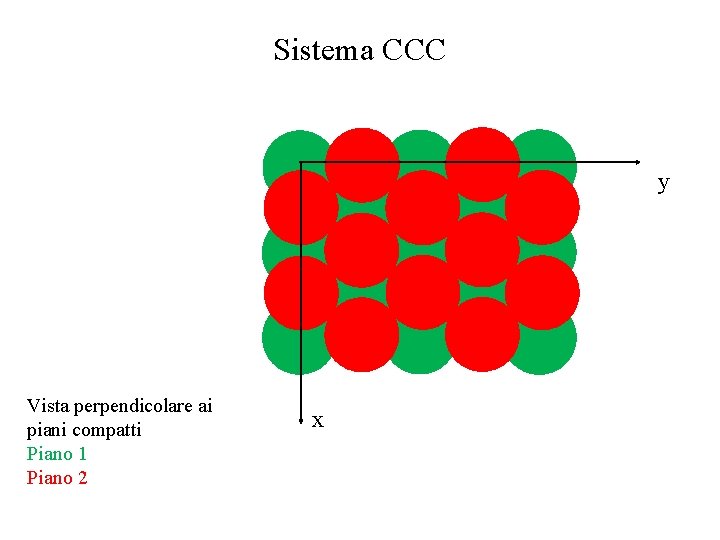
Sistema CCC y Vista perpendicolare ai piani compatti Piano 1 Piano 2 x

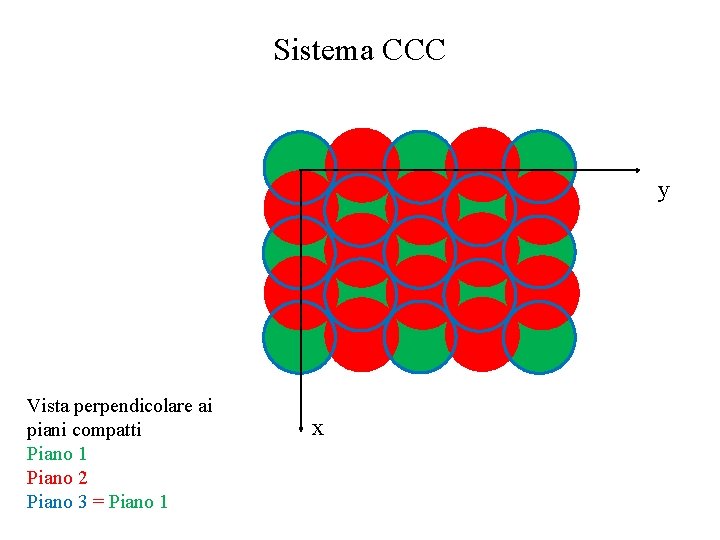
Sistema CCC y Vista perpendicolare ai piani compatti Piano 1 Piano 2 Piano 3 = Piano 1 x

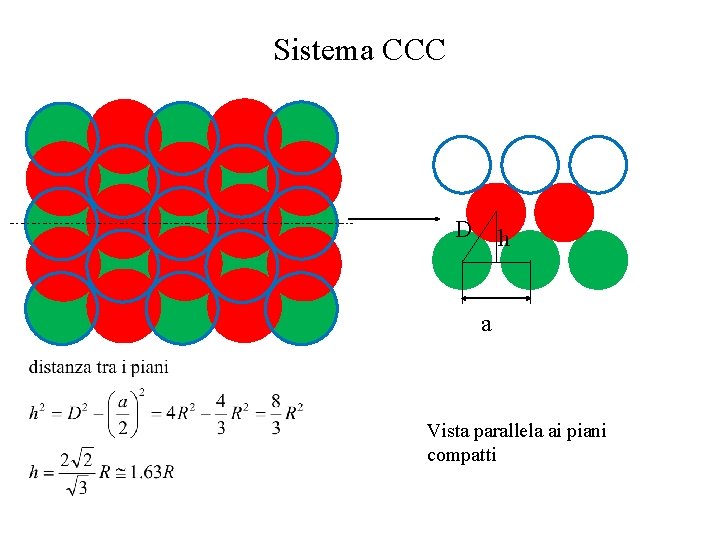
Sistema CCC D h a Vista parallela ai piani compatti

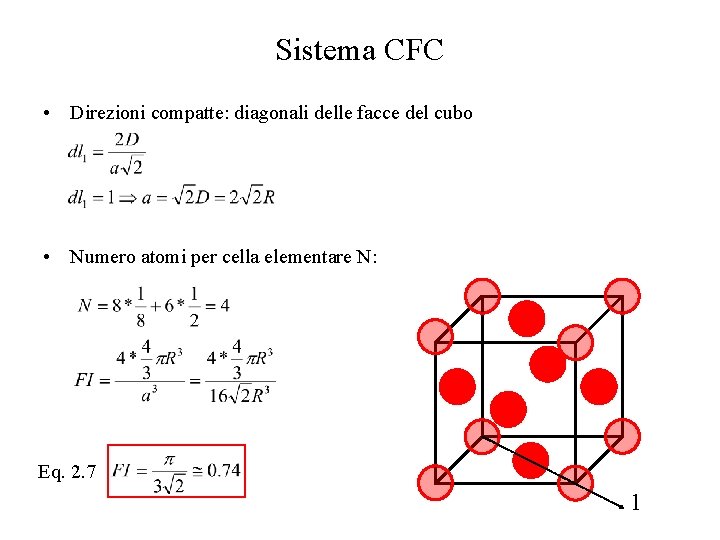
Sistema CFC • Direzioni compatte: diagonali delle facce del cubo • Numero atomi per cella elementare N: Eq. 2. 7 1

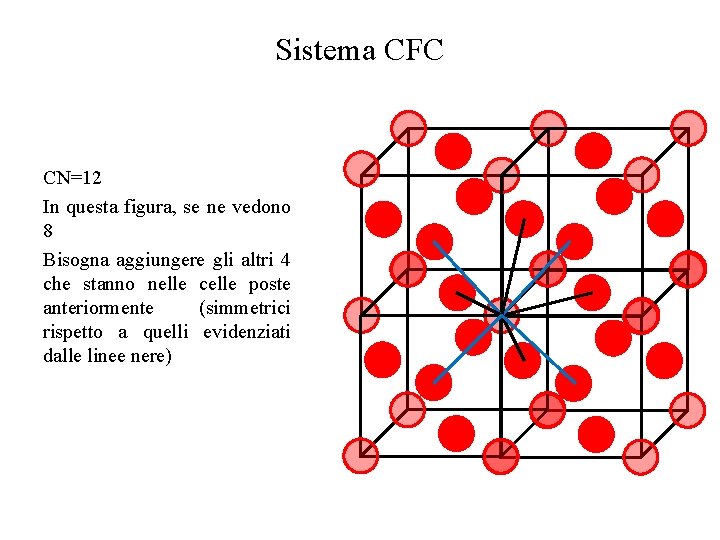
Sistema CFC CN=12 In questa figura, se ne vedono 8 Bisogna aggiungere gli altri 4 che stanno nelle celle poste anteriormente (simmetrici rispetto a quelli evidenziati dalle linee nere)

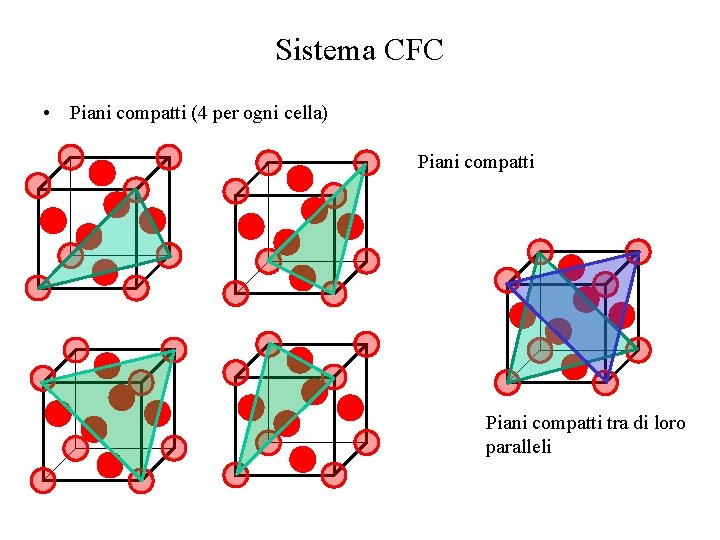
Sistema CFC • Piani compatti (4 per ogni cella) Piani compatti tra di loro paralleli

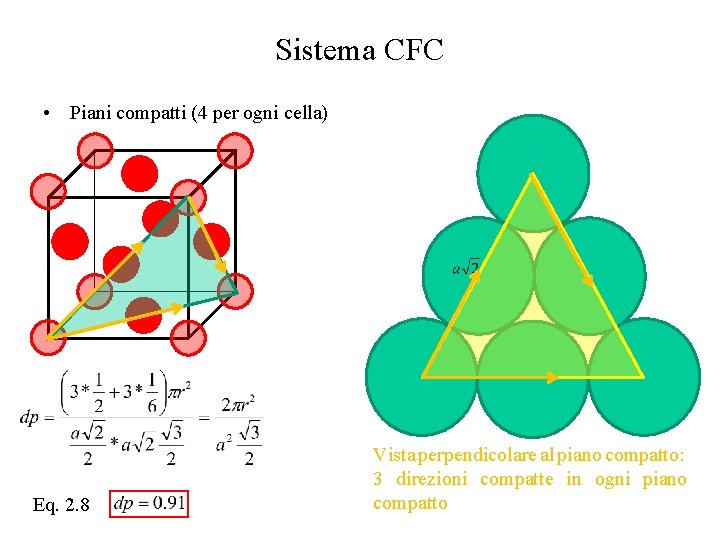
Sistema CFC • Piani compatti (4 per ogni cella) Eq. 2. 8 Vista perpendicolare al piano compatto: 3 direzioni compatte in ogni piano compatto

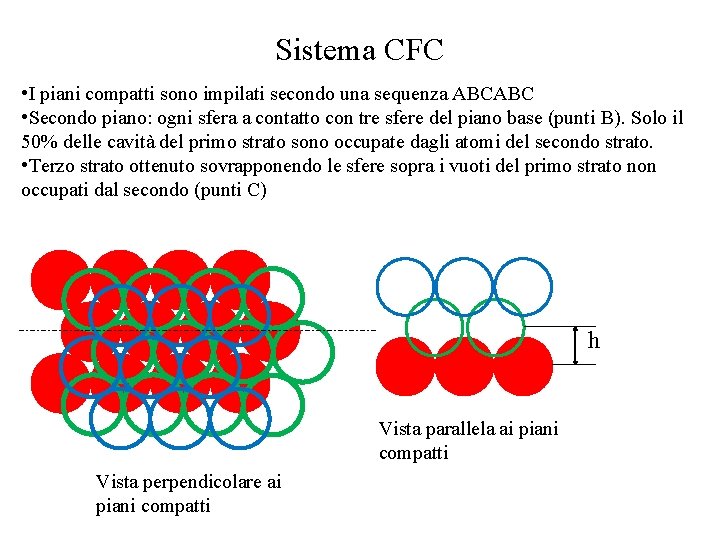
Sistema CFC • I piani compatti sono impilati secondo una sequenza ABCABC • Secondo piano: ogni sfera a contatto con tre sfere del piano base (punti B). Solo il 50% delle cavità del primo strato sono occupate dagli atomi del secondo strato. • Terzo strato ottenuto sovrapponendo le sfere sopra i vuoti del primo strato non occupati dal secondo (punti C) Vista perpendicolare ai piani compatti

Sistema CFC • I piani compatti sono impilati secondo una sequenza ABCABC • Secondo piano: ogni sfera a contatto con tre sfere del piano base (punti B). Solo il 50% delle cavità del primo strato sono occupate dagli atomi del secondo strato. • Terzo strato ottenuto sovrapponendo le sfere sopra i vuoti del primo strato non occupati dal secondo (punti C) Vista perpendicolare ai piani compatti

Sistema CFC • I piani compatti sono impilati secondo una sequenza ABCABC • Secondo piano: ogni sfera a contatto con tre sfere del piano base (punti B). Solo il 50% delle cavità del primo strato sono occupate dagli atomi del secondo strato. • Terzo strato ottenuto sovrapponendo le sfere sopra i vuoti del primo strato non occupati dal secondo (punti C) h Vista parallela ai piani compatti Vista perpendicolare ai piani compatti

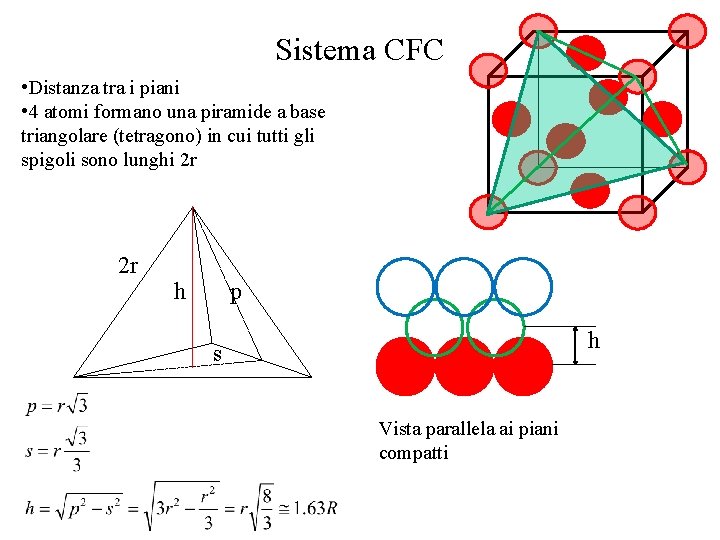
Sistema CFC • Distanza tra i piani • 4 atomi formano una piramide a base triangolare (tetragono) in cui tutti gli spigoli sono lunghi 2 r 2 r h p h s Vista parallela ai piani compatti

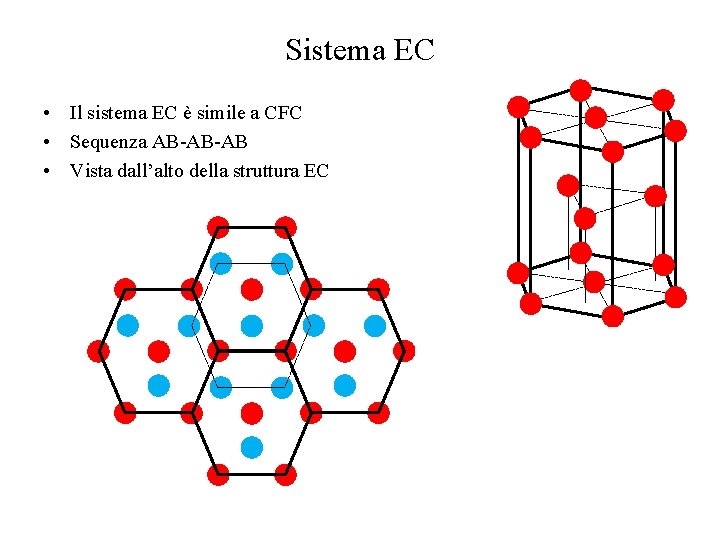
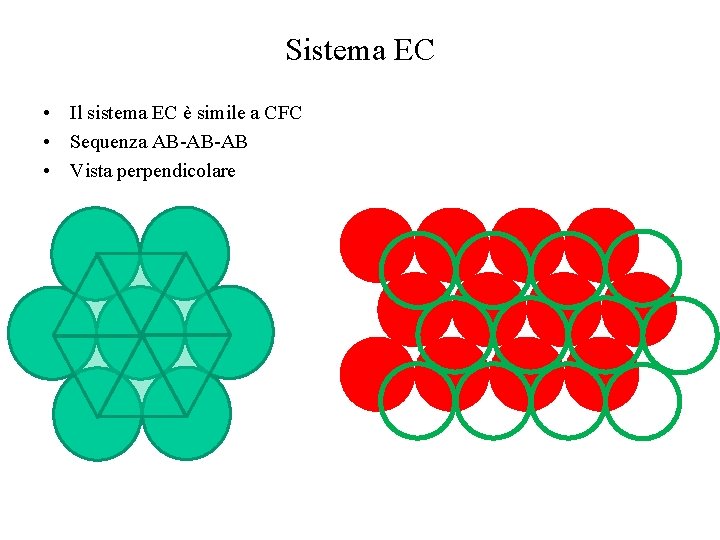
Sistema EC • Il sistema EC è simile a CFC • Sequenza AB-AB-AB • Vista dall’alto della struttura EC

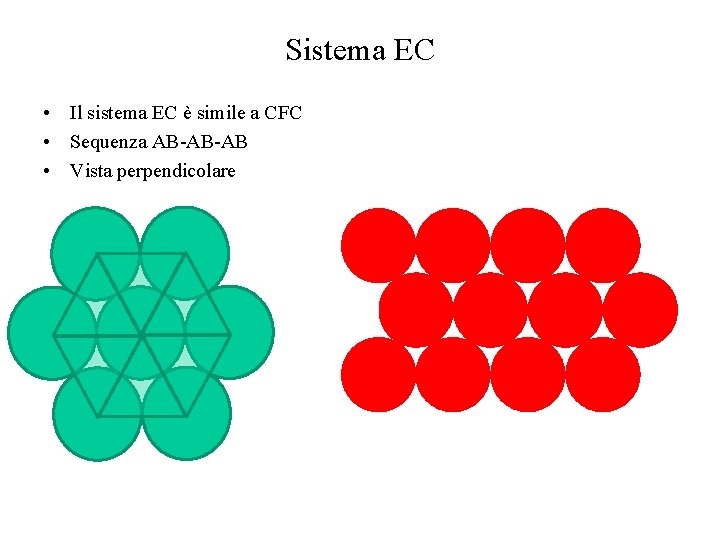
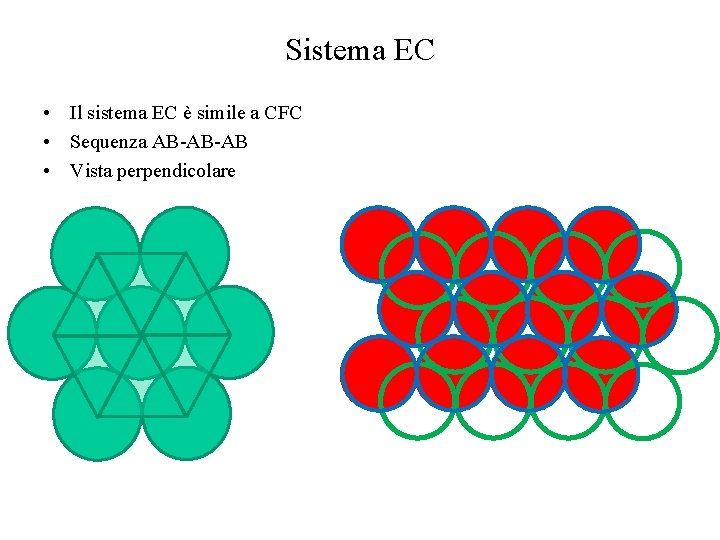
Sistema EC • Il sistema EC è simile a CFC • Sequenza AB-AB-AB • Vista perpendicolare

Sistema EC • Il sistema EC è simile a CFC • Sequenza AB-AB-AB • Vista perpendicolare

Sistema EC • Il sistema EC è simile a CFC • Sequenza AB-AB-AB • Vista perpendicolare

Differenze tra le strutture • Fattore di impacchettamento FI – CCC: FI=0. 68 – CFC e EC FI=0. 74 • Numero di coordinazione CN: Numero di atomi che circonda ciascun atomo • CCC: CN=8 • CFC e EC: CN=12

Polimorfismo • I materiali possono presentare più di una struttura, e cambiare la struttura in seguito a variazioni di temperatura o pressione • Questi materiali sono detti polimorfi o allotropici • Ghiaccio, silice, ferro sono materiali polimorfi • Anche il carbonio è polimorfo (diamante e grafite) fuso 1539°C 1394°C Ferrite (CCC) Austenite (CFC) 912°C Ferrite (CCC) Polimorfismo del ferro

Polimorfismo della silice • 1723°C: fusione della cristobalite • 1470 °C: cristobalite tridimite • 867 °C: • tridimite quarzo • trasformazioni che richiedono rottura di legami • forti variazioni volumetriche • trasformazioni lente, avvengono a temperature non ben definite • 573 °C: • Quarzo • richiede solo una leggera rotazione dei tetraedri • trasformazione rapida e reversibile 1723°C fusione Cristobalite (FCC) 1470°C Tridimite (EC) 867°C Quarzo (tetragonale) 573°C Quarzo (tetragonale) Polimorfismo dell’ossido di silicio

Trasformazioni polimorfiche • Se non varia la struttura cristallina le trasformazioni avvengono senza variazioni di volume • Se invece varia la struttura si osserveranno delle variazioni di densità • Fe CCC Fe CFC • M 0 massa non cambia • v 0 volume occupato non cambia

Posizioni interstiziali • Nei reticoli cristallini esistono delle posizioni interstiziali (spazi liberi in cui si possono sistemare atomi diversi da quelli del reticolo principale) • In queste posizioni si possono inserire degli atomi di dimensione minore rispetto all’atomo che costituisce il reticolo • La posizione che occupa l’atomo “ospite” dipende dal rapporto tra i raggi • L’atomo “ospite” deve stare a contatto con tutti gli atomi che circondano l’interstiziale • Do diametro dell’atomo ospite • Dp diametro della posizione intestiziale stabile instabile

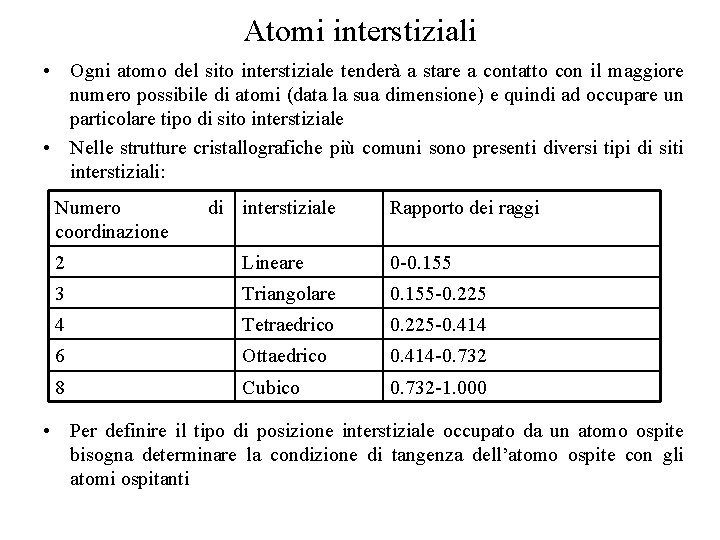
Atomi interstiziali • Ogni atomo del sito interstiziale tenderà a stare a contatto con il maggiore numero possibile di atomi (data la sua dimensione) e quindi ad occupare un particolare tipo di sito interstiziale • Nelle strutture cristallografiche più comuni sono presenti diversi tipi di siti interstiziali: Numero coordinazione di interstiziale Rapporto dei raggi 2 Lineare 0 -0. 155 3 Triangolare 0. 155 -0. 225 4 Tetraedrico 0. 225 -0. 414 6 Ottaedrico 0. 414 -0. 732 8 Cubico 0. 732 -1. 000 • Per definire il tipo di posizione interstiziale occupato da un atomo ospite bisogna determinare la condizione di tangenza dell’atomo ospite con gli atomi ospitanti

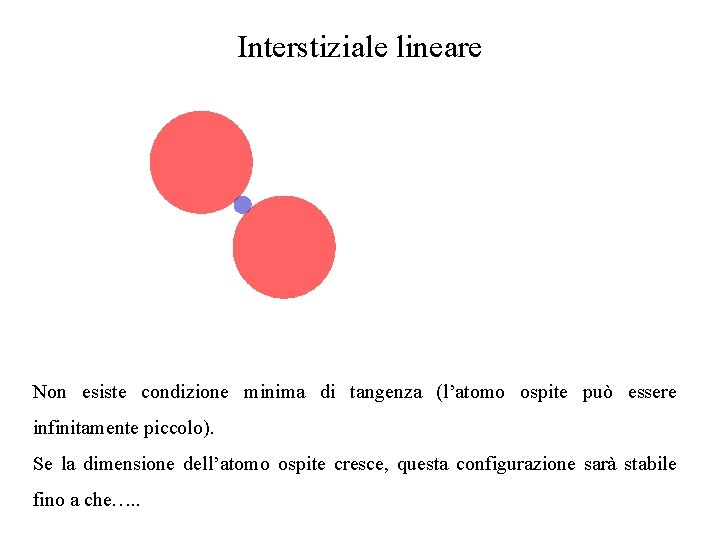
Interstiziale lineare Non esiste condizione minima di tangenza (l’atomo ospite può essere infinitamente piccolo). Se la dimensione dell’atomo ospite cresce, questa configurazione sarà stabile fino a che…. .

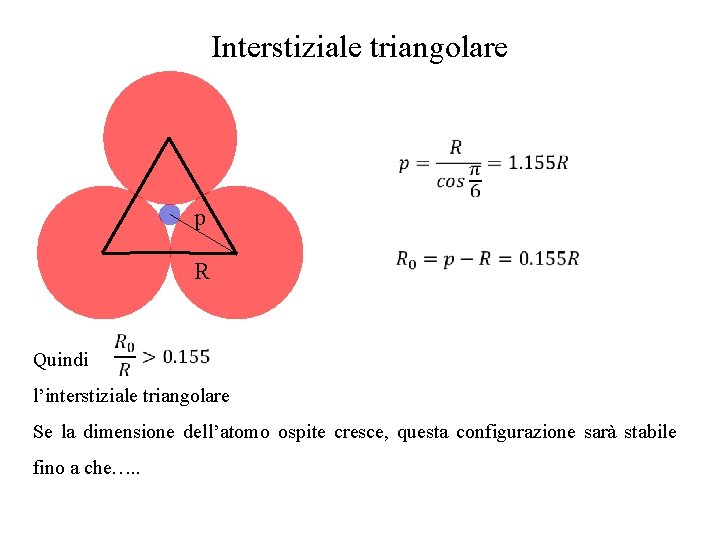
Interstiziale triangolare p R Quindi l’interstiziale triangolare Se la dimensione dell’atomo ospite cresce, questa configurazione sarà stabile fino a che…. .

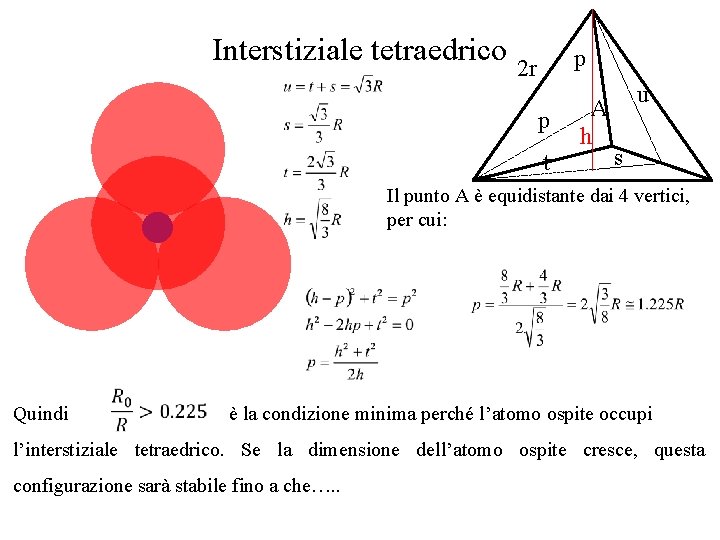
Interstiziale tetraedrico p 2 r p t A h u s Il punto A è equidistante dai 4 vertici, per cui: Quindi è la condizione minima perché l’atomo ospite occupi l’interstiziale tetraedrico. Se la dimensione dell’atomo ospite cresce, questa configurazione sarà stabile fino a che…. .

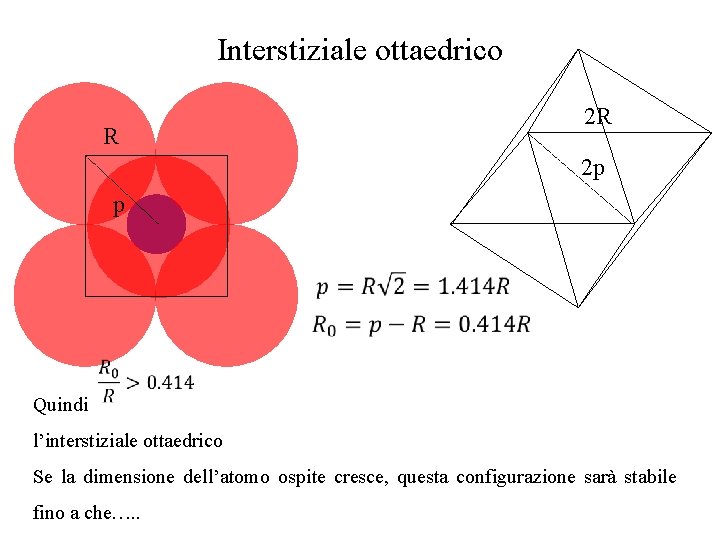
Interstiziale ottaedrico R 2 R 2 p p Quindi l’interstiziale ottaedrico Se la dimensione dell’atomo ospite cresce, questa configurazione sarà stabile fino a che…. .

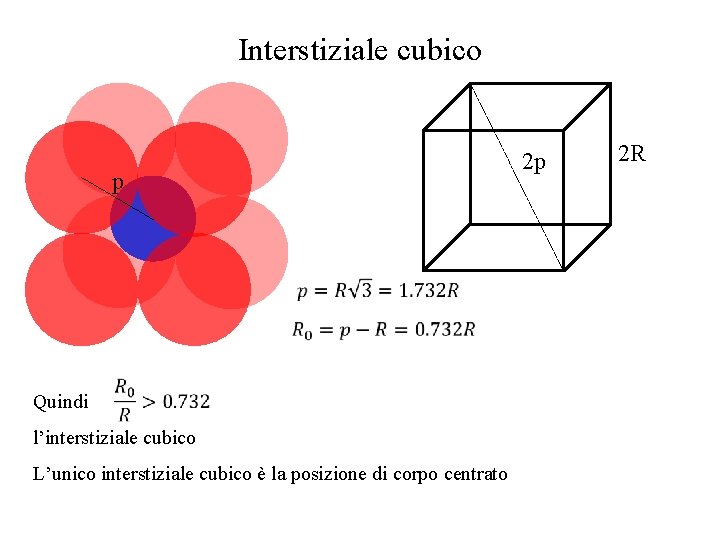
Interstiziale cubico p Quindi l’interstiziale cubico L’unico interstiziale cubico è la posizione di corpo centrato 2 p 2 R

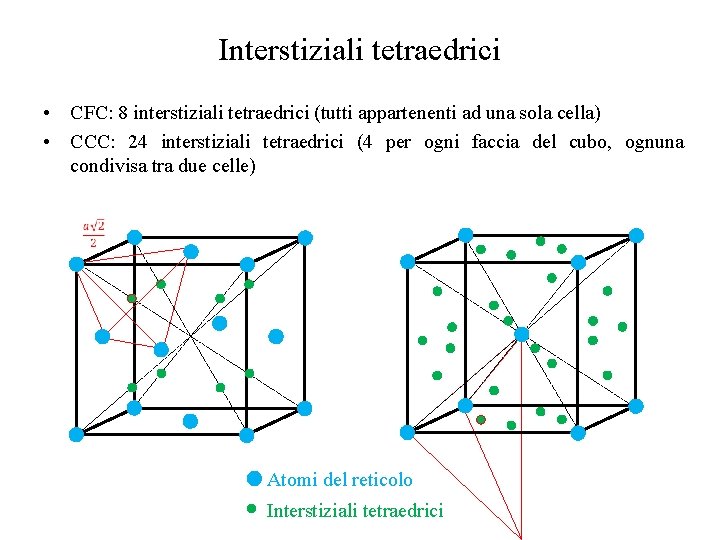
Interstiziali tetraedrici • CFC: 8 interstiziali tetraedrici (tutti appartenenti ad una sola cella) • CCC: 24 interstiziali tetraedrici (4 per ogni faccia del cubo, ognuna condivisa tra due celle) Atomi del reticolo Interstiziali tetraedrici

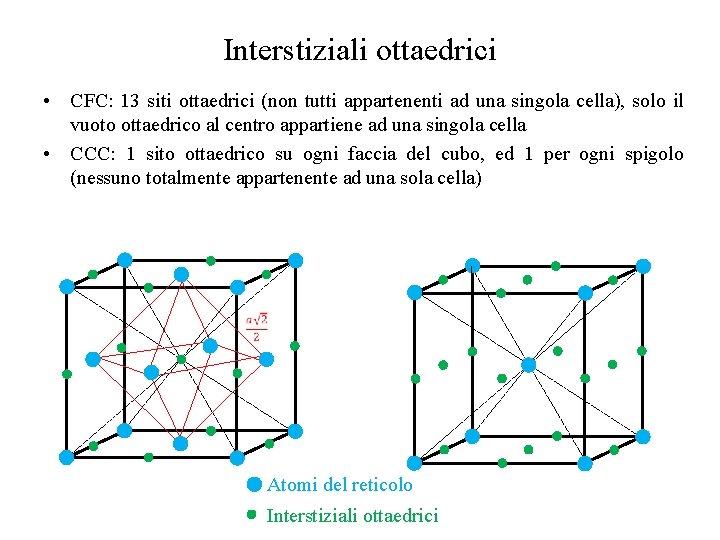
Interstiziali ottaedrici • CFC: 13 siti ottaedrici (non tutti appartenenti ad una singola cella), solo il vuoto ottaedrico al centro appartiene ad una singola cella • CCC: 1 sito ottaedrico su ogni faccia del cubo, ed 1 per ogni spigolo (nessuno totalmente appartenente ad una sola cella) Atomi del reticolo Interstiziali ottaedrici

Strutture cristalline dei metalli • Nei materiali metallici gli atomi sono tenuti insieme dal legame metallico • La struttura è nel complesso neutra • Nelle posizioni interstiziali possono trovare posto degli atomi ospiti che servono a modificare le proprietà del materiale • Data la neutralità della carica complessiva (sia che si aggiungano metalli sia che si aggiungano non metalli) all’interno della struttura possono essere aggiunti un numero arbitrario di atomi ospiti • Si forma quindi una LEGA (materiale composto di più specie chimiche differenti in proporzioni variabili) • Chiaramente, se l’elemento ospite supera la capacità dell’elemento ospitante (che dipende dal numero e tipo di interstiziali) il materiale ospite tende a segregare

Strutture cristalline dei ceramici • Nei materiali ceramici gli atomi sono tenuti insieme dal legame covalente e ionico • La presenza di ioni positivi e negativi fa si che sia necessario un rapporto stechiometrico tra anioni e cationi • Si parla in questo caso di un composto • Anche se viene riportata una formula bruta per il ceramico, si ricorda che il ceramico forma una struttura cristallina, non una molecola

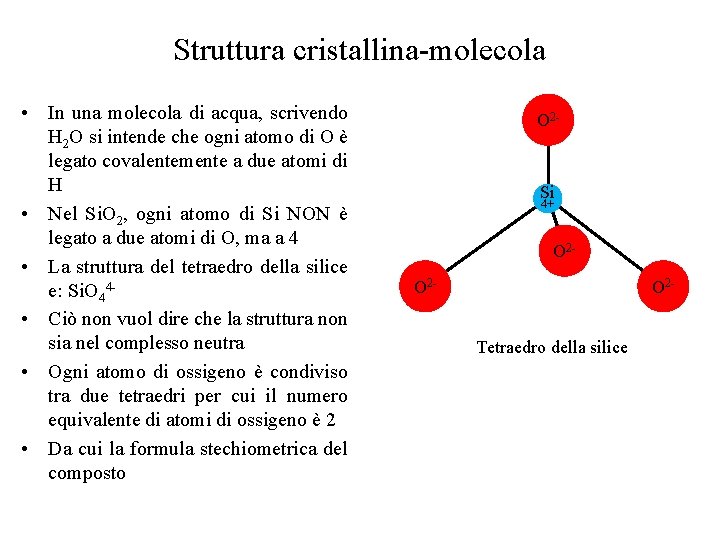
Struttura cristallina-molecola • In una molecola di acqua, scrivendo H 2 O si intende che ogni atomo di O è legato covalentemente a due atomi di H • Nel Si. O 2, ogni atomo di Si NON è legato a due atomi di O, ma a 4 • La struttura del tetraedro della silice e: Si. O 44 • Ciò non vuol dire che la struttura non sia nel complesso neutra • Ogni atomo di ossigeno è condiviso tra due tetraedri per cui il numero equivalente di atomi di ossigeno è 2 • Da cui la formula stechiometrica del composto O 2 - Si 4+ O 2 O 2 - O 2 Tetraedro della silice

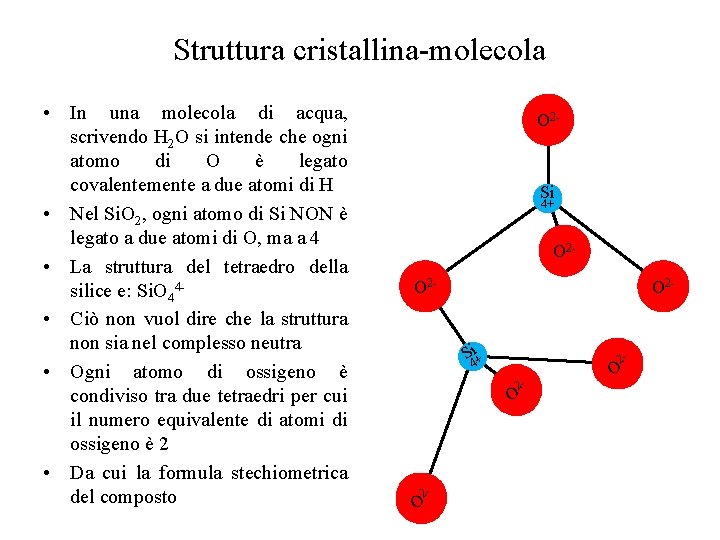
Struttura cristallina-molecola • In una molecola di acqua, scrivendo H 2 O si intende che ogni atomo di O è legato covalentemente a due atomi di H • Nel Si. O 2, ogni atomo di Si NON è legato a due atomi di O, ma a 4 • La struttura del tetraedro della silice e: Si. O 44 • Ciò non vuol dire che la struttura non sia nel complesso neutra • Ogni atomo di ossigeno è condiviso tra due tetraedri per cui il numero equivalente di atomi di ossigeno è 2 • Da cui la formula stechiometrica del composto O 2 - Si 4+ O 2 O 2 - O 2 S 4 i+ 2 - 2 - O O

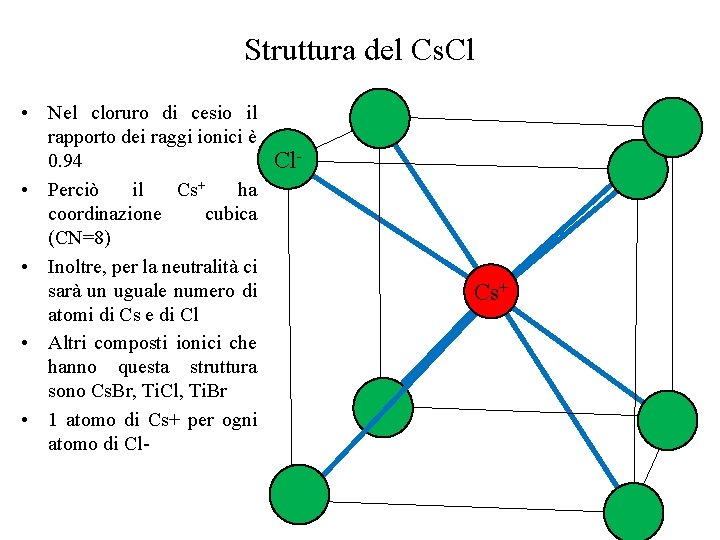
Struttura del Cs. Cl • Nel cloruro di cesio il rapporto dei raggi ionici è 0. 94 Cl • Perciò il Cs+ ha coordinazione cubica (CN=8) • Inoltre, per la neutralità ci sarà un uguale numero di atomi di Cs e di Cl • Altri composti ionici che hanno questa struttura sono Cs. Br, Ti. Cl, Ti. Br • 1 atomo di Cs+ per ogni atomo di Cl- Cs+

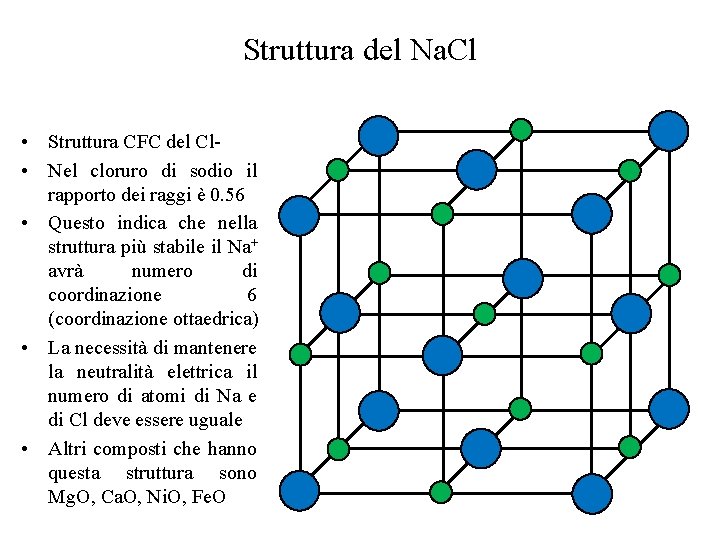
Struttura del Na. Cl • Struttura CFC del Cl • Nel cloruro di sodio il rapporto dei raggi è 0. 56 • Questo indica che nella struttura più stabile il Na+ avrà numero di coordinazione 6 (coordinazione ottaedrica) • La necessità di mantenere la neutralità elettrica il numero di atomi di Na e di Cl deve essere uguale • Altri composti che hanno questa struttura sono Mg. O, Ca. O, Ni. O, Fe. O

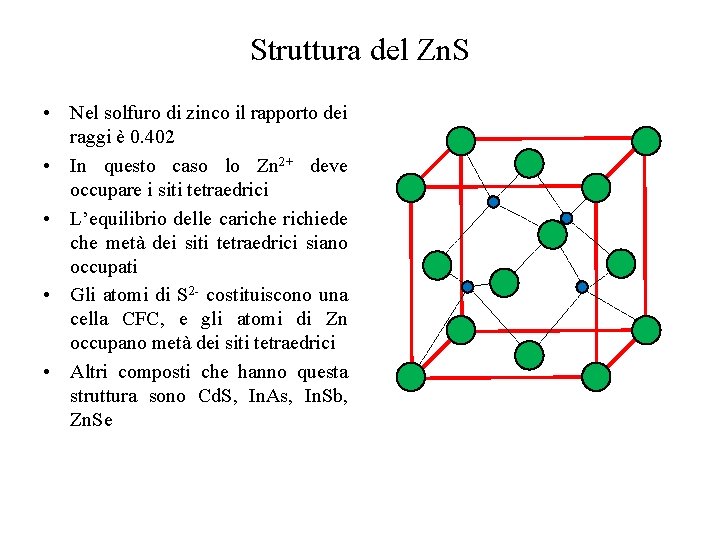
Struttura del Zn. S • Nel solfuro di zinco il rapporto dei raggi è 0. 402 • In questo caso lo Zn 2+ deve occupare i siti tetraedrici • L’equilibrio delle cariche richiede che metà dei siti tetraedrici siano occupati • Gli atomi di S 2 - costituiscono una cella CFC, e gli atomi di Zn occupano metà dei siti tetraedrici • Altri composti che hanno questa struttura sono Cd. S, In. As, In. Sb, Zn. Se

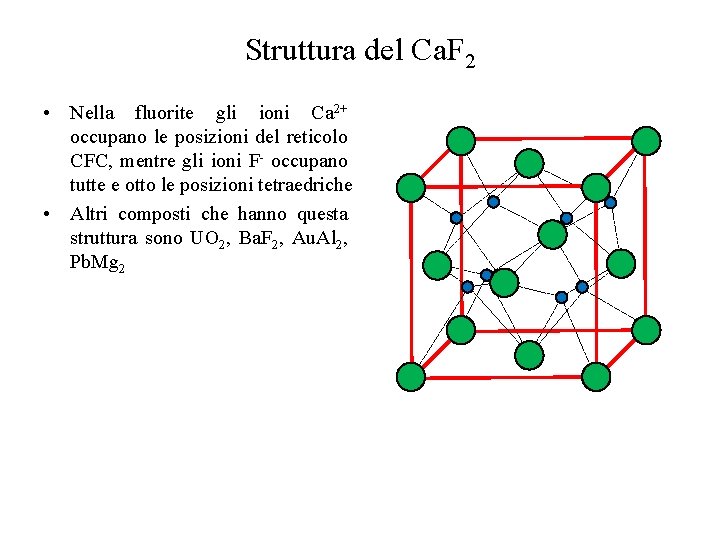
Struttura del Ca. F 2 • Nella fluorite gli ioni Ca 2+ occupano le posizioni del reticolo CFC, mentre gli ioni F- occupano tutte e otto le posizioni tetraedriche • Altri composti che hanno questa struttura sono UO 2, Ba. F 2, Au. Al 2, Pb. Mg 2

Imperfezioni • In ogni struttura cristallina, esistono delle zone del reticolo in cui la disposizione atomica non è ordinata • Le imperfezioni fanno parte del reticolo all’equilibrio, ma talvolta vengono aggiunte intenzionalmente per modificare alcune proprietà del materiale • Le imperfezioni possono essere di diverso tipo: Puntiformi Coinvolgono un nu mero molto ridotto di atomi (al limite uno solo) Lineari Coinvolgono una linea che attraversa una porzione del reticolo, lungo cui gli atomi non sono disposti in maniera regolare Planari Un’area di dimensioni macroscopiche separa due zone di diversa periodicità

Difetti puntuali • I difetti puntuali introducono una distorsione nel reticolo cristallino. – – Vacanze Interstiziali Sostituzionali Imperfezioni doppie • La presenza dei difetti nei cristalli modifica le proprietà meccaniche e di conducibilità

Vacanze • Un nodo del reticolo non è occupato da alcun atomo e rimane vuoto. • Le vacanze permettono il movimento degli atomi da un nodo reticolare ad un altro (diffusione) • Origine: – impurezze chimiche (ioni con carica diversa) – composti non stechiometrici (contengono un elemento con diverso numero di ox) – processi di solidificazione – vibrazioni atomiche.

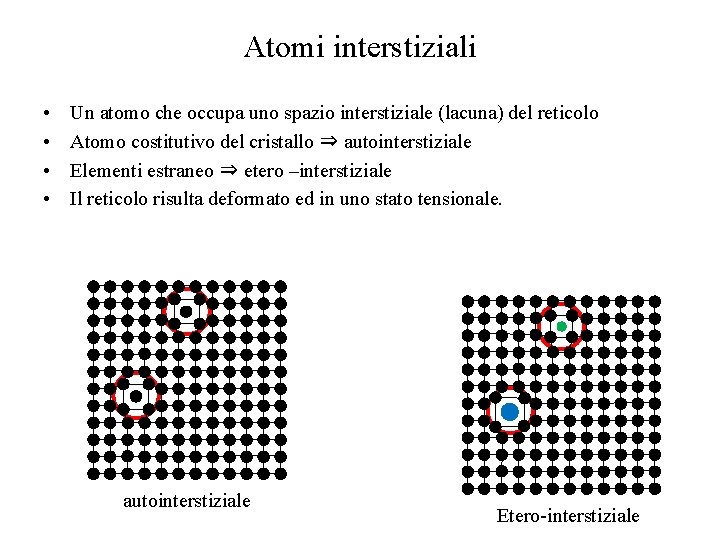
Atomi interstiziali • • Un atomo che occupa uno spazio interstiziale (lacuna) del reticolo Atomo costitutivo del cristallo ⇒ autointerstiziale Elementi estraneo ⇒ etero –interstiziale Il reticolo risulta deformato ed in uno stato tensionale. autointerstiziale Etero-interstiziale

Atomi sostituzionali • Atomo sostituzionale (con funzione di soluto) più piccolo o più grande dell’atomo del reticolo contenente il difetto (che ha funzione di solvente) • L'introduzione di alcune frazioni % di atomi sostituzionali genera le soluzioni solide sostituzionali.

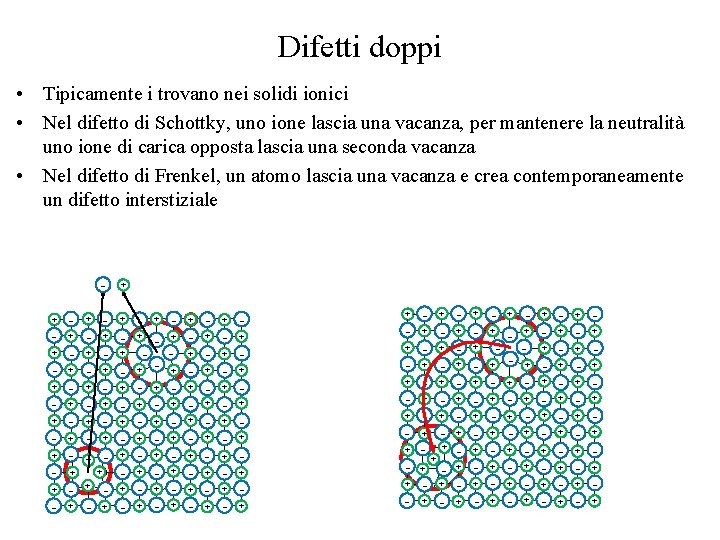
Difetti doppi • Tipicamente i trovano nei solidi ionici • Nel difetto di Schottky, uno ione lascia una vacanza, per mantenere la neutralità uno ione di carica opposta lascia una seconda vacanza • Nel difetto di Frenkel, un atomo lascia una vacanza e crea contemporaneamente un difetto interstiziale + + + - - + + + - + + - - + - + - + + + - + - + - + + + - - - + - + + + + + + + + + + - + + - + - + + - - - + + + - + - + + - - - + + + + - - + + + + + + - + + + + + - - + + +

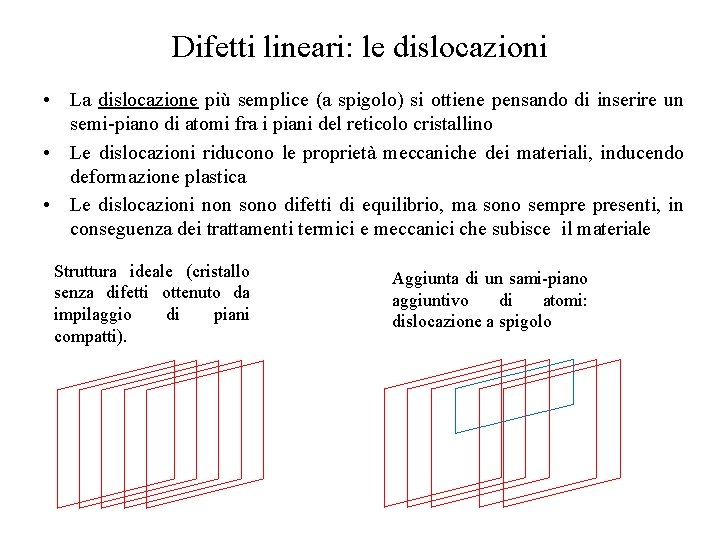
Difetti lineari: le dislocazioni • La dislocazione più semplice (a spigolo) si ottiene pensando di inserire un semi-piano di atomi fra i piani del reticolo cristallino • Le dislocazioni riducono le proprietà meccaniche dei materiali, inducendo deformazione plastica • Le dislocazioni non sono difetti di equilibrio, ma sono sempre presenti, in conseguenza dei trattamenti termici e meccanici che subisce il materiale Struttura ideale (cristallo senza difetti ottenuto da impilaggio di piani compatti). Aggiunta di un sami-piano aggiuntivo di atomi: dislocazione a spigolo

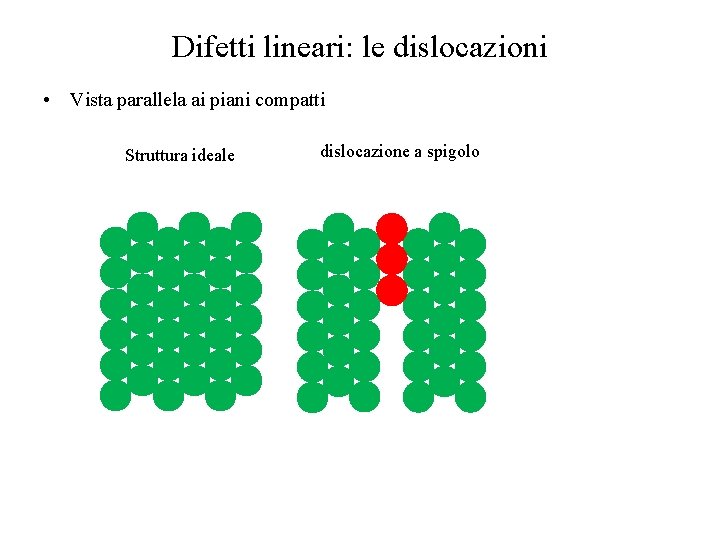
Difetti lineari: le dislocazioni • Vista parallela ai piani compatti Struttura ideale dislocazione a spigolo

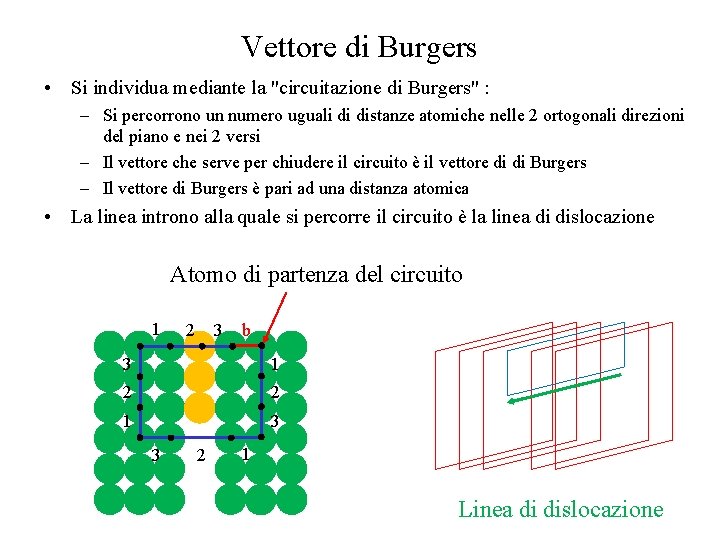
Vettore di Burgers • Si individua mediante la "circuitazione di Burgers" : – Si percorrono un numero uguali di distanze atomiche nelle 2 ortogonali direzioni del piano e nei 2 versi – Il vettore che serve per chiudere il circuito è il vettore di di Burgers – Il vettore di Burgers è pari ad una distanza atomica • La linea introno alla quale si percorre il circuito è la linea di dislocazione Atomo di partenza del circuito 1 2 3 b 3 1 2 2 1 3 3 2 1 Linea di dislocazione

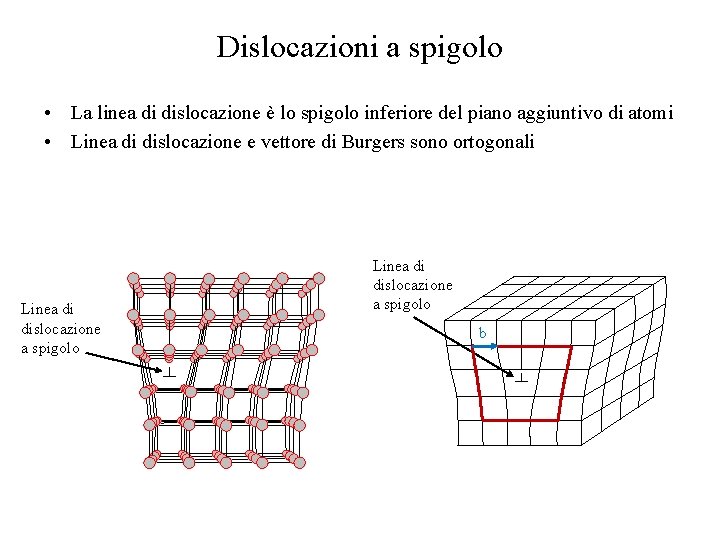
Dislocazioni a spigolo • La linea di dislocazione è lo spigolo inferiore del piano aggiuntivo di atomi • Linea di dislocazione e vettore di Burgers sono ortogonali Linea di dislocazione a spigolo b

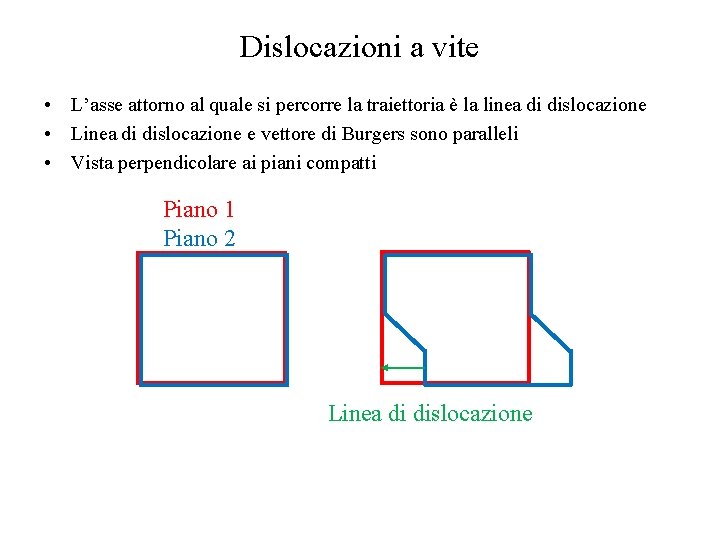
Dislocazioni a vite • L’asse attorno al quale si percorre la traiettoria è la linea di dislocazione • Linea di dislocazione e vettore di Burgers sono paralleli • Vista perpendicolare ai piani compatti Piano 1 Piano 2 Linea di dislocazione

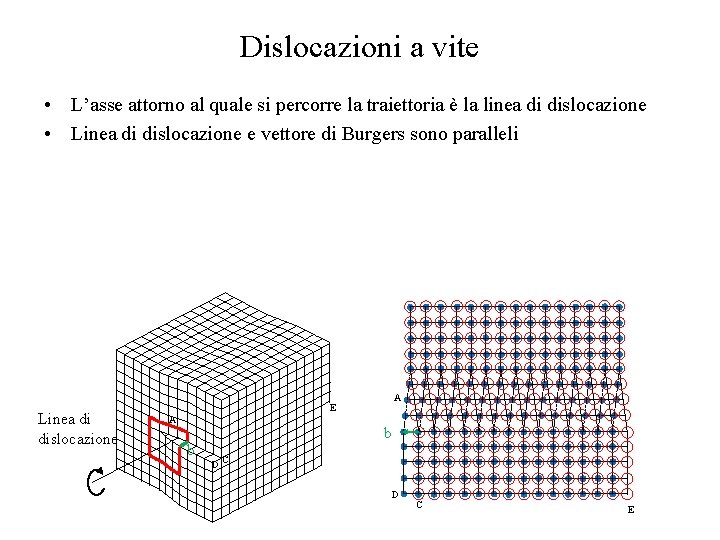
Dislocazioni a vite • L’asse attorno al quale si percorre la traiettoria è la linea di dislocazione • Linea di dislocazione e vettore di Burgers sono paralleli Linea di dislocazione A E A b b DC D C E

Energia delle dislocazioni • Si può dimostrare che l’energia libera per unità di lunghezza di una linea di dislocazione (a vite a spigolo o mista) è data da: • E= Gb 2 • Dove G è il modulo di taglio e una costante e b la lunghezza del vettore del Burgers • Ad ogni dislocazione è associato un aumento di energia

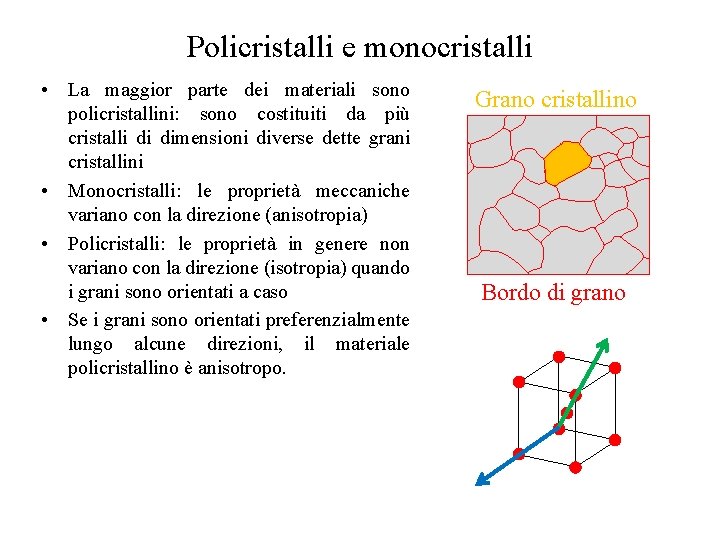
Policristalli e monocristalli • La maggior parte dei materiali sono policristallini: sono costituiti da più cristalli di dimensioni diverse dette grani cristallini • Monocristalli: le proprietà meccaniche variano con la direzione (anisotropia) • Policristalli: le proprietà in genere non variano con la direzione (isotropia) quando i grani sono orientati a caso • Se i grani sono orientati preferenzialmente lungo alcune direzioni, il materiale policristallino è anisotropo. Grano cristallino Bordo di grano

Difetti superficiali • Sono tipicamente i bordi di grano, nei solidi policristallini • Nei diversi grani, i piani reticolari sono orientati in maniera diversa ( materiale isotropo) • Durante la solidificazione, i grani crescono simultaneamente e laddove i fronti di crescita si incontrano, si forma il bordo di grano • Per acciai di impiego industriale, la dimensione media dei grano è di 0. 2 mm (ogni grano ha circa 1018 atomi)

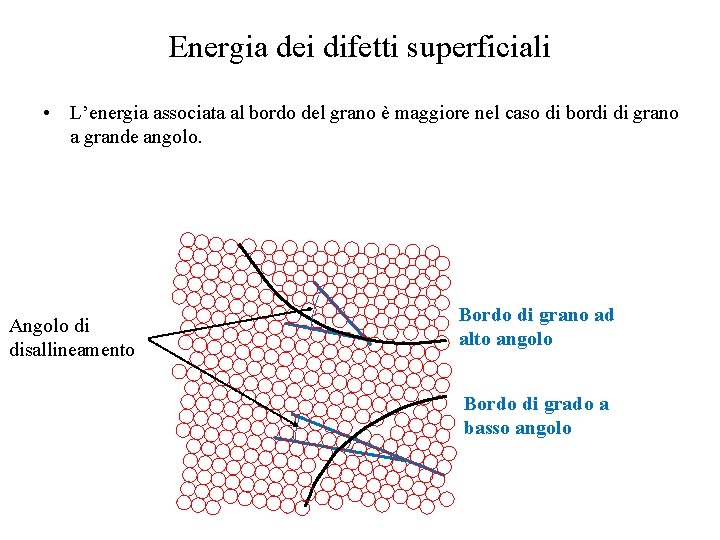
Energia dei difetti superficiali • L’energia associata al bordo del grano è maggiore nel caso di bordi di grano a grande angolo. Angolo di disallineamento Bordo di grano ad alto angolo Bordo di grado a basso angolo

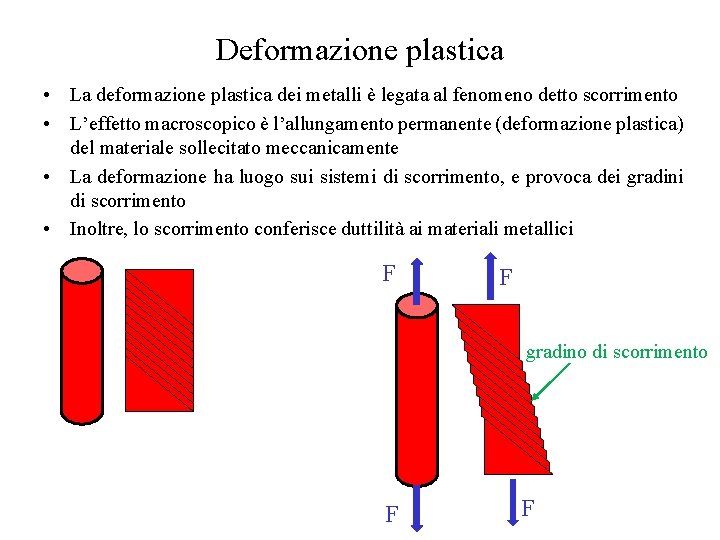
Deformazione plastica • La deformazione plastica dei metalli è legata al fenomeno detto scorrimento • L’effetto macroscopico è l’allungamento permanente (deformazione plastica) del materiale sollecitato meccanicamente • La deformazione ha luogo sui sistemi di scorrimento, e provoca dei gradini di scorrimento • Inoltre, lo scorrimento conferisce duttilità ai materiali metallici F F gradino di scorrimento F F

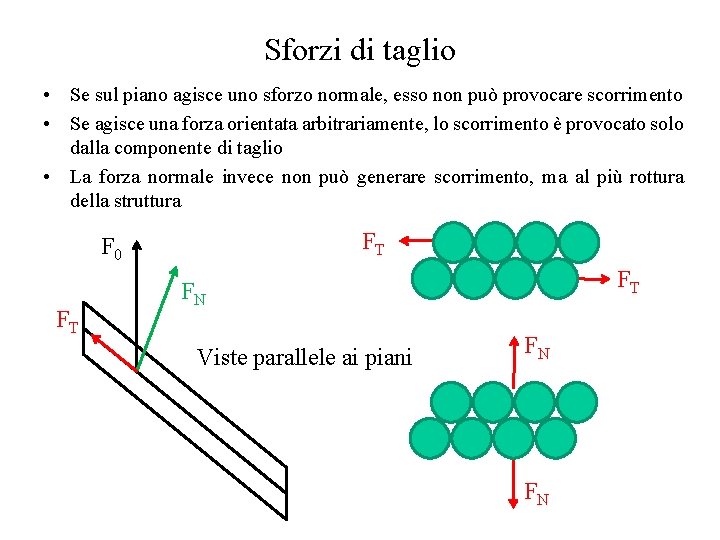
Sforzi di taglio • Se sul piano agisce uno sforzo normale, esso non può provocare scorrimento • Se agisce una forza orientata arbitrariamente, lo scorrimento è provocato solo dalla componente di taglio • La forza normale invece non può generare scorrimento, ma al più rottura della struttura FT F 0 FT FT FN Viste parallele ai piani FN FN

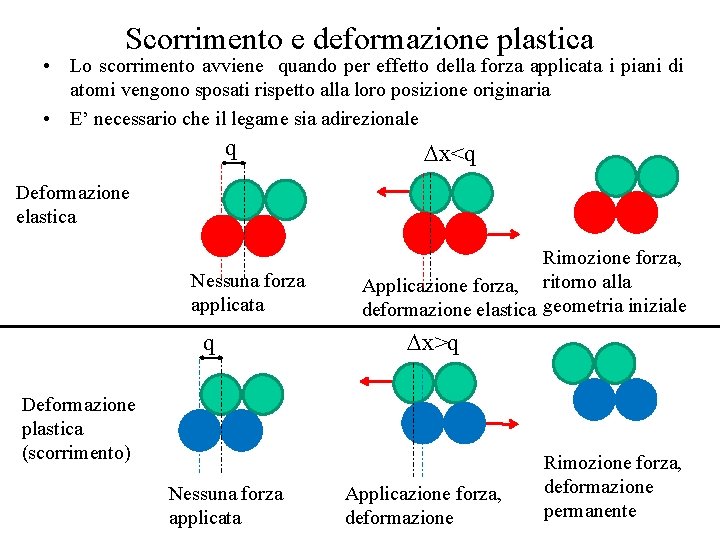
Scorrimento e deformazione plastica • Lo scorrimento avviene quando per effetto della forza applicata i piani di atomi vengono sposati rispetto alla loro posizione originaria • E’ necessario che il legame sia adirezionale q x<q Deformazione elastica Nessuna forza applicata q Rimozione forza, Applicazione forza, ritorno alla deformazione elastica geometria iniziale x>q Deformazione plastica (scorrimento) Nessuna forza applicata Applicazione forza, deformazione Rimozione forza, deformazione permanente

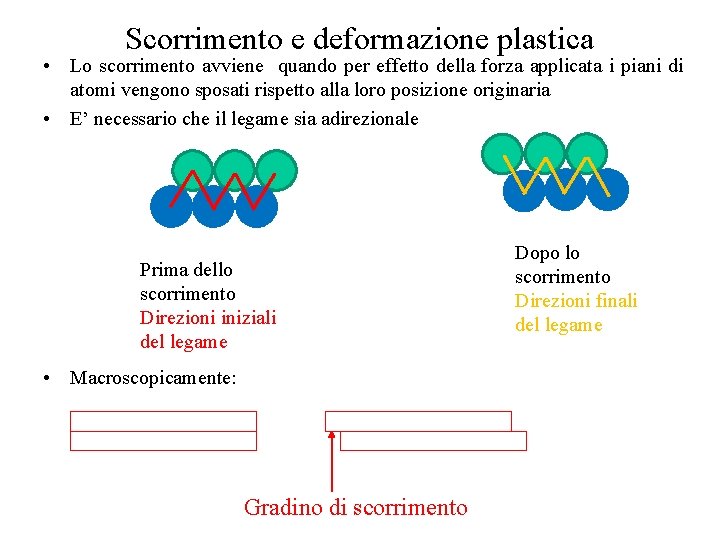
Scorrimento e deformazione plastica • Lo scorrimento avviene quando per effetto della forza applicata i piani di atomi vengono sposati rispetto alla loro posizione originaria • E’ necessario che il legame sia adirezionale Prima dello scorrimento Direzioni iniziali del legame • Macroscopicamente: Gradino di scorrimento Dopo lo scorrimento Direzioni finali del legame

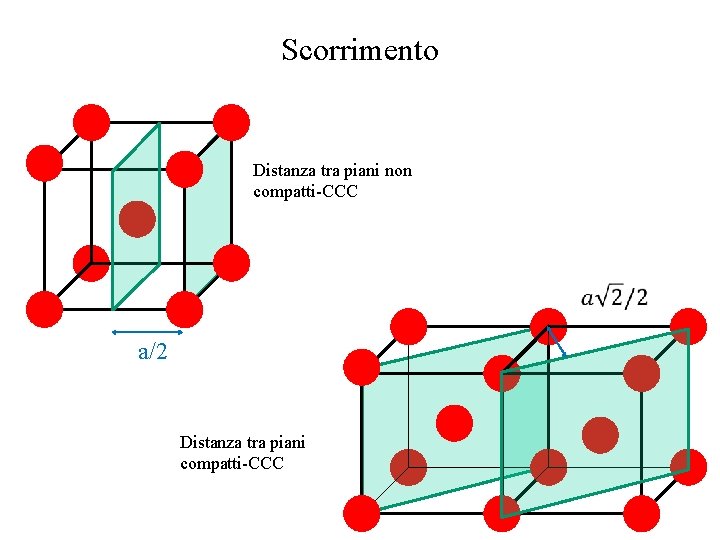
Scorrimento Distanza tra piani non compatti-CCC a/2 Distanza tra piani compatti-CCC

Sistemi di scorrimento • I sistemi di scorrimento sono individuati da piani compatti e direzioni compatte • I piani compatti sono piani preferenziali di scorrimento perché è richiesta meno energia per muovere un piano cristallino sull’altro • Analogamente, le direzioni di scorrimento sono le direzioni compatte • Se lo scorrimento sui sistemi è ostacolato dalla presenza di difetti, diventano attivi altri sistemi di scorrimento (ad energia di attivazione maggiore) Piani compatti, più lontani tra loro Piani non compatti, più vicini tra loro Viste parallele ai piani

Piani di scorrimento • y è minore per i piani compatti e maggiore per i piani meno compatti • I piani compatti scorrono più facilmente d 0 dmax Viste parallele ai piani

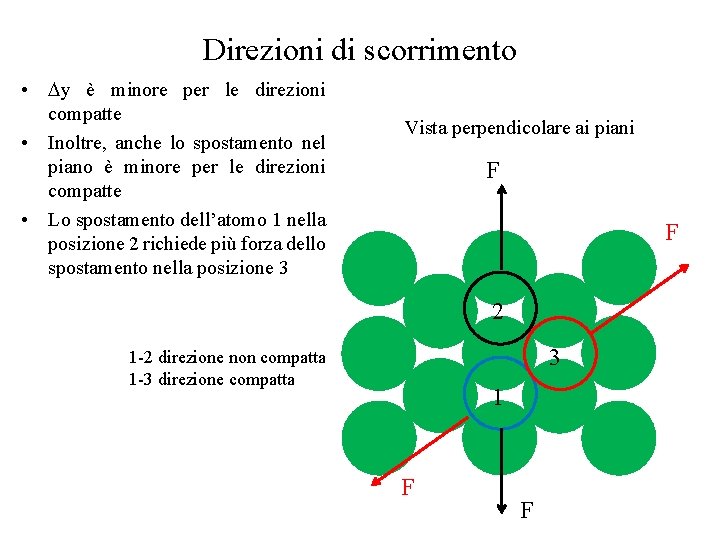
Direzioni di scorrimento • y è minore per le direzioni compatte • Inoltre, anche lo spostamento nel piano è minore per le direzioni compatte • Lo spostamento dell’atomo 1 nella posizione 2 richiede più forza dello spostamento nella posizione 3 Vista perpendicolare ai piani F F 2 3 1 -2 direzione non compatta 1 -3 direzione compatta 1 F F

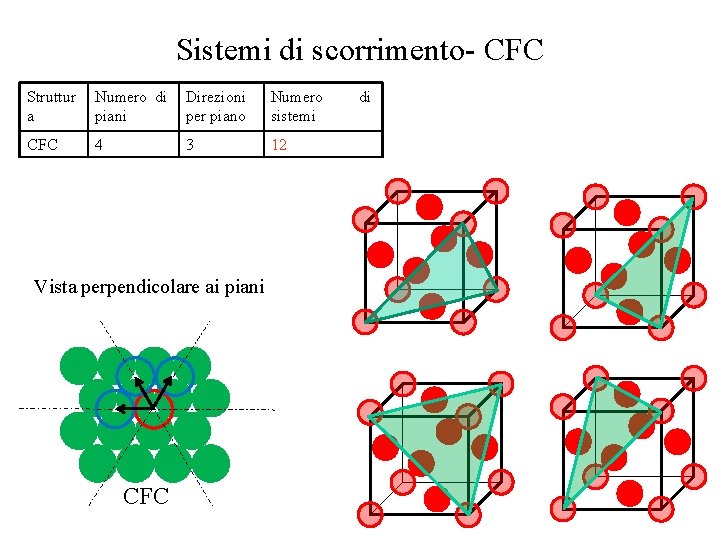
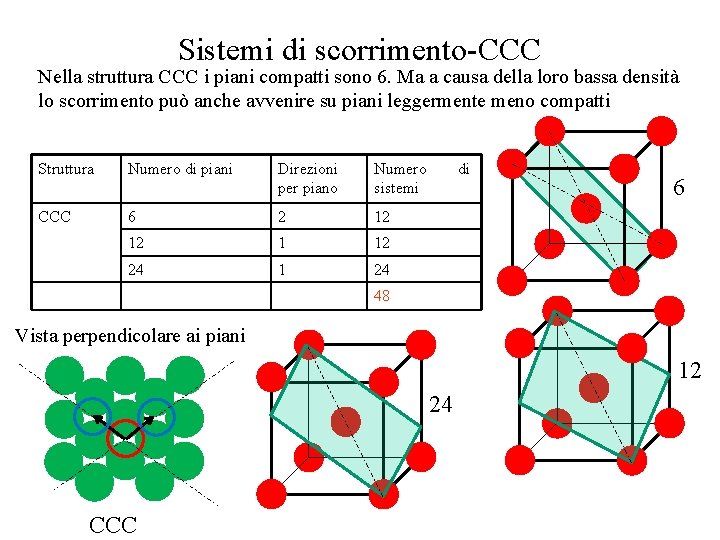
Influenza della struttura cristallina • Per ogni differente struttura cristallina esistono dei sistemi di scorrimento Struttura Numero di piani Direzioni per piano Numero sistemi CFC 4 3 12 CCC 6 2 12 12 1 12 24 1 24 48 EC 1 3 3 di Nella struttura CCC i piani compatti sono 6. Ma a causa della loro bassa densità lo scorrimento può anche avvenire su piani leggermente meno compatti Vista perpendicolare ai piani CCC CFC

Sistemi di scorrimento- CFC Struttur a Numero di piani Direzioni per piano Numero sistemi CFC 4 3 12 Vista perpendicolare ai piani CFC di

Sistemi di scorrimento-CCC Nella struttura CCC i piani compatti sono 6. Ma a causa della loro bassa densità lo scorrimento può anche avvenire su piani leggermente meno compatti Struttura Numero di piani Direzioni per piano Numero sistemi CCC 6 2 12 12 1 12 24 1 24 di 6 48 Vista perpendicolare ai piani 12 24 CCC

Influenza della struttura cristallina • Per la struttura CCC i sistemi compatti hanno una densità planare (0. 83) minore rispetto a quella dei piani compatti dei sistemi per CFC ed EC (0. 91) • I valori di forza necessari permettere lo scorrimento nei metalli CCC perciò sono più alti • La densità dei sistemi compatti influenza la resistenza del materiale

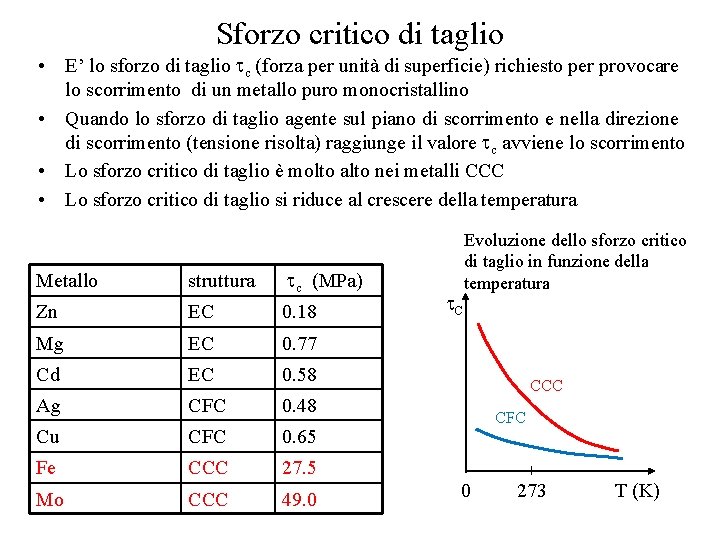
Sforzo critico di taglio • E’ lo sforzo di taglio c (forza per unità di superficie) richiesto per provocare lo scorrimento di un metallo puro monocristallino • Quando lo sforzo di taglio agente sul piano di scorrimento e nella direzione di scorrimento (tensione risolta) raggiunge il valore c avviene lo scorrimento • Lo sforzo critico di taglio è molto alto nei metalli CCC • Lo sforzo critico di taglio si riduce al crescere della temperatura Metallo struttura c (MPa) Zn EC 0. 18 Mg EC 0. 77 Cd EC 0. 58 Ag CFC 0. 48 Cu CFC 0. 65 Fe CCC 27. 5 Mo CCC 49. 0 C Evoluzione dello sforzo critico di taglio in funzione della temperatura CCC CFC 0 273 T (K)

Legge di Schmid • • angolo tra la direzione della forza e la direzione di scorrimento • angolo tra la direzione della forza e la normale al piano di scorrimento S 0 F χ λ Eq. 2. 9 FT direzione di scorrimento S Piano di scorrimento

Numero di sistemi di scorrimento • Nei metalli EC ci sono pochi sistemi di scorrimento (3). Applicando una forza esterna, è difficile che questa agisca in una direzione utile a causare lo scorrimento. Di conseguenza, i metalli EC sono in genere piuttosto fragili • Nei metalli CFC ci sono 12 sistemi di scorrimento, e quindi è molto più probabile che un sistema di scorrimento si trovi in posizione tale che gli angoli siano 45°. I metalli CFC sono piuttosto duttili • Nei metalli CCC ci sono molti sistemi di scorrimento (ad energia di attivazione maggiore) questo conferisce ai metalli CCC buona resistenza meccanica ed anche buona duttilità • Il numero di sistemi di scorrimento influenza la duttilità del materiale

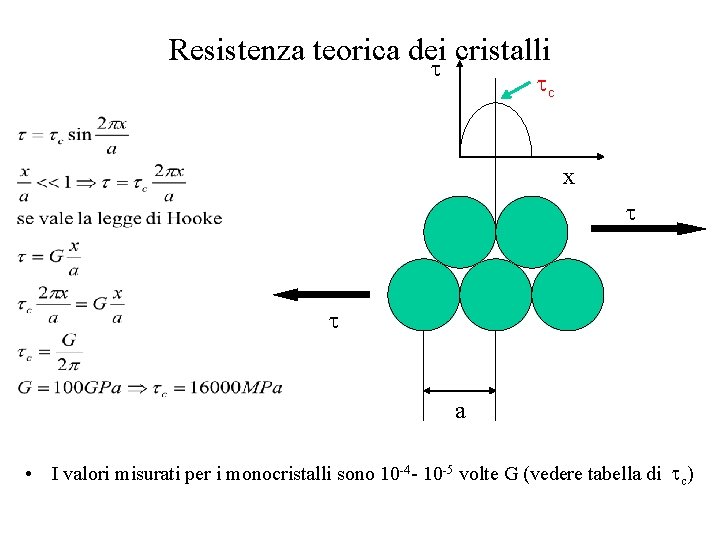
Resistenza teorica dei cristalli c x a • I valori misurati per i monocristalli sono 10 -4 - 10 -5 volte G (vedere tabella di c)

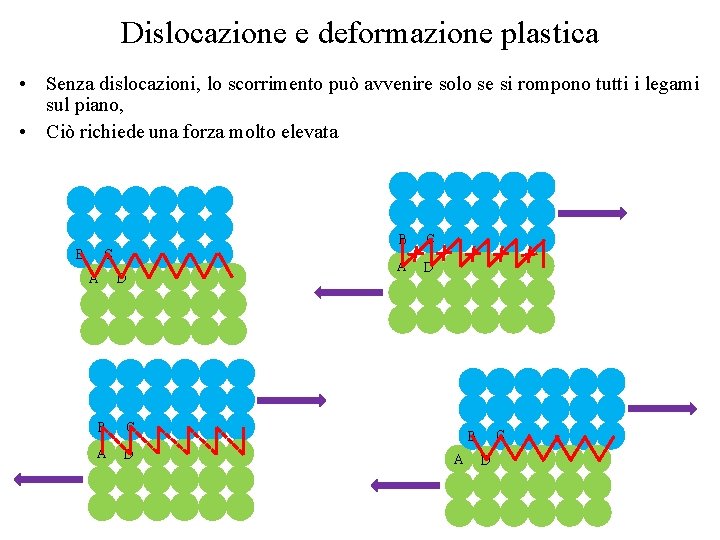
Dislocazione e deformazione plastica • Senza dislocazioni, lo scorrimento può avvenire solo se si rompono tutti i legami sul piano, • Ciò richiede una forza molto elevata C B A D B C A D C B A D

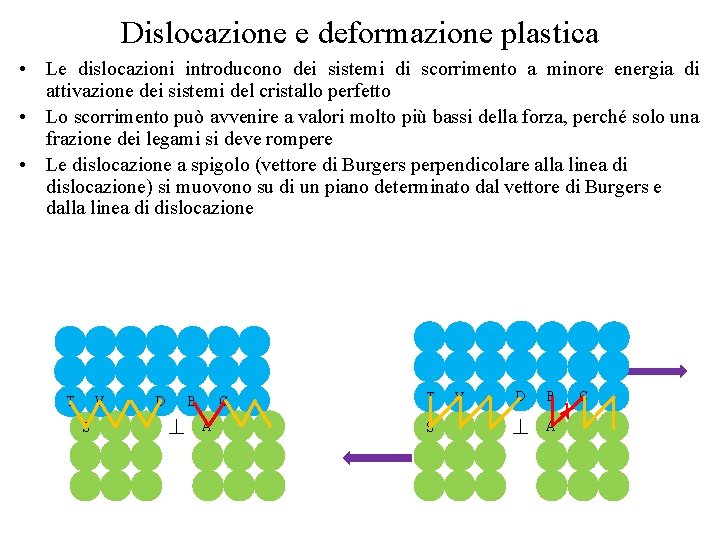
Dislocazione e deformazione plastica • Le dislocazioni introducono dei sistemi di scorrimento a minore energia di attivazione dei sistemi del cristallo perfetto • Lo scorrimento può avvenire a valori molto più bassi della forza, perché solo una frazione dei legami si deve rompere • Le dislocazione a spigolo (vettore di Burgers perpendicolare alla linea di dislocazione) si muovono su di un piano determinato dal vettore di Burgers e dalla linea di dislocazione T V S D B C A T S V D B A C

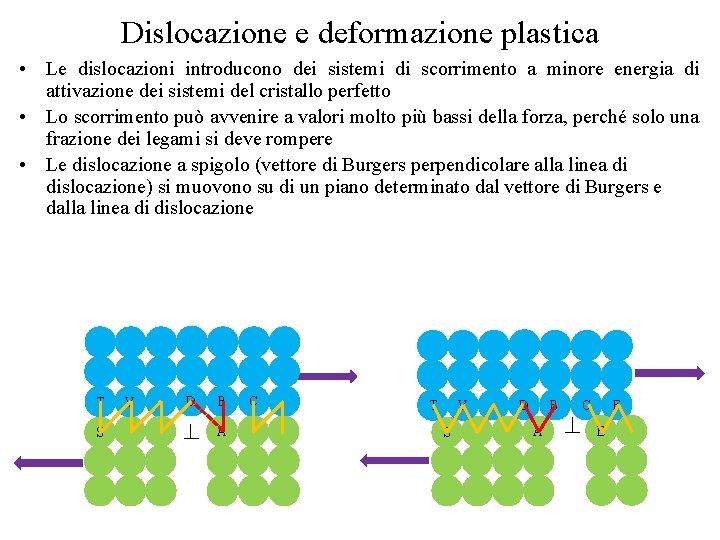
Dislocazione e deformazione plastica • Le dislocazioni introducono dei sistemi di scorrimento a minore energia di attivazione dei sistemi del cristallo perfetto • Lo scorrimento può avvenire a valori molto più bassi della forza, perché solo una frazione dei legami si deve rompere • Le dislocazione a spigolo (vettore di Burgers perpendicolare alla linea di dislocazione) si muovono su di un piano determinato dal vettore di Burgers e dalla linea di dislocazione T S V D B A C T V S D B A F C E

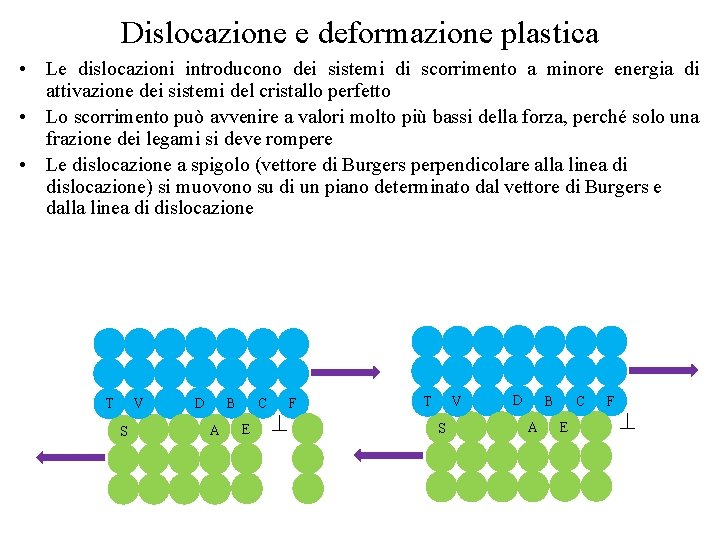
Dislocazione e deformazione plastica • Le dislocazioni introducono dei sistemi di scorrimento a minore energia di attivazione dei sistemi del cristallo perfetto • Lo scorrimento può avvenire a valori molto più bassi della forza, perché solo una frazione dei legami si deve rompere • Le dislocazione a spigolo (vettore di Burgers perpendicolare alla linea di dislocazione) si muovono su di un piano determinato dal vettore di Burgers e dalla linea di dislocazione T V S D B A C E F

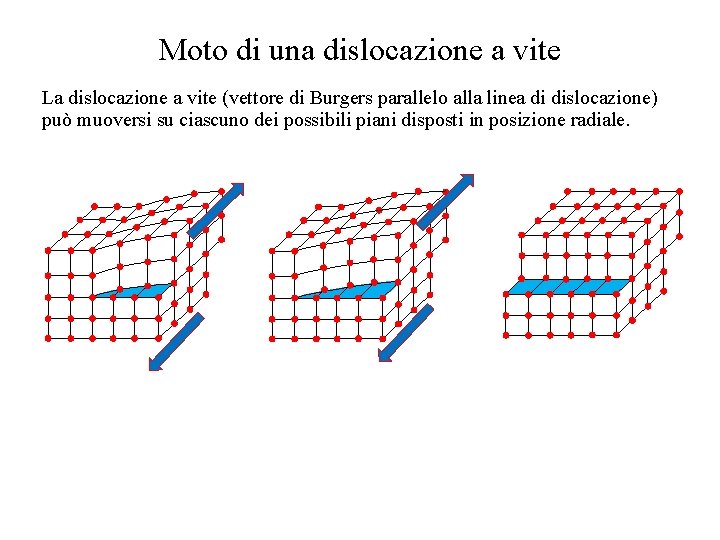
Moto di una dislocazione a vite La dislocazione a vite (vettore di Burgers parallelo alla linea di dislocazione) può muoversi su ciascuno dei possibili piani disposti in posizione radiale.

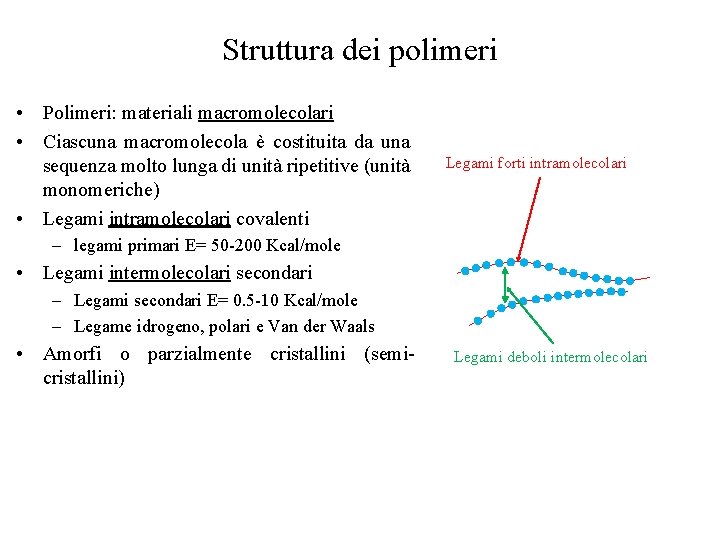
Struttura dei polimeri • Polimeri: materiali macromolecolari • Ciascuna macromolecola è costituita da una sequenza molto lunga di unità ripetitive (unità monomeriche) • Legami intramolecolari covalenti Legami forti intramolecolari – legami primari E= 50 -200 Kcal/mole • Legami intermolecolari secondari – Legami secondari E= 0. 5 -10 Kcal/mole – Legame idrogeno, polari e Van der Waals • Amorfi o parzialmente cristallini (semicristallini) Legami deboli intermolecolari

Legame covalente del carbonio • Il carbonio ha configurazione elettronica 1 s 22 p 2 • In questa configurazione, il carbonio dovrebbe avere valenza 2 (i due elettroni degli orbitali p) • Nei legami del carbonio si verifica l’ibridizzazione • Un elettrone viene promosso da 2 s a 2 p • La configurazione diventa con quattro orbitali, indicati come sp 3, tutti e quattro equivalenti (4 sp 3) • L’energia in più che viene spesa per l’ibridizzazione viene recuperata dal momento che invece di due legami se ne formano 4 • Si ottiene un legame tetraedrico (che rispetta l’equivalenza dei quattro orbitali) • Deve essere rispettata la disposizione nello spazio degli atomi

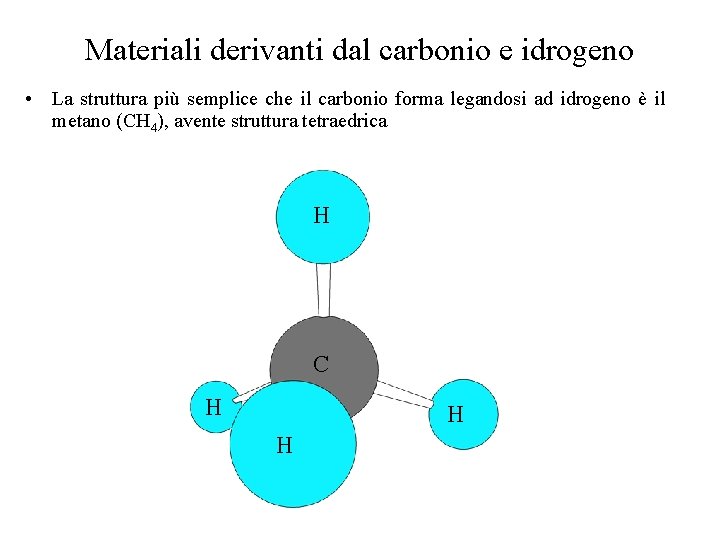
Materiali derivanti dal carbonio e idrogeno • La struttura più semplice che il carbonio forma legandosi ad idrogeno è il metano (CH 4), avente struttura tetraedrica H C H H H

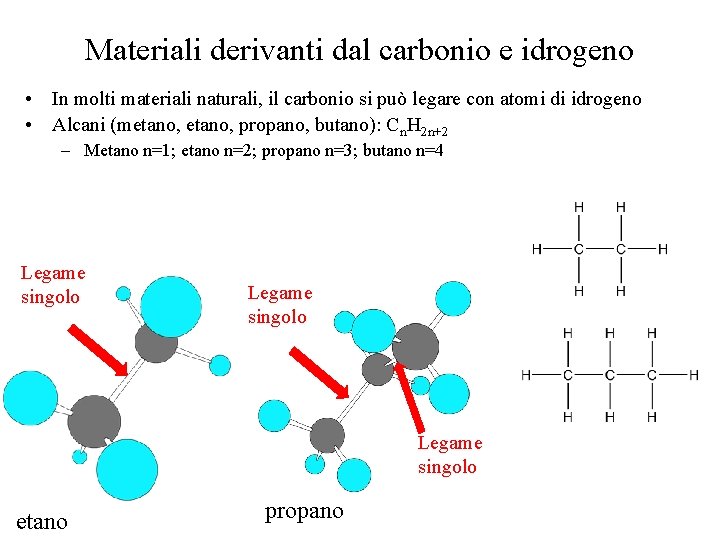
Materiali derivanti dal carbonio e idrogeno • In molti materiali naturali, il carbonio si può legare con atomi di idrogeno • Alcani (metano, propano, butano): Cn. H 2 n+2 – Metano n=1; etano n=2; propano n=3; butano n=4 Legame singolo etano propano

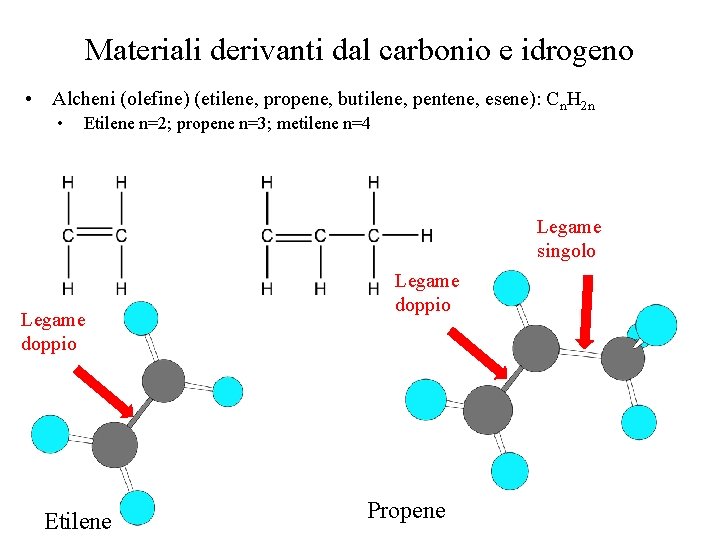
Materiali derivanti dal carbonio e idrogeno • Alcheni (olefine) (etilene, propene, butilene, pentene, esene): Cn. H 2 n • Etilene n=2; propene n=3; metilene n=4 Legame singolo Legame doppio Etilene Legame doppio Propene

Dal monomero al polimero (polimerizzazione) • Dall’unità di partenza monomero si ottengono nell’ordine: – Dimero (2 unità) – Trimero (3 unità) – Etc etc • Quando il peso molecolare è basso si parla di oligomero (oligomeri=poche parti) • Quando il peso molecolare è alto si ottiene un polimero • Il grado di polimerizzazione definisce il numero di monomeri presenti all’interno dell’oligomero o polimero – Dimero: α=2 – Trimero: α=3 monomeri polimero

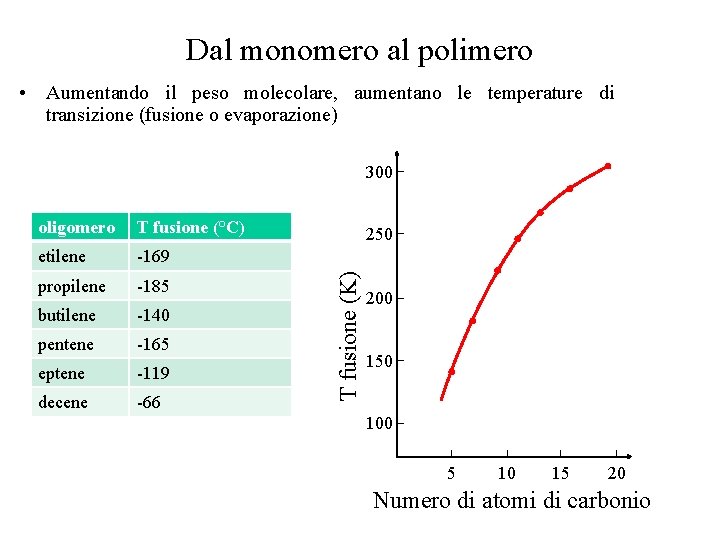
Dal monomero al polimero • Aumentando il peso molecolare, aumentano le temperature di transizione (fusione o evaporazione) 300 T fusione (°C) etilene -169 propilene -185 butilene -140 pentene -165 eptene -119 decene -66 250 T fusione (K) oligomero 200 150 100 5 10 15 20 Numero di atomi di carbonio

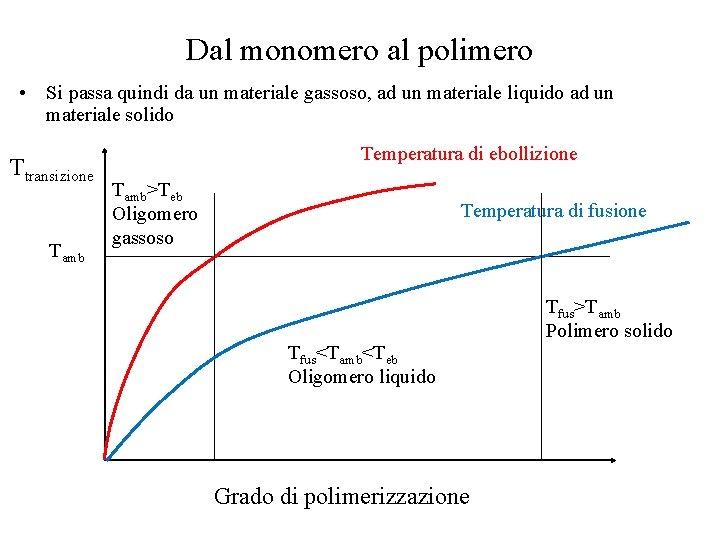
Dal monomero al polimero • Si passa quindi da un materiale gassoso, ad un materiale liquido ad un materiale solido Ttransizione Tamb Temperatura di ebollizione Tamb>Teb Oligomero gassoso Temperatura di fusione Tfus<Tamb<Teb Oligomero liquido Grado di polimerizzazione Tfus>Tamb Polimero solido

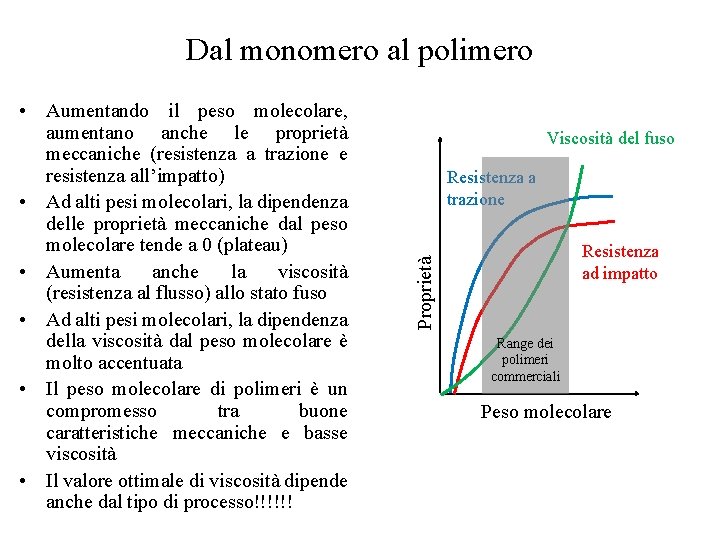
Dal monomero al polimero Viscosità del fuso Resistenza a trazione Resistenza ad impatto Proprietà • Aumentando il peso molecolare, aumentano anche le proprietà meccaniche (resistenza a trazione e resistenza all’impatto) • Ad alti pesi molecolari, la dipendenza delle proprietà meccaniche dal peso molecolare tende a 0 (plateau) • Aumenta anche la viscosità (resistenza al flusso) allo stato fuso • Ad alti pesi molecolari, la dipendenza della viscosità dal peso molecolare è molto accentuata • Il peso molecolare di polimeri è un compromesso tra buone caratteristiche meccaniche e basse viscosità • Il valore ottimale di viscosità dipende anche dal tipo di processo!!!!!! Range dei polimeri commerciali Peso molecolare

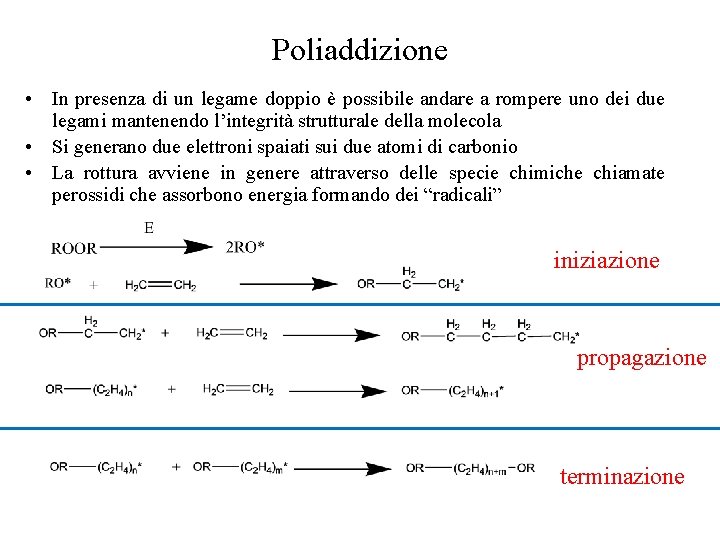
Poliaddizione • In presenza di un legame doppio è possibile andare a rompere uno dei due legami mantenendo l’integrità strutturale della molecola • Si generano due elettroni spaiati sui due atomi di carbonio • La rottura avviene in genere attraverso delle specie chimiche chiamate perossidi che assorbono energia formando dei “radicali” iniziazione propagazione terminazione

Polimeri da poliaddizione • • La poliaddizione coinvolge la rottura dei doppi legami In genere, le unità che reagiscono tra di loro sono tutte uguali E’ necessaria la presenza dei doppi legami Il peso molecolare del polimero MW è pari al peso molecolare del monomero Mn per il grado di polimerizzazione Eq. 2. 10 • Molti polimeri si ottengono per poliaddizione (poliolefine): – – Polietilene (PE) Polipropilene (PP) Polivinil-cloruro (PVC) Polistirene (PS) • UHMWPE (Ultra High Molecular Weight Poly. Ethylene): – MW=2 -6*106 g/mole – =70000 -215000

Policondensazione • La poliaddizione non è l’unico meccanismo con cui si ottengono dei polimeri • Un altro meccanismo molto importante è la policondensazione • Differenze rispetto alla poliaddizione: – La reazione coinvolge i gruppi terminali reattivi dei monomeri, che si legano tra di loro – Nel monomero non è richiesta la presenza del doppio legame – La reazione coinvolge monomeri di diversa natura chimica – La reazione porta all’ottenimento di sottoprodotti (specie a basso peso molecolare formatesi in forma liquida o gassosa) – Il peso molecolare del polimero è inferiore alla somma dei pesi molecolari dei monomeri • Nylon, polisolfuri, poliesteri (PET), siliconi, poliuretani, resine fenoliche

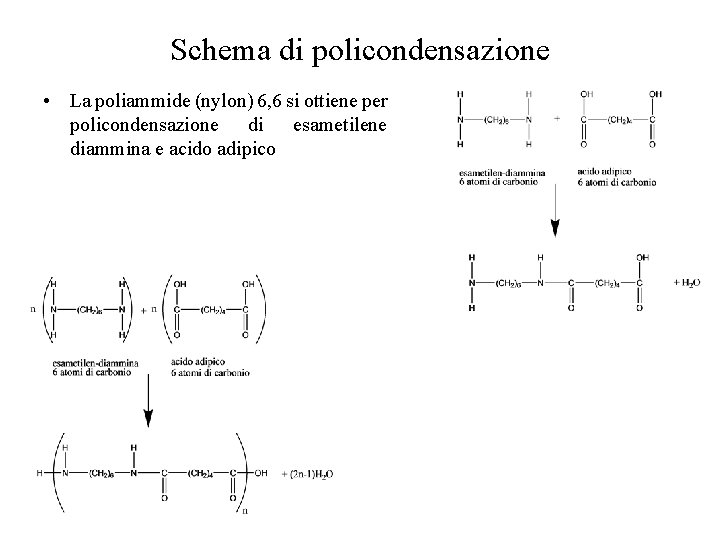
Schema di policondensazione • La poliammide (nylon) 6, 6 si ottiene per policondensazione di esametilene diammina e acido adipico

Polimeri termoplastici • Nei casi appena visti si ottengono delle catene lineari – Legami intramolecolari forti – Legami intermolecolari deboli • Le catene sono caratterizzate ciascuna da un certo valore del peso molecolare (in genere diverso da catena) • Ogni unità monomerica si lega ad altre due unità monomeriche • Questo tipo di polimeri si definiscono termoplastici • Sono dei polimeri amorfi o semicristallini • I materiali termoplastici possono essere fusi attraverso riscaldamento e fatti solidificare attraverso raffreddamento • I processi di fusione e solidificazione sono reversibili

Struttura dei termoplastici • I termoplastici possono essere: – Amorfi (sia allo stato solido che allo stato liquido) – Semicristallini • In funzione della temperatura e della loro conformazione molecolare

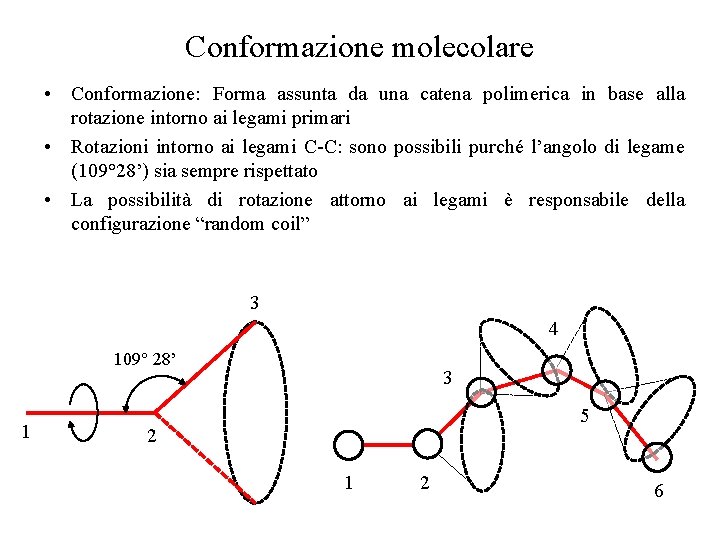
Conformazione molecolare • Conformazione: Forma assunta da una catena polimerica in base alla rotazione intorno ai legami primari • Rotazioni intorno ai legami C-C: sono possibili purché l’angolo di legame (109° 28’) sia sempre rispettato • La possibilità di rotazione attorno ai legami è responsabile della configurazione “random coil” 3 4 109° 28’ 1 3 5 2 1 2 6

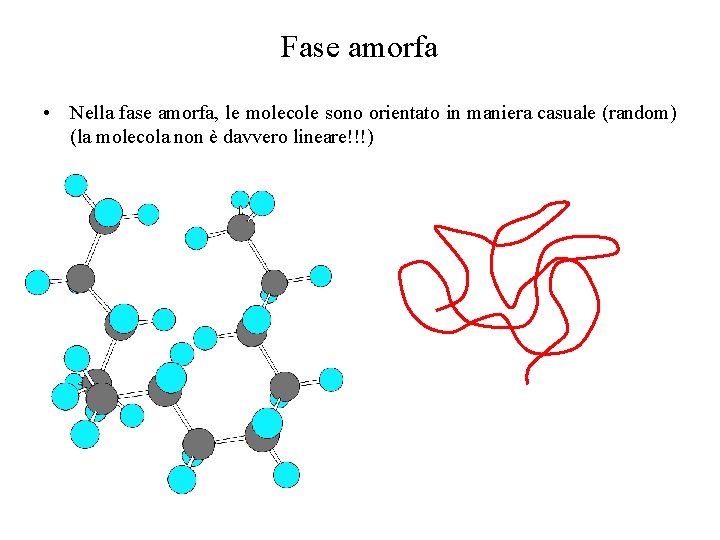
Fase amorfa • Nella fase amorfa, le molecole sono orientato in maniera casuale (random) (la molecola non è davvero lineare!!!)

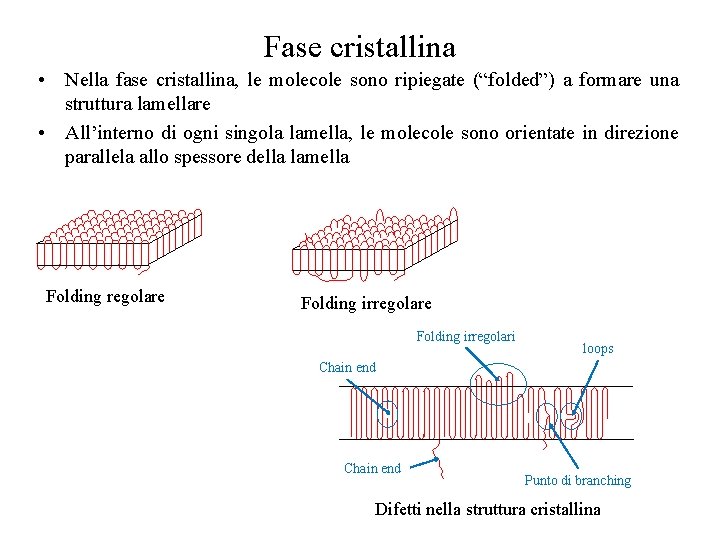
Fase cristallina • Nella fase cristallina, le molecole sono ripiegate (“folded”) a formare una struttura lamellare • All’interno di ogni singola lamella, le molecole sono orientate in direzione parallela allo spessore della lamella Folding regolare Folding irregolari loops Chain end Punto di branching Difetti nella struttura cristallina

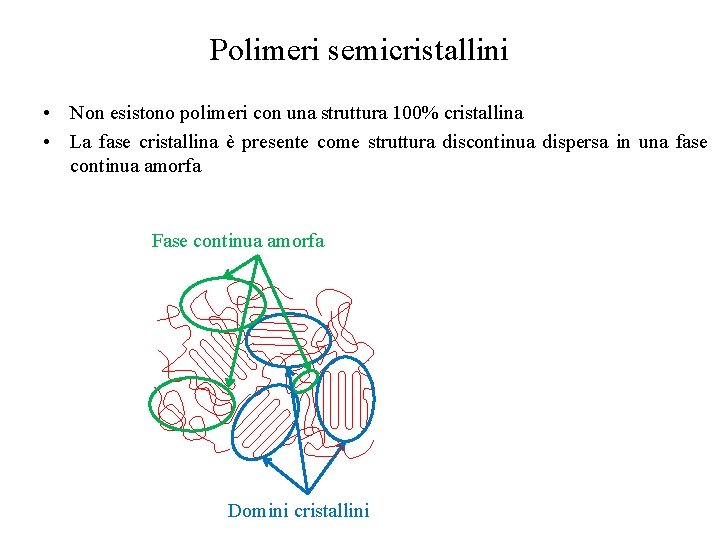
Polimeri semicristallini • Non esistono polimeri con una struttura 100% cristallina • La fase cristallina è presente come struttura discontinua dispersa in una fase continua amorfa Fase continua amorfa Domini cristallini

Funzionalità • La funzionalità di un monomero è il numero di siti del monomero a cui può essere attaccata una nuova unità • La funzionalità del monomero individua il tipo di polimero che può essere formato • Perché un polimero si formi, la funzionalità del monomero deve essere >2 (etilene, esametilendiammina, acido adipico) • Se la funzionalità = 2, il polimero che si forma è lineare (termoplastico) (polietilene)

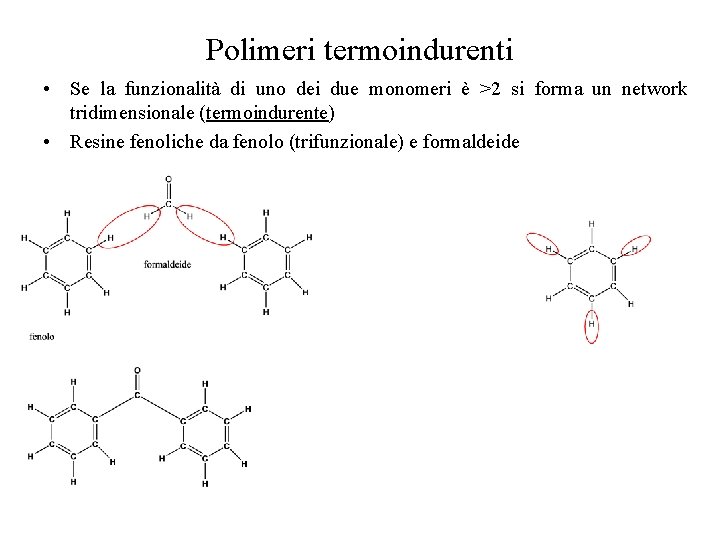
Polimeri termoindurenti • Se la funzionalità di uno dei due monomeri è >2 si forma un network tridimensionale (termoindurente) • Resine fenoliche da fenolo (trifunzionale) e formaldeide

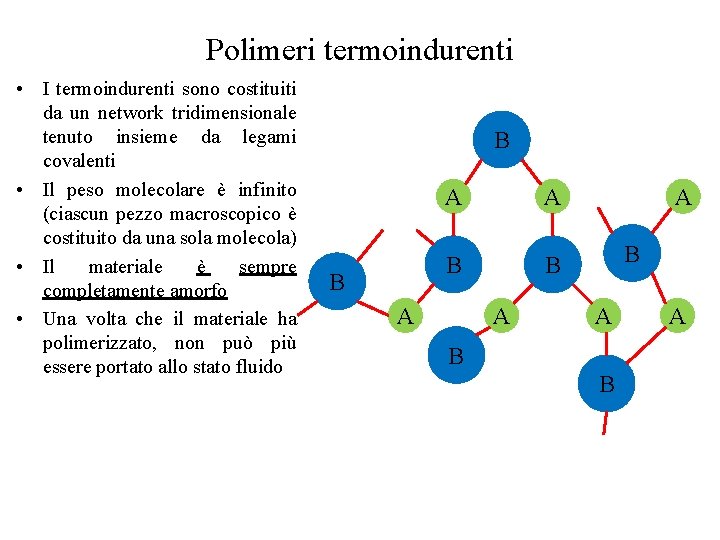
Polimeri termoindurenti • I termoindurenti sono costituiti da un network tridimensionale tenuto insieme da legami covalenti • Il peso molecolare è infinito (ciascun pezzo macroscopico è costituito da una sola molecola) • Il materiale è sempre completamente amorfo • Una volta che il materiale ha polimerizzato, non può più essere portato allo stato fluido B B A A A B B A

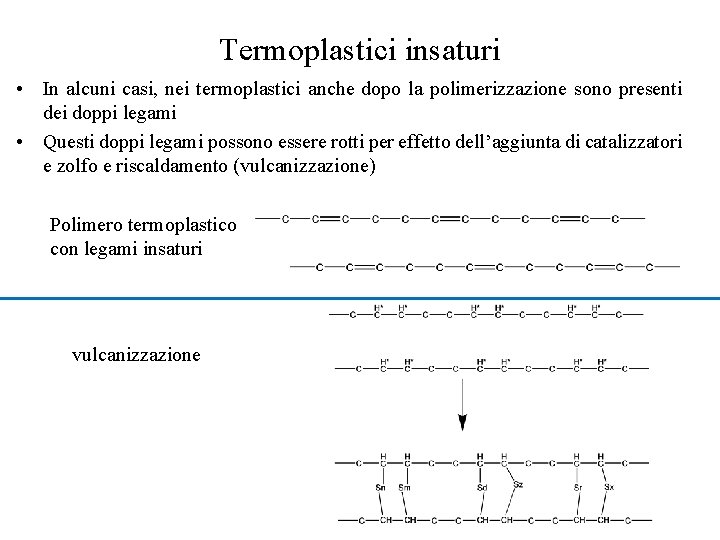
Termoplastici insaturi • In alcuni casi, nei termoplastici anche dopo la polimerizzazione sono presenti dei doppi legami • Questi doppi legami possono essere rotti per effetto dell’aggiunta di catalizzatori e zolfo e riscaldamento (vulcanizzazione) Polimero termoplastico con legami insaturi vulcanizzazione

Elastomeri • Sono materiali che hanno range elevatissimi di deformazione in campo elastico • Le proprietà variano in maniera significativa in base alla densità di reticolazione A A A Eq. 2. 11 A A A AA A A A A A • Oppure in base alla grandezza inversamente proporzionale: il peso molecolare tra punti di reticolazione (Mc) Eq. 2. 12 A B B A A A A B B B B A A B B
 Proprietà macroscopiche della materia
Proprietà macroscopiche della materia Callister scienza e ingegneria dei materiali
Callister scienza e ingegneria dei materiali Fendibilità dei materiali
Fendibilità dei materiali Ingegneria dei materiali
Ingegneria dei materiali Schema dalla materia prima al prodotto finito
Schema dalla materia prima al prodotto finito Spinte metallostatiche
Spinte metallostatiche Zanichelli campo magnetico
Zanichelli campo magnetico Dinamica dei sistemi di punti materiali
Dinamica dei sistemi di punti materiali Classificazione dei materiali
Classificazione dei materiali Come rico
Come rico Funzioni dei carboidrati
Funzioni dei carboidrati Testo argomentativo schema
Testo argomentativo schema Costanti poligoni regolari
Costanti poligoni regolari Qui tollis peccata mundi miserere nobis
Qui tollis peccata mundi miserere nobis La marcia dei diritti dei bambini testo pdf
La marcia dei diritti dei bambini testo pdf Tipi di roccia
Tipi di roccia Materiali biomimetici
Materiali biomimetici Via razzaboni 80 modena
Via razzaboni 80 modena Materiali conduttori e isolanti
Materiali conduttori e isolanti Oggetti fatti con materiali naturali
Oggetti fatti con materiali naturali Modulo elastico metalli
Modulo elastico metalli Tabella dosaggio calcestruzzo
Tabella dosaggio calcestruzzo Materiali ceramici tradizionali
Materiali ceramici tradizionali Prove meccaniche sui materiali
Prove meccaniche sui materiali Dimensioni embrici
Dimensioni embrici Materiali da costruzione scuola media
Materiali da costruzione scuola media Immobilizzazioni
Immobilizzazioni Materiali ceramici tradizionali
Materiali ceramici tradizionali Viedie materiāli
Viedie materiāli Nefiguralni kip
Nefiguralni kip Artefatto oggetto
Artefatto oggetto Simple past infinitive
Simple past infinitive Emmanuel son of god
Emmanuel son of god Come mi vedono gli altri e come mi vedo io
Come mi vedono gli altri e come mi vedo io Hey come on out analysis
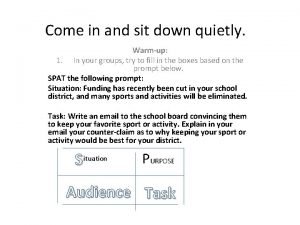
Hey come on out analysis Come in and sit down
Come in and sit down Come mi chiamo io
Come mi chiamo io Come and listen
Come and listen Come thou fount come thou king
Come thou fount come thou king Come in come in and sit down
Come in come in and sit down Come lord jesus come and be born in our hearts
Come lord jesus come and be born in our hearts Come mi chiamo come mi chiamo
Come mi chiamo come mi chiamo Subject + have/has + past participle
Subject + have/has + past participle Softly and tenderly jesus is calling
Softly and tenderly jesus is calling Come holy spirit dove divine
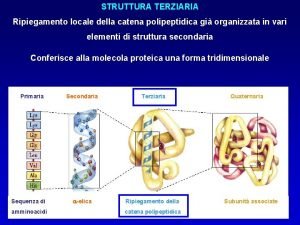
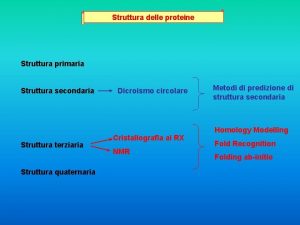
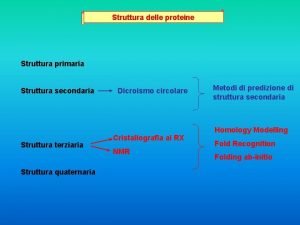
Come holy spirit dove divine Struttura terziaria proteine
Struttura terziaria proteine Inferno dante
Inferno dante Legge del contrappasso significato
Legge del contrappasso significato Impieghi e fonti
Impieghi e fonti Esempio di testo narrativo
Esempio di testo narrativo Mintzberg modello
Mintzberg modello Radici a fittone
Radici a fittone Capitale circolante netto negativo
Capitale circolante netto negativo Manutenzione
Manutenzione Parti dell aereo
Parti dell aereo La stravagante struttura della domus aurea
La stravagante struttura della domus aurea Luca malavoglia muore
Luca malavoglia muore Manchette giornale cos'è
Manchette giornale cos'è Argumento de la divina comedia
Argumento de la divina comedia Esempio di testo espositivo
Esempio di testo espositivo Lamina foglia
Lamina foglia Diencephalo
Diencephalo Le particelle subatomiche mappa concettuale
Le particelle subatomiche mappa concettuale Principi della costituzione
Principi della costituzione Magma primario e secondario zanichelli
Magma primario e secondario zanichelli Struttura plurifunzionale
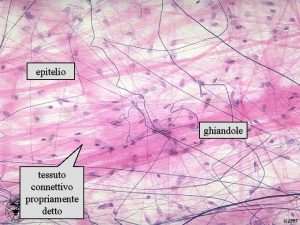
Struttura plurifunzionale Connettivi propriamente detti
Connettivi propriamente detti Fabula testo narrativo
Fabula testo narrativo Elementi costitutivi del testo narrativo
Elementi costitutivi del testo narrativo Americana struttura
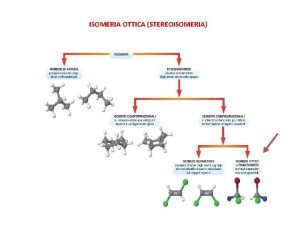
Americana struttura Isomeria ottica
Isomeria ottica Struttura sociale
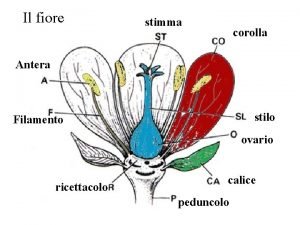
Struttura sociale Fiore staminifero
Fiore staminifero Struttura eparina
Struttura eparina Nomi alcani
Nomi alcani Struttura di un nervo
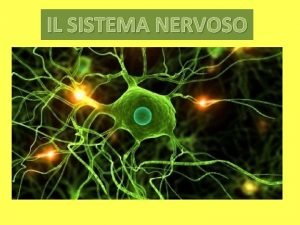
Struttura di un nervo Stato patrimoniale civilistico
Stato patrimoniale civilistico Struttura del paradiso di dante
Struttura del paradiso di dante Struttura ricorsiva
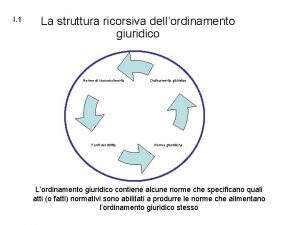
Struttura ricorsiva Teatro di marcello struttura
Teatro di marcello struttura Come si forma il legame peptidico
Come si forma il legame peptidico Tecniche narrative schema
Tecniche narrative schema Struttura divisionale accentrata e decentrata
Struttura divisionale accentrata e decentrata Lead giornalistico
Lead giornalistico Struttura sociale
Struttura sociale Introduzione al vangelo di luca
Introduzione al vangelo di luca Testo teatrale
Testo teatrale Gianni michelon
Gianni michelon Impaginazione lettera formale
Impaginazione lettera formale Esempio di lettera formale
Esempio di lettera formale Il diario e la lettera scuola media
Il diario e la lettera scuola media Struttura lettera informale
Struttura lettera informale Struttura alfa elica e beta foglietto
Struttura alfa elica e beta foglietto Struttura organizzativa elementare
Struttura organizzativa elementare Struttura trigonale planare
Struttura trigonale planare Le proteine funzioni
Le proteine funzioni Struttura organizzativa barilla
Struttura organizzativa barilla Rinforzano la struttura longitudinale della nave
Rinforzano la struttura longitudinale della nave La struttura dell'atomo mappa concettuale
La struttura dell'atomo mappa concettuale Fruttosio struttura ciclica
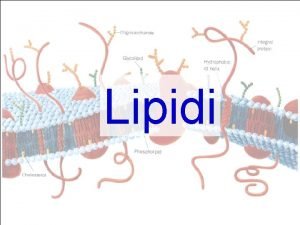
Fruttosio struttura ciclica Fosfolipidi struttura
Fosfolipidi struttura Struttura bucoliche
Struttura bucoliche Struttura multidivisionale
Struttura multidivisionale Struttura del tema argomentativo
Struttura del tema argomentativo Organigramma radiale
Organigramma radiale Articolo scientifico struttura
Articolo scientifico struttura Fiaba struttura
Fiaba struttura Amiloso
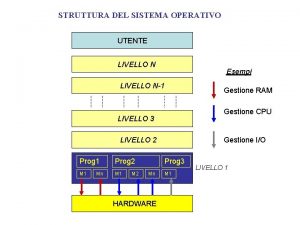
Amiloso Sistema operativo onion skin
Sistema operativo onion skin Struttura costituzione italiana
Struttura costituzione italiana Testo teatrale
Testo teatrale Chimica organica definizione
Chimica organica definizione Testo narrativo schema
Testo narrativo schema Schema dna
Schema dna Struttura terziaria proteine
Struttura terziaria proteine Organigramma gerarchico-funzionale
Organigramma gerarchico-funzionale Struttura sociale
Struttura sociale Struttura pnrr
Struttura pnrr Ipobrufen
Ipobrufen Struttura a dittico sofocle
Struttura a dittico sofocle Struttura del computer
Struttura del computer Struttura terziaria proteine
Struttura terziaria proteine Esempio di saggio
Esempio di saggio Anacronia flashback
Anacronia flashback Ovario fiore
Ovario fiore Saggio breve esempio
Saggio breve esempio Caratteristiche del romanzo
Caratteristiche del romanzo Struttura secondaria rna
Struttura secondaria rna Fasi del testo narrativo
Fasi del testo narrativo Struttura favola
Struttura favola Polis struttura
Polis struttura Rima alternata esempio
Rima alternata esempio Simbologia di lewis
Simbologia di lewis Basilica struttura
Basilica struttura Sistema monoprogrammato
Sistema monoprogrammato