CAPITOLO La struttura dellatomo 4 Indice 1 La













- Slides: 17

CAPITOLO La struttura dell’atomo 4 Indice 1. La carica elettrica 2. Le particelle subatomiche 3. Radioattività 4. Il modello atomico di Rutherford Mappa concettuale: Atomo 5. Numero atomico e numero di massa 6. Isotopi 7. Ioni 8. Massa degli atomi individuali 9. Massa atomica di un elemento 10. Massa molecolare © Paolo Pistarà © Istituto Italiano Edizioni Atlas 1

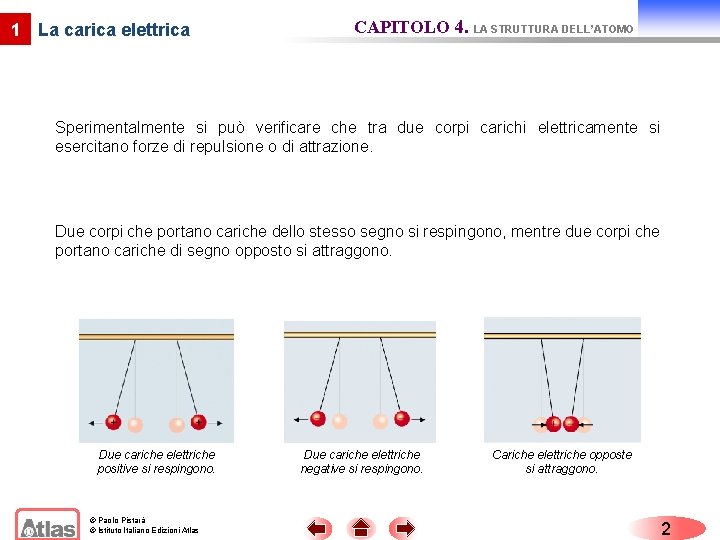
1 La carica elettrica CAPITOLO 4. LA STRUTTURA DELL’ATOMO Sperimentalmente si può verificare che tra due corpi carichi elettricamente si esercitano forze di repulsione o di attrazione. Due corpi che portano cariche dello stesso segno si respingono, mentre due corpi che portano cariche di segno opposto si attraggono. Due cariche elettriche positive si respingono. © Paolo Pistarà © Istituto Italiano Edizioni Atlas Due cariche elettriche negative si respingono. Cariche elettriche opposte si attraggono. 2

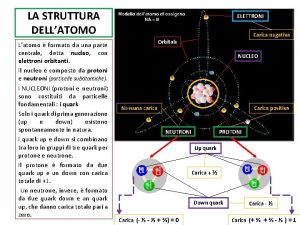
2 Le particelle subatomiche CAPITOLO 4. LA STRUTTURA DELL’ATOMO Le particelle subatomiche più importanti per la chimica sono: gli elettroni, i protoni e i neutroni. u Elettroni Gli elettroni sono particelle con carica negativa. All’elettrone si assegna convenzionalmente carica 1. Gli elettroni costituiscono i raggi catodici. Tubo catodico. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 3

2 Le particelle subatomiche CAPITOLO 4. LA STRUTTURA DELL’ATOMO u Protoni I protoni sono particelle la cui massa, determinata sperimentalmente, è: 1, 673 10 24 g. Ciascun protone ha una massa 1836 volte quella di un elettrone. Per convenzione al protone si assegna carica + 1. u Neutroni Il neutrone è una particella subatomica che non presenta carica elettrica (carica elettrica zero). La massa di un neutrone è circa uguale a quella di un protone: 1, 675 10 24 g © Paolo Pistarà © Istituto Italiano Edizioni Atlas 4

3 Radioattività CAPITOLO 4. LA STRUTTURA DELL’ATOMO La radioattività è l’emissione spontanea di energia e di particelle dal nucleo atomico. Gli elementi radioattivi possono emettere tipi di radiazioni: • radiazioni alfa ( ) • radiazioni beta (β) • radiazioni gamma (γ) © Paolo Pistarà © Istituto Italiano Edizioni Atlas 5

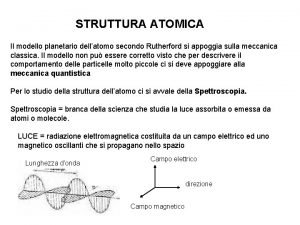
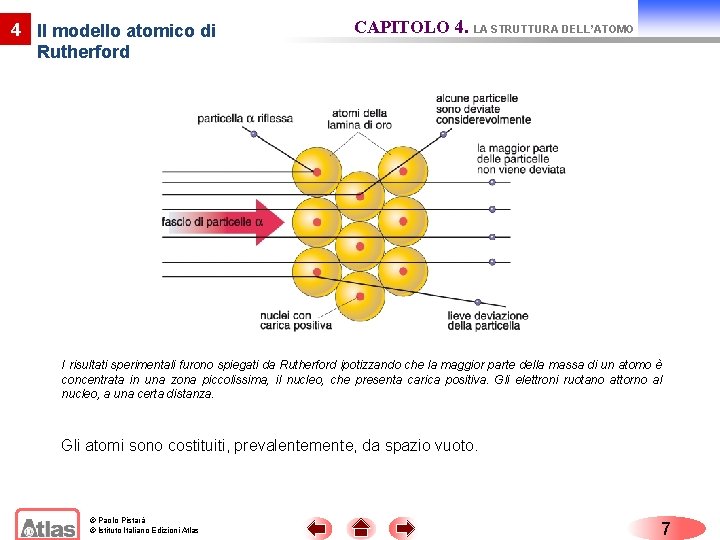
4 Il modello atomico di Rutherford CAPITOLO 4. LA STRUTTURA DELL’ATOMO Ricostruzione schematica dell’esperienza di Rutherford. Per studiare la struttura dell’atomo, Rutherford bombardò una lamina di oro molto sottile con raggi . La maggior parte delle particelle attraversa la lamina di oro senza subire deviazione. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 6

4 Il modello atomico di Rutherford CAPITOLO 4. LA STRUTTURA DELL’ATOMO I risultati sperimentali furono spiegati da Rutherford ipotizzando che la maggior parte della massa di un atomo è concentrata in una zona piccolissima, il nucleo, che presenta carica positiva. Gli elettroni ruotano attorno al nucleo, a una certa distanza. Gli atomi sono costituiti, prevalentemente, da spazio vuoto. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 7

CAPITOLO 4. LA STRUTTURA DELL’ATOMO Mappa concettuale: Atomo ATOMO NUCLEO Zona piccolissima di un atomo dove è concentrata tutta la massa. PROTONI Particelle nucleari positive. © Paolo Pistarà © Istituto Italiano Edizioni Atlas ELETTRONI Particelle subatomiche con carica negativa. NEUTRONI Particelle nucleari senza carica elettrica. 8

5 Numero atomico e numero di massa CAPITOLO 4. LA STRUTTURA DELL’ATOMO Il numero di protoni presenti nel nucleo di un atomo è detto numero atomico e si indica con Z. Il numero atomico viene evidenziato in basso, a sinistra del simbolo dell’elemento: 6 C Il carbonio con Z uguale a 6 ha sei protoni e, quindi, sei elettroni perché un atomo è elettricamente neutro. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 9

CAPITOLO 4. LA STRUTTURA DELL’ATOMO 5 Numero atomico e numero di massa Il numero di massa corrisponde al numero totale di protoni e di neutroni contenuti nel nucleo di un atomo e si indica con A. 12 C Il numero di massa viene riportato in alto, a sinistra del simbolo dell’elemento. Il carbonio con A uguale a 12 contiene 6 protoni e 6 neutroni. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 10

CAPITOLO 4. LA STRUTTURA DELL’ATOMO 6 Isotopi Per isotopi s’intendono gli atomi di uno stesso elemento che hanno numeri differenti di neutroni. Il rame, ad esempio, presenta due isotopi che possono essere così rappresentati: 63 Cu 29 65 29 Cu (simboli nucleari) oppure rame-63 rame-65 numero di massa numero atomico = numero di neutroni © Paolo Pistarà © Istituto Italiano Edizioni Atlas 11

CAPITOLO 4. LA STRUTTURA DELL’ATOMO 6 Isotopi (-) 1 1 (-) 2 1 H (-) 3 1 H H + + Idrogeno-1. Idrogeno-2 (deuterio). + Idrogeno-3 (trizio). I tre isotopi dell’idrogeno differiscono per il numero di neutroni contenuti nel nucleo. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 12

CAPITOLO 4. LA STRUTTURA DELL’ATOMO 7 Ioni In una reazione chimica gli atomi neutri possono perdere o acquistare elettroni. Le particelle elettricamente cariche si formano sono chiamate ioni. Gli ioni positivi sono chiamati cationi. Gli ioni negativi sono chiamati anioni. I composti che contengono cationi e anioni sono chiamati composti ionici. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 13

CAPITOLO 4. LA STRUTTURA DELL’ATOMO 8 Massa degli atomi individuali La massa di un singolo atomo, determinata con lo spettrometro di massa, indica quante volte la massa dell’atomo è maggiore (più pesante) rispetto all’unità di massa atomica. L’unità di massa atomica (simbolo u) corrisponde a 1/12 della massa del carbonio-12. Massa delle particelle subatomiche © Paolo Pistarà © Istituto Italiano Edizioni Atlas Nome Massa (g) Massa (u) Protone 1, 673 x 10− 24 1, 007276 Neutrone 1, 675 x 10− 24 1, 008665 Elettrone 9, 109 x 10− 28 0, 000549 14

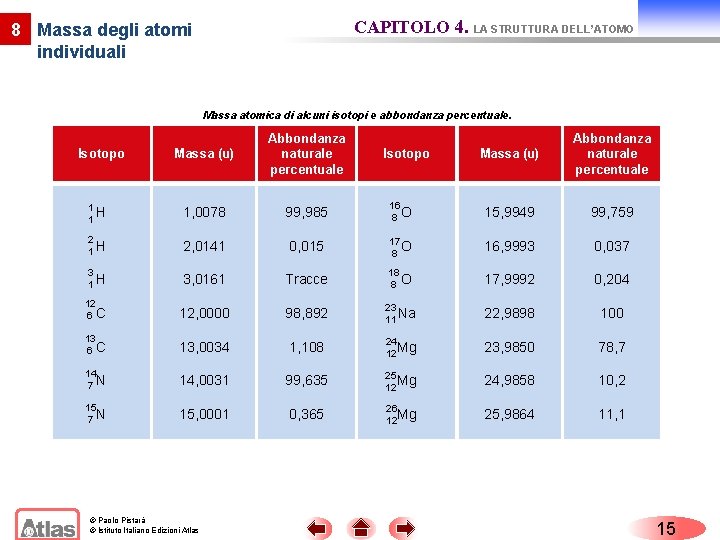
CAPITOLO 4. LA STRUTTURA DELL’ATOMO 8 Massa degli atomi individuali Massa atomica di alcuni isotopi e abbondanza percentuale. Massa (u) Abbondanza naturale percentuale 1 H 1 1, 0078 99, 985 16 8 O 15, 9949 99, 759 2 1 H 2, 0141 0, 015 17 O 8 16, 9993 0, 037 3 1 H 3, 0161 Tracce 18 8 O 17, 9992 0, 204 12 6 C 12, 0000 98, 892 23 11 Na 22, 9898 100 13 6 C 13, 0034 1, 108 24 Mg 12 23, 9850 78, 7 14 7 N 14, 0031 99, 635 25 Mg 12 24, 9858 10, 2 15 7 N 15, 0001 0, 365 26 Mg 12 25, 9864 11, 1 Isotopo © Paolo Pistarà © Istituto Italiano Edizioni Atlas Isotopo 15

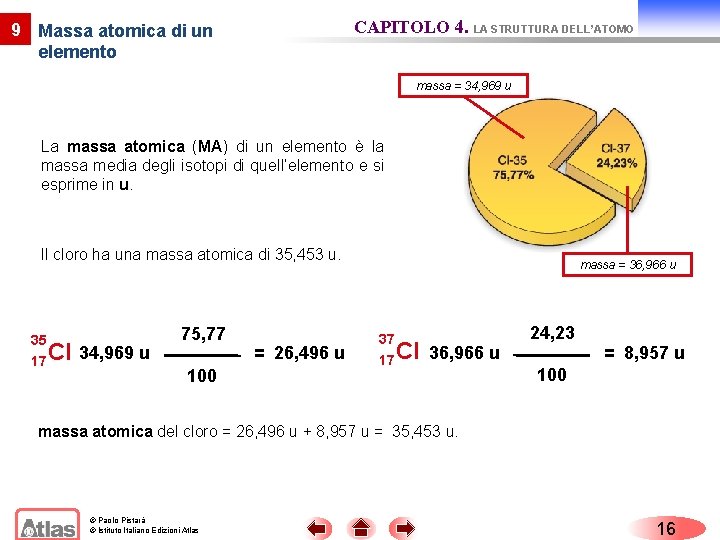
CAPITOLO 4. LA STRUTTURA DELL’ATOMO 9 Massa atomica di un elemento massa = 34, 969 u La massa atomica (MA) di un elemento è la massa media degli isotopi di quell’elemento e si esprime in u. Il cloro ha una massa atomica di 35, 453 u. 35 17 Cl 34, 969 u 75, 77 100 = 26, 496 u massa = 36, 966 u 37 17 Cl 36, 966 u 24, 23 = 8, 957 u 100 massa atomica del cloro = 26, 496 u + 8, 957 u = 35, 453 u. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 16

10 CAPITOLO 4. LA STRUTTURA DELL’ATOMO Massa molecolare La massa molecolare (MM) di un composto è uguale alla somma delle masse di tutti gli atomi presenti nella sua formula. Calcolo della massa molecolare del cloroetano, CH 3 CH 2 Cl: 2 atomi di C = 2 12, 01 = 24, 02 u 5 atomi di H = 5 1, 01 = 1 atomo di Cl = 1 35, 45 = 35, 45 u massa molecolare © Paolo Pistarà © Istituto Italiano Edizioni Atlas 5, 05 u Modello molecolare del cloroetano 64, 52 u 17
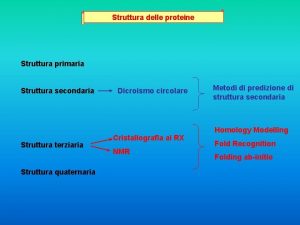
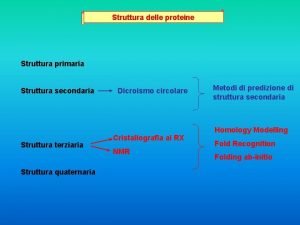
 Margine di struttura primario
Margine di struttura primario Soluzioni chimica zanichelli capitolo 10
Soluzioni chimica zanichelli capitolo 10 Chimica più soluzioni capitolo 6
Chimica più soluzioni capitolo 6 Soluzioni capitolo 14 zanichelli chimica
Soluzioni capitolo 14 zanichelli chimica L'addetto al trasporto sanitario può rimuovere il casco
L'addetto al trasporto sanitario può rimuovere il casco Scala di riduzione
Scala di riduzione Elettrolisi acqua
Elettrolisi acqua Chimica più soluzioni capitolo 10
Chimica più soluzioni capitolo 10 Barriere postzigotiche
Barriere postzigotiche Soluzione chimica più
Soluzione chimica più Soluzioni capitolo 19 chimica
Soluzioni capitolo 19 chimica Posca chimica più soluzioni
Posca chimica più soluzioni Valitutti soluzioni capitolo 11
Valitutti soluzioni capitolo 11 Soluzioni capitolo 14
Soluzioni capitolo 14 Mappa concettuale acidi e basi
Mappa concettuale acidi e basi Klein soluzioni
Klein soluzioni Soluzioni capitolo 8
Soluzioni capitolo 8 Soluzioni capitolo 10 chimica più
Soluzioni capitolo 10 chimica più