La struttura dellatomo Introduzione Il modello di Thomson









- Slides: 9

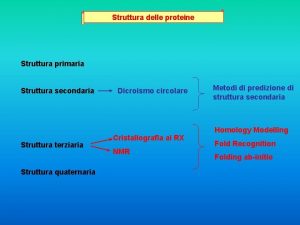
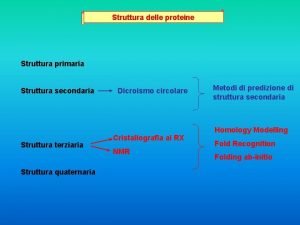
La struttura dell’atomo Ø Introduzione Ø Il modello di Thomson Ø l modello di Rutherford Ø Limiti del modello di Rutherford Ø Il modello di Bohr Ø I livelli energetici dell’atomo Ø Il principio di esclusione di Pauli Ø Fine presentazione

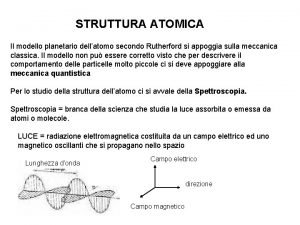
Introduzione Il concetto di “atomo” (dal greco “atomòs“ indivisibile) trae le sue origini dalla filosofia greca , ma è soltanto nel XIX secolo che vengono condotti i primi esperimenti per determinare le propriètà della materia. Gli esperimenti di spettroscopica dei gas, fornirono dei risultati inaspettati e apparentemente inspiegabili. ØMenu principale

IL modello di Thomson Nel 1897, J. J. Thomson a conclusione di una serie di esperimenti, capì di aver scoperto l’esistenza di una particella: l’elettrone. Secondo questo modello, l’atomo è una sfera di carica positiva, al cui interno sono distribuiti in maniera omogenea gli elettroni. ØMenù principale

Il modello di Rutherford Tra il 1908 e il 1911 Rutherford, per giustificare in termini razionali una celebre esperienza sulla diffusione delle particelle alfa da parte della materia (alluminio, oro, carbone) ipotizzò che l’atomo fosse costituito come un microscopico sistema solare, in cui gli elettroni, simili a pianeti, ruotassero attorno ad una massa positiva più tardi chiamata nucleo

Limiti del modello di Rutherford • Il modello planetario di Rutherford creò subito alcune difficoltà concettuali. • Le forze repulsive coulombiane agenti tra le cariche positive protoniche, confinate in un limitato volume, avrebbero dovuto dar luogo ad una istantanea disgregazione del nucleo. • Era impossibile giustificare la stabilità temporale dell’atomo. Infatti in base alle leggi dell’elettrodinamica classica, ogni carica che si muove di moto non uniforme irradia onde elettromagnetiche a spese della propria energia di moto. In un tempo molto piccolo un elettrone atomico (circa 10 -8 sec) dovrebbe quindi cadere sul nucleo

L’atomo di Bohr • Il primo problema fu risolto con l’introduzione delle forze nucleari agenti solo all’interno dei nuclei: la cosiddetta interazione nucleare forte • Il secondo problema fu risolto da Bohr nel 1913 ricorrendo alle nuove ipotesi connesse con la teoria dei quanti elaborata da Planck nei primi anni del 1900.

I livelli energetici • Secondo il modello di Bohr, gli elettroni occupano soltanto orbite ben definite , nelle quali l’elettrone non irradia energia. Si ha emissione o assorbimento di energia quantizzata (multiplo di hv) soltanto nella transizione tra i vari livelli atomici.

Principio di Pauli Ø Una importante conseguenza della modellistica degli atomi, direttamente connessa alle regole di quantizzazione è rappresentata dalla distribuzione elettronica negli atomi a più elettroni. Ø Il criterio base che sancisce la distribuzione degli elettroni negli atomi è rappresentato dal Principio di esclusione di Pauli

IL Principio di Pauli Ø Il numero di elettroni che può occupare uno strato corrispondente a un livello energetico di numero quantico n non può superare il valore 2 n 2 Lo strato K n=1 può contenere al massimo 2 elettroni Ø Lo strato L n=2 può contenere al massimo 8 elettroni Ø Lo strato M n=3 può contenere al massimo 18 elettroni Ø