Perch molecole discrete aventi un numero finito di





















- Slides: 48

Perché molecole discrete (aventi un numero finito di atomi) come I 2, P 4, S 8 sono solide a differenza di F 2, Cl 2 che sono gas? Perché molecole discrete gassose come N 2, O 2, Cl 2, H 2, i gas nobili etc. diventano solide a basse temperature? Le forze di dispersione o di London

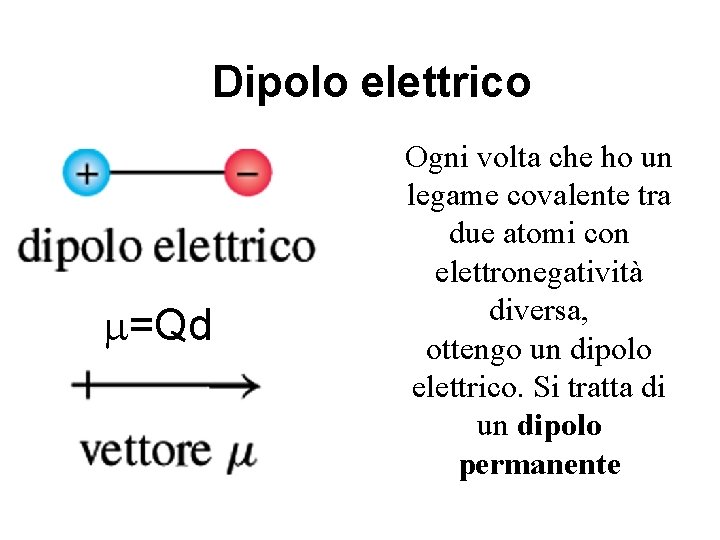
Interazione fra molecole apolari – Modello di interazione fra dipoli elettrici istantaneamente indotti • Dipolo elettrico: è costituito da due cariche uguali ma di segno opposto separate da una distanza d • Momento del dipolo elettrico, m = vettore il cui verso è diretto dalla carica + a quella – e il cui modulo è dato da: m = Q x d

Dipolo elettrico m=Qd Ogni volta che ho un legame covalente tra due atomi con elettronegatività diversa, ottengo un dipolo elettrico. Si tratta di un dipolo permanente

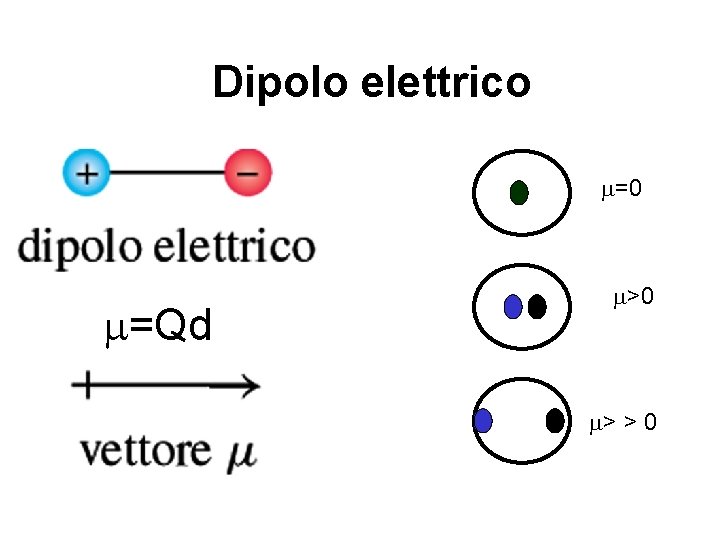
Dipolo elettrico m=0 m=Qd m>0 m> > 0

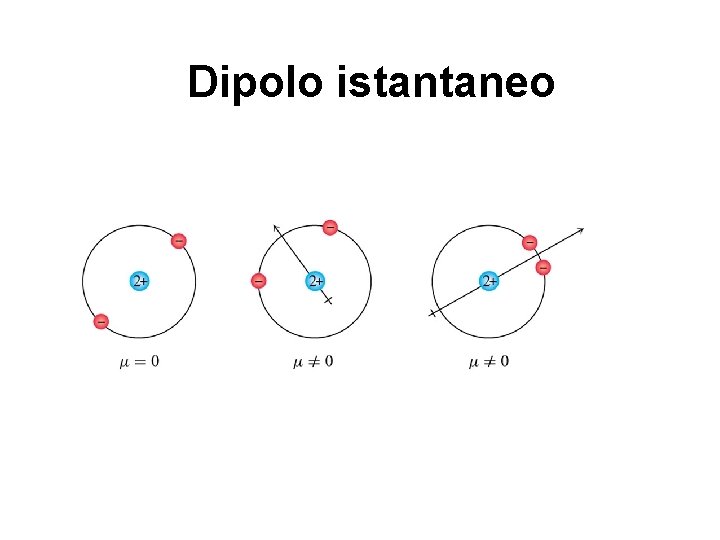
Dipolo istantaneo

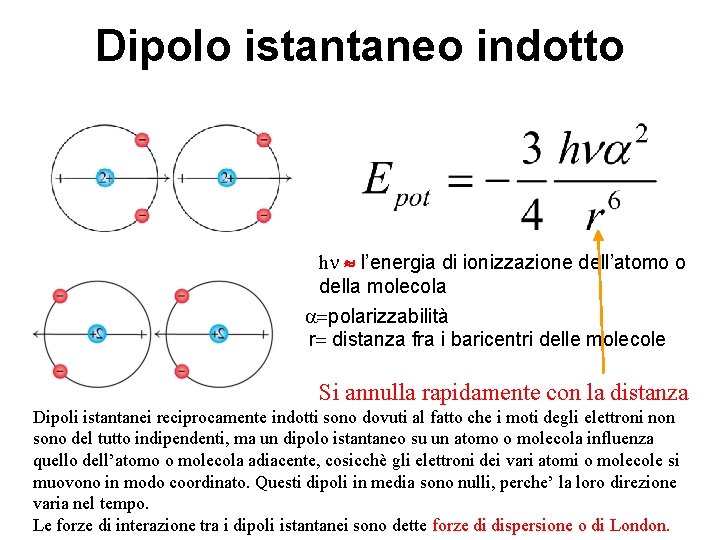
Dipolo istantaneo indotto hn l’energia di ionizzazione dell’atomo o della molecola a=polarizzabilità r= distanza fra i baricentri delle molecole Si annulla rapidamente con la distanza Dipoli istantanei reciprocamente indotti sono dovuti al fatto che i moti degli elettroni non sono del tutto indipendenti, ma un dipolo istantaneo su un atomo o molecola influenza quello dell’atomo o molecola adiacente, cosicchè gli elettroni dei vari atomi o molecole si muovono in modo coordinato. Questi dipoli in media sono nulli, perche’ la loro direzione varia nel tempo. Le forze di interazione tra i dipoli istantanei sono dette forze di dispersione o di London.

Polarizzabilità Misura la facilità con la quale la nube elettronica puo’ venire distorta, per esempio dalla presenza di un campo elettrico o di un altro dipolo Dipende dalla forza con cui gli elettroni esterni sono vincolati al nucleo e dal loro numero. Maggiore l’energia di ionizzazione, minore la polarizzabilità

Polarizzazione di un atomo in un campo elettrico. Il dipolo indotto permane finche’ permane E ed è tanto maggiore tanto piu’ grande è E m = a. E a è la polarizzabilità dell’atomo dipende dalla forza con cui gli elettroni più esterni sono vincolati al nucleo e dal loro numero

La polarizzabilità è una proprietà molecolare che aumenta con il numero di elettroni che costituiscono la molecola ed è inversamente proporzionale alla facilità di ionizzare la molecola: La polarizzabilità molecolare ha le dimensioni di un volume.

Le forze di dispersione sono l’unico tipo di forze intermolecolari operative tra molecole non polari, quali ad esempio H 2, Cl 2, CO 2, CH 4. Rispetto ad un legame covalente, l’energia di legame per le forze di London sono molto più piccole di quelle di un legame covalente: Per He energia di legame 75 J mol-1 Per legame covalente H 2 430 k. J mol-1

Le molecole polari e l’interazione per orientazione • Le molecole polari si attraggono reciprocamente per effetto dei loro dipoli permanenti in modo da rendere massima l’interazione dipolo-dipolo, detta anche interazione per orientazione. • Eattr -m/d 6

Interazione dipolo-dipolo in un solido molecolare.

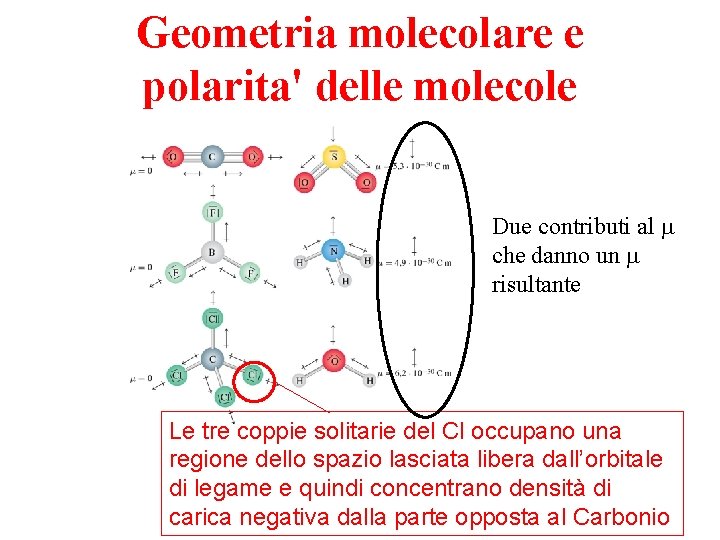
Geometria molecolare e polarita' delle molecole Due contributi al m che danno un m risultante Le tre coppie solitarie del Cl occupano una regione dello spazio lasciata libera dall’orbitale di legame e quindi concentrano densità di carica negativa dalla parte opposta al Carbonio

Interazione per induzione • Il dipolo permanente di una molecola induce su un’altra molecola, polare o non polare, un dipolo, chiamato indotto. • Esiste un’attrazione fra dipolo permanente e dipolo indotto. • Eattr -ma/d 6

Forze di interazione di van der Waals • Le interazioni fra dipoli reciprocamente indotti (forze di London), quelle per orientazione e quelle per induzione sono raggruppate sotto il termine generico di forze di interazione di van der Waals • Tutte questi tre tipi di interazioni sono sempre attivi tra molecole polari e solo le forze di London sono attive tra molecole apolari

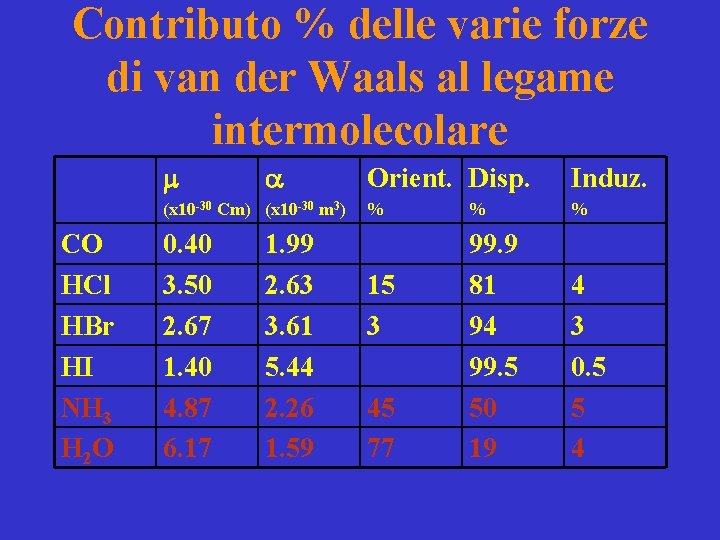
Contributo % delle varie forze di van der Waals al legame intermolecolare m a (x 10 -30 Cm) (x 10 -30 m 3) CO HCl HBr HI NH 3 H 2 O 0. 40 3. 50 2. 67 1. 40 4. 87 6. 17 1. 99 2. 63 3. 61 5. 44 2. 26 1. 59 Orient. Disp. Induz. % % % 99. 9 81 94 99. 5 50 19 4 3 0. 5 5 4 15 3 45 77

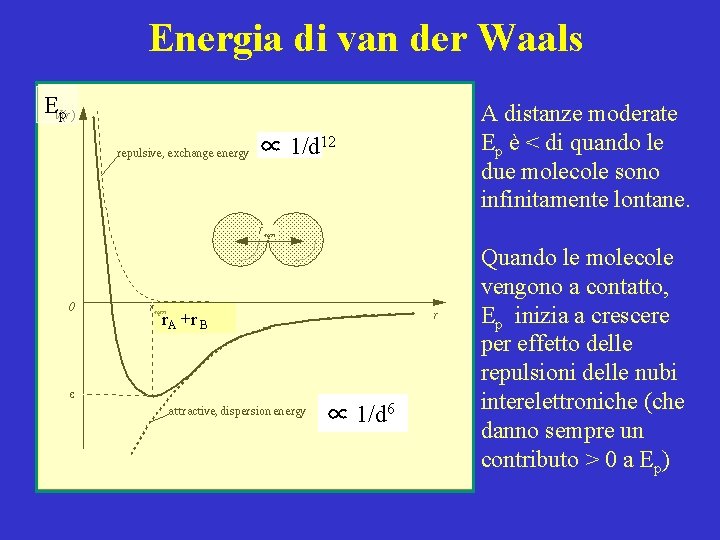
Energia di van der Waals Ep ∝ 1/d 12 r. A +r B ∝ 1/d 6 A distanze moderate Ep è < di quando le due molecole sono infinitamente lontane. Quando le molecole vengono a contatto, Ep inizia a crescere per effetto delle repulsioni delle nubi interelettroniche (che danno sempre un contributo > 0 a Ep)

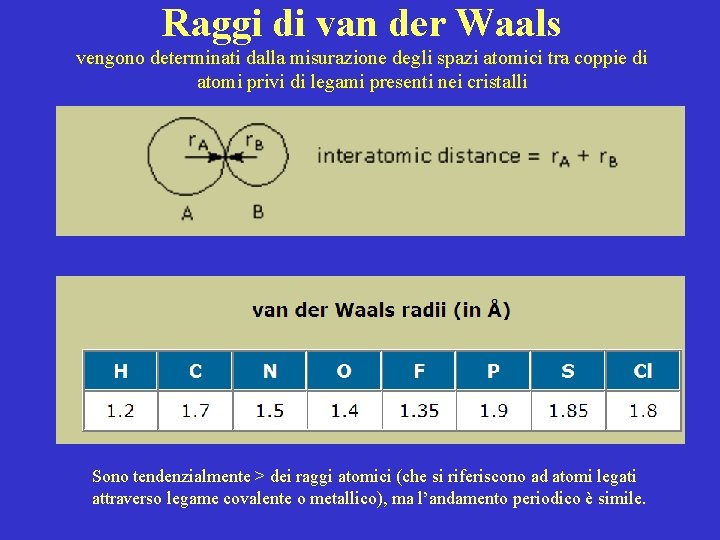
Raggi di van der Waals vengono determinati dalla misurazione degli spazi atomici tra coppie di atomi privi di legami presenti nei cristalli Sono tendenzialmente > dei raggi atomici (che si riferiscono ad atomi legati attraverso legame covalente o metallico), ma l’andamento periodico è simile.

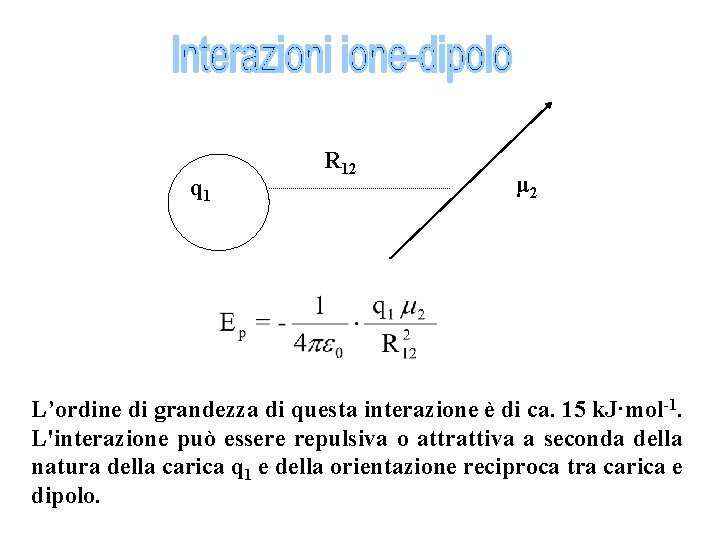
q 1 R 12 μ 2 L’ordine di grandezza di questa interazione è di ca. 15 k. J·mol-1. L'interazione può essere repulsiva o attrattiva a seconda della natura della carica q 1 e della orientazione reciproca tra carica e dipolo.

Stato di aggregazione e energia di legame intermolecolare derivante dalle forze di van der Waals • Con le forze di Van der Waals ci aspettiamo tutte le sostanze molecolari allo stato solido, ma pressoché tutte le sostanze possono essere ottenute allo stato solido, liquido e gassoso al variare della temperatura • La temperatura di ebollizione puo’ considerarsi un indice delle forze di interazione che esistono tra le molecole allo stato condensato, perchè? • Deve esistere un fattore correlabile alla temperatura, che si oppone all’energia di legame delle particelle e tende a separarle le une dalle altre.

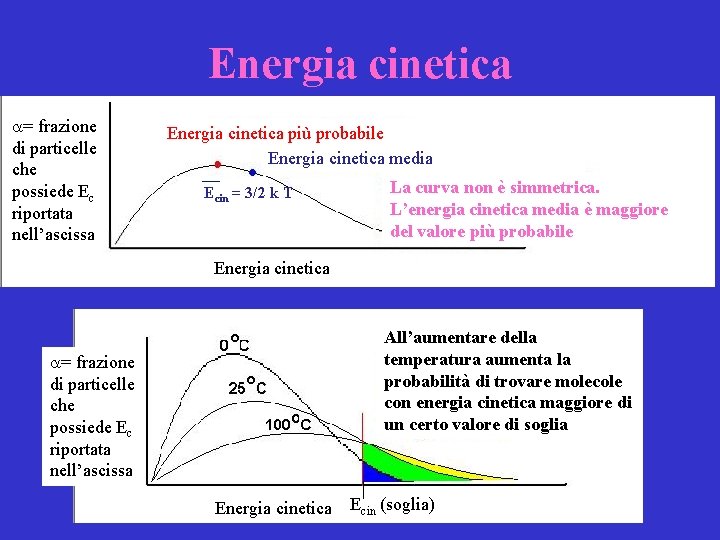
Energia cinetica • Questo fattore è l’energia cinetica, che è posseduta da tutte le particelle e dipende solo dalla temperatura. • Energia cinetica media: Ecin = 3/2 k T dove k è la costante di Boltzmann e T è la temperatura assoluta espressa in kelvin

Energia cinetica a= frazione di particelle che possiede Ec riportata nell’ascissa Energia cinetica più probabile Energia cinetica media Ecin = 3/2 k T La curva non è simmetrica. L’energia cinetica media è maggiore del valore più probabile Energia cinetica All’aumentare della temperatura aumenta la probabilità di trovare molecole con energia cinetica maggiore di un certo valore di soglia a= frazione di particelle che possiede Ec riportata nell’ascissa Energia cinetica Ecin (soglia)

Quando l’energia cinetica media delle particelle supera il valore assoluto di quella potenziale dovuta alle forze di attrazione, le particelle non sono più legate ed il sistema è gassoso Per questo motivo la Teb è un indice della forza delle interazioni intermolecolari

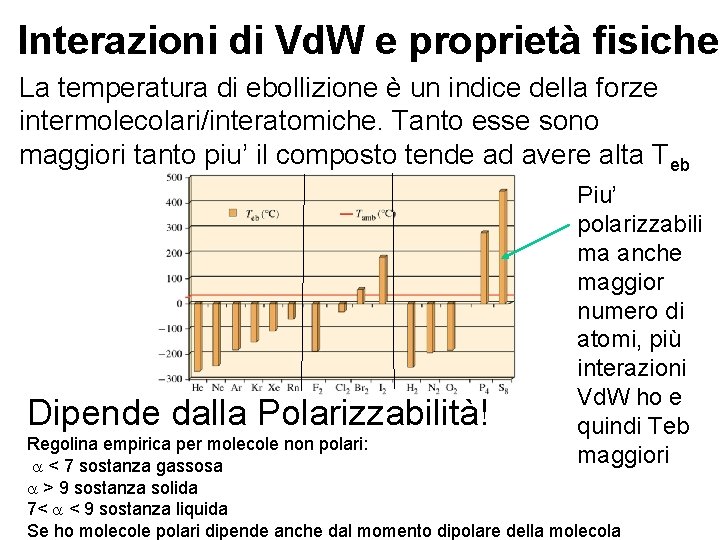
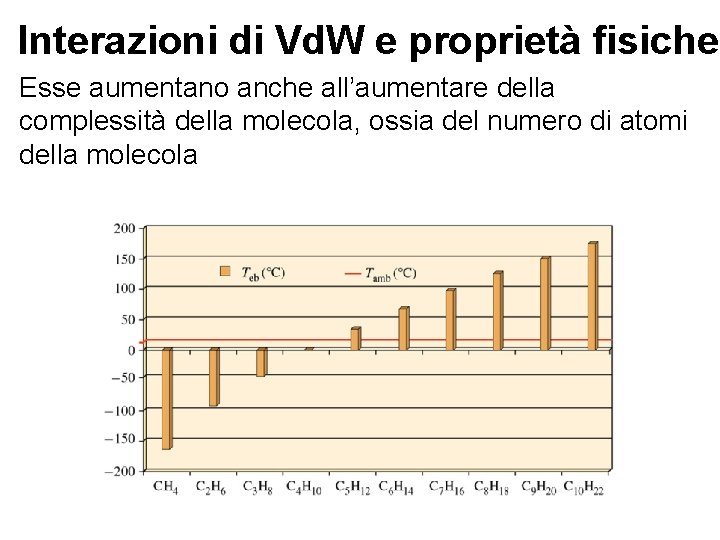
Interazioni di Vd. W e proprietà fisiche La temperatura di ebollizione è un indice della forze intermolecolari/interatomiche. Tanto esse sono maggiori tanto piu’ il composto tende ad avere alta Teb Dipende dalla Polarizzabilità! Piu’ polarizzabili ma anche maggior numero di atomi, più interazioni Vd. W ho e quindi Teb maggiori Regolina empirica per molecole non polari: a < 7 sostanza gassosa a > 9 sostanza solida 7< a < 9 sostanza liquida Se ho molecole polari dipende anche dal momento dipolare della molecola

Interazioni di Vd. W e proprietà fisiche Esse aumentano anche all’aumentare della complessità della molecola, ossia del numero di atomi della molecola

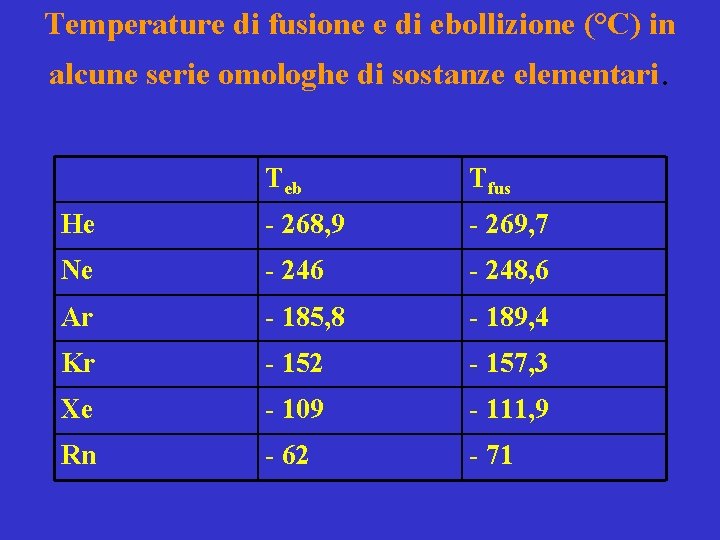
Temperature di fusione e di ebollizione (°C) in alcune serie omologhe di sostanze elementari. Teb Tfus He - 268, 9 - 269, 7 Ne - 246 - 248, 6 Ar - 185, 8 - 189, 4 Kr - 152 - 157, 3 Xe - 109 - 111, 9 Rn - 62 - 71

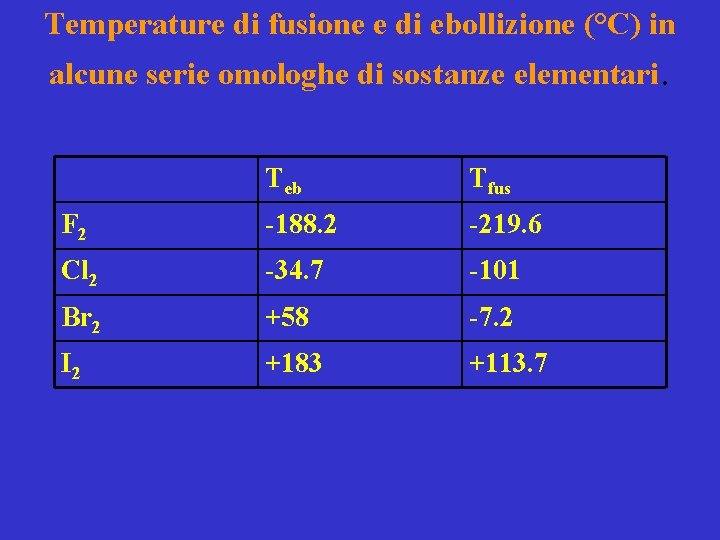
Temperature di fusione e di ebollizione (°C) in alcune serie omologhe di sostanze elementari. Teb Tfus F 2 -188. 2 -219. 6 Cl 2 -34. 7 -101 Br 2 +58 -7. 2 I 2 +183 +113. 7

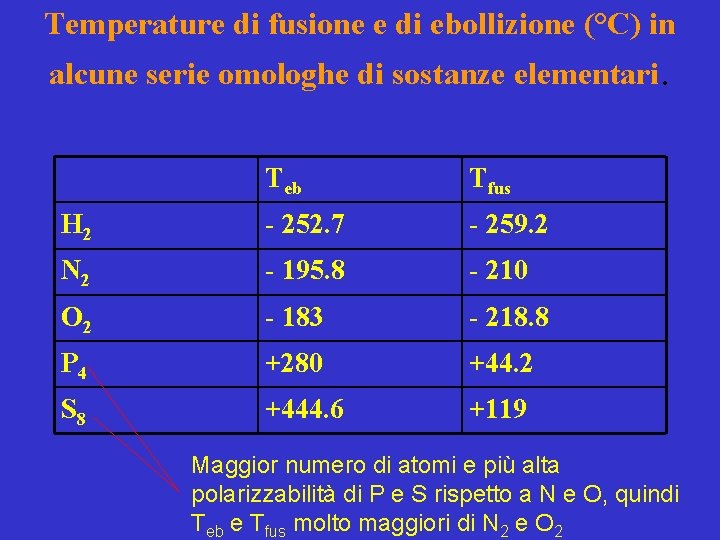
Temperature di fusione e di ebollizione (°C) in alcune serie omologhe di sostanze elementari. Teb Tfus H 2 - 252. 7 - 259. 2 N 2 - 195. 8 - 210 O 2 - 183 - 218. 8 P 4 +280 +44. 2 S 8 +444. 6 +119 Maggior numero di atomi e più alta polarizzabilità di P e S rispetto a N e O, quindi Teb e Tfus molto maggiori di N 2 e O 2

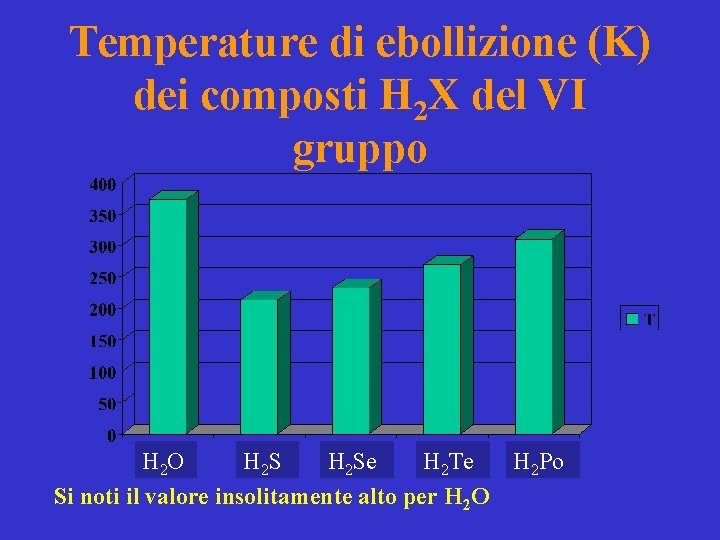
Temperature di ebollizione (K) dei composti H 2 X del VI gruppo H 2 O H 2 Se H 2 Te Si noti il valore insolitamente alto per H 2 O H 2 Po

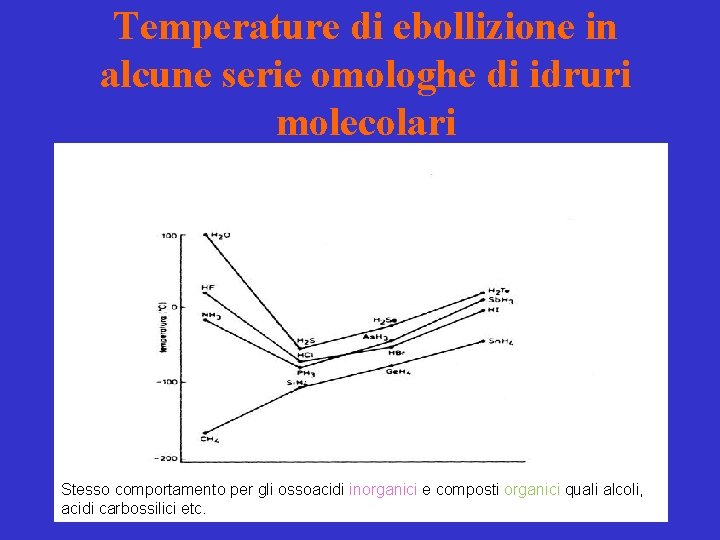
Temperature di ebollizione in alcune serie omologhe di idruri molecolari Stesso comportamento per gli ossoacidi inorganici e composti organici quali alcoli, acidi carbossilici etc.

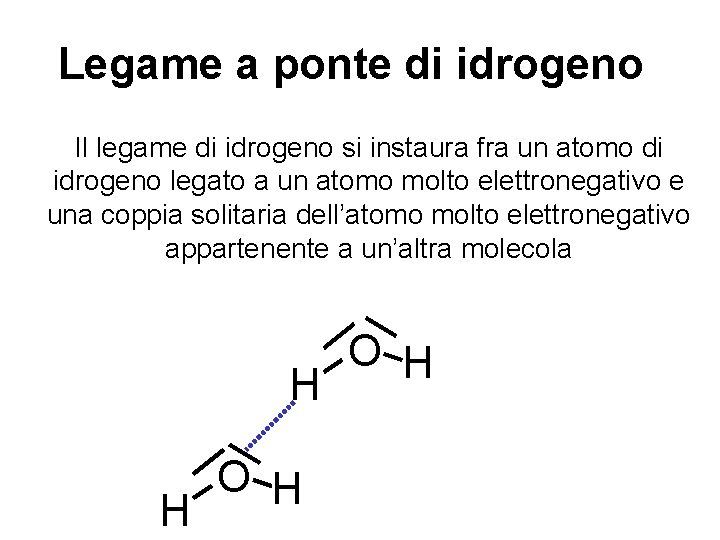
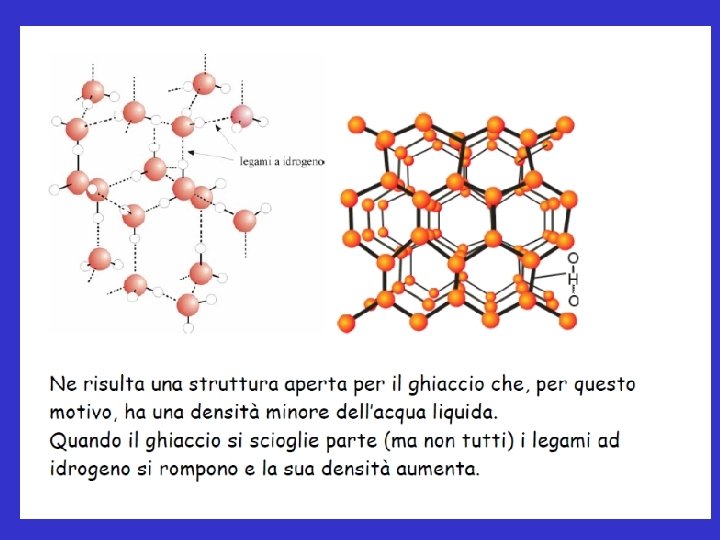
Legame a ponte di idrogeno Il legame di idrogeno si instaura fra un atomo di idrogeno legato a un atomo molto elettronegativo e una coppia solitaria dell’atomo molto elettronegativo appartenente a un’altra molecola H H O H

Legame a ponte di idrogeno • Quando un atomo di idrogeno è legato ad un atomo fortemente elettronegativo e di dimensioni non troppo grandi (O, N, F), il legame H-X è fortemente polare, con un verso diretto verso l’atomo più elettronegativo. • Sull’atomo di idrogeno si crea un’alta densità di carica a causa delle sue piccole dimensioni, quindi esso interagisce fortemente con quella parte di un’altra molecola in cui sono localizzate le coppie di non legame su atomo avente alta densità elettronica (ossia di dimensioni piccole). • Si realizza quindi un legame di natura elettrostatica, ma che presenta anche un carattere fortemente direzionale.

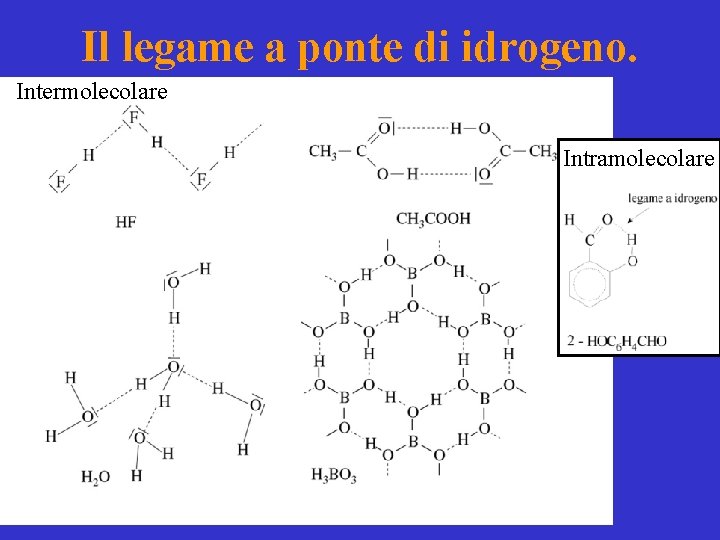
Il legame a ponte di idrogeno. Intermolecolare Intramolecolare

Natura elettrostatica? Legame direzionale Solo con O, N, F, in sistemi biologici anche con S Piu’ forte delle forze di Vd. W, ma un ordine di grandezza piu’ piccolo dei legami covalenti 20 -40 k. J mol-1 Esiste una densità elettronica tra i due atomi, NON è uguale al legame ionico! E’ assimilabile ad un debole legame chimico H O O

Perché lo indico con una linea tratteggiata ? Un atomo di idrogeno non puo’ formare due legami a coppia di elettroni, quindi é formalmente sbagliato indicare il legame ad idrogeno come la compartecipazione di un doppietto elettronico di Lewis Tuttavia, a differenza delle altre interazioni intermolecolari, il legame a idrogeno é DIREZIONALE, perché dipende dalla geometria delle coppie elettroniche intorno all’atomo “elettron-donatore”. Quindi é legittimo, anzi necessario, rappresentarlo graficamente in qualche modo per evidenziare la presenza di una organizzazione geometrica e strutturale del sistema.

Il legame a ponte di idrogeno: fattori geometrici X H Y Z D D ≈ 2. 8 Å distanza donatore-accettore 150° ≤ ≤ 180°, ossia è quasi lineare

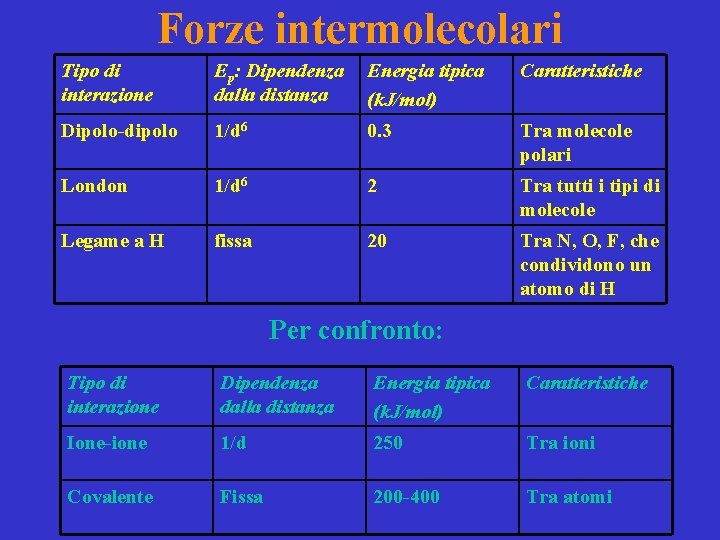
Forze intermolecolari Tipo di interazione Ep: Dipendenza dalla distanza Energia tipica (k. J/mol) Caratteristiche Dipolo-dipolo 1/d 6 0. 3 Tra molecole polari London 1/d 6 2 Tra tutti i tipi di molecole Legame a H fissa 20 Tra N, O, F, che condividono un atomo di H Per confronto: Tipo di interazione Dipendenza dalla distanza Energia tipica (k. J/mol) Caratteristiche Ione-ione 1/d 250 Tra ioni Covalente Fissa 200 -400 Tra atomi



Il legame a ponte di idrogeno può avvenire anche fra molecole chimicamente diverse X H X-H può essere diverso da Y-Z. : D Y Z X-H = N-H Y-Z = O=C

Le forze intermolecolari … non sono solo intermolecolari In molecole relativamente complesse contribuiscono a definire la struttura tridimensionale

Amminoacidi Amminoacido Formula generale R diversi danno luogo a diversi amminoacidi

Amminoacidi Gli amminoacidi naturali sono 20

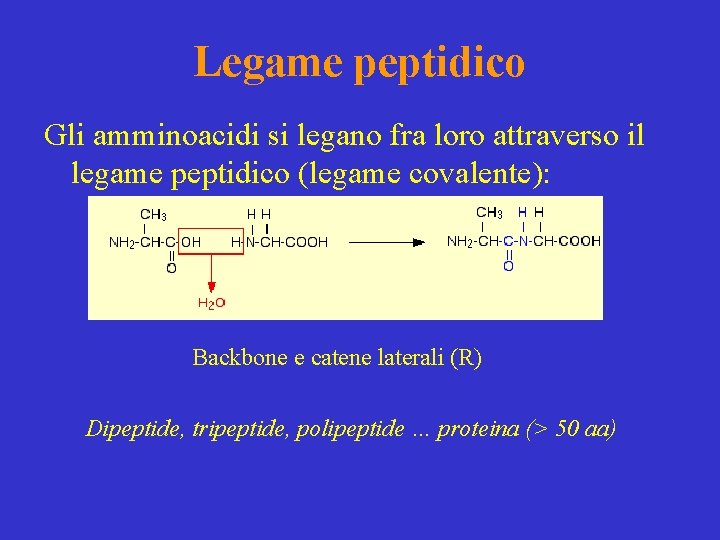
Legame peptidico Gli amminoacidi si legano fra loro attraverso il legame peptidico (legame covalente): Backbone e catene laterali (R) Dipeptide, tripeptide, polipeptide … proteina (> 50 aa)

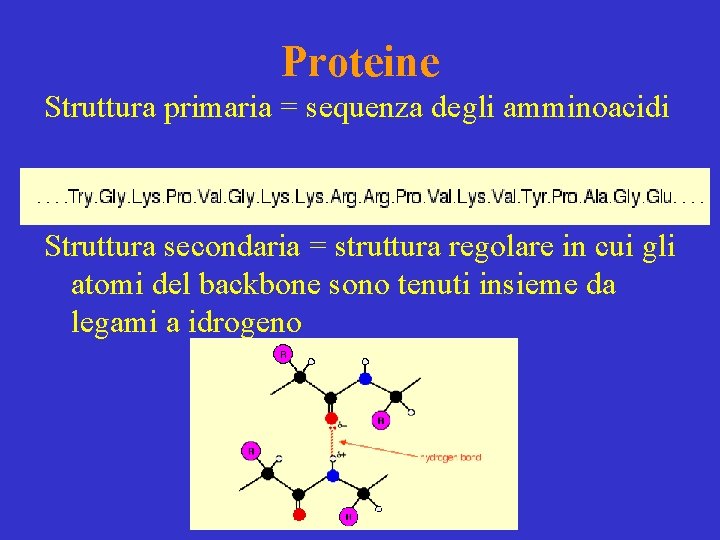
Proteine Struttura primaria = sequenza degli amminoacidi Struttura secondaria = struttura regolare in cui gli atomi del backbone sono tenuti insieme da legami a idrogeno

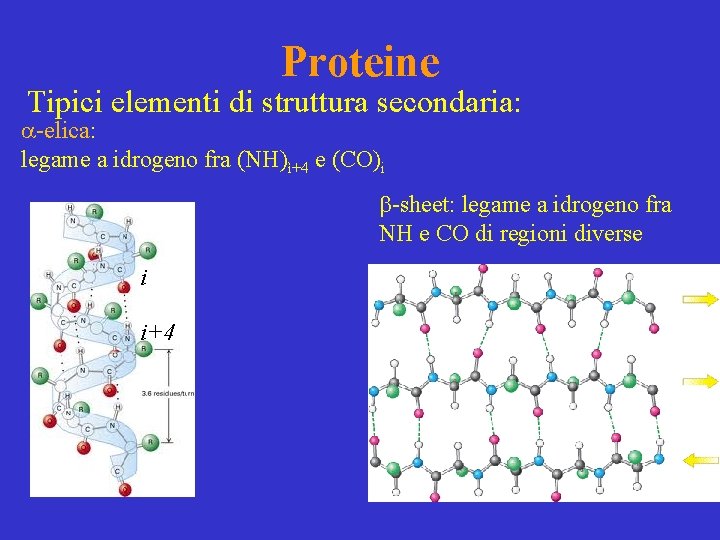
Proteine Tipici elementi di struttura secondaria: a-elica: legame a idrogeno fra (NH)ì+4 e (CO)i b-sheet: legame a idrogeno fra NH e CO di regioni diverse i i+4

Proteine Struttura terziaria = disposizione tridimensionale degli atomi che determina la forma complessiva della proteina. E’ determianta da interazioni di van der Waals, elettrostatiche e a idrogeno fra i vari aa.

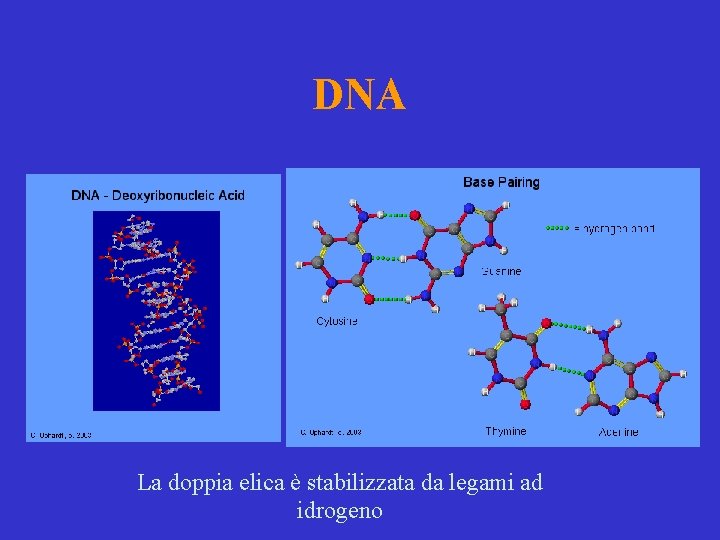
DNA La doppia elica è stabilizzata da legami ad idrogeno